巴西橡胶树HbCCoAOMT基因克隆及其表达分析
2016-05-30晁金泉陈月异杨署光田维敏
晁金泉 陈月异 杨署光 田维敏


摘 要 木质素是植物细胞壁的成分之一,其含量高低影响到细胞壁的弹性。橡胶树乳管膨压是割胶后胶乳排出的初动力,乳管细胞壁的物理性能可能是影响乳管膨压的因素之一。本研究采用QRT-PCR和RACE技术, 从巴西橡胶树无性系CATAS7-33-97的乳管细胞中克隆到一个木质素合成关键酶CCoAOMT基因的同源基因,命名为HbCCoAOMT。该基因的开放阅读框为741 bp,编码1个由246个氨基酸残基组成的蛋白质。该蛋白质分子量为27.76 ku,理论等电点为5.255。实时荧光定量PCR结果表明, 割胶和乙烯利处理均下调HbCCoAOMT基因在胶乳中的表达。该基因的表达量以及内层树皮的木质素含量在两个橡胶树品种(CATAS8-79和PR107)间存在显著差异。HbCCoAOMT差异表达可能影响到乳管细胞木质素含量和乳管细胞壁的物理性能。
关键词 橡胶树;HbCCoAOMT;乳管细胞壁;乳管膨压;木质素
中图分类号 S794.1 文献标识码 A
木质素是一类由香豆醇、松柏醇和芥子醇等单体聚合而成的多酚类物质,是植物体内一种主要的天然代谢产物,广泛存在于维管植物次生结构中,对维持植物组织的硬度和刚性有着重要的意义[1-2]。咖啡酰辅酶A-O-甲基转移酶(CCoAOMT)属于植物甲基转移酶类,是木质素生物合成途径中的关键酶,在木质素合成时以咖啡酰辅酶A为底物,将S-腺苷甲硫氨酸上的甲基基团转移到木质素单体的苯环碳3位置上,形成阿魏酰辅酶A[3]。CCoAOMT的氨基酸序列具有A,B,C,D,E,F,G,H共8个保守序列元件,其中A, B和C元件是植物甲基化酶所共有的序列,而D,E,F,G和H元件为CCoAOMT特有[4]。作为木质素合成途径的关键酶,CCoAOMT的活性变化将直接调控木质素单体的合成,改变木质素在植物细胞壁中所占的比例,进而影响植物次生结构的强度[5-7]。
橡胶是一种重要的工业原材料,在国计民生中起着重要作用。目前世界上90%以上的天然橡胶均来源于巴西橡胶树。橡胶树树皮内层中的次生乳管细胞是天然橡胶合成和贮存的场所[8]。通过切割乳管使胶乳流出到乳管末端堵塞物形成导致排胶停止这一时间段被称为排胶的持续时间,与天然橡胶产量呈显著正相关[9]。次生乳管是由乳管细胞彼此连通形成的一种特化组织,保持约8~12个大气压的膨压[10]。在割胶后,乳管膨压作为胶乳排出的初动力,是影响排胶时间的重要内在因子[11]。目前人们主要从排胶动力和排胶阻力对排胶机制进行研究[12-15]。在排胶阻力方面,主要是探究橡胶凝集的机理,如Shi等[14]鉴定出C乳清中的Hevb7是胶乳中重要的抗凝集因子;在排胶动力方面,主要是解析乳管膨压形成的生理和分子机制,如An等[15]克隆了与膨压形成相关的水通道蛋白HbPIP2;3,并发现其在高产品种CATAS8-79中的表达量要远远高于PR107,但对于乳管细胞壁的物理性能对乳管膨压的影响尚未有报道。在本研究中,笔者从乳管细胞中克隆了一个木质素合成途径关键基因的同源基因HbCCoAOMT,分析了割胶和乙烯利刺激对该基因表达的影响,以及该基因在排胶时间有显著差异的两个橡胶树品种(CATAS8-79和PR107)间的表达模式与内层树皮木质素含量的相关性,初步揭示该基因的差异表达可能是影响乳管细胞壁木质素含量和乳管膨压的因素之一。
1 材料与方法
1.1 材料
1.1.1 实验用树 实验材料为种植于中国热带农业科学院试验场的割龄为3 a的巴西橡胶树无性系CATAS7-33-97、CATAS8-79和PR107,以及CATAS7-33-97的未开割树。
1.1.2 菌株及试剂 Escherichia coli DH10B菌株由本实验室保存。植物总RNA提取试剂盒和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;逆转录试剂盒购自Fermentas公司;克隆载体pEASY-Blunt Simple Cloning Vector购自北京全式金生物技术有限公司;QRT-PCR荧光染料试剂SYBR Ⅱ premix购自TaKaRa公司;引物合成和测序由Invitrogen公司(上海)完成;其他生化试剂和常规试剂均为进口或国产分析纯试剂。
1.2 方法
1.2.1 材料处理 割胶处理选用树围一致的CATAS7-33-97的未开割树和开割树单株,采用二分之一树围割制(S/2)冰上收集胶乳保存于液氮用于RNA的提取。乙烯利处理选用割龄为3 a的CATAS7-33-97开割树,选树围一致的单株,于割胶前2 d用0.5%乙烯利涂抹于割线及其上部约2 cm的割面,采用二分之一树围割制(S/2)冰上收集胶乳保存于液氮用于RNA的提取。木质素含量测定选取树围一致的CATAS8-79和PR107开割树单株,用打孔器取離地面1.2 m处树皮内层样品,液氮保存。另外选取树围一致的CATAS8-79和PR107开割树单株,采用二分之一树围割制(S/2)冰上收集胶乳保存于液氮用于RNA的提取。每种实验处理设3次重复,每个重复为等量混合3株树样品。
1.2.2 总RNA提取与cDNA合成 橡胶树RNA的提取参照RNAprep Pure多糖多酚植物总RNA提取试剂盒的操作说明进行。cDNA第一链的合成使用Fementas公司逆转录试剂盒(RevertAid First Strand cDNA Synthesis Kit),按照公司操作说明进行。
1.2.3 HbCCoAOMT基因的RACE扩增和全长cDNA扩增 从课题组前期胶乳转录组数据库中得到一段与CCoAOMT高度同源的Unigene30660片段,开放阅读框分析显示该序列含有5′UTR序列[9]。根据序列设计3′-RACE引物(3′-RACE-F: CCC AGG ATT GAG ATT TGC ATG,3′-RACE-R: TAC GTT TTT TTT TTT TT),采用Clontech公司Smarter TMRACE cDNA Amplification Kit试剂盒进行3′端序列的克隆。经DNAMAN 5.22软件对3′端序列与Unigene30660序列进行拼接获取HbCCoAOMT基因的全长序列(GenBank:KU301753)。以Primer Premier 5软件设计全长序列的PCR引物进行扩增验证。引物序列为:HbCCoAOMT-F(ATG GCT TCC AAC AAT GAA CAG)和HbCCoAOMT-R(TCA CTT GAT CCG ACG GCA GAG A)。50 μL扩增体系中含cDNA 1 μL、2×TaKaRa PrimeSTAR Max Premix缓冲液25 μL、上下游引物(25 μmol/L)各2 μL及ddH2O 20 μL。PCR程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸 1.5 min,共35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶分离后经天根生物技术有限公司的琼脂糖凝胶回收试剂盒纯化目的条带,克隆到全式金公司的pEASY-Blunt Simple Cloning Vector载体上,转化大肠杆菌感受态细胞并挑取阳性菌株送Invitrogen公司(上海)测序。
1.2.4 生物信息学分析 利用NCBI在线软件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)进行开放阅读框预测;采用DNAMAN 5.22软件对HbCCoAOMT基因翻译及多序列比对;利用WoLF PSORT在线软件(http://www.genscript.com/wolf-psort.html)进行推导蛋白的亚细胞定位预测;利用ProtParam在线软件(http://web.expasy.org/protparam/)进行推导蛋白的分子量与等电点预测;从NCBI数据库下载其他植物的CCoAOMT蛋白序列,利用软件MEGA4.0以Neighbor Joining(NJ)模型进行1 000次boot-strap统计学检验构建CCoAOMT蛋白系统进化树。
1.2.5 实时荧光定量PCR分析 采用Bio-Rad公司的CFX96实时荧光定量PCR系统进行HbCCoAOMT基因的相对定量表达分析。以合成好的cDNA第一链稀释10倍后作为荧光定量PCR分析的模板。HbCCoAOMT荧光定量引物为QPCR-HbCCoAOMT-F(GAA CCC ATG AAG GAG C)和QPCR-HbCCoAOMT-R(GGA AGA GCA AGA GCA G)。内参选取本课题组前期优化的橡胶树稳定内参HbUBC2b[16],引物序列为:QPCR-HbUBC2b-F(CGA CCA AGT TTT CAT TTC GGG TG)和QPCR-HbUBC2b-R(AGT CTC TTC TTT GCT GGG GTT G)。20 μL扩增体系中含cDNA 1 μL、2×TaKaRa SYBR Premix Ex Taq TMⅡ 10 μL、上下游引物(25 μmol/L)各1 μL及ddH2O 7 μL。QRT-PCR程序为:94 ℃预变性2 min;94 ℃变性 10 s,60 ℃复性20 s,72 ℃延伸20 s,共40个循环。利用CFX manager 3.0软件自动进行基线和Cq值分析。以HbUBC2b作为内参基因,采用2-△△Ct算法分析相对表达量。
1.2.6 橡胶树树皮内层木质素含量测定 木质素含量测定采用乙酰溴法[17]。将保存于液氮中的CATAS8-79和PR107树皮内层材料研磨成粉状,70 ℃烘箱干燥至恒重。各取5 mg干粉加入5 mL 30%乙酰溴(冰醋酸配制)和0.69 mol/L的高氯酸,封盖后置于70 ℃水浴1 h,而后加入10 mL 2 mol/L的NaOH和10 mL冰醋酸终止反应,并用冰醋酸定容至50 mL。以冰醋酸为空白对照,在OD=280 nm处测其吸光值,根据木质素回归曲线[17]计算所测样品中木质素含量。
2 结果与分析
2.1 HbCCoAOMT基因的克隆及生物信息学分析
通过3′-RACE方法及测序从橡胶树无性系CATAS7-33-97胶乳中得到1条长236 bp的片段,经DNAMAN将其与Unigene30660拼接后获得1条包含橡胶树HbCCoAOMT基因完整开放阅读框的cDNA序列(KU301753)。该序列长度为973 bp,含有1个741 bp的开放阅读框,5′端非翻译区为62 bp,3′端非翻译区为170 bp(图1)。ProtParam tool软件预测该基因编码了1个由246个氨基酸残基组成的蛋白,其分子量大小约为27.76 ku,理论等电点为5.255,属于弱碱性蛋白。亚细胞定位预测结果显示HbCCoAOMT蛋白定位于细胞质中。
2.2 HbCCoAOMT推导的氨基酸序列比对及进化树构建
序列相似性分析结果表明HbCCoAOMT蛋白序列与蓖麻RcCCoAOMT(XP_002518739.1)、棉花GhCCoAOMT(ACF48821.1)、杨树PeCCoAOMT(XP_
011000746.1)、油菜BrCCoAOMT(XP_009138259.1)、馬铃薯StCCoAOMT(XP_006339880.1)蛋白相似性分别为92%、90%、90%、87%和86%(图2),均含有CCoAOMT蛋白所特有A,B,C,D,E,F,G,H结构元件。
为研究橡胶树HbCCoAOMT与其他CCoAOMT蛋白在进化上的关系,选取葡萄[18]、烟草[19]、野茶树[20]、苜蓿[21]、黄麻[22]、玉米[6]、拟南芥[23]、辐射松[5]等8个物种的CCoAOMT蛋白序列,利用Mega 6.06软件,采用Neighbor-Joining,进行1 000次 bootstrap统计学检验构建进化树(图3)。聚类结果表明植物CCoAOMT蛋白家族可分为两个亚类(Ⅰ和Ⅱ),其中橡胶树与葡萄、烟草、野茶树、苜蓿归为Ⅰ亚类,并且与苜蓿的同源蛋白MsCCoAOMT亲缘关系最近(图3)。
2.3 割胶和乙烯利处理对HbCCoAOMT基因表达的影响
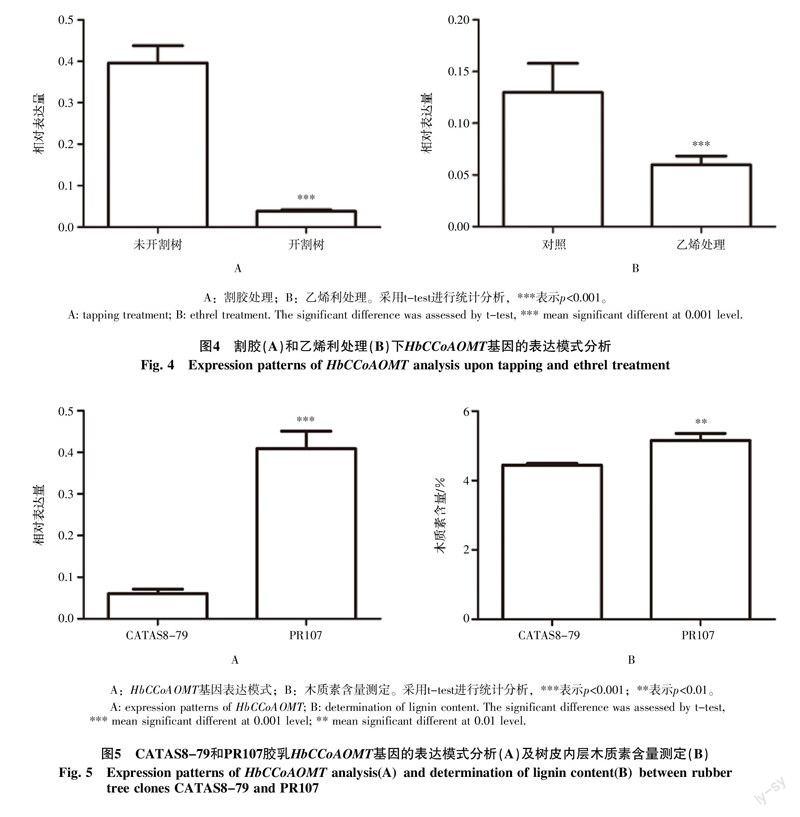
割胶是获取天然橡胶的唯一方式[10]。QRT-PCR结果表明HbCCoAOMT基因在开割树胶乳中的相对表达量仅为未开割树胶乳中的八分之一(图4-A),说明割胶可显著抑制HbCCoAOMT基因表达。乙烯利是一种乙烯释放剂,生产上可显著延长排胶时间达到增产的目的[24]。本研究发现施用乙烯利可显著下调HbCCoAOMT基因的表达,其相对表达量仅为对照组的一半(图4-B)。
2.4 不同橡胶树品种HbCCoAOMT基因的表达量与木质素含量测定
分别测定排胶时间长的橡胶树品种CATAS8-79和排胶时间短的橡胶树品种PR107胶乳中HbCCoAOMT基因的表达量以及其树皮内层的木质素含量。结果表明CATAS8-79的HbCCoAOMT基因表达量(图5-A)以及木质素含量(图5-B)均显著低于PR107。
3 讨论
植物细胞膨压是细胞吸水对细胞壁产生的压力,对于保持细胞的紧张度,维持植物体正常的生命活动有着重要的生理学意义[25]。根据细胞壁体积弹性模量学说,细胞壁的可塑性越大表明细胞壁越柔软,维持的膨压越高;相反细胞壁越坚硬,膨压也就越低[26]。木质素是植物细胞壁的成分之一,其含量高低与细胞壁的可塑性负相关,影响植物生长。Zhang等[27]对白桦的木质素合成关键基因BpCCR干涉后发现,与对照相比,转基因株系的木质素含量显著下降,但生长速度却得到了明显提高,这可能是由于木质素含量降低增强了细胞壁的可塑性,利于细胞膨大。谢兆森等[28]研究表明在葡萄的第1次快速生长期内果肉细胞膨压快速升高,这一过程伴随着维管束结构大量消失,认为木质素减少导致的细胞壁延伸性增强是葡萄果实急剧膨大的原因所在。在天然橡胶生产中,割胶后的排胶持续时间是影响天然橡胶产量的重要因素之一。不同橡胶树品种间排胶持续时间有明显差异,并且割胶和施用乙烯利均可显著延长排胶时间,进而达到增产的目的[9-10,24]。作为胶乳排出的初动力,人们长期以来对于乳管膨压的认识仅仅停留在水份进出乳管细胞以及割胶后的伤口阻碍方面[12-13,15,29],而忽视了次生乳管细胞壁的物理性能在其中的作用。
本研究从橡胶树胶乳中克隆了一个编码木质素合成途径关键酶CCoAOMT的基因的同源基因HbCCoAOMT。氨基酸序列分析表明,HbCCoAOMT具有典型的CCoAOMT家族保守结构域,其中A,B,E,F,G,H元件在不同成员间保守性较高,而C和D元件保守性较差,这可能与物种特异性有关。系统发生树分析表明HbCCoAOMT属于植物CCoAOMT家族I亚类,与来自苜蓿的同源蛋白MsCCoAOMT亲缘关系最近。在苜蓿中,抑制MsCCoAOMT基因的表达可显著降低木质素的含量,并且通过降低G型木质素单体进而改变G/S木质素比例[21]。割胶和乙烯利刺激均可显著延长橡胶树的排胶持续时间[10,24]。在排胶动力方面,主要认为乙烯利刺激的这种效应与调节水通道蛋白有关[15]。在排胶阻力方面,以往认为乙烯利刺激的这种效应与提高黄色体的稳定性有关[24]。但最近研究证明,这种效应与胶乳C-乳清中的一种Hevb7蛋白有关。该蛋白可抑制橡胶粒子与黄色体膜碎片和B-乳清中的蛋白结合,从而延缓乳管伤口堵塞[14]。在本研究中,发现割胶和乙烯利刺激均可显著下调HbCCoAOMT基因的表达,这可能导致乳管细胞壁的木质素含量降低,进而降低乳管细胞壁刚性,维持较高的乳管膨压,增大排胶的初动力。橡胶树品种CATAS8-79和PR107在排胶持续时间上存在显著差异,前者的排胶持续时间显著长于后者[9]。An 等[26]利用实时膨压测定仪测定了两者的树干树皮膨压,证明CATAS8-79的乳管膨压要明显高于PR107。本研究表明,HbCCoAOMT在CATAS8-79胶乳中的表达量显著低于PR107,并且CATAS8-79树皮内层的木质素含量也显著低于PR107。这些结果表明HbCCoAOMT差异表达可能与乳管细胞木质素含量差異有关,是影响乳管细胞壁的物理性能和乳管细胞膨压的因素之一。
参考文献
[1] Bonawitz N D, Kim J I, Tobimatsu Y, et al. Disruption of Mediator rescues the stunted growth of a lignin-deficient Arabidopsis mutant[J]. Nature, 2014, 509: 376-380.
[2] Mandal S, Kar I, Mukherjee A K, et al. Elicitor-induced defense responsesin Solanum lycopersicum against Ralstonia solanacearum[J]. Sci World J, 2013, 25: 561056.
[3] Whetten R, Sederoff R. Lignin biosynthesis[J]. Plant Cell, 1995, 7(7): 1 001-1 013.
[4] Joshi C P, Chiang V L. Conserved sequence motifs in plant S-adenosyl-L-methionine-dependent methyltransferases[J]. Plant Mol Biol, 1998, 37(4): 663-674.
[5] Wagner A, Tobimatsu Y, Phillips L, et al. CCoAOMT suppression modifies lignin composition in Pinus radiata[J]. Plant J, 2011, 67: 119-129.
[6] Li X, Chen W, Zhao Y, et al. Downregulation of caffeoyl-CoA O-methyltransferase(CCoAOMT)by RNA interference leads to reduced lignin production in maize straw[J]. Genet Mol Biol, 2013, 36: 540-546.
[7] Li W, Tian Z, Yu D. WRKY13 acts in stem development in Arabidopsis thaliana[J]. Plant Sci, 2015, 236: 205-213.
[8] Chow K S, Mat-Isa M N, Bahari A, et al. Metabolic routes affecting rubber biosynthesis in Hevea brasiliensis latex[J]. J Exp Bot, 2012, 63: 1 863-1 871.
[9] Chao J, Chen Y, Wu S, et al. Comparative transcriptome analysis of latex from rubber tree clone CATAS8-79 and PR107 reveals new cues for the regulation of latex regeneration and duration of latex flow[J]. BMC Plant Biol, 2015, 15: 104.
[10] Tang C, Huang D, Yang J, et al. The sucrose transporter HbSUT3 plays an active role in sucrose loading to laticifer and rubber productivity in exploited trees of Hevea brasiliensis(para rubber tree)[J]. Plant Cell Environ, 2010, 33(10): 1 708-1 720.
[11] Jacob J L, Prevot J C, Roussel D, et al. Physiology of Rubber Tree Latex[M]. Boca Raton, Fla. : CRC Press, 1989: 345-382.
[12] Buttery B R, Boatman S G. Turgor Pressures in Phloem: Measurements on Hevea Latex[J]. Science, 1964, 145: 285-286.
[13] 安 锋, 曾宪海, 林位夫. 橡胶树乳管膨压的测定技术及其变化规律[J]. 热带作物学报, 2010, 31(1): 151-157.
[14] Shi M J, Cai F G, Tian W M. Ethrel-stimulated prolongation of latex flow in the rubber tree(Hevea brasiliensis Müll. Arg.): an Hev b 7-like protein acts as a universal antagonist of rubber particle aggregating factors from lutoids and C-serum[J]. J Biochem, 2016, 159(2): 209-216.
[15] An F, Zou Z, Cai X, et al. Regulation of HbPIP2;3, a Latex-Abundant Water Transporter, Is Associated with Latex Dilution and Yield in the Rubber Tree(Hevea brasiliensis Müll. Arg.)[J]. PLoS One, 2015, 10(4): e0125595.
[16] Chao J, Yang S, Chen Y, et al. Evaluation of reference genes for quantitative real-time PCR analysis of the gene expression in laticifers on the basis of latex flow in rubber tree(Hevea brasiliensis Müll. Arg.)[J]. Front Plant Sci, 2016, 7: 1 149.
[17] 王建慶, 曹佃元, 张 玉. 乙酰溴法测定棉籽壳中木质素的含量[J]. 纺织学报, 2013, 34(9): 12-16.
[18] Busam G, Junghanns K T, Kneusel R E, et al. Characterization and expression of caffeoyl-coenzyme A 3-O-methyltransferase proposed for the induced resistance response of Vitis vinifera L[J]. Plant Physiol, 1997, 115: 1 039-1 048.
[19] Martz F, Maury S, Pinc, on G, et al. cDNA cloning, substrate specificity and expression study of tobacco caffeoyl-CoA 3-O-methyltransferase, a lignin biosynthetic enzyme[J]. Plant Mol Biol, 1998, 36(3): 427-437.
[20] Zhang Y, Lv H P, Ma C Y, et al. Cloning of a caffeoyl-coenzyme A O-methyltransferase from Camellia sinensis and analysis of its catalytic activity[J]. J Zhejiang Univ Sci B, 2015, 16(2): 103-112.
[21] Guo D, Chen F, Inoue K, et al. Downregulation of caffeic acid 3-O-methyltransferase and caffeoyl CoA 3-O-methyltransferase in transgenic alfalfa impacts on lignin structure and implications for the biosynthesis of G and S lignin[J]. Plant Cell, 2001, 13(1): 73-88.
[22] Zhang G, Zhang Y, Xu J, et al. The CCoAOMT1 gene from jute(Corchorus capsularis L.)is involved in lignin biosynthesis in Arabidopsis thaliana[J]. Gene, 2014, 546(2): 398-402.
[23] Do C T, Pollet B, Thévenin J, et al. Both caffeoyl Coenzyme A 3-O-methyltransferase 1 and caffeic acid O-methyltransferase 1 are involved in redundant functions for lignin, flavonoids and sinapoyl malate biosynthesis in Arabidopsis[J]. Planta, 2007, 226(5): 1 117-1 129.
[24] Zhu J, Zhang Z. Ethylene stimulation of latex production in Hevea brasiliensis[J]. Plant Signal Behav, 2009, 4: 1 072-1 074.
[25] Chen L Y, Shi D Q, Zhang W J, et al. The Arabidopsis alkaline ceramidase TOD1 is a key turgor pressure regulator in plant cells[J]. Nat Commun, 2015, 16(6): 6030.
[26] Steudle E. Water Deficits: Plant Responses from Cell to Community[M]. Oxford, UK: Bios Scientific Publishers, 1993: 5-36.
[27] Zhang W, Wei R, Chen S, et al. Functional characterization of CCR in birch(Betula platyphylla × Betula pendula)through overexpression and suppression analysis[J]. Physiol Plant, 2015, 154(2): 283-296.
[28] 謝兆森, 曹红梅, 李 勃, 等. 巨峰葡萄果实不同发育期维管束水分运输变化[J]. 中国农业科学, 2012, 45(1): 111-117.
[29] An F, Cahill D, Rookes J, et al. Real-time measurement of phloem turgor pressure in Hevea brasiliensis with a modified cell pressure probe[J]. Botanical Studies, 2014, 55: 19.
