LACCLR2细菌漆酶性质及其脱色作用的研究
2016-05-30刘岩刘锐苏新国赵冠里胡源媛
刘岩 刘锐 苏新国 赵冠里 胡源媛

摘 要:该试验以LACCLR2细菌漆酶为研究对象,对漆酶的酶学性质以及漆酶对染料的降解脱色效果进行了研究,结果表明:漆酶反应的最适温度是50℃,最适pH为6,铜离子浓度为0.01%时酶活力最高。针对染料的脱色实验,靛蓝最显著,褪色率达到77.4%,COD/BOD提高了43.5%。
关键词:细菌漆酶;酶学性质;染料脱色
中图分类号 TQ925 文献标识码 A 文章编号 1007-7731(2016)18-0029-04
Study of LACCLR2 Bacterial Laccase Properties and Decolorization
Liu Yan1 et al.
(1Guangdong Food and Drug Vocational College,Guangzhou 510520,China)
Abstract:In this experiment,LACCLR2 as research subject,we studied its enzymatic properties and dye decolorization,conclusion as below:The optimum reaction temperature is 50℃,The optimum reaction pH is 6,the optimum copper ion concentration is 0.01%. Indigo decolorization most significant effect,decolorization rate is 77.4%.
Key words:Bacterial Laccases;Enzymatic properties;Decolorization
1 引言
漆酶(EC1.10.3.2)又名蓝色多铜氧化酶,是一种含铜的多酚氧化酶,其与植物中的抗坏血酸氧化酶、哺乳动物的血浆铜蓝蛋白都是属于蓝色多铜氧化酶家族[1]。漆酶是一种可催化漆固化过程的蛋白质,由日本学者吉田在漆树的漆液中首先发现。漆酶可以氧化包括酚类、多酚类、苯胺、木质素、多环芳香烃甚至无机物等一系列物质,以分子氧气为电子受体,生成唯一的副产物是水。漆酶在印染废水处理、食品生产等领域具有广泛的应用前景,受到了世界科学界的重视。
长期以来,人们一直以为漆酶仅仅存在于真核生物。1993年,Givaudan在水稻根周围的土壤中分离出一株产漆酶的脂固氮螺菌,证实了原核生物也可以产生漆酶[2]。2000年,Alexandre通过生物信息学技术,证实漆酶普遍存在于原核生物中。如今人们在大肠杆菌、枯草芽孢杆菌、抗生链霉菌、交互单胞菌、嗜热栖热菌等多种原核生物中都检测到了漆酶的存在。
漆酶主要有三类,分别是植物漆酶、真菌漆酶和细菌漆酶。其中,植物漆酶很难被检测和纯化,真菌漆酶又不耐受高温和碱性环境,而通过对细菌漆酶的研究发现,细菌一般为单体蛋白,具有较好的稳定性,偏向碱性的最适作用pH,抑制剂少,可以克服植物漆酶和真菌漆酶应用的缺点,因而具有巨大的应用潜力。但目前关于细菌漆酶的研究还较少,严重阻碍了细菌漆酶的应用,因此,开展对细菌漆酶的广泛研究具有重要的意义。
2 材料与方法
2.1 主要材料
2.1.1 产漆酶细菌菌种 本课题组提供。
2.1.2 试验器皿 三角瓶、烧杯、量筒、试管、玻璃棒、容量瓶、滴管、试管架、比色皿、移液枪、离心管、保鲜膜、pH试纸、培养皿、pH计。
2.1.3 试验设备 GT16-3小型台高速离心机(广州市正一科技有限公司);BCD-222@HC华凌冰箱(华凌集团有限公司);722G可见光分光光度计(上海仪器分析仪器有限公司);SW-CJ-2FD双人洁净工作台(苏州安泰空气技术有限公司);HR-4数显恒温水浴锅(常州澳华仪器有限公司);电子天平(广州市正一科技有限公司);YH系列电热器(江苏建湖近湖镇教学仪器厂);精密电子天平(赛多利斯科学仪器(北京)有限公司);PHS-25实验室pH计(上海虹益仪器仪表有限公司);高压蒸汽灭菌锅(上海三申医疗器械有限公司);JY92-IIN超声波细胞破碎机(宁波新芝生物科技股份有限公司)。
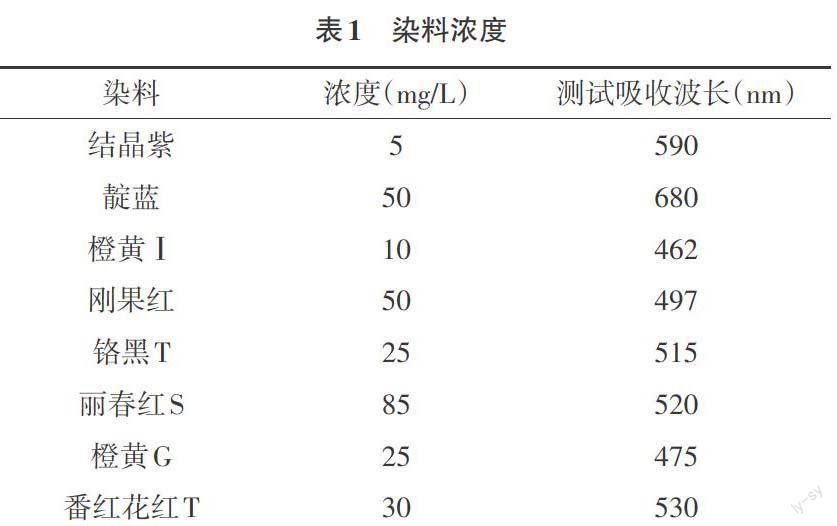
2.1.4 试剂 愈创木酚(阿拉丁);95%乙醇(天津市富宇精细化工有限公司);硫酸铜(天津市光复科技发展有限公司);NaCl(广东环凯微生物科技有限公司);酵母膏(广东环凯微生物科技有限公司);蛋白胨(天津市福晨化学试剂厂);结晶紫(阿拉丁);橙黄Ⅰ(阿拉丁);刚果红(阿拉丁);铬黑T(天津市天新精细化工开发中心);丽春红S(阿拉丁);磷酸氢二钾(天津市大茂化学试剂厂)。
2.1.5 改良LB培养基 酵母膏0.5%、蛋白胨1%、NaCl0.5%、硫酸铜0.04%、琼脂1.5%、pH为7.4[3]。
2.2 试验方法
2.2.1 漆酶粗酶液的制备 (1)从平板中将单菌落接入5mL液体培养基的试管里,37℃培养箱培养2d。(2)把试管的培养液转入100mL锥形瓶中,37℃培养箱培养2d。(3)将培养好的菌液倒入4mL的离心管,然后离心3min,离心速度为9 000r/min,舍弃上清液。(4)用40mL水将离心沉淀的菌体复溶。(5)用细胞破碎仪破碎菌体,设定参数为全程破碎时间60min,功率为45%,每次3s,每次间隔3s。(6)破碎完毕,将细胞破碎液以12 000r/min的速度离心20min,丢弃沉淀,上清液即为所需粗酶液,置于4℃冰箱保藏备用。
2.2.2 酶活的测定 制备4mL的反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%。然后每4mL的反应体系中分别加入0.2mL之前制备的粗酶液,在50℃水浴中反应30min,测出反应后OD465差值。每个反应都须平行三次。以每1min消耗1μmol底物定义为一个漆酶活力单位,以U/L表示。
2.2.3 漆酶酶学性质的研究
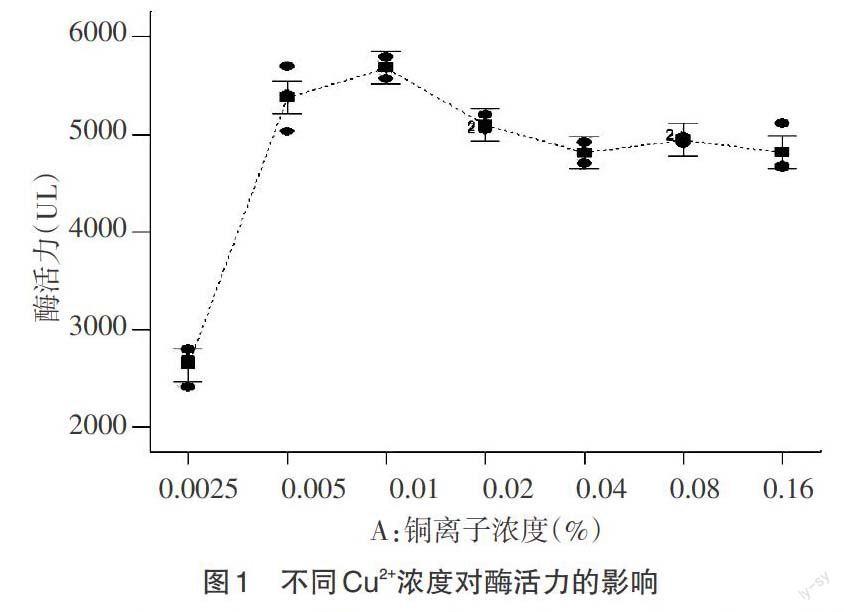
2.2.3.1 最适Cu2+浓度 取4mL反应体系,愈创木酚的浓度为0.05%(50μL愈创木酚加到100mL去离子水),而Cu2+浓度各个不相同,其浓度依次为0.0025%、0.005%、0.01%、0.02%、0.04%、0.08%、0.16%。将全部反应体系置于37℃预热5min后,每个反应体系加入0.2mL粗酶液,对照组添加相同量的灭活酶液。均置于37℃恒温水浴锅中水浴30min,测其反应前后OD465,每组平行三次,求平均值。
2.2.3.2 最适温度 制备4mL的反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%,每4mL的反应体系中加入0.2mL制备的粗酶液,然后摇匀。不同反应体系分别放入30℃、35℃、40℃、45℃、50℃、55℃、60℃恒温水浴锅水浴30min,对照组添加相同量的灭活酶液,测其OD465,每组平行三次,求平均值。
2.2.3.3 最适pH 制备4mLpH分别为3、4、5、6、7、8、9的反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%。向每个反应体系加入0.2mL粗酶液,对照组添加相同量的灭活酶液。均置于50℃恒温水浴锅中水浴30min,测其反应前后OD465,每组平行三次,求平均值。
2.2.3.4 温度稳定性 制备4mL反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%。向每个反应体系分别加入0.2mL经过50℃、60℃、70℃、80℃水浴预处理过的粗酶液。对照组则添加相同量的灭活酶液。摇匀后均置于50℃恒温水浴锅中水浴30min,测其反应前后OD465,每组平行三次,求平均值。
2.2.3.5 漆酶对染料的脱色效果研究 (1)酶对靛蓝的脱色。制备4mL靛蓝溶液反应体系,其中硫酸铜的浓度为0.01%,向每个反应体系加入0.2mL粗酶液,对照组添加相同量的灭活酶液。均置于50℃恒温水浴锅中水浴30min,测其反应前后OD465,每组平行三次,求平均值。(2)其他染料的脱色。按照对靛蓝的脱色实验,对结晶紫、刚果红、橙黄Ⅰ、丽春红S、橙黄G、铬黑T做相似的脱色实验,算出脱色率,比较各个染料的脱色效果(表1)。
2.3 COD/BOD测定 COD按照国标GB11914-1989测定,BOD按照标准HJ505-2009测定。
2.4 计算
2.4.1 酶活力的计算 酶活力以样品与底物反应30min后变化的OD值表示,以1min单位体积酶液消耗1μmol漆酶底物定义为一个漆酶活力单位,以U/L表示[4]。已知愈创木酚在465nm处消光系数ε=48mmol·L-1·cm-1。公式如下:
[U=OD×Vt×ε×10-6×V0] (2)
式中:OD:吸光度增加值;t:反应时间(min);V:反应体积(mL);ε:消光系数;V0:酶液体积(mL)。
2.4.2 脱色率的计算 根据染料溶液颜色深浅与吸光值呈现线性关系,可用分光光度计在相对应的波长下测量该染料的吸光值便可反应出染料的颜色变化。公式如下:
脱色率(%)=[(Ao-A)/Ao]×100
式中:A—经脱色反应后溶液的吸光值;A0—脱色反应前溶液的吸光值。
3 结果与分析
3.1 酶活力的测定 以愈创木酚为底物,50℃反应30min,用分光光度法测其OD值,每组平行三次,求其平均值,可得该漆酶的酶活力为8 750U/L(表2)。
3.2 漆酶的酶学性质
3.2.1 最适Cu2+浓度 以愈创木酚为反应底物,添加不同浓度的Cu2+,50℃反应30min,用分光光度法测其OD值,每组平行三次,求其平均值。采用Design-Expert软件处理对实验数据进行分析处理。如图1所示,Cu2+浓度在0.002 5~0.01,酶活力随着Cu2+浓度增加而增加,在0.01~0.05随着铜离子的浓度增加有少量下降,在0.05~0.16,酶活较为稳定,其中在Cu2+浓度在0.01%时,酶活力达到最大值。由此判断0.01%为实验漆酶的最适Cu2+浓度。当Cu2+浓度超过0.01%时,酶活力会有所下降,但是下降幅度并不大,故少量Cu2+可以提高漆酶活力,但过高Cu2+浓度也会抑制漆酶酶活力。
3.2.2 最适温度 制备4mL的反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%,每4mL的反应体系中加入0.2mL制备的粗酶液,然后摇匀,再至于不同的温度下反应30min,用分光光度法测其OD值,每组平行三次,求其平均值。采用Design-Expert软件处理对实验数据进行分析处理。如图2所示,当反应体系的温度在30~50℃时,随着温度的增加酶活力也相对应地增加,并在50℃时酶活力达到最大值,故50℃为最适温度。在50~60℃,酶活力有所下降,故温度过高或者过低都会抑制漆酶的酶活力,反应中应该注意让反应温度在最适温度附近,利于漆酶催化反应。由图2可知,在60℃的时候,酶活力还相对较高,故可推断出说明该酶能在较高温度催化反应。
3.2.3 最适pH 制备4mLpH分别为3、4、5、6、7、8、9的反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%。向每个反应体系加入0.2mL粗酶液,50℃下反应30min。采用Design-Expert软件处理对实验数据进行分析处理。如图3所示,pH为3时酶基本丧失活性,而在pH4~9,虽有所下降,但是下降幅度非常小,仍具有较高的酶活力,其中当pH为6时酶活最高,是酶的最适作用pH。试验证明本漆酶对pH有较强的适应能力,在偏酸性、中性和偏碱性条件下该漆酶均可以发挥催化作用,这有利于其在工业上的应用。
3.2.4 漆酶的热稳定性 制备4mL反应体系,其愈创木酚的浓度为0.05%,硫酸铜的浓度为0.01%。向每个反应体系分别加入0.2mL经过50℃、60℃、70℃、80℃水浴预处理过的粗酶液,50℃下反应30min,测其OD值,平行3次,取其平均值。采用Design-Expert软件处理对实验数据进行分析处理。如图4所示,漆酶经50℃处理30min后,酶活力损失达60.5%,并且随着处理温度的上升,酶活力损失率逐步提高,即酶活力逐步下降,在80℃处理30min后,酶活力损失率更是达到了98.5%。故该酶经过高温处理后,酶活力会显著下降,即对温度稳定性较差。
3.2.5 漆酶对染料的脱色效果 由于漆酶能够催化许多芳香族酚类物质氧化,试验中为了研究该漆酶对于不同种类的染料的作用效果,选用多种染料如靛蓝、结晶紫、刚果红、橙黄Ⅰ、丽春红S、橙黄G、铬黑T等进(下转39页)(上接31页)行脱色实验,通过算出脱色率如表3所示。分析酶对染料的脱色效果,结果显示:对照组还呈现较明显的蓝色,而实验组的颜色基本褪去。因此,添加了漆酶的实验组对靛蓝有较明显的脱色效果。
3.3 测定靛蓝的COD/BOD值 按照标准的方法,处理前靛蓝的COD/BOD为13.1%,处理后靛蓝的COD/BOD为18.8%,提高率为43.5%。
4 讨论与结论
本文针对课题组提供的产漆酶菌株,探究其胞内产酶的酶学性质,也对该漆酶的应用做了初步的试验研究。根据上述的实验结果进一步分析可知,Cu2+是该漆酶的激活剂,在一定范围内Cu2+可以提高漆酶的酶活力。加入反应体系中的Cu2+浓度在0.01%时,漆酶的酶活力明显增加,酶活力为8 750U/L,酶活力提高了2.2倍,故0.01% Cu2+为该漆酶催化反应的最适添加量。该漆酶的较适宜的温度范围是45~50℃,其中50℃为该漆酶的最适温度,而且在60℃时酶仍能保持较高酶活,酶活力仅损失4.9%,说明该酶作用温度较高。同时发现该酶经不同温度下处理过后,酶活力损失较大,在50℃时就达到了60.5%,到80℃时更是达到了98.5%,故该酶稳定性并不好。该漆酶对pH适应性较强,pH范围在4~9时,酶活力较高且较稳定,并在pH为6时达到最大值,故pH为6是该漆酶的最适作用pH。
查阅文献发现漆酶对较多染料有脱色作用。本试验中用该漆酶对多种染料如结晶紫、铬黑T、刚果红、橙黄Ⅰ、丽春红、橙黄G等进行降解脱色试验,结果表明,该漆酶对靛蓝有较明显的脱色效果,脱色率达77.4%,对其他染料则无明显的脱色效果。
参考文献
[1]韩君莉,郭丽琼,林俊芳.漆酶结构的研究进展[J].生物加工过程,2006,04:1-6.
[2]GivaudanA,EffosseA,FaureD,et al.Polyphenol oxidase in Azospirillum lipoferum isolated from rice rhizosphere:Evidence for laccase activity in non-motile strains of Azospirillum lipoferum[J].FEMS Microbiology Letters,1993,108:205
[3]徐腾飞,卢磊,赵敏,等.一株产漆酶细菌的分离鉴定及酶学性质研究[J].微生物学通报,2013,40(25903):434-442.
[4]林俊芳,刘志明,陈晓阳,等.真菌漆酶的酶活测定方法评价[J].生物加工过程,2009,7(4):1-8.
