水稻糊粉层PCD过程细胞形态观察
2016-05-30郑岩李江杨鹏陈惠萍
郑岩 李江 杨鹏 陈惠萍


摘 要 糊粉层细胞程序性死亡(programmed cell death,PCD)是水稻(Oryza Sativa L.)种子萌发过程中的关键事件。为探明水稻糊粉层细胞程序性死亡过程中细胞形态的变化,利用荧光显微技术结合染色方法对不同萌发时间的水稻种子糊粉层细胞形态进行了观察。结果显示:糊粉层细胞死亡过程中液泡呈现2种变化类型,液泡化的最终形态也有所差异;糊粉层细胞死亡的发生与液泡化程度紧密联系,并且与胚的生长及距离有明显的时间效应和位置效应。
关键词 水稻;糊粉层;细胞程序性死亡;液泡化
中图分类号 S511 文献标识码 A
The Cell Morphology of Rice Aleurone
Layers During Programmed Cell Death
ZHENG Yan,LI Jiang,YANG Peng,CHEN Huiping*
College of Horticulture and Landscape Architecture,Hainan University,Haikou,Hainan 570228,China
Abstract The programmed cell death(PCD)of aleurone layers is a key event in the germination of Oryza sativa L seeds. In this study,in order to investigate the changes of cell morphology of rice aleurone layers in PCD,cell morphology were examined at different germinating time and in different parts by combining staining methods and observation of fluorescent microscope. The results showed that aleurone cells displayed two types of vacuolar change and the final forms of the two vacuolation were different during the PCD course of aluerone layers. In addition,the PCD progress of aleurone layers was closely correlated with the degree of vacuolization, and which has obvious time- and position effect with the growth of embryo and the distance from embryo. then resulting in the cell death of aleurone layers.
Key words Rice;Aleurone layer;Programmed cell death;Vacuolation
doi 10.3969/j.issn.1000-2561.2016.02.014
禾谷类作物的胚乳分为淀粉性胚乳和糊粉层。当籽实成熟时,淀粉性胚乳细胞死亡,只有糊粉层细胞有活性。在禾谷类作物种子萌发和幼苗形成时,糊粉层细胞合成并分泌多种水解酶到胚乳中,提供营养给胚,供其生长发育需要。当糊粉层细胞完成分泌作用时,细胞发生死亡,这种死亡称为细胞程序性死亡(programmed cell death,PCD)[1-2],是由特定基因调控的死亡过程。研究表明,糊粉层细胞程序性死亡是禾谷类种子萌发过程的关键环节[2-6]。
液泡在植物PCD中起着重要的作用[7-9],它是PCD启动阶段各种水解酶和其它死亡执行者的集散地。液泡的崩解是植物PCD中关键的步骤。液泡介导的细胞死亡的最后一步就是液泡膜的破裂和液泡水解酶的大量释放,其中被释放和激活的蛋白酶促进了细胞质的降解[10]。因此,液泡膜破裂是植物细胞程序性死亡的重要过程[11]。大麦糊粉层细胞在死亡之前开始高度的液泡化,细胞质内的相关细胞器内含物迅速降解[5]。在糊粉层细胞高度液泡化及液泡膜破裂前,其细胞仍然是活细胞。因此,糊粉层细胞液泡化的程度可以作为描述糊粉层PCD进程的形态学依据。
目前,除大麦[1,3,5,12]外,关于其它禾谷类种子糊粉层细胞程序性死亡过程的细胞形态变化的研究较少,因此,还难于从分子水平探讨糊粉层细胞程序性死亡的机制。在本研究中,笔者利用荧光染色法结合荧光显微镜对萌发水稻种子的糊粉层细胞形态进行了观察,以期为进一步开展糊粉层细胞死亡的研究提供理论依据。
1 材料与方法
1.1 材料
供试材料为水稻(Oryza Sativa L.)品种优Ⅱ128, 用0.1%高锰酸钾溶液消毒其种子5 min,经蒸馏水冲洗干净后,放入含10 mL蒸馏水的垫有双层滤纸的培养皿中,置于光照培养箱中,每日光照12 h,强度为400 μmol/(m2·s),昼夜温度为25 ℃/20 ℃。分别在种子萌发后的1、3、5、8、14 d ,从萌发种子的近胚端和远胚端剥取糊粉层,用于细胞形态观察。
1.2 方法
1.2.1 AO染色法 剥离出单独的糊粉层,用8.5 μg/mL吖啶橙(Acridine orange,AO)工作液染色15 min,洗去背景荧光后,用荧光显微镜(Nikon Eclipse 80i,Japan)观察细胞DNA荧光,所用的激发滤光片波长为488 nm,阻断滤光片波长为515 nm,观察的同时进行拍照。
1.2.2 水稻糊粉层的分离和原生质体的制备 将水稻种子置于20%漂白剂中消毒20 min,并用无菌水清洗数次;浸种4 h后,置于消毒的培养皿中培养4 d,除去胚根和胚芽,残留的部分用无菌水冲洗;在无菌条件下,将种子和胚根、胚芽分离,并用手术刀片分离糊粉层;将分离的糊粉层收集于调整过的Gamborgs B-5培养基(内含20 mmol/L CaCl2, 0.1 mol/L葡萄糖和0.6 mol/L甘露醇),转移到含5% 纤维素酶和1 mmol/L DTT调整过的Gamborgs B-5培养基,在室温下震荡1 h,然后转入不含纤维素酶和DTT调整过的Gamborgs B-5培养基,震荡至少30 min;取12粒种子的糊粉层转入3 mL含5%纤维素酶和1 mmol/L DTT(内含150 units/mL nystatin,0.1mg/mL cefotaxime)的新鲜培养基,放置24 h;用手术刀片刮下糊粉层上的原生质体,以500 r/min离心3 min收集原生质体;将原生质体重新悬浮在调整过的Gamborgs B-5培养基中,首先用105 μm孔径的筛子过滤,除去碎片;然后用10 μm孔径的筛子,滤过残留的淀粉粒;用MaMgEMS溶液[内含15 mmol/L MgCl2·6 H2O,0.1% MES(pH 5.6),0.6 mol/L甘露醇]收集筛子上的原生质体。
2 结果与分析
2.1 水稻种子糊粉层PCD过程液泡变化类型
通过对正常条件下水稻糊粉层PCD形态变化的观察,发现水稻糊粉层细胞发生死亡时,其形态变化随糊粉层细胞位置和萌发时间的不同而异。同一时期的水稻种子,靠近胚端的糊粉层细胞从远胚处到近胚处(图1-a~e),细胞的变化是蛋白贮藏小泡之间逐渐融合变大,但最终蛋白贮藏小泡很可能破裂,不形成中央大液泡(图1-e)。而在靠近种子远胚端的糊粉层细胞,随着时间的延长,蛋白贮藏小泡之间逐渐融合,最终形成一个中央大液泡,并把细胞核挤到细胞边缘(图1-E)。为了便于对糊粉层细胞的形态进行分类,把这2种不同位置(靠近胚端、糊粉层中部)的细胞死亡形态变化人为分为2种类型(Ⅰ和Ⅱ),每个类型都各经历5个变化阶段。类型Ⅰ包括a、b、c、d、e阶段;类型Ⅱ包括A、B、C、D、E阶段。这2种类型的主要差别在于糊粉层细胞最终是否形成中央大液泡(图1-e和图1-E)。
2.2 萌发的水稻种子糊粉层发生PCD的细胞特征
通过对正常条件下培养4 d的水稻糊粉层细胞进行吖啶橙(Acridine orange,AO)染色,并用荧光显微镜观察(图2),发现AO的荧光强度与胚的位置之间存在对应关系,即离胚越远,荧光强度越强(图2-A)。进一步观察还发现,在最靠近胚的地方部分(图2-B、图2-D)细胞的液泡化已经结束,细胞中央只有一个细胞核,在形态上表现出了类型I-e的特点(图2-d);较近胚的糊粉层细胞逐步表现出胞内有少数贮藏蛋白小泡,类似类型Ⅰ-d的特点(图2-e)。而离胚稍远的细胞则体现出Ⅱ-B的特点(图2-f)。通过AO染色,发现在正常培养条件下,糊粉层细胞荧光强度与液泡化之间存在负相关,即液泡化程度越高,荧光强度越低。
2.3 近胚端糊粉层发生PCD的细胞特征
通过对正常条件下培养6 d的糊粉层细胞进行观察,发现随着培养时间的延长,近胚端糊粉层细胞的液泡化、与胚的距离及AO染色荧光强度这三者之间的关系更加明显(图3)。总体上仍为:距离胚越近的糊粉层细胞,AO染色荧光强度越低,甚至有的细胞表现出阴性;距离胚越远的糊粉层细胞AO染色荧光强度越高(图3-A)。通过对不同部位糊粉层细胞的进一步观察,发现这5个区域(图3-b~f)的细胞依次表现出类型Ⅰ的a、b、c、e阶段的细胞特点和液泡化特征。随着液泡化的进行,AO染色荧光逐渐降低,最终消失(图3-B~F)。说明在正常情况下,糊粉层细胞在液泡化的同时伴随着PCD的发生。
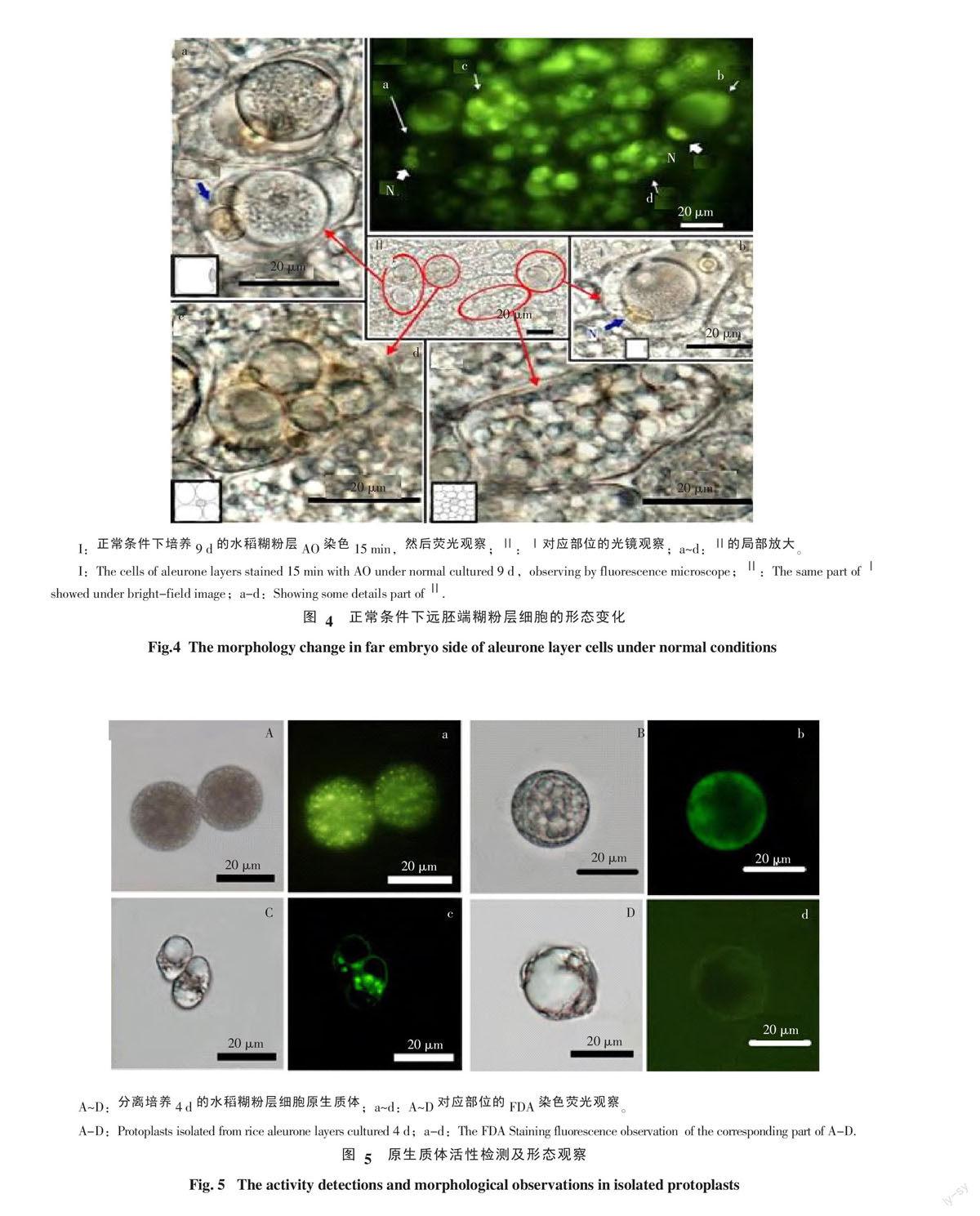
2.4 远胚端糊粉层发生PCD的细胞特征
通过对正常条件下萌发水稻种子的远胚端糊粉层细胞的观察(图4-Ⅰ、图4-Ⅱ),发现在正常处理9 d后的远胚端糊粉层,细胞液泡化类型比较多样,在同一区域出现了类型Ⅱ-B(图4-d)、类型Ⅱ-D(图4-c)类型Ⅱ-E(图4-a、图4-b)。通过AO荧光染色观察,发现这几类不同液泡化水平的细胞AO染色均呈阳性,同时类型Ⅱ-E(图4-a、图4-b)的细胞核被中央大液泡挤到细胞一侧边缘,AO染色呈现明显的绿色荧光,说明DNA没有被降解。
2.5 水稻糊粉层细胞原生质体的形态观察
通过用FDA染色可检测糊粉层原生质体的活性。从图5可以明显地看出,随着液泡化的发生,贮藏蛋白小泡逐渐变大并几乎占据细胞质整个空间。一开始,蛋白贮藏小泡较小,均匀分散在细胞质中,因此,整个细胞质都呈现均匀的FDA荧光(图5-A);当糊粉层细胞发生液泡化,细胞质逐渐被挤到蛋白贮藏小泡外围,分布在细胞膜内侧(图5-B);随着液泡化程度的加深,细胞质被2个大液泡压缩成一小部分,处于2个大液泡间,大液泡另一侧则与细胞膜重合(图5-C);最后中央大液泡占据整个细胞,细胞膜的完整性被破坏,细胞死亡,FDA染色呈阴性(图5-D)。
3 讨论与结论
正常条件下种子萌发过程中,在胚释放出的赤霉素(GA)诱导下,糊粉层细胞产生一系列水解酶(水解酶、蛋白酶等)以分解胚乳中贮藏的营养物质[13],使胚乳组织从盾片向顶端逐渐解体,胚乳逐渐形成胶状体;随后糊粉层细胞内的糊粉粒与原球体开始解体,为胚的前期生长提供养分。当糊粉层细胞完成分泌功能后,发生细胞程序性死亡,剩余部分相互融合并液泡化,最终成为无结构的液滴[14]。Fath等[1-2]研究发现,大麦糊粉层细胞死亡过程伴随着液泡化、质膜完整性丧失、蛋白酶和核酸酶活力增加、细胞消失,同时DNA降解后不形成典型的180~200 bp的DNA条带,类似细胞自溶, 具有非典型凋亡PCD的特点, 本研究也证实了糊粉层细胞PCD的过程中并不形成180~200 bp的DNA条带(数据未列)。 Bethke等[5]提出大麦糊粉层细胞的液泡化可以作为形态学特征之一,用以反映细胞PCD的进程。
通过本研究发现,在正常条件下糊粉层细胞的液泡化在形态上可以反映糊粉层细胞PCD的进程。同时发现糊粉层细胞液泡化不但具有时间效应, 还同时具有位置效应(图1~4)。 为了便于对糊粉层液泡化的细胞形态进行分析研究,把2种最终液泡化形态不同的细胞人为分为2种类型(Ⅰ和Ⅱ), 每个类型都各经历5个变化阶段, 即类型Ⅰ包括a、 b、c、 d、 e阶段;类型Ⅱ包括A、 B、 C、 D、 E阶段(图1)。 类型Ⅰ主要分布在近胚端糊粉层,类型Ⅱ主要分布在远胚端糊粉层。
类型Ⅰ细胞靠近胚的地方, 受胚的影响较大,胚分泌的一些激素(如GA)对其产生显著影响, 同时其自身分泌的酶类和生物活性物质也较多,对细胞形态和功能均会造成一定的影响,最终导致类型Ⅰ在经历阶段d、 e后糊粉层细胞不形成完整的中央大液泡,类型Ⅰ糊粉层细胞相同时间内发生液泡化的程度与胚的位置有关。 经AO荧光染色后, 发现DNA的降解在空间上表现出明显的梯度: 距离胚越近, DNA降解越快, 液泡化程度越大(图2、3)。 Bethke等[5,12] 的研究也证明了大麦活体糊粉层细胞PCD受到胚的位置调控, 靠近胚的糊粉层细胞最先发生PCD,这可能与胚产生的植物激素GA和ABA的互相拮抗有关。
类型Ⅱ细胞由于离胚较远, 受胚的影响较小,细胞形态的变化在位置上表现不明显,有时在同一位置出现多种类型液泡化的细胞(图4)。 糊粉层细胞形态的变化, 也主要反映在不同时间上(图1-A~E), 在经历阶段D、E后,形成中央大液泡。 Bethke等[5]在利用GA诱导大麦糊粉层细胞PCD的研究中,发现液泡化的类型和进程与本研究描述的类型Ⅱ相似(图1-A~E)。
原生质体是研究糊粉层细胞PCD的良好材料。在本研究中, 通过FDA染色,检测原生质体存活率。 从图5-A、 B、 C 中可见,这3种类型细胞的原生质体都具有良好活性, 其中A型的活性最高,B型次之, C型最低, D型则为死细胞的原生质体, 而液泡化程度则刚好相反。研究结果再次证明了在正常条件下,糊粉层细胞液泡化程度反映了PCD的进程。 同时, 在制备的原生质体中, 主要都是液泡化不明显的A型细胞的原生质体(图5),其活性最强, 可以用于进一步的试验研究。
参考文献
[1] Fath A, Bethke P C, Jones R L. Barley aleurone cell death is not apoptotic: characterization of nuclease activities and DNA degradation[J]. The Plant Journal, 1999, 20(3): 305-315.
[2] Fath A, Bethke P C, Lonsdale J E, et al. Programmed cell death in cereal aleurone[J]. Plant Molecular Biology, 2000, 44(3): 255-266.
[3] Fath A, Bethke P C, Jones R L. Enzymes that scavenge reactive oxygen species aredown-regulated prior to gibberellic acid-induced programmed cell death in barley aleurone[J]. Plant Physiology, 2001, 126(1): 156-166.
[4] Fath A, Bethke P, Beligni V, et al. Active oxygen and cell death in cereal aleurone cells[J]. Jouurnal of Experimental Botany, 2002, 53(372): 1 273-1 282.
[5] Bethke P C, Lonsdale J E, Fath A, et al. Hormonally regulated programmed cell death in barley aleurone cells[J]. Plant Cell,1999, 11(6): 1 033-1 045.
[6] Wu M Z, Huang J J, Xu S, et al. Hasm oxygenase delays programmed cell death in wheat aleurone layers by modulation of hydrogen peroxide metabolism[J]. Jouurnal of Experimental Botany, 2011, 62(1): 235-248.
[7] Hara-Nishimura I, Hatsugai N. The role of vacuole in plant cell death[J]. Cell Death & Differentiation, 2011, 18(8): 1 298-1 304.
[8] Gadjev I, Stone J M, Gechev T S. Programmed cell death in plants: new insights into redox regulation and the role of hydrogen peroxide[J]. International Review of Cell and Molecular Biology, 2008, 270: 87-144.
[9] Guo W J, Ho T H D. An abscisic acid-induced protein, HVA22, inhibits gibberellin-mediated programmed cell death in cereal aleurone cells[J]. Plant Physiology, 2008, 147(4): 1 710-1 722.
[10] Senatore A, Trobacher C P, Greenwood J S. Ricinosomes predict programmed cell death leading to anther dehiscence in tomato[J]. Plant Physiology, 2009, 149(2): 775-790.
[11] Higaki T, Kurusu T, Hasezawa S, et al. Dynamic intracellular reorganization of cytoskeletons and the vacuole in defense responses and hypersensitive cell death in plants[J]. Journal of Plant Research, 2011, 124(3): 315-324.
[12] Btehke P C, Jones R L. Cell death of barley aleurone protoplasts is mediated by reative oxygen species[J]. The Plant Journal, 2001, 25(1): 19-29.
[13] Okamoto K, Murai T, Eguchi G, et al. Enzymic mechanism of starch breakdown in germinating rice seeds[J]. Plant Physiology, 1982, 70(3): 905-911.
[14] 王 忠, 顾蕴洁, 李卫芳, 等.水稻糊粉层的形成及其在萌发过程中的变化[J]. 扬州大学学报: 自然科学版, 1998, 1(1): 19-24.
