槟榔芋疫霉菌生物学特性、致病力测定及田间防治药剂筛选
2016-05-30叶泉清钟佳玲陈媚蓝志萍陈郭燕
叶泉清 钟佳玲 陈媚 蓝志萍 陈郭燕
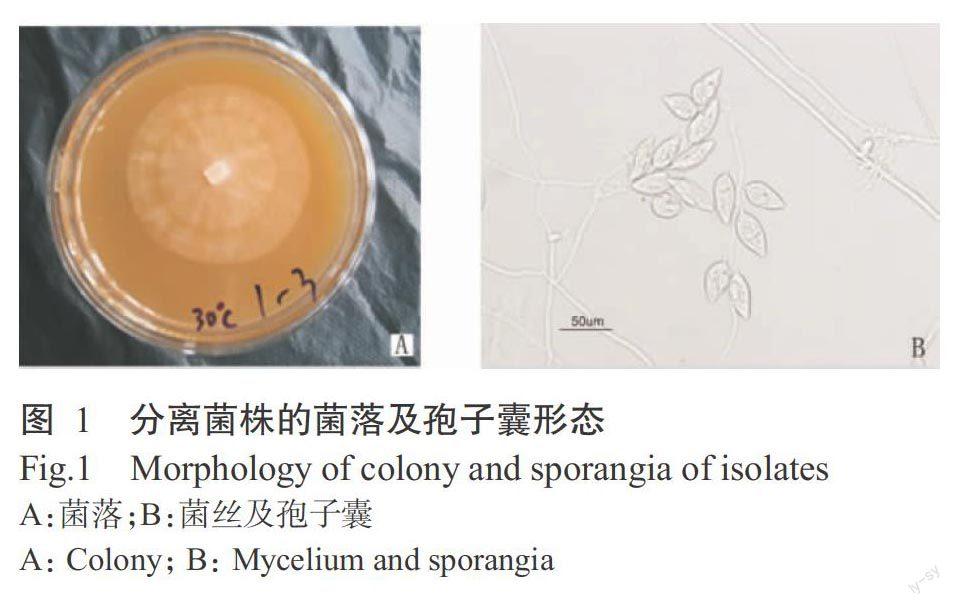
摘要:【目的】对引起槟榔芋疫病的芋疫霉菌开展生物学特性、致病力研究及田间防治药剂筛选,为综合防治槟榔芋疫病提供参考。【方法】以荔浦芋为材料,采用组织分离法从患疫病荔浦芋植株中分离病原菌,对病原菌进行生物学性状测定,并根据菌株菌丝的形态、孢子囊形态特征及大小、回接发病症状等将病原菌鉴定到种;分别采用离体叶片接种法和田间植株喷雾接种法,测定菌株的致病力,并鉴定供试荔浦芋的抗病性。将7种杀菌剂配制成500倍稀释液的较高浓度,设清水对照,于芋疫病严重时期施药,药后定期观测田间防治效果。试验期间到荔浦芋产区调查种植户防治芋疫病的用药情况。【结果】从患疫病荔浦芋植株中分离得到病原菌,病原菌菌丝宽3~8 μm,孢子囊多为卵圆形或长椭圆形,大小33~108 μm×28~56 μm,长宽比1.1~3.0,鉴定为芋疫霉菌(Phytophthora colocasiae Racib.)。芋疫霉菌株的最适生长温度为25~30 ℃,在25 ℃下生长最快,生长速率为1.33 cm/d;用两种方式接种的荔浦芋叶片发病率均高达100%,且病斑扩散快,据此判断菌株具有强致病力,供试荔浦芋鉴定为感病品系。7种药剂的田间防治效果有限,其中以50%烯酰吗啉和58%甲霜·锰锌的防效相对较好,平均防效分别为58.8%和52.4%。调查发现,种植户较多使用甲霜灵+烯酰吗啉防治芋疫病,其中以甲霜灵+烯酰吗啉+丁子香酚的防治效果较好。【结论】广西荔浦县荔浦芋疫霉菌有强致病力,荔浦芋为感病品系。50%烯酰吗啉和58%甲霜·锰锌可作为防治荔浦芋疫病的药剂使用,建议在发病初期及时施药,并合理进行杀菌剂的轮换和混配。
关键词: 槟榔芋;芋疫霉菌;生物学特性;致病力;药剂筛选
中图分类号: S432.4 文献标志码:A 文章编号:2095-1191(2016)04-0588-06
0 引言
【研究意义】槟榔芋属天南星科芋属球茎用变种(Colocasia esculenta L. var. cormosus Chang)魁芋类型,产于广西、广东、福建等地。生产过程中,芋疫病(又称芋瘟)是其主要病害,在产区发生普遍。该病由卵菌纲的芋疫霉菌(Phytophthora colocasiae Racib.)侵染引起,一般4月开始零星发病,6~9月盛行,主要危害叶片、叶柄,严重时亦危害球茎,遇高温、雨天病斑快速发展,导致叶片大量腐烂、植株折倒,造成芋头产量和品质下降(王汉荣等,2009)。广西荔浦芋是槟榔芋的著名品种,在广西桂林市荔浦县常年种植面积为2000~3500 ha,总产量6万~10万t,而芋疫病的发生对荔浦芋产量也有极大影响。目前,除选用抗病种芋、合理肥水管理和轮作措施外,药剂防治仍是控制芋疫病的主要手段(唐学军等,2014),但化学农药的长期大量使用,增加了病原菌产生耐药性的风险。相关研究表明,我国许多地区的卵菌病害对甲霜灵等化学农药产生了严重的抗药性(吴文君和罗万春,2008),因此,有必要了解目前常用药剂防治槟榔芋疫病的田间效果;此外,结合开展对病原菌致病力等特性的研究及种芋抗病性鉴定,对保障槟榔芋产业的可持续发展具有重要意义。【前人研究进展】前人已对芋疫病进行了药剂防治试验。张宝棣等(1994)对广州市香槟芋疫病开展了药剂防治试验,结果以58%瑞毒霉锰锌可湿性粉剂的防效最佳,达71%;朱敦军(2009)对贺州香芋疫病的药效试验结果表明,50%烯酰吗啉的防效达79.2%;周清平等(2012)对芋头湛江-8号疫病进行药剂筛选,发现锰锌·氟吗啉的防效达72.8%,50%烯酰吗啉的防效达67.9%。在芋霉菌生物学特性、致病力及芋疫病抗病性研究等方面,王向社等(2001)通过对采自海南岛不同地方的19个芋疫霉菌株进行研究,发现它们虽属同一个种,但各菌株的生物学特性及致病力和对甲霜灵敏感性存在差异,表明芋疫霉菌的致病力等特性和对同一药剂敏感性可能存在地方差异,认为以当地芋头品种开展药效试验的结果有一定的地域局限性;周清平等(2012)收集10个魁芋品系,采用离体叶片抗病性鉴定方法,从中鉴定出2个抗病品系,2个中抗品系,其余为感病品系;国外也有类似研究(Brooks,2008)。【本研究切入點】至今未见对槟榔芋疫病开展综合防治研究的报道。【拟解决的关键问题】采用组织分离法从荔浦芋疫病植株分离病原菌,对分离菌株开展生物学性状测定,并根据菌丝的形态、孢子囊形态特征及大小、回接发病症状等将病原菌鉴定到种;采用离体叶片接种法测定菌株的致病力,鉴定供试芋头的抗病性;采用喷雾法进行7种常用杀菌剂对芋疫病的田间药效试验,旨在了解槟榔芋疫霉菌的生物学性状、致病力大小、品种的抗病性等,为探究病害发生规律的成因和槟榔芋抗疫病育种提供理论基础,并筛选出防治效果较好的药剂,为合理用药、有效防治芋疫病提供参考。
1 材料与方法
1. 1 试验材料
试验于2014年8~9月在桂林市七星区朝阳乡横塘村进行,供试品种为荔浦芋。选择田块A和田块B,两田相距超200 m,均为壤质水稻土,肥力中等。田块A为连作田,芋疫病发生严重,经检查病株率70%,病叶率63%,试验前未使用过药剂,拟进行药剂防治试验;田块B为零星发病,进行致病力试验。
培养基:胡萝卜琼脂(CA)培养基:新鲜胡萝卜200 g榨汁、琼脂20 g/L;选择性培养基:取头孢氨苄50 mg、多菌灵50 mg、利福平100 mg混合,加入50 mL灭菌水溶解后,倒入950 mL灭菌后冷却至60 ℃的CA培养基,摇匀倒皿。
供试药剂:选用王汉荣等(2009)、唐学军等(2014)推荐的防治槟榔芋疫病药剂供试,分别为(1)58%甲霜·锰锌可湿性粉剂(标正作物科学有限公司)、(2)80%代森锰锌可湿性粉剂(陶氏益农农业科技有限公司)、(3)68%精甲霜·锰锌水分散粒剂(瑞士先正达作物保护有限公司)、(4)64%噁霜·锰锌可湿性粉剂(先正达苏州作物保护有限公司)、(5)50%烯酰吗啉水分散粒剂(青岛润生农化有限公司)、(6)72%霜脲·锰锌可湿性粉剂(中国农业科学院植物保护研究所廊坊农药中试厂)、(7)72.2%霜霉威盐酸盐水剂(拜耳作物科学中国有限公司)。
1. 2 试验方法
1. 2. 1 病原菌分离 病原菌分离参考周清平等(2012)的方法,从供试田块A采集具有芋疫病典型症状的病叶,用选择性培养基分离,经CA培养基转接纯化,形态学观察所分离菌株。参照方中达(1998)的方法开展单孢分离获得菌株,转接至CA培养基培养3 d后,切取直径0.5 cm菌丝块回接植株叶背面,选取表现与田间症状相同的病斑分离菌株并纯化供鉴定用。
1. 2. 2 病原菌鉴定 参考李智军等(2007)的方法,将纯化菌株在CA培养基上25 ℃培养3 d后,切取菌落边缘的菌丝块移至CA培养基中央,放置生化培养箱中25 ℃培养3~5 d,观察菌落形态,通过载玻片培养法观察菌丝特征,参考郑小波(1997)的方法检测孢子囊的脱落性,测定30个孢子囊的大小、柄长和乳突高度。
1. 2. 3 菌株生物学特性、致病力测定及芋头抗性鉴定 菌株的生长温度、生长速率和致病力测定参照王向社等(2001)的方法。参考王向社等(2001)、周清平等(2012)的方法,采用离体叶片接种法测定菌株致病力。从田块A摘取3片芋头嫩叶到室内,用纯化菌株制备游动孢子悬浮液,调节至1×103个孢子/mL,在每张叶片选4个点,其中3个点各接种20 μL孢子悬液,第4个点接种灭菌水作对照,保湿、28 ℃光照培养,4 d后检查发病情况并测量病斑直径。参照周清平等(2012)的芋头品系抗性标准鉴定芋头的抗性:病斑直径小于0.5 cm为抗病;0.5~1.0 cm为中抗;大于1.0 cm为感病。致病力强弱的判断参考王向社等(2001)的标准,接种后叶片发病率达100%,病斑扩散快,则认为菌株具有强的致病力。为进一步测验菌株田间致病力,采用喷雾法接种田间植株:在供试田块B无疫病区选择10株健康植株,每株选1张叶片用上述孢子悬浮液点状喷淋3个点,叶片正、反面各接种5株,另选10株健康植株以清水喷淋作对照,4 d后检查发病情况,测量病斑直径。
1. 2. 4 田间药剂防治试验
1. 2. 4. 1 试验设计 试验设8个处理,参考王汉荣等(2009)、唐学军等(2014)的建议用量,并考虑疫情严重,将供试7种药剂均按稀释500倍液的较高浓度使用,药剂序号对应为处理1~7,处理8为清水对照(CK)。每处理3次重复,小区面积25.0 m2,双行距1.8 m,株距0.3~0.4 m,区间留隔离带、保护行,各处理采用随机区组排列。用背式手动喷雾器在芋叶正反面均匀喷药,药液量以叶面药液刚形成下滴水珠为宜,分别于2014年8月23日、8月30日、9月6日进行3次药剂防治试验,水肥等田间管理按常规进行。试验期间的天气多为晴天,平均气温28.5 ℃,湿度51%~86%,雨日3 d。
1. 2. 4. 2 调查项目及方法 采取定株调查,每小区调查40株,检查全部叶片,于施药前和每次药后7 d各调查1次,共4次,记录发病叶片数和病级,计算病情指数和绝对防效。芋疫病分级标准参照周清平等(2012)的标准:0级,无病斑;1级,病斑面积占整张叶面积的5%以下;3级,病斑面积占整张叶面积的6%~10%;5级,病斑面积占整张叶面积的11%~25%;7级,病斑面积占整张叶面积的26%~50%;9级,病斑面积占整张叶面积的50%以上。病斑扩展速率:第1次施药前从所调查植株上选择形状整齐的中小病斑作标记,并测量每一病斑的纵向直径(沿叶脉辐射方向)和横向直径,药后3、7 d各跟踪测量1次,每药处理测量30个病斑,计算病斑的扩展速率。
病情指数=Σ(各级病叶数×相对级数值)/调查总叶数×最高病级值×100
绝对防治效果(%)=(对照区病指增长值-处理区病指增长值)/对照区病指增长值×100
1. 2. 5 产区种植户防治用药调查 试验期间到荔浦芋主产区调查芋疫病药剂防治情况。分别从荔浦县新坪镇、东昌镇和龙怀乡各选择3个村,每村1户种植户的芋头田共9个调查点,了解防治芋疫病使用的药剂,检查疫病病情。
1. 3 统计分析
采用Excel 2003和SPSS 17.0软件对试验数据進行统计分析,并采用LSD法进行显著性检验。
2 结果与分析
2. 1 病原菌的形态学鉴定
从供试田块A分离纯化的病原菌菌株在CA培养基上培养5 d后,菌落呈白色圆形,边缘整齐,菌丝稀疏,气生菌丝较少。菌丝宽3~8 μm,无隔,在分枝处偶有膨大,孢囊梗细,短而直,简单合轴分枝。孢子囊呈卵圆形或长椭圆形,少数呈梨形,大小33~108 μm×28~56 μm,平均72 μm×39 μm,长宽比1.9(1.1~3.0),顶端具半乳突,厚2.2~4.0 μm(图1)。孢子囊脱落,孢囊柄长5.1~20.4 μm。未观察到厚垣孢子。菌株配对培养不产生卵孢子,属异宗配合。根据菌丝、孢子囊的形态特征及回接发病症状,参照陆家云(2001)的方法,可将病原菌鉴定为芋疫霉菌(Phytophthora colocasiae Racib.)。
2. 2 病菌生物学特性、致病力测定及芋头抗性鉴定
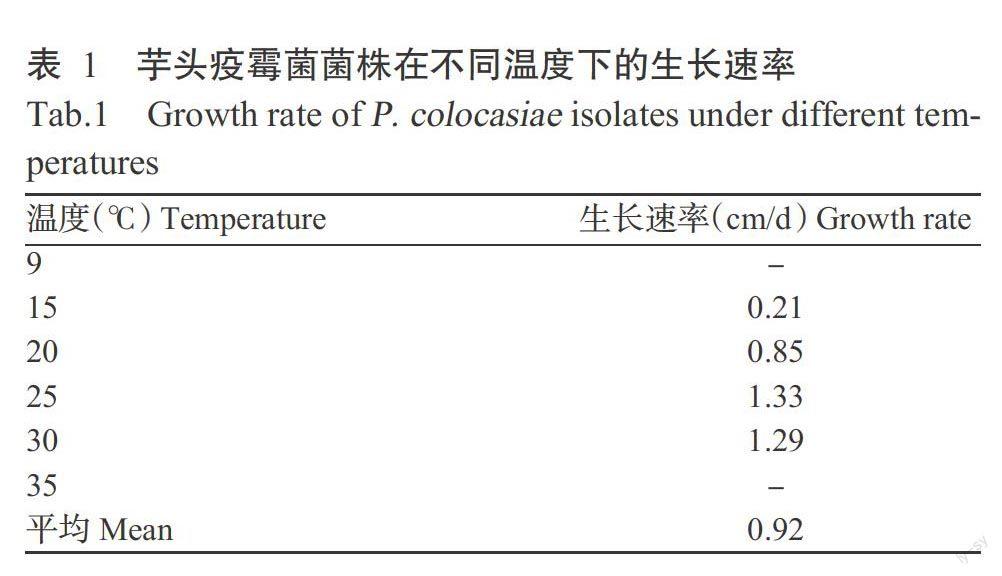
表1为芋疫霉菌株在不同培养温度下3~5 d后的菌落生长速率。从表1可以看出,芋疫霉菌株在15~30 ℃内均能正常生长,在25 ℃下生长最快,生长速率为1.33 cm/d;其次是30 ℃,生长速率为1.29 cm/d;在9和35 ℃时菌株不能生长,但转移至室温下又能恢复生长。离体叶片在接种该菌2 d后开始出现水渍状病斑,4 d后叶片100%发病,病斑直径1.6~3.3 cm,平均扩展速率0.67 cm/d。参照周清平等(2012)的芋头品系抗性标准,判断供试荔浦芋为感病品系。用孢子悬浮液点状喷淋田间10株健康植株各1张叶片,4 d后叶片全部发病,每叶至少出现1个病斑,正面接种出现的病斑数比反面接种略多,病斑直径0.6~5.6 cm,平均为3.2 cm,平均扩展速率0.80 cm/d,对照植株未见染病。用两种方式接种的叶片发病率均高达100%,且病斑扩散快,参考王向社等(2001)对致病力的判断标准,可以认为该芋疫霉菌株具有强致病力。
2. 3 田间药剂防治试验结果
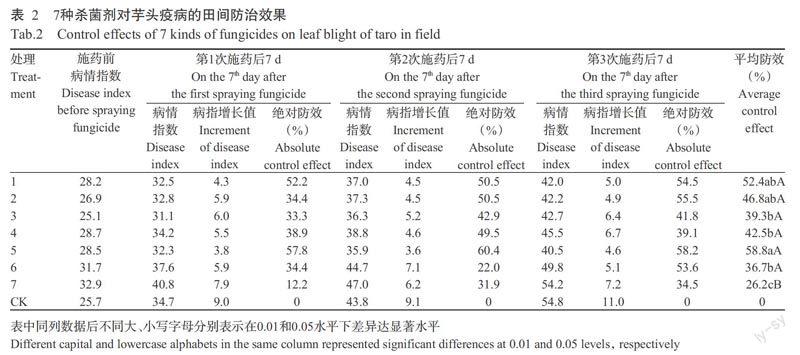
从表2可以看出,7种药剂对槟榔芋疫病的防治效果欠佳,其中防效相对较好的是50%烯酰吗啉(处理5),3次不同时间施药后绝对防效分别为57.8%、60.4%和58.2%,平均防效58.8%;其次是58%甲霜·锰锌(处理1),3次绝对防效分别为52.2%、50.5%和54.5%,平均防效为52.4%;80%代森锰锌(处理2)对芋疫病也有一定的防效,平均防效为46.8%,3种药剂间防效差异不显著(P>0.05)。试验期间观察,各药剂在供试浓度下对植株安全,无药害产生。
第1次施药3 d后每处理测量30个标记病斑,计算病斑的扩展速率,结果见表3。由表3可以看出,施药后病斑的发展态势大体呈增长略大于增宽,长与宽的平均增大值近似平均扩展速率,其中处理5的病斑平均扩展速率为0.22 cm/d,处理1为0.24 cm/d,其余处理在0.38~0.45 cm/d,CK为0.58 cm/d,表明各药剂对病斑扩展均有一定的抑制作用,其中以50%烯酰吗啉和58%甲霜·锰锌的控制效果较好。但各药剂均未能控制病斑的发展,在施药后7 d再次测量时,不少标记病斑与周边未标记病斑连成一片,不利于确定其增大值,从测量的部分独立发展的病斑数据比较,反映出扩展速率无明显变化,药剂的防效没有因时间推移出现跃升。
2. 4 产区防治用药调查
在荔浦芋产区走访调查,发现产区普遍发生芋疫病,调查的9位种植户的芋头田全部发病,经抽样检查,病株率为25%~90%,病叶率20%~60%,疫病为害严重。表4为种植户在调查前3个月内使用的防治药剂。从表4可以看出,种植户施用较多的药剂是甲霜灵+
烯酰吗啉,有的种植户还加入烯酰·吡唑酯或丁子香酚混配使用。调查还发现,多处调查田块中随处可见干枯的病斑、烂叶,说明药剂的防治效果有限,施药只能减缓疫情的发展,把病情控制在某种程度;对比发现,施用甲霜灵+烯酰吗啉+丁子香酚的芋田荔浦芋植株长势较好,一片整齐绿色,病叶较少,病斑也小。
3 讨论
Zhang等(1994)、王向社等(2001)分别用V8汁琼脂培养基分离、培养多个海南岛芋疫霉菌株,本研究用CA培养基分离、纯化广西荔浦芋疫霉菌株,虽然使用的培养基不同,但菌株在菌落形态、菌丝形态特征、生长的温度范围及最适温度等方面与海南岛芋疫霉菌株表现较一致,反映出芋疫霉菌在这些性状上的稳定性。但两处菌株的生长速率、致病力存在一定差异,在生长速率方面,海南岛芋疫霉菌株在25 ℃下生长最快,为1.21 cm/d,30 ℃下为1.10 cm/d,而广西荔浦芋疫霉菌株在相同温度下分别为1.33和1.29 cm/d,后者表现出较快的生长速率,且在30 ℃的较高温度下仍生长较快;在致病力方面,王向社等(2001)测定了海南岛19个芋疫霉菌株,感病指数在8.3~100.0,本研究同样以离体叶片接种孢子悬浮液,叶片发病率为100%,此外,以喷雾法接种的田间植株叶片全部发病,且病斑扩散迅速,表明广西荔浦芋疫霉菌株具有强致病力。雨水是该病的重要传播途径,但目前对经雨水传播的侵染过程研究较少,因此,本研究以孢子悬浮液喷淋接种田间植株,模拟雨水的传播并测验田间致病力,结果接种4 d后植株全部发病,孢子可以从芋叶正、反面侵入。Nyasse等(2007)研究表明,田间湿度、持水量及种植密度直接影响疫病的发生及流行;王汉荣等(2009)认为,高温多雨潮湿的季节适合槟榔芋疫病发生流行。本研究揭示的广西荔浦芋疫霉菌株的生长温度、生长速率和致病力等生物学特性在一定程度上支持了上述病害发生规律理论,对其防治也有参考意义。通过对供试芋头的抗性鉴定,发现广西荔浦芋为感病品系。目前,芋疫霉菌是否存在生理小种尚未见报道,因此有必要进一步采集不同地理来源菌株鉴定槟榔芋种质资源的抗性。
田间药剂试验结果表明,供试7种杀菌剂对广西荔浦芋疫病均有一定的防效,但效果有限,相对较好的是50%烯酰吗啉和58%甲霜·锰锌,两者的平均防效分别为58.8%和52.4%,可用于芋疫病的防治,与张宝棣等(1994)、朱敦军(2009)、周清平等(2012)研究发现上述两种药剂在防治芋疫病上有良好效果的结论基本一致,但朱敦军(2009)和周清平等(2012)于6月或更早时间在芋疫病零星发病时分别使用50%烯酰吗啉进行防治,平均防效为79.2%和67.9%,而在本研究中该种药剂的防效相对较差,且精甲霜·锰锌、霜霉威盐酸盐等药剂的防效也较低。究其原因,可能与本地荔浦芋疫霉菌致病力强、芋头抗性弱、施药较晚、病情严重等因素相关。本研究防治试验于8~9月荔浦芋疫病严重时期进行,药前病株率70%,病叶率63%,期间多为晴天,平均气温28.5 ℃,每次施药2~4 d后都会遇上雨天,高温偶雨的天气助长了病情发展,由于病斑多且面积大,产生大量孢子囊借助气流或雨水溅散传播,侵染后短期内病斑扩展迅速并产生新霉层进行再侵染,且大量病斑所在位置的叶肉及叶脉萎蔫干枯,进而对杀菌剂的吸收、运转等造成阻碍,影响其杀菌效率。因此,对槟榔芋疫病的化学防治,提倡在发病初期及时施药,也被认为是防治芋疫病的关键(王汉荣等,2009;唐学军等,2014),当芋疫病发病严重时才用药,此时药剂的防治效果极有限(刘独臣,2013)。此外,对于使用时间长、范围广的甲霜灵、烯酰吗啉等药剂,应开展抗药性研究,加强田间抗性检测以合理用药防治。
在广西荔浦县荔浦芋产区对部分芋头种植户防治槟榔芋疫病的用药情况进行走访调查发现,荔浦縣农户在药剂种类及使用方法上与文献推荐相比存在一定差异,王汉荣等(2009)、唐学军等(2014)推荐使用甲霜·锰锌、噁霜·锰锌、精甲霜·锰锌、霜脲·锰锌、霜霉威、丙森·缬霉威、烯酰·锰锌等药剂防治疫病,多是单用,采用喷雾防治;荔浦县的种植户大多使用甲霜灵和烯酰吗啉两种药剂,且多为混合使用,同时还使用双炔酰菌胺、烯酰·吡唑酯、枯草芽孢杆菌、丁子香酚等杀菌剂。其中,烯酰·吡唑酯是烯酰吗啉与吡唑醚菌酯的混剂,吡唑醚菌酯属于甲氧基丙烯酸酯类杀菌剂,该类杀菌剂自1992年开发出嘧菌酯和醚菌酯后至今已有10余种,具有广谱、高效等特点,属于线粒体呼吸抑制剂,因作用机理独特,与目前使用的杀菌剂不存在交互抗性(吴文君和罗万春,2008)。本研究在调查中发现,因一些传统药剂防治效果下降,部分种植户尝试换用不同类型的药剂,但由于缺乏对农药知识的了解,轮替的药剂种类少且长期频繁使用,以致病菌对药剂产生抗性的风险上升,防效下降。此外,本研究发现荔浦芋疫霉菌具有强致病力,芋头较感病,都增加了芋疫病防治的难度。
4 结论
本研究结果表明,广西荔浦县荔浦芋疫霉菌有强的致病力,荔浦芋为感病品系,建议在芋疫病发病初期及时施药防治。供试7种杀菌剂中以50%烯酰吗啉和58%甲霜·锰锌的防效相对较好,可作为防治芋疫病的药剂轮换使用;在种植户的田间防治实践中,烯酰吗啉可与多种杀菌剂混配使用,其中烯酰吗啉+甲霜灵+丁子香酚是效果较好的复配方式,亦可作为芋疫病防治药剂使用。
参考文献:
方中达. 1998. 植病研究方法[M]. 第3版. 北京:中国农业出版社: 137-139.
Fang Z D. 1998. Plant Disease Research Method[M]. The 3rd Edition. Beijing: China Agriculture Press: 137-139.
李智军, 龙卫平, 郑锦荣, 雷建军. 2007. 广东辣椒疫霉菌分离鉴定及其致病力和生理小种分化研究[J]. 华南农业大学学报, 28(1): 50-54.
Li Z J, Long W P, Zheng J R, Lei J J. 2007. Isolotion and identification of Phytophthora capsici in Guangdong province and measurement of their pathogenicity and physiological race differentation[J]. Journal of South China Agricultural University, 28(1): 50-54.
刘独臣. 2013. 四川芋疫病发生规律及防治技术[J]. 长江蔬菜, (18): 118-119.
Liu D C. 2013. Occurrence rules and integrated control technolo-gy of Phytophthora colocasiae on taro in Sichuan province[J]. Journal of Changjiang Vegetables,(18): 118-119.
陆家云. 2001. 植物病原真菌学[M]. 北京:中国农业出版社: 88-97.
Lu J Y. 2001. Plant Pathogenic Mycology[M]. Beijing: China Agriculture Press: 88-97.
唐学军, 赖昌健, 何小兰, 邓廷禧, 廖首发. 2014. 荔浦芋实用生产技术[M]. 北京:金盾出版社.
Tang X J, Lai C J, He X L, Deng T X, Liao S F. 2014. Practical Production Technology of Lipu Taro[M]. Beijing: Jindun Publishing House.
王向社,李锐,胡茂松,熊金宇,郑服丛. 2001. 海南岛芋疫霉菌生物学特性、致病力、对甲霜灵的敏感性研究[J]. 热带作物学报, 22(1): 83-90.
Wang X S, Li R, Hu M S, Xiong J Y, Zheng F C. 2001. Study on the biology, virulence of Phytophthora colocasiae Racib and its sensitivety to metalaxyl[J]. Chinese Journal of Tropical Crops, 22(1): 83-90.
王汉荣, 方丽, 茹水江, 任海英. 2009. 槟榔芋疫病的识别与防治[J]. 中国蔬菜,(21):21-22.
Wang H R, Fang L, Ru S J, Ren H Y. 2009. Identification and control of the leaf blight of Colocasia esculenta L. var. cormosus Chang[J]. China Vegetables,(21): 21-22.
吴文君, 罗万春. 2008. 农药学[M]. 北京:中国农业出版社: 108-135.
Wu W J, Luo W C. 2008. The Pesticide Science[M]. Beijing: China Agriculture Press: 108-135.
张宝棣, 彭庆平, 何容根. 1994. 广州地区芋疫病的发生及防治研究[J]. 云南农业大学学报, 9(3):141-147.
Zhang B D, Peng Q P, He R G. 1994. Studies on the occurrence and control of the leaf blight of taro in Guangzhou region[J]. Journal of Yunnan Agricultural University, 9(3): 141-147.
鄭小波. 1997. 疫霉菌及其研究技术[M]. 北京:中国农业出版社: 85-87.
Zheng X B. 1997. Phytophthora sp. and Its Research Technique[M]. Beijing: China Agriculture Press: 85-87.
周清平, 胡汉桥, 梁钾贤, 李素贤, 吴仁锋. 2012. 芋疫病抗病性鉴定及药剂筛选[J]. 湖北植保,(5):27-30.
Zhou Q P, Hu H Q, Liang J X, Li S X, Wu R F. 2012. Identification for resistance of taro to Phytophthora colocasiae and screening of fungicides for control[J]. Hubei Plant Protection,(5): 27-30.
朱敦军. 2009. 50%烯酰吗啉水分散粒剂防治芋头疫病药效试验[J]. 现代农业科技,(13): 151.
Zhu D J. 2009. Control effect of 50% dimethomorph water dispersible granule on leaf blight of taro[J]. Modern Agricultural Science and Technology,(13): 151.
Brooks F E. 2008. Detached-leaf bioassay for evaluating taro resistance to Phytophthora colocasiae[J]. Plant Disease, 92(1): 126-131.
Nyasse S, Efombagn M I B, Kebe B I. 2007. Integrated ma-nagement of Phytophthora diseases on cocoa(Theobroma cacao L.): Impact of plant breeding on pod rot incidence[J]. Crop Protection, 26(1): 40-45.
Zhang K M, Zheng F C, Li Y D, Ann P J, Ko W H. 1994. Isolates of Phytophthora colocasiae from Hainan island in China: evidence suggesting an Asian origin of this spceies [J]. Mycologia, 86(1): 108-112.
(責任编辑 麻小燕)
