葡萄黑痘病病原菌生长特性研究
2016-05-30林玲陈立李玮谢蜀豫文仁德陈国品李洪艳韩佳宇盘丰平白先进曹慕明
林玲 陈立 李玮 谢蜀豫 文仁德 陈国品 李洪艳 韩佳宇 盘丰平 白先进 曹慕明


摘要:【目的】探索葡萄黑痘病病原菌在不同培养条件下的生长情况,优化其培养条件,以缩短培养该菌纯培养物的周期,提高培养效率。【方法】通过常规培养手段,从患黑痘病黑巴拉多病叶上分离葡萄黑痘病病原菌,PCR扩增该菌ITS片段,经测序后在NCBI比较该片段序列。用同一规格培养皿培养病原菌,每隔7 d观察并统计该病原菌在4种不同培养基组分、5个不同温度梯度、4个不同蔗糖浓度梯度、4种光照时间、5个不同pH条件下共计21 d的生长情况。【结果】分离到病原菌并扩增获得其ITS片段,经比对,该片段序列与NCBI已公布葡萄痂囊腔菌序列AY826763的相似度达99.9%,证实所分离病原菌为葡萄痂囊腔菌(Elsinoe ampelina)。葡萄痂囊腔菌的生长最适培养基为PSA,其次是YEB;最适培养温度为25 ℃、最适蔗糖浓度为4.5 g/L、最适pH为8,在最适培养温度、蔗糖浓度和pH下病原菌的生长速度分别为0.07、0.03和0.01 cm/d;光照时间对葡萄痂囊腔菌生长影响不明显。【结论】葡萄痂圆孢菌生长受环境条件影响,通过培养条件优化能显著加快其生长速度,提高培养效率。
关键词: 葡萄黑痘病;葡萄痂囊腔菌;培养条件;生长特性
中图分类号: S436.8 文献标志码:A 文章编号:2095-1191(2016)04-0571-05
0 引言
【研究意义】葡萄黑痘病(Grape black pox)是危害葡萄的主要真菌病害之一,其病原菌有性态为葡萄痂囊腔菌[Elsinoe ampelina(de Bary) Shear],无性态为葡萄痂圆孢(Sphaceloma ampelinum de Bary),由于该菌属于寄生性真菌,营养要求苛刻,在实验室中离体培养较困难(张剑侠等,2009;徐宁等,2014;刘会宁和李彬,2015),不利于对黑痘病的后续研究。因此,通过研究葡萄痂囊腔菌的生长特性,优化其培养条件,从而快速大量地获得其纯培养菌体,对于葡萄黑痘病研究有着重要意义。【前人研究进展】葡萄黑痘病害发生广泛,严重影响葡萄的食用价值和商品价值。国内研究人员目前已对黑痘病的发生规律进行了一些研究,王倩(2011)研究发现,我国葡萄主产区除新疆和少数干旱地区外,均有葡萄黑痘病害发生;在春夏多雨潮湿的地区,黑痘病发病盛期为3月中旬~4月下旬,这段时间是防治黑痘病的关键时期。刘志刚(2006)调查发现葡萄黑痘病的发生与气候因素(如大气湿度、降雨等)密切相关,多雨高湿的环境不仅有利于黑痘病病菌分生孢子形成、传播和萌发侵入,还能促使患病组织迅速生长,导致葡萄植株抵抗力下降,加重病害的发生;干旱年份或少雨地区则发病较轻。杨华等(2009)研究发现黑痘病菌能够侵染葡萄的花穗、幼果、卷须和新生枝叶等幼嫩组织,严重影响葡萄的食用价值和商品价值,使葡萄各产区蒙受巨大的经济损失。在葡萄黑痘病病原分离及培养方面的研究报道较少。肖欢等(2010)通过分子生物学手段分离得到黑痘病病原菌——葡萄痂囊腔菌。目前国内研究人员仅采用以葡萄糖为碳源的马铃薯葡萄糖琼脂培养基培养葡萄痂囊腔菌,没有探索其生长特性,且生长至肉眼可见菌落时间长达3个月,难以快速有效地满足后续对黑痘病研究的需求(王倩,2011)。【本研究切入点】目前对于葡萄黑痘病致病菌本身生长特性的研究尚未见报道。【拟解决的关键问题】通过单因素试验,对葡萄痂囊腔菌的培养条件进行优化,以加快该菌的生长速度,提高获得纯培养物的效率,为葡萄黑痘病研究提供菌源保障。
1 材料与方法
1. 1 试验材料
供试葡萄品种为黑痘病高感品种黑巴拉多,取自广西农业科学院明阳双季葡萄示范基地种质资源圃。
供试主要试剂:三羟甲基氨基甲烷(Tris)、蛋白胨、酵母提取物、琼脂为OXOID.LTD产品,Ezup柱式基因组DNA抽提试剂盒(真菌)、ITS通用引物、Taq DNA聚合酶、PCR Buffer、dNTP、100 bp Plus DNA Ladder为生工生物工程(上海)股份有限公司产品,NaCl、酒精、NaOH等均为国产分析纯。
供试主要仪器:低温离心机(Eppendorf,5804R,Germany)、常温离心机(Eppendorf,5418R,Germany)、PCR仪(Eppendorf,5341,Germany)、烘箱(上海精宏 实验设备有限公司,DHG-9123A型)、水浴锅(上海一恒科学仪器有限公司,DK-8D)、高压灭菌锅(TOMY、SX-500,Japan)、恒温摇床(上海智城分析仪器制造有限公司,ZHWY-2102)、超净工作台(苏州安泰空气技术有限公司,SW-CJ-2FD)、微波炉(Galanz,P7021P- 61A)、电泳仪(北京六一仪器厂,DDY-6C型)、凝胶成像系统(SYNGENEG:BOX)、智能生化培养箱(黑龙江东拓仪器制造有限公司,SPX-2508)。
1. 2 试验方法
1. 2. 1 常用培养基配制 PSA培养基(1 L):马铃薯(去皮)200 g,加水1000 mL煮沸30 min,纱布过滤,加入蔗糖10 g,琼脂14 g,加热充分溶解后,加水补足至1000 mL,最后分装至三角瓶中,121 ℃高压灭菌20 min后取出,冷却备用。
YEB培养基(1 L):酵母提取物6 g,蛋白胨5 g,葡萄糖5 g,琼脂7 g,加热充分溶解后,加水补足至1000 mL,121 ℃高压灭菌20 min后取出,冷却备用。
LB培养基(1 L):胰蛋白胨(Tryptone)10 g,酵母提取物(Yeast extract)5 g,NaCl 10 g,琼脂粉15~20 g,加双蒸水至1000 mL,用5 mol/L NaOH(约0.2 mL)调pH至7.2,121 ℃灭菌30 min。
CM培养基(1 L):硝酸钠3 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,瓊脂7 g,加热充分溶解后,加水补足至1000 mL,121 ℃高压灭菌20 min后取出,冷却备用。
1. 2. 2 葡萄痂囊腔菌的分离培养及纯化 2014年4月,自广西农业科学院明阳双季葡萄示范基地葡萄种质资源圃患病黑巴拉多上摘取病叶片(图1),置于冰壶中带回实验室,采用传统方法分离黑痘病病原菌。将病叶置于密封袋中,用无菌水轻柔冲洗。在无菌操作台上进行接种,在病叶上选取典型单一病斑,用灭菌解剖刀从病健交界处切取约1 cm2的小块,在75%乙醇中振荡3~5 s,用0.01%升汞在表面轻轻擦拭晾干,最后放入无菌水中漂洗晾干。将病组织接种在PSA培养基上,每皿接种4片材料,在25 ℃恒温箱中暗培养。待菌落长出,用灭菌接种针在菌落边缘挑取小块,接至PSA斜面培养基上,在25 ℃恒温箱中继续培养。将分离得到的菌纯化、继续扩繁,培养成熟后用0.9% NaCl溶液将斜面上的孢子洗下制成2×106个/mL菌丝悬浮液。在阴天,随机选取10株葡萄,用喷雾器喷施菌悬液接种黑巴拉多幼叶,另设1喷施清水对照,套袋保湿并观察,待症状稳定后直接从病斑上刮取病原菌(沈国军和徐祖荣,2010)。
1. 2. 3 葡萄痂囊腔菌DNA提取与rDNA-ITS区域核苷酸序列测定 使用生工生物工程(上海)股份有限公司的Ezup柱式基因组DNA抽提试剂盒(真菌)提取病原菌DNA,并略有改进。取冷冻干燥菌丝约0.2 g,在研钵中预冷,然后研磨成粉末,迅速将干粉末转移,置于灭菌2 mL离心管中,在离心管中加入500 μL抽提缓冲液,55 ℃恒温水浴50 min,期间每隔10 min轻轻振荡混匀离心管内的缓冲液;待完成后,离心,轻轻吸取上清液至新离心管,加入等体积氯仿∶异戊醇(24∶1),涡旋振荡充分混匀,离心取上层水相;重复2次;离心后轻轻吸取上清液至新离心管,加1/10体积的3 mol/L NaAc(pH 5.2)和等体积异丙醇涡旋混匀,-20 ℃下静置30 min;离心,弃上清液,用无水乙醇洗涤沉淀,将沉淀溶于30 μL TE缓冲液中,-20 ℃保存备用。
扩增所用引物为真菌ITS区通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')(林玲,2010;张剑侠等,2010)。PCR反应体系(20.0 μL):10×PCR反应缓冲液2.5 μL,MgCl2(25 mmol/L)2.0 μL,dNTP(2.5 mmol/L)2.0 μL,Taq DNA聚合酶(5 U/μL)0.2 μL,上、下游引物(10 μmol/L)各1.0 μL,DNA模板2.0 μL,灭菌水10.3 μL。反应程序:94 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行30个循环;72 ℃延伸10 min。取扩增产物6 μL电泳检测,在凝胶成像系统进行观察并拍照。使用 DNA凝胶回收试剂盒(天根生化科技有限公司,产品号DP209)回收目的DNA片段,由生工生物工程(上海)股份有限公司测序。将测得的ITS序列在NCBI网站中进行同源性比对分析(雷百战和李国英,2004;尚晶晶,2010)。
1. 2. 4 葡萄痂囊腔菌培养条件筛选
培养基筛选:将葡萄痂囊腔菌接种于PSA培养基上,待菌落生长至d=50 mm时用无菌打孔器取d=3 mm的菌丝块,分别转接至4种真菌培养基(CM、LB、YEB、PSA)上,接种后的培养基在25 ℃暗培养,每处理重复3次。每隔7 d测量其菌落直径并用肉眼观察菌落厚薄。
培养基含糖量筛选:以蔗糖配制成浓度分别为3.0、4.5、6.0和7.5 g/L的PSA培养基,按上述方法接菌,置于28 ℃下培养,定时测定菌落直径并观察菌落厚薄。
培养温度筛选:在5~30 ℃范围内设置5种不同温度(10、15、20、25、30)处理,按上述方法接菌,定时测定菌落直径并观察菌落厚薄。
光照条件筛选:分别在全光照、全黑暗、8 h光照/16 h黑暗和8 h黑暗/16 h光照条件下用PSA培养基在20 ℃下培养,接菌方法同上,定时测定菌落直径并观察菌落厚薄。
pH筛选:在PSA培养基上设置5种不同pH(4、6、8、10、12)处理,按上述方法接菌,定时测定菌落直径并观察菌落厚薄。
1. 3 统计分析
试验所得数据采用Excel 2007和DPS 9.50数据处理系统软件进行统计分析。
2 结果与分析
2. 1 葡萄痂囊腔菌DNA提取与ITS片段扩增
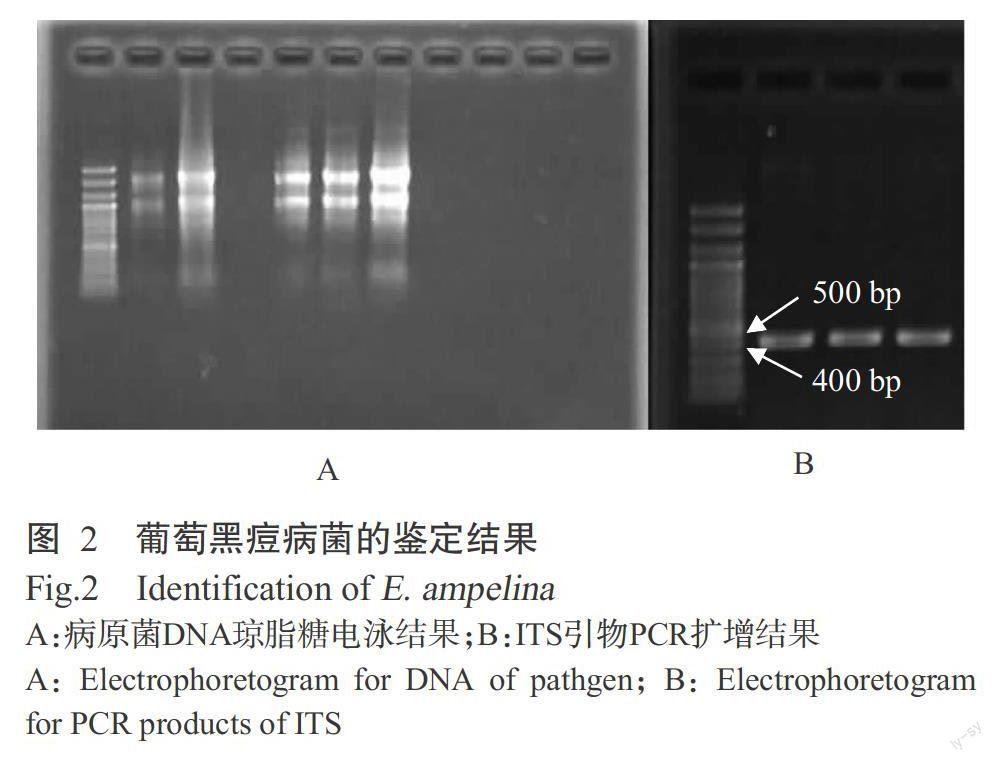
使用真菌试剂盒提取葡萄黑痘病病原菌DNA,其带型清楚可见(图2-A),扩增得到长度为451 bp的ITS片段(图2-B),扩增片段经回收,送至生工生物工程(上海)股份有限公司测序,结果在NCBI比对,序列片段与已公布的葡萄痂囊腔菌序列AY826763的相似度达99.9%,证实所分离病菌为葡萄痂囊腔菌(Elsinoe ampelina)。
2. 2 葡萄痂囊腔菌培养条件优化结果
2. 2. 1 不同培养基对葡萄痂囊腔菌生长的影响 从表1可知,葡萄痂囊腔菌在4种培养基中均能生长,但生长速度不一致,在PSA和YEB培养基上病原菌生长比LB和CM培养基快,其中以在PSA培养基上的生长速度最快。差异显著性分析结果表明,葡萄痂囊腔菌在PSA和YEB培养基上的生长速度显著(P<0.05,下同)高于在LB和CM培养基上的生长速度,而在PSA与YEB培养基上的生长速度间无显著差异(P>0.05,下同)。
2. 2. 2 不同蔗糖浓度对葡萄痂囊腔菌生长的影响
从表2可知,葡萄痂囊腔菌在蔗糖浓度3.0~7.5 g/L下均能生长,但生长速度不一致,其中在蔗糖浓度为4.5 g/L时生长最快,生长速度达0.03 cm/d。差異显著性分析结果表明,蔗糖浓度4.5 g/L下的葡萄痂囊腔菌生长速度显著高于在其他蔗糖浓度下的生长速度。
2. 2. 3 不同温度对葡萄痂囊腔菌生长的影响 从表3可知,葡萄痂囊腔菌在10~30 ℃条件下均能生长,但生长速度不一致,其中在25 ℃下生长最快,平均生长速度达0.07 cm/d。差异显著性分析结果表明,25 ℃条件下葡萄痂囊腔菌生长速度显著高于在其他温度条件下的生长速度。
2. 2. 4 不同光照条件对葡萄痂囊腔菌生长的影响
从表4可知,葡萄痂囊腔菌在不同光照条件下均能生长,且生长速度相近。差异显著性分析结果表明,不同光照条件下病原菌生长速度差异不显著。
2. 2. 5 不同pH对葡萄痂囊腔菌生长的影响 从表5可知,葡萄痂囊腔菌在pH 4时几乎不生长,在pH 8时生长最快,平均生长速度为0.01 cm/d。差异显著性分析结果表明,pH 8时葡萄痂囊腔菌生长速度显著高于其他處理的菌落生长速度。
3 讨论
本研究从感染黑痘病的黑巴拉多病叶片上分离、纯化了病原菌并提取其DNA,PCR扩增得到其ITS片段,片段测序后与NCBI已公布葡萄痂囊腔菌序列AY826763的相似度达99.9%,证实所分离病菌正是葡萄黑痘病菌E. ampelina,与肖欢等(2010)研究所得结果一致。
通过统计在不同培养条件下葡萄痂囊腔菌的生长情况,明确了蔗糖浓度和培养温度是影响该菌生长的最大因素。本研究结果表明,葡萄痂囊腔菌在PSA、LB、YEB和CM培养基上均可生长,但在PSA和YEB上生长较快,尤其在PSA培养基上生长最快,在LB和CM培养基上只能缓慢生长;葡萄痂囊腔菌在10~30 ℃下均可生长,PSA培养基上的病菌在25 ℃下生长速度最快,达0.07 cm/d;病菌在3.0~7.5 g/L的蔗糖浓度下均能生长,尤其在4.5 g/L浓度下生长速度最快,达0.03 cm/d;光照时间长短对葡萄痂囊腔菌生长影响不明显;葡萄痂囊腔菌在pH 4~12条件下均能生长,但在pH 6~10生长较快,最适pH为8,与前人的研究结果(王倩,2011)一致。在目前已有的研究报道中,葡萄痂圆孢菌多在PDA上培养,菌落直径可达1 cm,但生长周期长达3个月,生长速度为0.03 cm/d(肖欢等,2010;王倩,2011;刘昆玉等,2013),如此漫长的培养周期严重影响了后续对黑痘病防治研究工作的开展。本研究通过对葡萄痂圆孢菌实验室培养条件进行筛选和调优,成功将其菌落生长至直径1 cm的培养周期由3个月缩短至1个月,菌落生长速度提高了133%,极大缩短了黑痘病研究过程中获取病原菌培养物的工作周期,为提高葡萄黑痘病研究的工作效率起到了推动作用。
4 结论
本研究从患黑痘病的黑巴拉多病叶上分离获得黑痘病病原菌葡萄痂圆孢菌(E. ampelina)。葡萄痂圆孢菌生长受环境条件影响,其可在多种培养基上生长,其中对PSA培养基的利用最好;高浓度蔗糖对其生长有抑制作用;该菌生长不受光照的影响,在25 ℃下生长最好;其在pH 6~10下生长较好,生长环境偏碱性。可见,通过培养条件优化能显著加快其生长速度,提高培养效率。
参考文献:
雷百战, 李国英. 2004. 新疆葡萄炭疽病病原的鉴定及其生物学特性的研究[J]. 石河子大学学报(自然科学版), 22(4):298-300.
Lei B Z, Li G Y. 2004. Identification and biological characteristics of Colletotrichum gloeospor ioides on grape in Xinjiang[J]. Journal of Shihezi University(Natural Science), 22(4): 298-300.
林玲. 2010. 湿热地区不同葡萄品种对黑痘病的抗性分析[J].中国果业信息, 22(2): 52.
Lin L. 2010. Study on the anthracnose disease resistance of different varieties of grape cultivar in hot and humid southern China[J]. China Fruit News, 22(2): 52.
刘会宁,李彬. 2015. 云大-120对葡萄黑痘病抗性及果实品质的影响[J]. 中国南方果树, 44(6): 88-90.
Liu H N, Li B. 2015. Yunda-120 has effects on grape fruit quanlity[J]. China Southern Fruit, 44(6): 88-90.
刘昆玉,方芳,石雪晖,杨国顺,钟晓红,倪建军,徐丰,白描,聂松青,陈湘云. 2013. 腺枝葡萄与刺葡萄对葡萄黑痘病和霜霉病的抗性[J]. 湖南农业大学学报(自然科学版), 39(1): 46-51.
Liu K Y, Fang F, Shi X H, Yang G S, Zhong X H, Ni J J, Xu F, Bai M, Nie S Q, Chen X Y. 2013. Resistance of Vitis adenoclada Hand. -Mazz. and Vitis davidii Fox to Sphaceloma ampelinum and Plasmopara viticola[J]. Journal of Hunan agricultural University(Natural Science), 39(1): 46-51.
刘志刚. 2006. 葡萄黑痘病发生危害情况及防控措施[J]. 安徽农学通报,12(6): 166.
Liu Z G. 2006. Occurrence situations and countermeasures of grape anthracnose disease[J]. Journal of Anhui Agricultu-
ral, 12(6): 166.
尚晶晶. 2010. 中国葡萄炭疽病病原菌的鉴定及种群分化的研究[D]. 呼和浩特:内蒙古农业大学.
Shang J J. 2010. Indentification and population differentiation of pathogen caused grape anthracnose in China[D]. Huhhot: Inner Mongolia Agricultural University.
沈国军,徐祖荣. 2010. 葡萄黑痘病的识别与防治[J]. 现代园艺,17(7): 41.
Shen G J, Xu Z R. 2010. The identification and countermeasures of Sphecelomaampelinum de Bary[J]. Northwest Horticulture, 17(7): 41.
王倩. 2011. 中國野生毛葡萄抗黑痘病抑制消减杂交文库构建及表达序列标签(ESTs)分析[D]. 杨凌:西北农林科技大学.
Wang Q. 2011. Construction and est analysis of a suppressive subtraction cdna library of Chinese wild vitis quinquangularis inoculated with Elsinoe ampelina[D]. Yangling: North West Agriculture and Forestry University.
肖欢,朱明旗,侯鸿敏,赵素平,王西平. 2010. 陕西杨陵葡萄黑痘病病原菌的分离与鉴定[J]. 西北林学院学报, 25(2):132-135.
Xiao H, Zhu M Q, Hou H M, Zhao S P, Wang X P. 2010. Isolation and identification of Elsinoe ampelina in Yangling[J]. Journal of Northwest Forestry University, 25(2):132-135.
徐宁,廖惠红,覃丽萍,黄凤珠,黄羽,彭宏祥. 2014. 葡萄与黑痘病菌互作叶片细胞结构观察[J]. 西南农业学报,27(2):641-645.
Xu N,Liao H H,Qin L P,Huang F Z,Huang Y,Peng H X. 2014. Observation on cell structure of leaf during interaction between grape and anthracnose[J]. Southwest China Journal of Agricultural Sciences,27(2): 641-645.
杨华,周步海,邓晔,王景宏,顾克余,杨智青,时凯. 2009. 葡萄黑痘病研究进展及防治对策[J]. 江西农业学报, 21(11): 61-63.
Yang H, Zhou B H, Deng Y, Wang J H, Gu K Y, Yang Z Q, Shi K. 2009. The study progress and countermeasures of Sphecelomaampelinum de Bary[J]. Acta Agriculture Jiangxi, 21(11): 61-63.
张剑侠,王跃进,杨亚洲,余皓. 2010. 检测葡萄抗黑痘病基因DNA探针的合成及应用[J]. 农业生物技术学报, 18(5):985-992.
Zhang J X, Wang Y J, Yang Y Z, Yu H. 2010. Synthesis and application on DNA probe for detecting anthracnose resistance gene in grape[J]. Journal of Agricaltural Biotechnology,18(5): 985-992.
张剑侠,王跃进,张艳艳,周邦军. 2009. 中国野生葡萄抗黑痘病基因RAPD标记的克隆、序列分析及辅助育种应用[J]. 果树学报, 26(4): 456-460.
Zhang J X, Wang Y J, Zhang Y Y, Zhou B J. 2009. Cloning and sequence analysis of the RAPD marker linked to anthracnose-resistance gene in Chinese wild Vitis and its application for markerassisted breeding[J]. Journal of Fruit Science, 26(4): 456-460.
(责任编辑 麻小燕)
