不同生育期橡胶树幼茎细胞壁三要素的变化动态
2016-05-30曾仙珍王祥军李维国
曾仙珍 王祥军 李维国

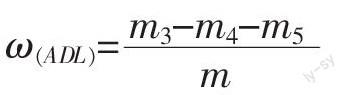
摘 要 对巴西橡胶树热研7-33-97半年生组培苗的木质部不同发育时期的木质素、纤维素和半纤维素含量进行测定分析,用Van Soes方法计算得到木质素、纤维素和半纤维素的含量。结果表明,木质素、纤维素和半纤维素在生长发育过程中的含量随着生长发育逐渐增加。其中木质素与纤维素的含量随着生长发育趋于稳定状态,而半纤维素的含量从GX期开始迅速增加,直到SX期也没有出现趋向稳定的趋势;木质素/纤维素的比值在发育过程中变化不大,木质素/半纤维素的比值及纤维素/半纤维素的比值在GX期均达最大。木质素与纤维素的相关性显著,积累是同步的。
关键词 巴西橡胶树;木质素;纤维素;半纤维素;生长发育
中图分类号 S794.1 文献标识码 A
Abstract In this paper, the content of lignin, cellulose and hemicellulose of xylem at different stages of Reyan 7-33-97 rubber tree seedlings wood, and the content of them were calculated by Van Soes method. The results showed that the content of lignin, cellulose and hemicellulose in the process of growth gradually increased. In addition, the content of lignin and cellulose tended to a stable state with the growing development, and the content of hemicellulose from GX period began to increase rapidly, until the SX period did not incline to stable trend. Cellulose/lignin ratio during the development process changed a little, lignin/cellulose ratios and ratio of cellulose/hemicellulose ratios in the GX were the largest. Correlation of lignin and cellulose showed that the accumulation of lignin and cellulose were synchronous.
Key words Hevea brasiliensis; Lignin; Cellulose; Hemicellulose; Growth and development
doi 10.3969/j.issn.1000-2561.2016.05.010
巴西橡胶树原产地在巴西亚马逊河流域马拉岳西部地区,属多年生高大落叶乔木,大戟科三叶橡胶属,是天然橡胶的主要来源[1]。由于常规橡胶树的种植方法需要8年才可以割胶,国内外许多学者着手研究橡胶树育种,在各方面取得了一定的进展,从20世纪50年代开始,研究橡胶树的组织培养技术[2],到90年代打开了橡胶树的基因大门[3-4]。
近年来有许多关于植物木质素、纤维素及半纤维素的研究,纤维素、半纤维素和木质素都是细胞壁的组成成分[5],随着积累使细胞壁厚度和木质化程度增加,增强细胞的支撑作用,提高抗风性。这些组分在发育中的组成、相互作用及如何应激外界因素的影响,日渐被研究学者们重视[6]。目前,国内外还没有关于橡胶树的幼苗树茎在生长发育过程中的木质素、纤维素和半纤维素的报道。木材中的木质纤维素的合成与积累并不是随意发生的,与调控的基因和蛋白酶等有关,具有时间性和空间性[7-8]。对橡胶树生长过程中木质素、纤维素及半纤维素的含量变化进行研究,有助于明确橡胶树的木质素、纤维素和半纤维素的形成机制及其规律,为研究橡胶树的木质素、纤维素、半纤维素合成的有关基因与蛋白质提供一定的基础依据。
1 材料与方法
1.1 材料
本试验选用的材料为种植于中国热带农业科学院九队苗圃的巴西橡胶树(Hevea brasiliensis)半年生热研7-33-97组培苗。统一选择顶蓬叶子在古铜时期的材料,取4个时期树皮分别为淡绿色(LGX)、绿色(GX)、半木栓化(SSX)、木栓化(SX)的木质部部分(图1)。
1.2 方法
1.2.1 NDF(中性洗涤纤维)含量的测定 参照Van Soest[9]和Goering[10]的方法,并稍作修改。称取样品1.0 g(记为m)和0.5 g无水亚硫酸钠于圆底烧瓶中,加100 mL中性洗涤剂和2 mL十氢化萘轻摇混匀后至连接冷凝装置,置于电炉上加热,大火沸10 min后转小火微沸1 h后冷却10 min,将瓶内的全部残渣冲洗到砂芯漏斗中,抽滤,抽滤干净后用丙酮冲洗3遍,放在105 ℃烘箱中烘至恒重,记为m2。
1.2.2 ADF(酸性洗涤纤维)的测定 参照文献[9-10]的方法,并稍作修改。称取样品1.0 g(记为m′)于圆底烧瓶中,加100 mL酸性洗涤剂和2 mL十氢化萘混匀后,置于电炉上大火煮沸10 min转小火微沸1 h,冷却10 min,将残渣抽滤干净,用丙酮冲洗残渣,105 ℃烘箱烘至恒重记为m2′。
1.2.3 木质素含量的测定 参照文献[9-10]的方法,并稍作修改。在1.2.2中烘干的漏斗中加入1.0 g酸洗石棉,加入72%的硫酸溶液用玻璃棒将样品和石棉搅成糊状,待硫酸流出时,每隔1 h加硫酸溶液并搅动,3 h后过滤,用超纯水洗涤残渣至滤液的pH值为中性,放到105 ℃烘箱中烘至恒重记为m3。再放在500 ℃电炉灼烧2 h后转入105 ℃烘箱中烘干至恒重,记为m4。称取1 g石棉,放入已知质量的漏斗中加硫酸溶液,同实验组一样做法,最后记录石棉的失重记为m5,作为空白对照,m5<0.002 g。
1.3 数据处理
半纤维素的质量分数:
ω(半纤维素)=ω(NDF)-ω(ADF)
酸性木质素ADL的质量分数计算:
纤维素的质量分数计算:
ω(纤维素)=ω(ADF)-ω(72%硫酸处理后的残渣)
采用SPSS软件对所得的数据进行方差分析ANOVA和多重比较分析LSD Duncan;p<0.05为差异显著,p<0.01为差异极显著。
2 结果与分析
2.1 幼茎木材不同生育期的木质素、纤维素和半纤维素含量
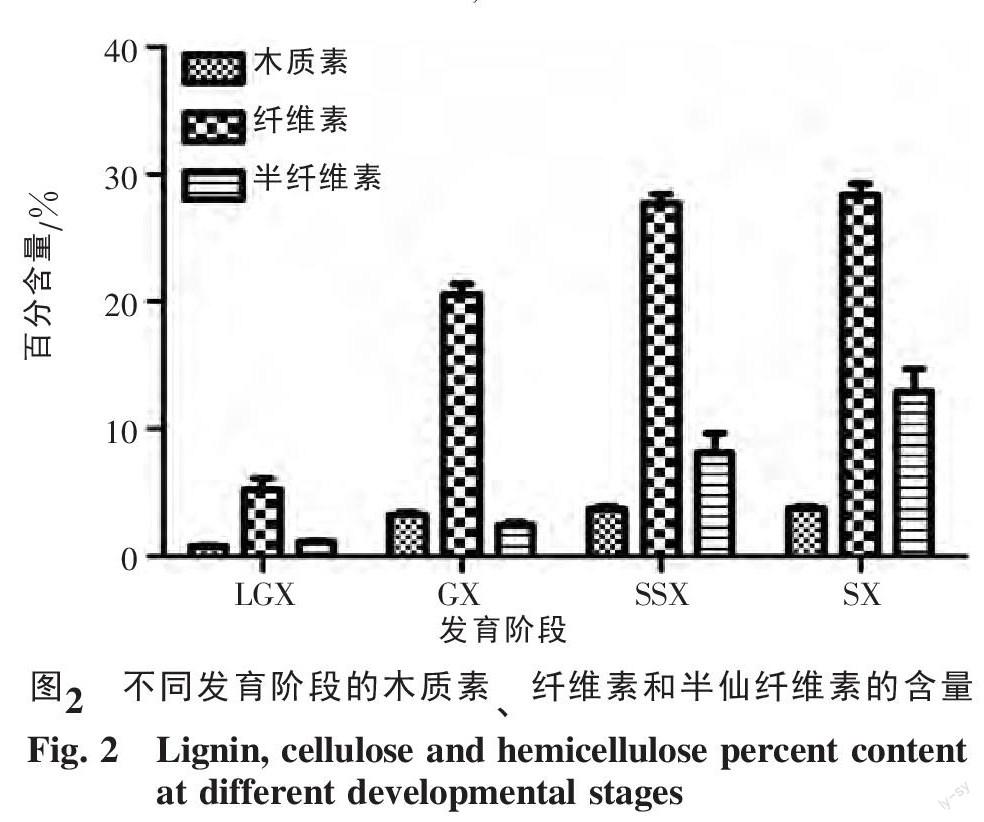
橡胶树在生长的各个阶段中,木材中的化学成分的组成不同,在本研究中,测定了半年生的橡胶树组培苗幼茎木质素、纤维素和半纤维素的含量,不同发育阶段的木质素、纤维素和半纤维素的积累都随着生长发育逐渐增加(图2)。
木质素含量在LGX时最低,随着植株的生长发育而逐渐增加,在SX期时最高。木质素含量在整个生长过程中增加不大,从LGX期到GX期快速增加,GX期之后直到SX期,含量的增长趋势逐渐减弱,趋于稳定。用SPSS统计软件对各时期木质素的含量进行ANOVA分析(表1),显示GX期与SSX期和SX期的木质素含量差异不显著,LGX期的木质素含量与其他3个时期的木质素含量均达到了极显著差异
纤维素的含量从LGX期到SSX期快速增长,从SSX期到SX期纤维素的含量变化不大,增长缓慢。这4个生长发育的过程中,SSX期与SX期的纤维素没有显著性差异,在其他各组之间比较结果显示均达到了显著的差异。
半纤维素的含量从LGX到GX期半纤维素含量增加较为缓慢,从GX期开始,半纤维素迅速增加,直到SX期。LGX期与GX期之间半纤维素没有显著性差异,其他几个时期之间都达到显著性差异,且在LGX与SSX期和SX期之间均达到了极显著。
木质素与纤维素的含量随着生长发育积累增长然后到SSX期后开始趋于稳定,而半纤维素含量的增加到SSX时期和SX时期,并没有趋向稳定,还有增长的趋势,半纤维素的大量积累是从GX时期开始。对于木质素与纤维素的积累,SSX时期是一个转折点,对于半纤维素,GX时期是一个转折点,其合成迅速增加。
2.2 幼茎木材不同生育期木材中木质素、纤维素、半纤维素含量的比值
橡胶树在生长过程中,木材中的化学成分组成各有不同,在各时期,木质素、纤维素、半纤维素之间比值的变化,结果如图3显示,在生长发育的各个阶段中,比值会有所变化。
在幼苗的不同发育阶段中,木质素/纤维素的比值在发育过程中变化不大,说明在橡胶树幼苗内,木质素和纤维素的增长速率相同。木质素/半纤维素的比值及纤维素/半纤维素的比值变化趋势相同,从LGX期到GX期都是在增大,在GX期最大,然后随着生长发育逐渐减小,而且,结果显示在SSX和SX期的比值均比LGX期的比值小,由此可见,随着生长发育木质化程度的增高,木质素及纤维素的增长速率逐渐减小,且比半纤维素的增长速率低。
2.3 幼茎木材木质素、纤维素、半纤维素合成及与发育阶段间的相关性分析
对橡胶树木质素、纤维素和半纤维素与发育阶段间的相关性分析见表2,可见,均有显著相关性,Pearson值越大,相关性越高,二者的关系越密切。分析的结果中显示,相关系数都超过0.7,说明木质素、纤维素、半纤维素与发育阶段之间存在相关性,而且木质素与纤维素的相关系数达到0.968,在这4个因素中相关性最高,说明木质素与纤维素的关系最密切,植株在生长发育过程中木质素与纤维素的积累是同步的。
3 讨论与结论
纤维素、半纤维素和木质素是细胞壁的组成成分[11-12],随着合成[13-15]、积累使细胞壁厚度和木质化程度增加,增强细胞的支撑作用,提高树木的抗风性。前人对非洲、美洲和南美洲的81种热带植物的幼苗与大树的木材化学成分的研究发现幼苗中的木质素含量均高于大树的木质素含量[16-19]。在本次研究的幼龄橡胶树组培苗中,木质素与纤维素的含量随着生长发育逐渐增加,增长的速率却在减小。在巴西橡胶树幼苗中,纤维素和木质素的大量合成是在LGX到GX期,增长的速率是最大的,所以在这个阶段纤维素和木质素的合成最多。研究学者们从拟南芥、水稻和杨树中研究了纤维素合酶及纤维素合酶基因[20-21]。对于木质素合成酶的研究,现已有报道测出了拟南芥、烟草、杨树、火炬松等植物的木质素合成酶的DNA序列[22-26]。表达序列标签分析和微阵列分析也被用于木质部的发育研究,相继得到了很好的结果[27-28],对木材的发育机制的研究提供了平台。刘彤等[29]根据与拟南芥木质素合成基因高度同源的AtMYB20的克隆得到了调控橡胶树木质素合成的基因HbMYB20。幼苗木质部中半纤维素的含量在LGX到GX期增加的速率不大。在GX期有较高的木质素与纤维素比值和纤维素与半纤维素的比值,在这一时期木质素的合成量最大,其次是纤维素,半纤维素的大量合成是在SSX和SX期。植物细胞中,纤维素与半纤维素由氢键相连形成网络结构,虽然木质素与纤维素的相关性最高,但是纤维素与半纤维素的含量在后期较为接近,随着生长发育,或许会更加接近。
橡胶树半年生幼苗不同育期细胞壁中的木质素、纤维素及半纤维素的含量逐渐增加。幼龄木材的化学特征与大树木材化学特征并不相同,幼龄木材发育过程中的化学成分的变化会体现在大树中[30],研究橡胶树幼茎的木材化学成分对研究橡胶树的木材特征具有重要意义。GX和SSX时期是一个转折点,可进一步对GX和SSX期相关蛋白质及代谢物的研究,探索橡胶树在生长发育过程中,与木质素、纤维素和半纤维素合成有关的蛋白质及基因,为后续橡胶树生长发育机制的研究提供研究方向。
参考文献
[1] 邱海燕. 巴西橡胶树REF、 RT和SRPP基因物理定位的研究[D]. 海口: 海南大学, 2010.
[2] 谭德冠, 黄华孙, 庄南生, 等. 巴西橡胶树倍性育种研究进展[J]. 热带农业科学, 2004(1): 58-64.
[3] 田 郎. 生物技术在巴西橡胶树遗传改良中的应用综述[J]. 陕西林业科技, 2010(6): 105-118.
[4] 何 鑫. 巴西橡胶树JAZ和MYC家族几个成员基因表达和产量相关性的研究[D]. 海口: 海南大学, 2013.
[5] 宋东亮, 沈君辉, 李来庚, 等. 高等植物细胞壁中纤维素的合成[J]. 植物生理学报, 2008, 44(4): 791-796.
[6] Josè-Estanyol M, Puigdomènech P. Plant cell wall glycoproteins and their genes[J]. Plant Physiology and Biochemistry, 2000, 38(1): 97-108.
[7] 吕春娟. 乔木根系抗拉力学特性及其与化学成分关系[D]. 北京: 北京林业大学, 2013.
[8] 张 莉. 木质纤维素组分分离工艺的研究[D]. 长春: 长春工业大学, 2014.
[9] Van Soest P J. Use of detergents in the analysis of fibrous feeds. II. A rapid method for the determination of fiber and lignin[J]. J Assoc of Anal Chem, 1963, 46: 829-835.
[10] Goering H K, Van Soest P J. Forage fiber analyses(apparatus, reagents, prcedures, and some applications)[J]. USDA Agr Handb, 1970.
[11] 宋东亮, 沈君辉, 李来庚. 高等植物细胞壁中纤维素的合成[J]. 植物生理学通讯, 2008, 44(4): 791-796
[12] Josè-Estanyol M, Puigdomènech P. Plant cell wall glycoproteins and their genes[J]. Plant Physiology and Biochemistry, 2000, 38(1): 97-108.
[13] Doblin M S, Kurek I, Jacob-Wilk D, et al. Cellulose biosynthesis in plants: from genes to rosettes[J]. Plant Cell Physiol, 2002, 43: l 407-1 420.
[14] Joshi C P, Bhandari S, Ranjan P, et al. Genomics of cellulose biosynthesis in poplars[J]. New Phytol, 2004, 164: 53-6l.
[15] Saxena I M, Brown Jr R M. Cellulose biosynthesis: current views and evolving concepts[J]. Ann Bot, 2005, 96: 9-2l.
[16] Nuopponen M H, Wikberg H I, Birch G M, et al. Characterization of 25 tropical hardwoods with Fourier transform infrared, ultraviolet resonance Raman, and 13C‐NMR cross‐polarization/magic‐angle spinning spectroscopy[J]. Journal of Applied Polymer Science, 2006, 102(1): 810-819.
[17] Santana M A E, Okino E Y A. Chemical composition of 36 Brazilian Amazon forest wood species[J]. Holzforschung, 2007, 61(5): 469-477.
[18] Rana R, Langenfeld-Heyser R, Finkeldey R, et al. FTIR spectroscopy, chemical and histochemical characterisation of wood and lignin of five tropical timber wood species of the family of Dipterocarpaceae[J]. Wood Science and Technology, 2010, 44(2): 225-242.
[19] Van Geffen K G, Poorter L, Sass-Klaassen U, et al. The trait contribution to wood decomposition rates of 15 Neotropical tree species[J]. Ecology, 2010, 91(12): 3 686-3 697.
[20] Richmond T. Higher plant cellulose synthases[J]. Genome Biol, 2000(4): 3001.1-3001.6.
[21] Tanaka K, Murata K, Yamazaki M, et al. Three distinct rice cellulose synthase catalytic subunit genes required for cellulose synthesis in the secondary wal1[J]. Plant Physiol, 2003, 133(1): 73-83.
[22] Suzuki S, Li L, Sun Y H, et al. The cellulose synthasegene superfamily and biochemical functions of xylem-spe-cific cellulose synthase-like genes in Populus trichocarpa[J]. Plant Physio1, 2006, 142: 1 233-1 245.
[23] Bell-Lelong D A, Cusumano J C, Meyer K, et al. Cinnamate-4-hydroxylase expression in Arabidopsis Regulation in response to development and the environment[J]. Plant Physiology, 1997, 133(3): 729-738.
[24] Sewall V J H, Ni W, Blount J W, et al. Reduced lignin contene and altered lignin composistion in transgenic tobacco down-regulated in expression of 1-phenylalanine ammonia-lyase or cinnamate 4-hydroxylase[J]. Plant Physiol, 1997, 115: 41-50.
[25] Barakat A, Bagniewska A, Choi A, et al. The cinnamyl alcohol dehydrogenase gene family in Populus: phylogeny, organization, and expression[J]. BMC Plant Biology, 2009, 9(26): 1-15.
[26] MacKay J J, Liu W, Whetten R, et al. Genetic analysis of cinnamy alcohol dehydrogenase in loblolly pine: single gene in heritance, molecular characterization and evolution[J]. Molecular and General Genetics MGG, 1995, 247(5): 573-545.
[27] Mellerowicz E J, Baucher M, Sundberg B, et al. Unravelling cell wall formation in the woody dicot stem[M]//Plant Cell Walls. Springer Netherlands, 2001: 239-274.
[28] Hertzberg M, Aspeborg H, Schrader J, et al. A transcriptional roadmap to wood formation[J]. Proceedings of the National Academy of Sciences, 2001, 98(25): 14 732-14 737.
[29] 刘 彤, 杨文凤, 校现周, 等. 橡胶树HbMYB20基因的克隆及其对拟南芥次生壁发育的调控[J]. 林业科学, 2015, 51(4): 52-59.
[30] Martin A R, Thomas S C, Zhao Y. Size-dependent changes in wood chemical traits: a comparison of neotropical saplings and large trees[J]. AoB Plants, 2013, 5(8): plt039.
