响应曲面法优化美拉德反应以制备蘑菇酪氨酸酶活性抑制组分
2016-05-30黄小楠李奕星李芬芳陈娇袁德保金志强
黄小楠 李奕星 李芬芳 陈娇 袁德保 金志强


摘 要 MRPs作为天然抗褐变剂,可抑制引起果蔬酶促褐变的酪氨酸酶的酶活。为进一步优化美拉德反应以制备酪氨酸酶活性抑制组分,本研究采用响应面法对MRPs制备工艺进行研究。在单因素实验基础上,确定美拉德反应初始pH、反应温度、反应时间、底物浓度比(糖 ∶ 氨基酸)4个因素,设计4因素5水平的二次回归中心组合试验。经响应面法分析,为方便实际操作,确定最佳工艺条件为:初始pH为2.94,反应时间为1.9 h,反应温度为110.09 ℃,底物浓度比(糖 ∶ 氨基酸)为0.57。经实验验证,得出结果与理论值相对误差较小,故采用二次回归中心组合设计得到的最优MRPs制备条件参数准确可靠。
关键词 响应曲面;美拉德反应;酪氨酸酶;活性抑制
中图分类号 S646.11 文献标识码 A
Abstract MRPs as the natural anti browning agent can inhibit tyrosine enzyme activity. In order to optimize the maillard reaction in the preparation of tyrosinase activity of components,the technique conditions of maillard reaction products preparation were studied by response surface method. Based on the single-factor tests, determining four factors ∶ the initial pH of maillard reaction,reaction temperature,reaction time and the substrate concentration ratio(sugar ∶ amino acids)and designing four factors and five levels quadratic regression test center combination. The conditions were optimized as:initial pH 2.94,reaction time 1.9 h,reaction temperature 110.09 ℃,the substrate concentration ratio(sugar,amino acids)0.57. After experimental verification,the results were close to the theoretical value and these predicted values were exact and reliable.
Key words Response surface;Maillard reaction;Tyrosinase;The inhibition of activity
doi 10.3969/j.issn.1000-2561.2016.07.025
褐变是果蔬采后及加工损失的重要原因之一,如香蕉、苹果、蘑菇、莲藕等。褐变分为酶促褐变和非酶促褐变,而酶促褐变占主导。酶促褐变是指酚类物质在相关酶系催化下形成醌,并进一步聚合形成褐色素等[1]。多酚氧化酶是对果蔬酶促褐变起关键作用的酶系,蘑菇中主要是酪氨酸酶(多酚氧化酶的一种)[2]。
美拉德反应指氨基化合物(氨基酸、肽、蛋白质)和羰基化合物(糖类)之间发生的一系列复杂反应,美拉德产物(MRPs)是非酶促褐变反应的产物。国内外大量研究证实,MRPs能抑制香蕉、蘑菇等果蔬的酶促褐变[3]。目前,将MRPs用于蘑菇酪氨酸酶的抑制也有相关文献报道。Billaud等[3]研究经优化的谷胱甘肽-葡萄糖模式体系制备的MRPs对蘑菇酪氨酸酶的抑制活性;Wu等[4]考察了不同类型还原糖(单糖、双糖或低聚糖)对MRPs抑制蘑菇酪氨酸酶过程的影响,发现单糖影响效果优于其他还原糖。本项目组前期开展了反应条件[5]、超滤[6]对果糖-赖氨酸MRPs抑制香蕉褐变的影响,利用果糖-赖氨酸MRPs结合物理场来控制香蕉汁的褐变并对其进行温和灭菌等[7],研究发现果糖-赖氨酸模式MRPs及其富集组分对香蕉PPO具有很好的抑制活性。食品科研工作者开展酶学研究时,常选取来源于蘑菇的酪氨酸酶作为模式酶类。然而,尚未见关于果糖-赖氨酸模式MRPs对蘑菇酪氨酸酶抑制方面的研究报道。基于香蕉PPO与酪氨酸酶结构的相似性,以及不同模式MRPs在抑制机制方面存在着较多的共性特征,如螯合酶蛋白中的Cu2+与酶分子的可逆结合等,笔者推测果糖-赖氨酸MRPs对蘑菇酪氨酸酶也有较好的抑制效果。通常来讲,MRPs的组分组成与反应温度、时间、初始pH值、底物浓度及比例等关系密切[4]。基于此,本研究以果糖、赖氨酸为反应底物,以酶活残存率为响应值,在单因素实验基础上,采用二次回归中心组合(CCD)试验优化MRPs制备条件,以期建立可预测最佳制备条件的数学模型。本研究对蘑菇采后酶促褐变的抑制具有重要意义。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 赖氨酸、果糖、蘑菇酪氨酸酶、磷酸二氢钠、氢氧化钠、L-多巴胺、磷酸氢二钠、浓磷酸、等,均为国产分析纯。
1.1.2 仪器与设备 CR-22G冷冻高速离心机(日本HITACHI公司);4836 controller PARR 5500压力反应釜(美国Parr公司);Alpha-4冷冻干燥机(德国Matrin Christ 公司);UV-2300紫外分光光度计(上海天美科学仪器有限公司)。
1.2 方法
1.2.1 MRPs的制备 MRPS制备参照周娅等[6]报道的方法略作调整,配制浓度均为1 mol/L的赖氨酸与果糖溶液,然后将2种溶液以一定体积比混合,用4 mol/L的NaOH或浓磷酸溶液调节混合液的pH值,再将混合液置于压力反应釜中,于不同的反应温度或时间条件下制备MRPs;待反应结束,立即将反应产物放置于冰水中冷却,将冷却后的MRPs冻成干粉储藏备用。
1.2.2 MRPs对酪氨酸酶抑制能力的测定 将蘑菇酪氨酸酶与pH6.8的磷酸缓冲溶液按照质量(g)与体积(mL)之比为1 ∶ 4的比例混合均匀,即为试验酶液。蘑菇酪氨酸酶活力测定试验参照 Shukla等[8]、Fatiha等[9]报道的方法略作调整,取1 mL 0.1%的MRPs溶液,加入2 mL 0.175 mol/L的磷酸缓冲液(pH6.8)和0.8 mL 0.01 mol/L的L-多巴胺溶液,混匀,将混合液置于30 ℃中水浴10 min,再加入制备好的酶液0.8 mL;加入酶液后开始计时,并在475 nm处测定其吸光度,每隔1 min测定1次,共6次,每个样液重复3次。酶活性以1min内OD值每增加0.001为一个活性单位(U),设加入样品后酶活为V1,空白组不添加MRPs溶液,测定酶活为V0,酪氨酸酶活残存率R=V1/V0×100%。
1.2.3 试验设计 通过单因素试验确定初始pH(A)、反应时间(B)、反应温度(C)、浓度比(D)对酪氨酸酶活残存率(R)的影响。在此基础上,利用Design-Expert 8.0.6软件设计4因素5水平二次回归中心组合试验,以酪氨酸酶活残存率为响应值,进行响应面分析。响应曲面试验因素和水平见表1。
1.3 数据处理
采用Design-Expert 8.0.6软件对实验数据进行回归分析。
2 结果与分析
2.1 美拉德反应条件对MRPs抑制酪氨酸酶活性的影响
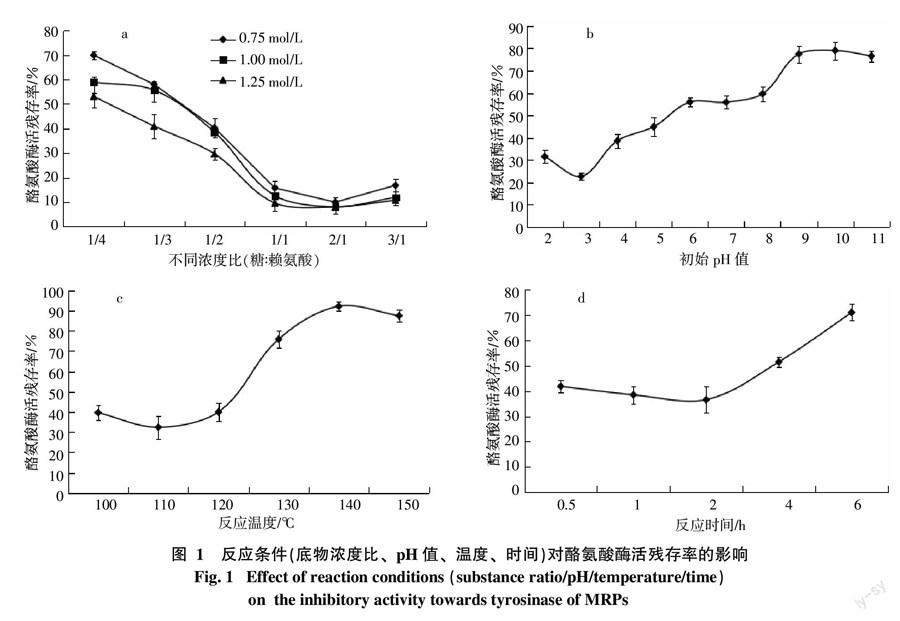
底物及浓度比对MRPs抑制酪氨酸酶活性的影响见图1-a。任意总浓度时,随果糖与赖氨酸浓度比的增大,酪氨酸酶活残存率先减小后增大。浓度比2/1时,酶活残余率最小。底物比一定时,总浓度越大,酶活残余率越低。
pH的影响见图1-b。pH<3时,酶活残存率随pH值增大而减小;pH=3~9时,酶活残存率随pH值增大而增大,pH=3时,酶活残存率低于25%;pH=9~11时,酶活残存率随pH值增大而减小,但酶活残余率均高于75%。
温度的影响见图1-c。100~110 ℃时,酶活残存率随温度升高而减小;110~140 ℃时,酶活残存率随温度升高而增大;大于140 ℃时,随温度升高酶活残存率呈下降趋势。
美拉德产物的酶抑制活性不仅受浓度、pH值、温度的影响,还与加热时间有很大关系。本研究中,时间的影响见图1-d。随时间延长,酶活残存率先下降后升高。
综上所述,单因素试验结果显示,较优的反应条件为:底物浓度比为2 ∶ 1,pH为3,反应温度为110 ℃,反应时间为1.5 h。
2.2 美拉德反应条件的响应曲面优化
表2为不同试验条件下所测定的蘑菇酪氨酸酶活残存率,利用Design-Expert 8.0.6软件对酪氨酸酶活残存率进行回归分析。
2.3 模型建立与分析
利用软件对表2的数据进行拟合,得到数学模型如下:
Y=14.58-1.44A-5.92B-1.62C-4.45D+5.13AB-3.21AC-0.24AD+0.29BC-3.86BD-1.09CD+6.52A2+4.95B2+7.72C2+5.52D2。方差分析显示,模型极显著且失拟项不显著(表3)。上述结果表明该方程拟合度较好,试验误差小,试验范围内能较准确地预测酶活残存率。此外,一次项A(初始pH)、B(反应时间)对酪氨酸酶活残存率的线性效应显著,其他因素不显著;二次项A2、B2、C2和D2对酪氨酸酶活残存率的曲面效应极显著,交互项AB、AD交互效应显著,其他交互作用不显著。因此,该模型的最佳反应条件为:初始pH2.94,反应时间1.9 h,反应温度110.09 ℃,底物浓度比(糖 ∶ 氨基酸)0.57,此时酪氨酸酶酶活残存率为10.23%。
2.4 响应面图与等高线图分析
固定2因素于零水平,其他因素的交互效应见响应曲面图及等高线图(图2)。由表3可以看出,各因素对MRPs抑制酪氨酸酶活能力影响大小的排序如下:初始pH>反应时间>反应温度>浓度比。等高线的形状可反映自变量间交互效应的显著性,椭圆形表示2因素交互效应显著,圆形则反之[10]。结合图2-a~f与表3的方差分析结果,反应初始pH值(A)与反应时间(B)的交互效应显著,反应初始pH值(A)与底物浓度比(D)交互效应显著。
3 讨论与结论
蘑菇采后褐变严重制约其货架期。蘑菇酪氨酸酶是多酚氧化酶的一种,该酶对蘑菇酶促褐变起关键作用。MRPs具有抑制蘑菇酶促褐变的作用[3],MRPs中的蛋白黑素、还原酮以及一些含N、S的杂环化合物等具有抗氧化、螯合铜离子、抑制酶活等特性,上述特性在抑制蘑菇酶促褐变中起重要作用[11]。而MRPs对蘑菇酪氨酸酶的活性抑制是衡量其抑制酶促褐变能力的重要指标。
以果糖-赖氨酸为底物,本研究首先揭示了美拉德反应条件(包括底物浓度和比例、pH、温度、时间)对MRPs抑制蘑菇酪氨酸酶活性的影响。当果糖与赖氨酸比例为2/1时,产物活性最高。Gu等[12]、赵晶等[13]指出,氨基与羰基比例为1 ∶ 2时有利于反应的进行,当氨基酸浓度过量时,分子内氨基和羧基会形成内酰胺,从而降低参与美拉德反应的氨基的物质量。Billaud等[14]考察了葡萄糖-半胱氨酸MRPs对苹果PPO的抑制,发现初始pH<6时抑制作用明显,pH为2~4时表现出较强的PPO抑制能力,该结论与本研究得出的结论(果糖-赖氨酸MRPs在初始pH为2-4时对蘑菇酪氨酸酶具有较强的抑制活性,在pH=3时对蘑菇酪氨酸酶抑制能力最强)基本一致。温度是影响美拉德反应的一个重要因素,温度升高有利于美拉德反应的进行,但温度过高时不利于MRPs的稳定,从而影响MRPs的酶活抑制能力,这与Lan等[15]、周向军等[16]的研究结果基本一致。随着美拉德反应时间的延长,MRPs组成组分发生变化,其对蘑菇酪氨酸酶的抑制活性先增强后减弱。
基于较优的单因素试验结果,通过响应曲面法对反应条件进行优化,并构建相应模型。本研究得到的最优条件如下:底物浓度比(糖 ∶ 氨基酸)0.57,pH2.94,反应时间1.9 h,反应温度110.09 ℃,此时蘑菇酪氨酸酶活残存率为10.23%。Billaud等[3]在单因素试验基础上,设计了2因素5水平的二次回归中心组合试验,考察葡萄糖-谷胱甘肽MRPs对蘑菇酪氨酸酶活性的抑制,确定最优反应条件如下:葡萄糖浓度为0.8~1.0 mol/L,谷胱甘肽浓度为0.15~0.5 mol/L,pH接近3,于110 ℃中反应7 h,此时酶活残存率约为25%。综上所述的2个不同的反应体系,都以对蘑菇酪氨酸酶活性的抑制为同样的考察指标,通过对比最优条件可发现,两者的初始pH及反应温度比较接近,而底物浓度及反应时间则差别较大;就2个体系最优反应条件而言,本研究中的果糖-赖氨酸模式MRPs对蘑菇酪氨酸酶的抑制活性要高于文献[3]报道。实验结果说明针对不同模式底物开展反应条件优化的必要性。同时,上述结果也进一步说明,因美拉德反应组分的复杂性,反应条件与美拉德产物组成组分及其活性间具有极其紧密的联系。
然而,到目前为止,关于对酶促褐变起抑制作用的MRPs具体成分(包括其他模型体系)及其分子作用机理尚未见报道,这也正是笔者正在开展的研究内容。
参考文献
[1] Zhou D, Li L, Wu Y W, et al. Salicylic acid inhibits enzymatic browning of fresh-cut Chinese chestnut (Castaneamollissima) by competitively inhibiting polyphenol oxidase[J]. Food Chemistry, 2015, 171: 19-25.
[2] Xing R, Wang F, Dong L, et al. Inhibitory effects of Na7PMo11CuO40 on mushroom tyrosinase and melanin formation and its antimicrobial activities[J]. Food Chemistry, 2016, 197: 205-211.
[3] Billaud C, Maraschin C, Nicolas J, et al. Maillard reaction products as“natural anti-browning”agents in fruit and vegetable technology[J]. Molecular Nutrition & Food Research, 2005, 49: 656-662.
[4] Wu J J, Cheng K W, Wang M F, et al. Antibrowning activity of MRPs in enzyme and fresh-cut apple slice models[J]. Food Chemistry, 2008, 109: 379-385.
[5]郑洁琼, 袁德保, 丁 武, 等. 初始pH值对果糖-赖氨酸模型美拉德产物抑制香蕉酶促褐变相关性质的影响[J]. 食品科学, 2012, 33(21): 24-28.
[6] 周 娅, 张海德, 袁德保, 等. 果糖-赖氨酸模型体系美拉德产物不同级分对抑制香蕉酶促褐变相关性质的影响[J]. 现代食品科技, 2013, 29(11): 2 653-2 657.
[7] 高 祺, 袁德保, 杨劲松, 等. 果糖-赖氨酸体系美拉德反应产物结合低温脉冲电场灭菌对香蕉汁品质的影响[J]. 现代食品科技, 2015, 31(12): 1-9.
[8] Shukla S, Park J, Kim H D, et al. Total phenolic content, antioxidant, tyrosinase and α-glucosidase inhibitory activities of water soluble extracts of noble starter culture Doenjang, a Korean fermented soybean sauce variety[J]. Food Control, 2016, 59: 854-861.
[9] Fatiha B, Didier H, Naima G, et al. Phenolic composition, in vitro antioxidant effects and tyrosinase inhibitory activity of three Algerian Mentha species: M. spicata(L.), M. pulegium(L.)and M. rotundifolia(L.)Huds(Lamiaceae)[J]. Industrial Crops and Products, 2015, 74: 722-730.
[10]全沁果, 杨 明, 林 菲, 等. 响应面法优化鸡蛋壳柠檬酸钙的制备工艺[J]. 核农学报, 2016(1): 79-85.
[11] Billaud C, Maraschin M N, Peytat M, et al. Maillard reaction products derived from thiol compounds as inhibitors of enzymatic browning of fruits and vegetables: the structure -activity relationship[J]. Ann Ny Acad Sci, 2005, 1043: 876-885.
[12]Gu F L, Abbas S, Zhang X M. Optimization of Maillard reaction products from casein-glucose using response surface methodology[J]. LWT-Food Science and Technology, 2009, 42(8): 1374.
[13]赵 晶, 张宏坤, 马丹雅, 等. 葡萄糖与赖氨酸美拉德反应产物的抗氧化性研究[J]. 食品工业科技, 2013, 34(11): 92-94.
[14] Billaud C, Maraschin C, Nicolas J, et al. Inhibition of polyphenoloxidase from apple by Maillard reaction products prepared from glucose or fructose with L-cysteine under various conditions of pH and temperature[J]. LWT-Food Science and Technology, 2004, 37(1): 69-78.
[15] Lan X H, Liu P, Xia S Q, et al. Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system: Further insights into thermal degradation and cross-linking[J]. Food Chemsistry, 2010, 120(4): 967-972.
[16]周向军, 祁爱平, 高义霞, 等. 甘氨酸和精氨酸与果糖美拉德反应条件及产物抗氧化作用[J]. 食品与生物技术学报, 2014, 33(9): 987-996.
