维生素D受体免疫组织荧光染色方法建立
2016-05-30杨祎琦王永吉
杨祎琦, 程 佳, 王永吉
(陕西理工学院 维生素D生理与应用研究所, 陕西 汉中 723000)
维生素D受体免疫组织荧光染色方法建立
杨祎琦,程佳,王永吉
(陕西理工学院 维生素D生理与应用研究所, 陕西 汉中 723000)
[摘要]建立维生素D受体(Vitamin D Receptor,VDR)特异性免疫荧光染色方法,对人十二指肠组织中VDR进行测定。采用石蜡包埋的方法对组织进行永久性固定、并制作组织石蜡切片,利用苏木精-伊红(Hematoxylin & Eosin,H&E)方法鉴定组织形态结构的完整性,利用免疫荧光(Immunofluorescence,IF)染色方法对组织中VDR进行免疫荧光染色,确定抗体使用最佳浓度范围并优化实验条件。结果表明:人十二指肠VDR在绒毛上皮细胞的胞质中高表达,一抗D-6的最佳稀释比率为1∶100,二抗A594的最佳稀释比率为1∶250,抗原最佳复性条件为0.01 mol/L pH 6.0柠檬酸缓冲液中850 W功率微波煮沸20 min。按照此方法制作的石蜡切片组织形态结构完整,VDR染色特异性高,重复性好。
[关键词]十二指肠;维生素D受体;免疫荧光染色
维生素D受体(Vitamin D Receptor,VDR)属于核受体(类固醇激素/甲状腺激素受体)超家族成员[1],以核受体(Nuclear VDR,nVDR)和膜受体(Membranae VDR,mVDR)两种形式存在,nVDR分子量大约50 kDa左右,mVDR分子量大约60 kDa左右[2],在体内主要介导维生素D的细胞作用,参与调节体内钙磷平衡、骨盐沉积、细胞的增殖分化及免疫系统功能等[3]。国内关于VDR的研究从1975年开始,相关研究论文逐年增加,根据中国知网等网站的检索数据,2014年达到峰值(1 309篇)。许多研究已证实VDR与乳腺癌、肺癌、糖尿病、高血压、肥胖症、甲状旁腺功能亢进、骨质疏松症等多种癌症及世界高危疾病之间关系密切。如VDR在乳腺癌细胞核中高表达,在细胞质中也有少量表达,并随癌细胞分化程度的增加而增加[4],但在乳腺上皮和肌上皮细胞为VDR阴性[5];VDR在宫颈癌细胞核中随癌症临床分期的增加呈表达上升的趋势[6-7];另外,维生素D可作用于肾素-血管紧张素系统(Renin Angiotensin System,RAS)达到降血压的功效,但其是否通过表达在分泌肾素的球旁器某种细胞中的VDR而起作用则不得而知[8]。
由于VDR在体内的广泛分布,目前明确VDR在不同组织的何种细胞表达,以及准确识别组织或细胞中的VDR,对于研究维生素D介导的药物治疗方法至关重要。随着生物技术领域的发展,VDR的检测研究使用了同位素标记、放射自显影及免疫组织化学等方法,特别是国外已建立了一种特异性和灵敏性的免疫组织荧光染色法,用于研究VDR的组织检测。国内有使用SABC(链霉素-生物素-过氧化物酶复合物技术)免疫组织化学技术测定组织细胞中VDR表达的报告,然而SABC的特异性和灵敏性等有待进一步研究。
本研究参考国内外对VDR检测研究的结果,结合现有条件,建立一种特异性VDR免疫荧光染色技术,为后续研究VDR的功能及作用机制打好基础。
1材料与方法
1.1材料
1.1.1组织
人的十二指肠组织切片,由陕西省西安交通大学附属3201医院提供。
1.1.2试剂
二甲苯(Fisher),无水乙醇,浓盐酸,苏木精染液,伊红染液,D-6抗体(Stanta Cruz),Alex Fluor 594-conjugated goat anti-mouse IgG(H+L)(Invitrogen),柠檬酸(Sigma),磷酸盐缓冲液(PBS,pH 7.4)(北京鼎国昌盛生物有限公司),Triton X-100(Sigma),牛血清白蛋白(BSA)(Genview),硫酸铝钾和碘酸钠(天津市盛奥化学试剂有限公司),冰醋酸(国药集团化学试剂有限公司),甘油(Sigma),DAPI(Invitrogen),阳离子防脱玻片(北京鼎国昌盛生物有限公司),其它未标明试剂均为实验室研究级。
1.1.3仪器
倒置荧光显微镜(Nikon Ti-S),微波炉(格兰仕G80F23YSL-X1),培养箱(LRH-70,上海一恒科学仪器有限公司),石蜡切片机(莱卡旋转式石蜡切片机2265),智能恒温磁力搅拌器(ZNCL-S,河南爱傅特仪器发展有限公司),纯水机(细胞型1810B,上海摩勒科学仪器有限公司),分析天平(TB-214,北京赛多利斯仪器系统有限公司),冷藏冷冻箱(海尔BCD-215 KS),pH计(STARTER 3C,上海奥豪斯仪器有限公司)。
1.2方法
1.2.1石蜡组织包埋
固定:组织用10%福尔马林溶液固定24~48 h,PBS洗涤。
脱水:用梯度乙醇逐级脱水,如70%乙醇,2 h;80%乙醇,2 h;90%乙醇,2 h;95%乙醇,2 h;100%乙醇,1 h;100%乙醇,30 min。
透明:分别用100%乙醇/二甲苯(1∶1)处理30 min,二甲苯处理20 min,再用二甲苯处理10 min。
浸蜡:用蜡I、蜡II、蜡III在65 ℃各浸埋40 min。
包埋:在自动包埋机上包埋。
1.2.2组织蜡块切片
切片:将包埋好的蜡块用刀片修成规则的长方形,再贴附于小木块上,然后将小木块固定在切片机的蜡块钳内,使蜡块切面垂直于水平面。固定切片刀,转动切片机手轮,切出片片相连的蜡带。用毛笔将蜡带放在纸上。
贴片:将洁净的阳离子防脱载玻片滴上无离子水后,放在加热板上加热至45 ℃左右,再将一定数量的蜡片转放于温水中,蜡片展开铺平后,用滤纸吸除多余水分,蜡片即贴在玻片上。
烤片:将载玻片放入37 ℃温箱中干燥24 h后,室温保存备用。
1.2.3H&E染色
脱蜡:石蜡切片需用二甲苯脱蜡(2次,各10 min),再用无水乙醇洗去二甲苯(2次,各5 min)。
复水:脱蜡后的样本用不同的乙醇溶液浸泡复水,如100%乙醇、75%乙醇、50%乙醇,每个溶液浸泡2次,各5 min,然后浸泡于蒸馏水中(2次,各5 min)。
染色:在苏木精液中染色30 min(细胞核染色),洗去苏木精液(流水1 min,1%盐酸乙醇5 s,再水洗10 s),进行胞质脱色(70%乙醇,2 min;80%乙醇,2 min;90%乙醇,2 min),随后进行伊红液染色(6 min),染色后进行脱水(95%乙醇、100%乙醇、二甲苯,每个溶液浸泡2次,每次5 min),脱水后盖上盖玻片,用中性树胶封固,在显微镜下观察结果。
1.2.4IF染色
脱蜡:用二甲苯脱蜡4次,每次8 min。
复水:在100%、90%、70%、50%、20%乙醇溶液中浸泡,每次5 min;然后水洗2次,每次5 min;再用1%Triton X-100浸洗30 min。
抗原复性:样本在900 mL 0.01 mol/L柠檬酸缓冲液中微波(850 W微波炉)煮沸20 min,然后冷却大于3 h。
封闭非特异性抗原:PBS+Tween 20溶液(PBS-T)洗涤2次,各5 min;用3% BSA-PBS溶液室温温育封闭20 min。
一抗孵育:VDR抗体D-6(1∶250稀释)溶液,在37 ℃下温育2 h;PBS-T洗4次,各5 min。
二抗孵育:二抗A549抗体(1∶500稀释)溶液,在37 ℃下温育1 h;PBS-T洗4次,各5 min;50%甘油封片,倒置荧光显微镜观察结果。
2结果与分析
2.1H&E染色结果
由于细胞核为嗜碱性物质,可被苏木精染成蓝色,胞浆主要为嗜酸性物质,可被伊红染成不同程度的红色,从而与细胞核区分开来,因此可对该组织切片进行结构分析。
从图1中可以看出,十二指肠微绒毛由数量较多的柱状细胞和少量杯状细胞组成,并且形态完整。绒毛上皮游离面是纹状缘。绒毛内中轴为结缔组织固有层,绒毛根部的上皮向固有层内凹陷,形成密集、管状的小肠腺。十二指肠由小肠腺向外依次是结缔组织和粘膜平滑肌。

图1 人十二指肠组织H&E染色
2.2IF染色结果
VDR作为抗原,可与特异性强、灵敏度高的第一抗体(D-6)结合;第一抗体与VDR形成复合物作为另一抗原,可特异地与带荧光物质标记的第二抗体(A594)结合,从而精确地对VDR进行组织亚细胞定位。
图2的结果显示,未加VDR抗体D-6,仅用二抗进行人十二指肠组织荧光染色,无特异的二抗染色,说明实验所选用的二抗与人十二指肠组织无或仅有很弱的相互作用。而细胞核染色特异清晰。
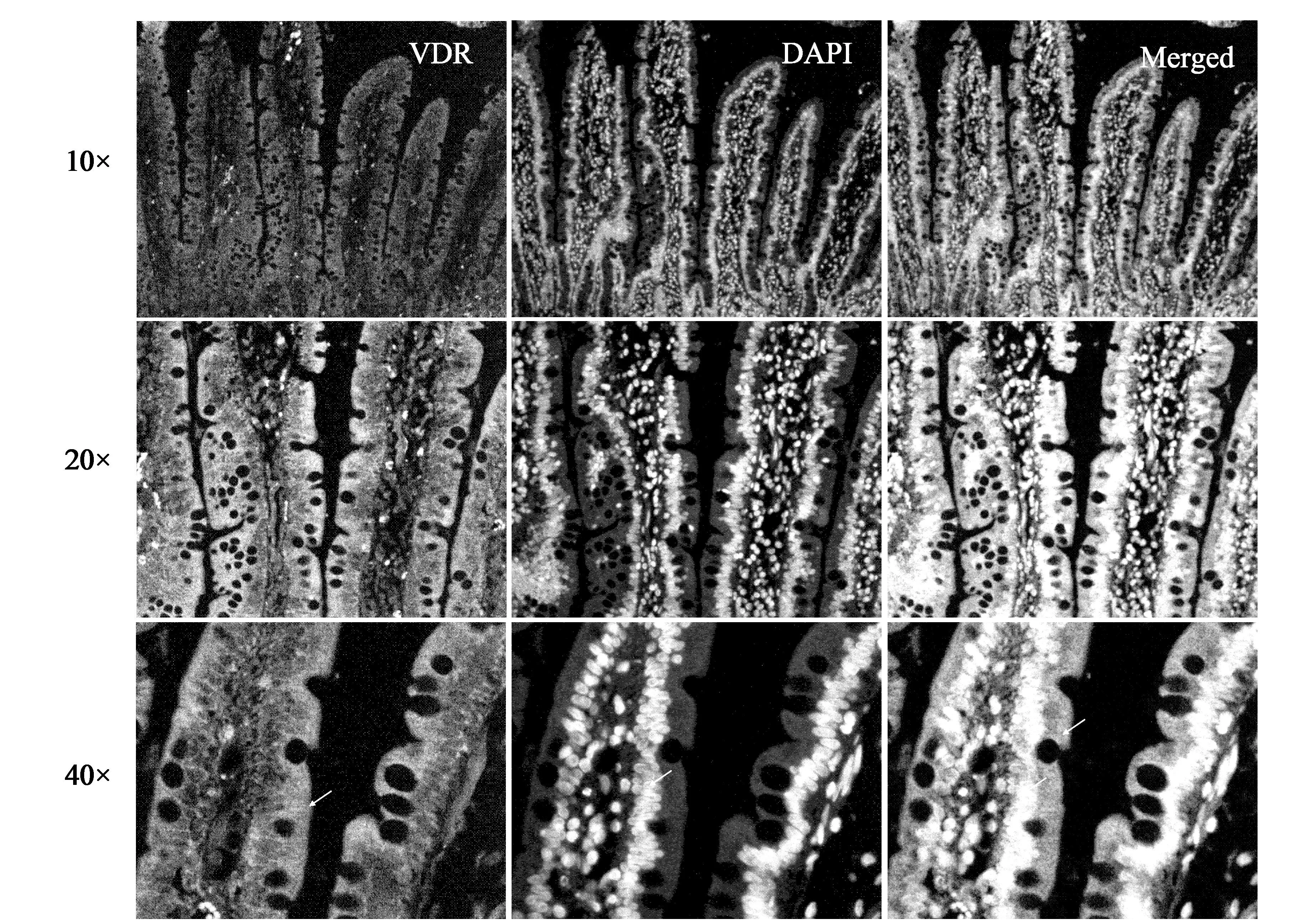
(a) 组织本底吸收色 (b) 细胞核DAPI染色 (c) VDR与DAPI叠加图2 人十二指肠维生素D受体阴性对照免疫荧光染色
与图2比较,图3的结果显示,用VDR抗体D-6进行人十二指肠组织荧光染色,一抗给出非常特异的VDR染色,而且VDR染色主要分布在细胞质中。分析发现,人的十二指肠VDR均匀分布在绒毛上皮细胞中,是仅有的VDR样性细胞。杯状细胞、结缔组织和平滑肌组织等均未见特异的VDR染色。
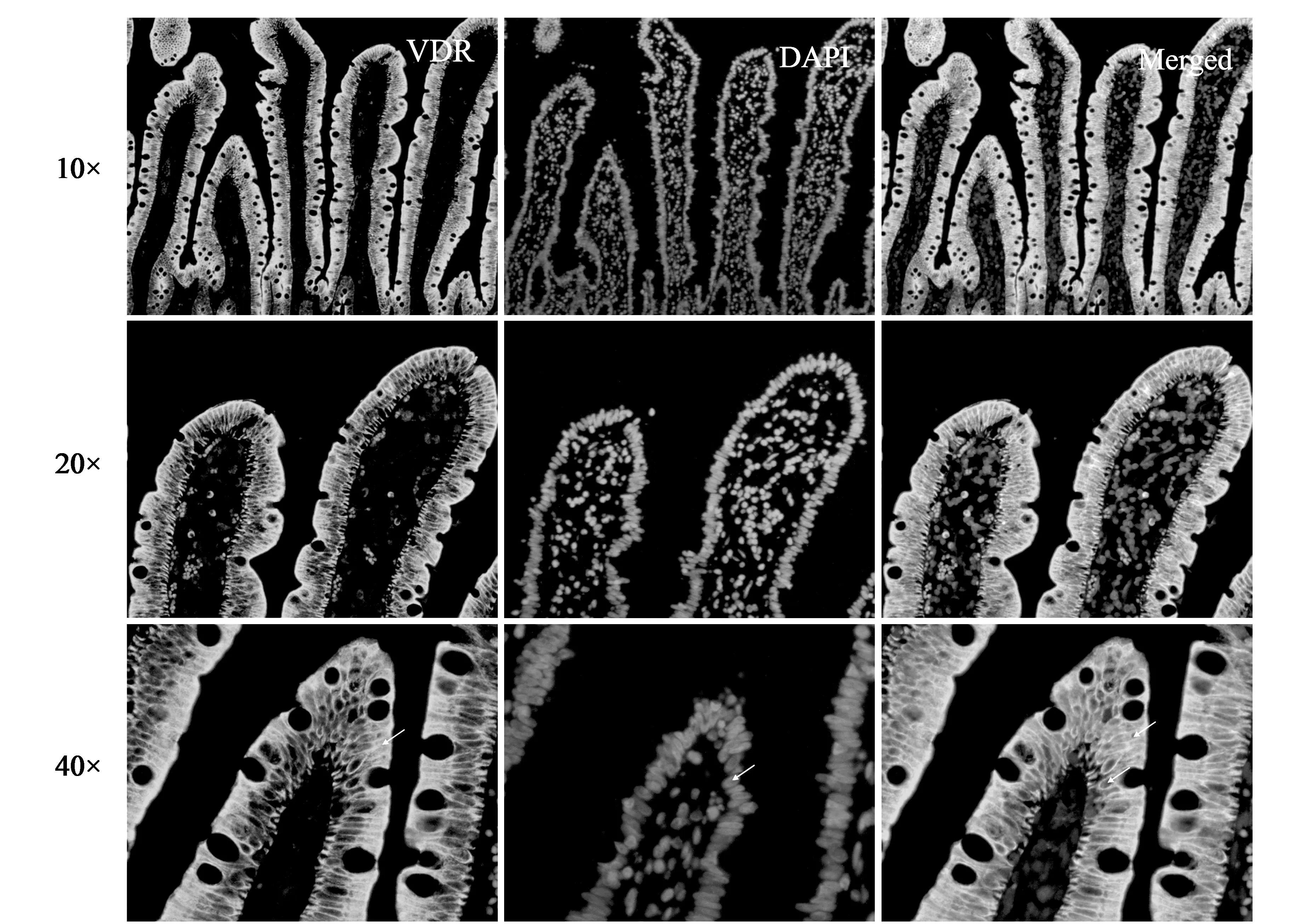
(a) VDR染色 (b)细胞核DAPI染色 (c) VDR与DAPI叠加图3 人十二指肠维生素D受体免疫荧光染色
3讨论
H.F.Deluca等[10]于1975年在鸡的胚肠黏膜中发现有VDR的存在后,人们用了不同的方法来定位组织或细胞中的VDR,历史上先后使用了如同位素标记、原位杂交和免疫组化等方法,现在已确定在小肠柱状细胞中存在VDR,并有重要的调节钙磷吸收的功能,但小肠的其他组织有无VDR仍有争论[11]。
近来,一种特异而灵敏的VDR免疫荧光染色方法被用来分析VDR在多种组织细胞中的存在和相对表达量[12]。该染色方法重复性好,适于石蜡包埋的组织切片,其核心是使用VDR D-6抗体[13]。本研究在现有的设备、试剂及实验条件下,使用D-6抗体建立了VDR免疫荧光染色方法,成功地分析了VDR在正常人体的十二指肠组织中的表达,绒毛上皮细胞是仅有的VDR样细胞。杯状细胞、结缔组织和平滑肌组织等均未见特异的VDR染色。这与以前在小鼠中的研究结果一致[13]。
在国内,对组织细胞中VDR表达的测定通常使用ELISA[14]、Western blot、RT-PCR[15]和免疫组织化学法[16],其中免疫组织化学法多以链霉素-生物素-过氧化物酶复合物技术(SABC)为主。在SABC法中,二抗采用的是生物素标记,底物为DAB显色,细胞核采用苏木精染色。王少华等[9]报告了直肠癌及癌旁黏膜组织中VDR表达的检测结果,与之相比,本研究使用了特异性核灵敏度的免疫组织染色法,而且二抗用荧光标记技术,更有利于VDR细胞内的定位研究。
本研究经过多次实验,对人十二指肠组织的VDR和细胞核进行染色,确定出了VDR染色的最佳抗体浓度,组织脱落最佳烘烤温度和时间。在染色过程中,在抗原复性步骤常会因组织贴附不牢固而出现组织脱落现象,经过多次实验发现,在进行脱蜡步骤之前将切片于72 ℃烘烤2 h后立即实验,组织脱落效果明显降低,且脱蜡效果较好。VDR染色中,一抗D-6浓度为1∶100,二抗A594浓度为1∶250,如进行细胞核染色,则在稀释的二抗中加入0.1%的DAPI,效果最佳。在二抗孵育之前,需要对其进行12 000 r/min离心2 min,以去除非特异性抗体荧光。该方法的建立为研究VDR的科学工作者提供技术参考。
[参考文献]
[1]唐伟军,钟鸣,王少华,等.直肠癌组织中维生素D受体表达的研究[J].肿瘤,2001,21(2):114-116.
[2]李燕舞,章世元.维生素D受体研究进展[J].饲料博览,2002(11):11-14.
[3]缪玉娥,王珏,王潍博.胃癌及其癌旁黏膜中维生素D受体的表达[J].山东大学学报:医学版,2012,50(2):74-77.
[4]关爱华,关文曾.维生素D受体在乳腺癌组织中的表达[J].中国妇幼保健,2005,20(8):966-967.
[5]胡宗涛,孟刚.乳腺癌组织中维生素D受体表达研究[J].中国肿瘤临床与康复,2008,15(5):414-416.
[6]侯萍,张燕,高伟,等.维生素D在宫颈癌中的表达及临床意义[J].中国煤炭工业医学杂志,2009,12(5):694-696.
[7]林兰,林锦贤,余江,等.人宫颈癌SiHa细胞核维生素D受体的检测[J].福建医药杂志,2012,34(4):73-75.
[8]陈丽萌,陈晨.活性维生素D调节肾素分泌机制及其潜在降压作用研究进展[J].北京医学,2010(4):283-285.
[9]王少华,唐伟军,钟鸣,等.直肠癌及其癌旁黏膜中维生素D受体表达研究[J].中华普通外科杂志,2001,16(11):39-41.
[10]DELUCA H F.Vitamin D:the vitamin and the hormone[J].Federation Proceedings,1974,33(11):2211-2219.
[11]WANG Y,ZHU J,DELUCA H F.Where is the vitamin D receptor?[J].Archives of Biochemistry & Biophysics,2012,523(1):123-133.
[12]STUMPF W E,SAR M,REID F A,TANAKA Y,DELUCA H F.Target cells for 1,25-dihydroxyvitamin D3 in intestinal tract,stomach,kidney,skin,pituitary and parathyroid[J].Science,1979(206):1188-1190.
[13]WANG Y,BECKLUND B R,DELUCA H F.Identification of a highly specific and versatile vitamin D receptor antibody[J].Archives of Biochemistry & Biophysics,2010(2):166-177.
[14]曹丽丽,陈瑞冬,迟兆富.多发性硬化症患者维生素D3及其受体水平检测[J].现代免疫学,2005,25(5):383-388.
[15]雷红,梁晓慧,韩璐,等.维吾尔族、汉族原发性高血压患者维生素D受体和肾素mRNA表达水平[J].中华高血压杂志,2015,23(1):79-82.
[16]陈玉霞,刘宇健,宋亮年.维生素D受体在1,25(OH)2D3调节人骨肉瘤HOS-8603增殖中的作用[J].中国病理生理杂志,2001,17(10):979-982.
[17]李金潺,卫丹丹,李小峰,等.维生素D在自身免疫性疾病中的作用[J].中国全科医学,2015,18(18):2184-2187.
[责任编辑:魏 强]
Method establishment of vitamin D receptor immunohistochemical staining
YANG Yi-qi,CHENG Jia,WANG Yong-ji
(Vitamin D Research Institute, Shaanxi University of Technology,Hanzhong 72300, China)
Abstract:A highly specific and sensitive vitamin D receptor (VDR) immunohistochemical staining was established and was successfully applied to determine VDR cellular expression in human duodenal tissue using paraffin-embedded tissue sections. The H&E staining was used to identify the integrity of the tissue structure while the immunofluorescence(IF) was used for the in situ determination of VDR in the tissue. The experimental conditions were optimized as the following: the dilution for the primary VDR antibody(D-6) was 1∶100, the dilution for the second antibody(A594) was 1∶250, the antigen retrieval procedure included: boiling the tissue sections in 0.01 mol/L pH 6.0 citrate buffer with 850 W microwave for 20 min and cooling down at the room temperature for 3 h. Using this IF method, VDR was selectively found in human duodenal epithelial cells, indicating high specificity and sensitivity of the method.
Key words:duodenum;vitamin D receptor;immunofluorescence staining
[中图分类号]Q291
[文献标识码]A
作者简介:杨祎琦(1990—),女,陕西省西安市人,陕西理工学院硕士研究生,主要研究方向为维生素D受体在大鼠原代脂肪细胞中的作用;[通信作者]程佳(1983—),女,内蒙古自治区呼和浩特市人,陕西理工学院讲师,硕士生导师,博士,主要研究方向为维生素D受体与脂肪细胞分化研究;王永吉(1965—),男,陕西省汉中市人,陕西理工学院教授,硕士生导师,博士,主要研究方向为维生素D生理学。
基金项目:陕西省科技厅科技创新团队项目(2012KCT-29);汉中市科技局项目(2014ZKC47-07);陕西理工学院研究生创新基金资助项目(SLGYCX1522)
收稿日期:2015-07-22修回日期:2015-12-07
[文章编号]1673-2944(2016)02-0045-06
