两种化学发光法测定乙肝五项性能评估
2016-05-30刘妮妮叶琳琳刘玉琳
王 军,刘妮妮,赵 权,叶琳琳,刘 婧,刘玉琳,徐 菲
两种化学发光法测定乙肝五项性能评估
王军,刘妮妮,赵权,叶琳琳,刘婧,刘玉琳,徐菲
[关键词]光激化学发光法;乙型肝炎;定量分析
光激化学发光法(light initiated chemiluminescence assay,LICA)是以纳米级高分子微粒为载体的免疫化学发光技术,本研究对该方法与化学发光微粒免疫分析法(chemiluminescent microparticle immunoassay,CMIA)检测乙型肝炎病毒(HBV)感染的血清学标志物的结果做比较,以分析该方法检测性能与CMIA的符合程度及对临床诊断的影响。
1 材料和方法
1.1仪器、试剂及检测样本收集1015例疑似HBV感染者静脉血,分离血清待测;收集乙肝五项同时为阴性(经CMIA筛查)的一个血清盘。光激化学发光法的仪器(LiCA HT高通量免疫分析仪和LiCA SP全自动移液器)和试剂,均为上海博阳生物科技有限公司产品;化学发光微粒免疫分析法的仪器(ARCHITECT i2000SR)和试剂,均为美国雅培公司产品;相关试剂批号如下:
雅培试剂批号:HBsAg(26057LF00);HBsAb (27235LF00);HBeAg(24065LI00);HBeAb(24512L I00);HBcAb(22362LI00)。
博阳试剂批号:HBsAg(A1019);HBsAb(A1020);HBeAg(A1021);HBeAb(A1021);HBcAb(A1021)。
1.2结果判断标准(1)雅培结果判断标准:HBsAg>0.05 IU/mL;HBsAb>10 mIU/mL;HBeAg>1 S/CO;HBeAb<1 S/CO;HBcAb>1 S/CO。(2)博阳结果判断标准:HBsAg>0.2 ng/ml;HBsAb>10 mIU/ml;HBeAg>1 PEIU/ml;HBeAb>2 PEIU/ml;HBcAb>5.3 PEIU/ml。
1.3评价方法
1.3.1精密度根据EP5-A文件中关于实验方案的要求,应对标本每天做2批实验,批间相隔的时间不少于2 h,每批对样品进行双份测定,20 d后得到80个结果,共40对。每次检测前,分别取出HBsAg、HBsAb、HBeAg、HBeAb、HBcAb的阴性血清盘、低值质控品QL和高值质控品QH,室温放置30 min后再上机检测。按EP5-A文件的要求对检测结果进行统计分析,计算CV值。
1.3.2回收率测定分别取上海博阳生物科技有限公司提供的HBsAg、HBsAb 6点定标液各200 μl,按浓度梯度分别加入5个试管中,0浓度管为空白,不加定标液;随机取一份HBsAg阳性血清和HBsAb阳性血清,通过光激化学发光法分别测其浓度,然后将两份血清各200 μl分别加入已知浓度的试管中,每管重复测量2次,取其均值,以各浓度点的实测平均值占其理论期望值的百分数计算其回收率。
1.3.3检测结果比较通过两种方法对1015例HBV感染者临床样本的平行检测,以雅培CMIA为参考对象来评估博阳LICA方法检测的乙型肝炎病毒5项血清学指标与CMIA检测结果的符合率。
1.4统计学方法采用SPSS 16.0统计软件,曲线拟合采用3次样条曲线拟合,对两种方法检测结果差异的显著性比较采用配对χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1工作曲线对不同检测项,取同一批号不同靶值的定标品连续检测5 d,2次/d。曲线拟合采用3次样条曲线拟合,根据各自的均值绘制工作曲线,r2=0.998。
2.2试验性能评价
2.2.1精密度检测LICA五项血清学标志精密度结果见表1、2。

表1 LICA乙肝五项低值质控品精密度
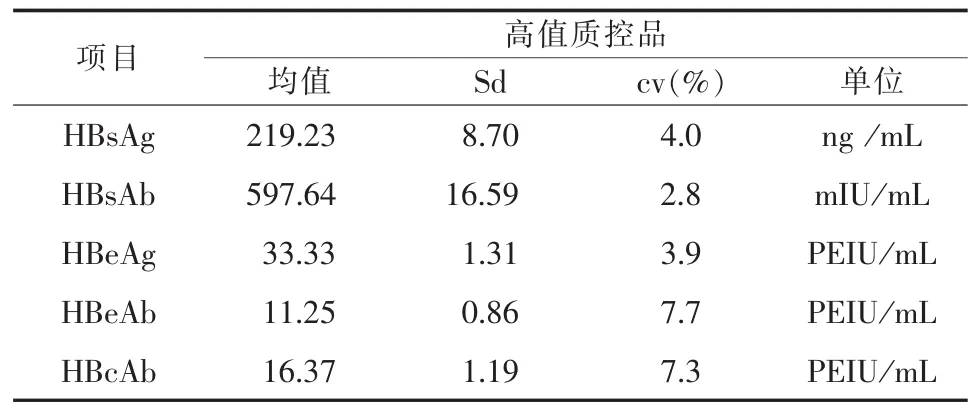
表2 LICA乙肝五项高值质控品精密度
2.2.2回收率测定不同浓度HBsAg、HBsAb的回收率见表3、4,HBsAg平均回收率为100.16% (96.81%~102.69%);HBsAb平均回收率为99.7% (95.85%~104.55%)。

表3 不同浓度的HBsAg回收率
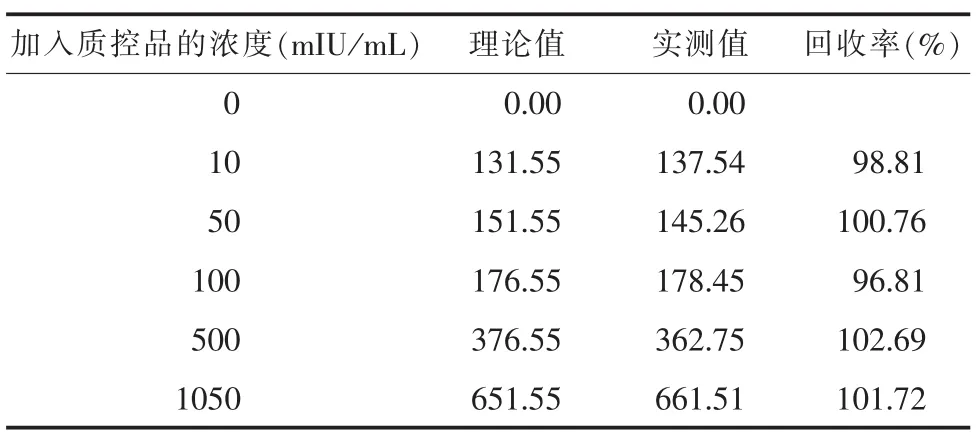
表4 不同浓度的HBsAb回收率
2.2.3两种方法检测结果比较见表5。

表5 LICA与CMIA检测HBV感染5项血清学标志结果比较
3 讨 论
LICA检测原理源于90年代问世的单线态氧分子能量传递发光免疫分析技术[2-4],该技术采用了纳米级颗粒,大大增加了生物分子的包被面积,同时借助链霉亲和素-生物素放大系统,使单位体积反应体系中含有更高浓度的生物分子,为实现超高敏感性,减少样本和试剂用量奠定了基础。另外,这种纳米颗粒在液相中保持稳定的悬浮状态,并借助于结合则发光原理,实现了均相免清洗检测,和其他化学发光法相比具有如下特点:(1)LICA反应体系为均相反应,传统免疫检测技术多为非均相反应,非均相反应具有反应不充分、反应时间长、反应体系温度均一性差的缺点,而LICA整个反应是在均相中进行的,均相具有反应充分、反应时间短、反应体系温度均一性好的优点,显示出该方法具有很高的精密度;(2)LICA另一个特点是免清洗,由于在均相中反应,加上其独特的检测原理结合则发光,所以检测过程无须进行清洗分离,则能有效降低检测过程中的随机误差和交叉污染,最大限度地提高了检测的准确度;(3)LICA样本及试剂用量微量化,每项样本及试剂用量仅25 μL,随着样本用量地大幅减少,使得检测小型化芯片化和高通量成为可能;(4)LICA超敏感性,由于采用了纳米级微粒,增加了反应表面积,缩短了反应时间,使检测的敏感性大大提高。有文献报道,该方法对可能存在的干扰物质,如单线态氧淬灭物质(抗氧化剂、血红蛋白、维生素C等)生物素结构类似物如总胆红素、三酰甘油等具有较好的耐受能力,少数物质在较高的浓度时的确存在干扰,但在常规浓度情况下,这些干扰作用可以忽略不计,表现出较高的特异性[5-7]以CMIA为参照,LICA对1015例临床样本检测结果显示,2种检测方法对检测结果的符合率分别为99.9%、99.7%、99.8%、99.51%、99.7%,具有很高的一致性,而作为辅助指标的抗HBe和HBeAg存在一定差异,其中两者不符的样本多处于灰区弱阳或弱阴范围,导致差异的原因是由于2种方法在抗HBe和HBeAg的原材料和溯源选择上存在一定差异[8];当2种方法检测结果发生分歧时,可寻求第三方验证,本次试验,由于样本剩余量不足,未能将所有与CMIA不符的结果进行第三方验证。总体上,LICA与CMIA在HBV感染的血清学标志项目上符合率很高,而在个别项目上存在一定的差异,但这并不影响本评价试验得出的结论。总之,LICA以其独特的检测技术实现了微量敏感快速均相免清洗检测,与CMIA相比,具有相近的检测性能。
参考文献
[1]王治国.临床检验方法确认与性能验证[M].北京:人民卫生出版社,2009:253-255.
[2]Dafforn A,Kirakossian H,Lao K.Miniaturization of the luminescent oxygen channeling immunoassay for use in multiplex array formats and otherbiochips[J].Clin Chem,2000,46(9):1495-1497.
[3]Poulsen F,Jensen KB.A luminescent oxygen channeling immunoassay for the determination of insulin in human plasma[J].J Biomol Screen,2007,12(2):240-247.
[4]Szekeres PG,Leong K,Day TA,et al.Development of homo-geneous 384-well high-throughput screening assays for Abeta1-40 and Abeta 1-42 using alpha screen technology[J].Biomol Screen,2008,13(2):101-111.
[5]马宏伟,赵卫国,潘柏申.血清肌红蛋白光激化学发光免疫测定法的建立[J].检验医学,2006,21(1):55-57.
[6]高云朝,赵卫国.光激化学发光法检测甲胎蛋白实验性能评价[J].检验医学,2009,24(8):578-581.
[7]Hou Y,McGuinnees DE,Prongay AJ,et al.Screening for antiviral inhibitors of the HIV integrase-LEDGF/p75 interaction using the alpha screen luminescent proximity assay[J].J Biomol Screen,2008,13(5):406-414.
[8]邱春嫦,劳小斌.电化学发光免疫法定量检测乙肝病毒的临床应用[J].中国热带医学,2005,5(4):678-679.
[2015-08-18收稿,2015-09-16修回][本文编辑:吴蓉]
[中图分类号]R512.62
[文献标志码]B
[作者单位]266071山东青岛,解放军401医院检验科(王军,刘妮妮,赵权,叶琳琳,刘婧,刘玉琳,徐菲)
DOI:10.14172/j.issn1671-4008.2016.02.010
