夏季南海北部微型浮游动物群落
2016-05-28李灼孙军刘海娇薛冰张翠霞张锐天津科技大学海洋与环境学院天津00457天津科技大学天津市海洋资源与化学重点实验室天津00457厦门大学近海海洋环境科学国家重点实验室福建厦门61102
李灼,孙军*,刘海娇,薛冰,张翠霞,张锐(1.天津科技大学海洋与环境学院,天津00457;2.天津科技大学天津市海洋资源与化学重点实验室,天津00457;.厦门大学近海海洋环境科学国家重点实验室,福建厦门61102)
夏季南海北部微型浮游动物群落
李灼1,2,孙军1,2*,刘海娇1,2,薛冰1,2,张翠霞1,2,张锐3
(1.天津科技大学海洋与环境学院,天津300457;2.天津科技大学天津市海洋资源与化学重点实验室,天津300457;3.厦门大学近海海洋环境科学国家重点实验室,福建厦门361102)
摘要:根据2014年8月至9月于珠江口至南海中部断面(18°00′~22°00′N,114°00′~116°00′E)的南海北部海域进行采样调查,并进行了微型浮游动物群落分析。共发现微型浮游动物142种,隶属于2门44属,其中砂壳纤毛虫28属78种,占所有发现物种数的54.93%;寡毛类纤毛虫14属59种,占所有发现物种数的41.55%。优势类群为:拟卡金斯急游虫(Strombidium paracalkinsi)、具沟急游虫(Strombidium sulcatum)、维尔伯特急游虫(Strombidium wilberti)和无节幼体(nauplii)。调查区微型浮游动物的丰度介于11.43~959.35 ind/L之间,平均值为264.99 ind/L。微型浮游动物垂直分布总体特点是密集区位于50 m水层,50 m水层之下丰度逐渐减少。表层微型浮游动物丰度高值区位于J5—I1站位之间。断面的香农-威纳指数范围在0.92~4.18之间,平均值为2.77;均匀度指数在0.63~1之间,平均值为0.87。应用典范对应分析(CC A)发现温度和盐度是影响微型浮游动物群落的重要因素。通过对连续追踪站位的调查发现,上层水体微型浮游动物群落丰度随着时间而发生一定的变化,下层水体相对较平缓。微型浮游动物昼夜的垂直丰度变化与叶绿素浓度昼夜变化大致相符。
关键词:微型浮游动物;群落结构;昼夜变化;南海北部
李灼,孙军,刘海娇,等.夏季南海北部微型浮游动物群落[J].海洋学报,2016,38(4):31—42,doi:10.3969/j.issn.0253-4193.2016.04.003
Li Zhuo,Sun Jun,Liu Haijiao,et al.Microzooplankton com munities in the northern South China Sea in sum mer[J].Haiyang Xuebao,2016,38(4):31—42,doi:10.3969/j.issn.0253-4193.2016.04.003
1 引言
微型浮游动物(microzooplankton)是指体长在20 ~200μm之间的浮游动物,包括原生动物和后生动物,类群有桡足类的幼虫、轮虫、放射虫、有孔虫等,其中纤毛虫是微型浮游动物的优势类群,属于寡毛类纤毛虫(Oligotrichs)和砂壳纤毛虫(Tintinnina)两个亚纲[1]。研究表明,微型浮游动物在大洋和近岸都是浮游植物的主要摄食者[2]。微型浮游动物在微食物环(Microbiol Loop)中有着重要的地位:微型浮游动物摄食以溶解有机碳为食的异养细菌,而中型浮游动物又以微型浮游动物为食,从而使得溶解态的初级生产力得以传递到食物网上层[3]。所以,微型浮游动物控制着营养关系和生物地球化学过程,是海洋浮游食物网的基础[4]。
南海是中国最大的边缘海,在中国占有重要的政治和经济地位。近年来,国内外学者对南海北部微型浮游动物群落的关注度渐次升高,相关的研究报道正在逐步为南海北部微型浮游动物群落方面提供愈发完善的基础资料。例如,在2004年秋季南海北部微型浮游动物水样采集中,共发现纤毛虫17种,隶属于10个属[5];在2007年夏季南海北部表层水样采集中,共检出4纲8目22属38种纤毛虫,其中主要是砂壳目纤毛虫[6];在2007年秋季南海北部表层水样采集中,共发现砂壳纤毛虫16属49种,且得出了南海北部无壳纤毛虫生物量占绝对优势的结论[7]。随着时间的推移,学者们在南海北部陆续发现微型浮游动物新种的同时,发现此海域纤毛虫在丰度上占优势地位,并且纤毛虫主要由寡毛类纤毛虫和砂壳纤毛虫组成[5—7]。
Utermöhl方法是国际通用的浮游植物研究方法,此方法可以对不同水层的浮游植物进行精确的定量分析[8],此方法的原理对于微型浮游动物也同样适用。本文采用Utermöhl方法研究了2014年夏季南海北部的微型浮游动物群落,分析了采样海区微型浮游动物的物种组成和优势物种组成等特征,同时用统计学方法典范对应分析对采样海区的生物数据和环境因子之间进行了相关性分析。可为此海域提供重要的生物基础资料。
2 材料与方法
2.1站位设置
于2014年8月至9月搭载“实验一号”科学调查船,在南海北部水域(18°00′~22°00′N,114°00′~116°00′E)进行调查。本航次设置了11个微型浮游动物采样站位,其中包含了2个连续跟踪站,分别为SE ATS站和J4站。所有站位划分为1个垂直于海岸线的观测断面(断面A)(图1)。
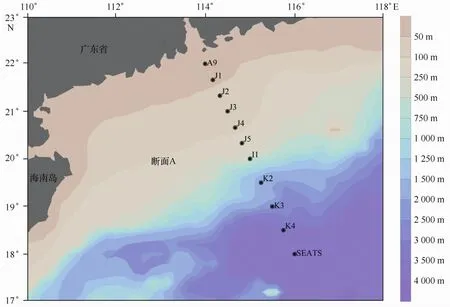
图1 2014年夏季南海北部微型浮游动物调查站位Eig.1 Study area of the northern South China Sea in sum mer,2014
2.2采样方法和分析
现场使用Seabird SBE 17 plus进行不同水层的水样采集。水深、温度和盐度数据皆由海鸟C T D获得。水层设置为7层(5 m,25 m,50 m,75 m,100 m,150 m和200 m),深度不足200 m的站位,在距底层5 ~25 m处采集水样。每层水取1 000 m L水样装入聚乙烯(PE)瓶,取水后立即用酸性Lugol’s试剂(0.7%最终浓度)固定保存。样品带回实验室后,静置沉降24 h以上,用底部套有20μm筛绢的虹吸管吸取上清液,浓缩水样至200 m L,保存于常温黑暗环境中。采用Utermöhl方法分析[8],取25 m L或100 m L浮游动物样品于H ydro-Bios的Utermöhl计数框,静置沉降24 h,在麦克奥迪A E2000倒置显微镜200和400倍下进行物种鉴定和个体计数。微型浮游动物物种鉴定参照分类学文献[9—11]。
2.3数据处理
微型浮游动物群落结构分析采用香农-威纳多样性指数(Shannon-Wiener diversity index,H′)、Pielou均匀度指数(Pielou’s evenness index,J)和优势度指数(Y),计算公式如下:
香农-威纳多样性指数[12]:
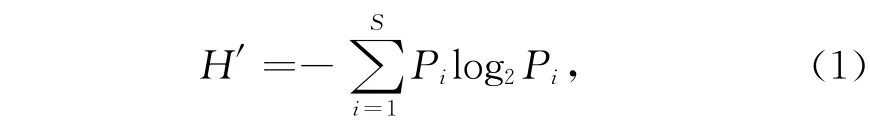
式中,Pi是样品中第i种的细胞丰度与该样品总细胞丰度比值;S为该样品物种数。
Pielou均匀度指数[13]:
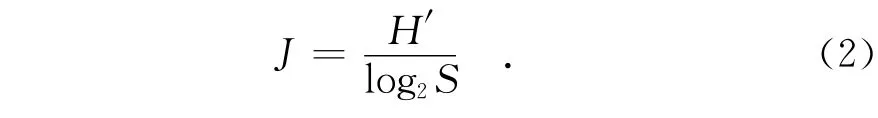
优势度指数[14]:
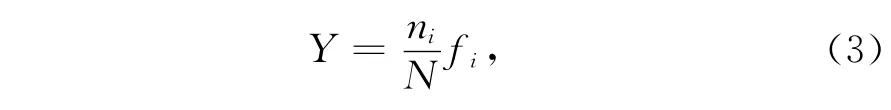
式中,ni为第i个种在所有样品中的总细胞丰度;N为所有物种的总细胞丰度;fi为该物种在各个站位出现的频率。
微型浮游动物与环境因子的典范对应分析(canonical correspondence analysis,CC A)使用M VSP 3.1进行分析,得出优势物种丰度与环境因子的双序图。
3 结果
3.1海区环境特征
2014年夏季南海北部A断面的温度和盐度分布情况如图2。从图上可以看出A断面的温度和盐度垂直方向层化现象明显,分布变化均匀。水体温度由浅至深逐步降低,与之相对应的是,盐度由浅至深逐步升高。近岸站位A9站位由于靠近大陆较近,受陆源冲淡水影响较大,故A9站位上层水体温度盐度皆比同纬度其他站位低,并且盐度变化较大。同纬度水域并无明显的跃层现象出现。
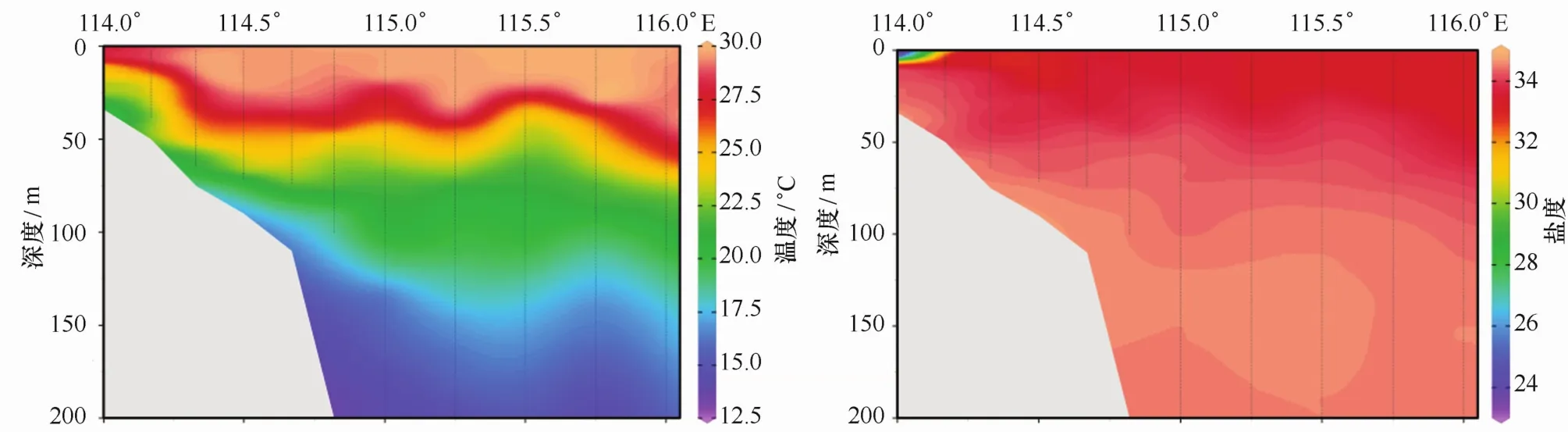
图2 断面A的温度和盐度分布特征Eig.2 Distribution of temperature and salinity in the Transect A
3.2微型浮游动物物种组成
通过对11个站位采到的114个微型浮游动物样品进行初步分析得到的结果是:共发现微型浮游动物142种,隶属于2门44属。其中砂壳纤毛虫28属78种(2种未定种),占所有发现物种数的54.93%;寡毛类纤毛虫14属59种(12种未定种),占所有发现物种数的41.55%;放射虫1属4种(未定种),占所有发现物种数的2.82%;桡足类无节幼体由于个体较小无法由身体特征进行分类皆归为1属1种,占所有发现物种数的0.70%。砂壳纤毛虫和寡毛类纤毛虫是南海北部微型浮游动物的主要组成类群。但是,由于砂壳纤毛虫在本次调查中的丰度比和频数较低,故优势度并不高。优势度排名前10位的物种中除无节幼体外皆为寡毛类纤毛虫(表1)。由于A9站位是近岸站位,距珠江口较近,营养盐丰富,受冲淡水影响较大,此站位的微型浮游动物群落变化较大,丰度也远比其他站位要高。因此,本文在微型浮游动物群落分析中,并未包含A9站位。
3.3微型浮游动物的丰度
3.3.1丰度概述
在本次调查中,各个站位的微型浮游动物总丰度在11.43~959.35 ind/L之间。平均丰度为264.99 ind/L。砂壳纤毛虫在各个站位的丰度在0~99.38 ind/L之间,平均丰度为14.91 ind/L,优势种为酒杯类管虫(Dadayiella ganymedes),丰度最大可达到16.56 ind/L;寡毛类纤毛虫在各个站位的丰度在5.71~894.31 ind/L之间,平均丰度为223.41 ind/L,优势种为拟卡金斯急游虫(Strombidium paracalkinsi),丰度最大可达到152.70 ind/L。
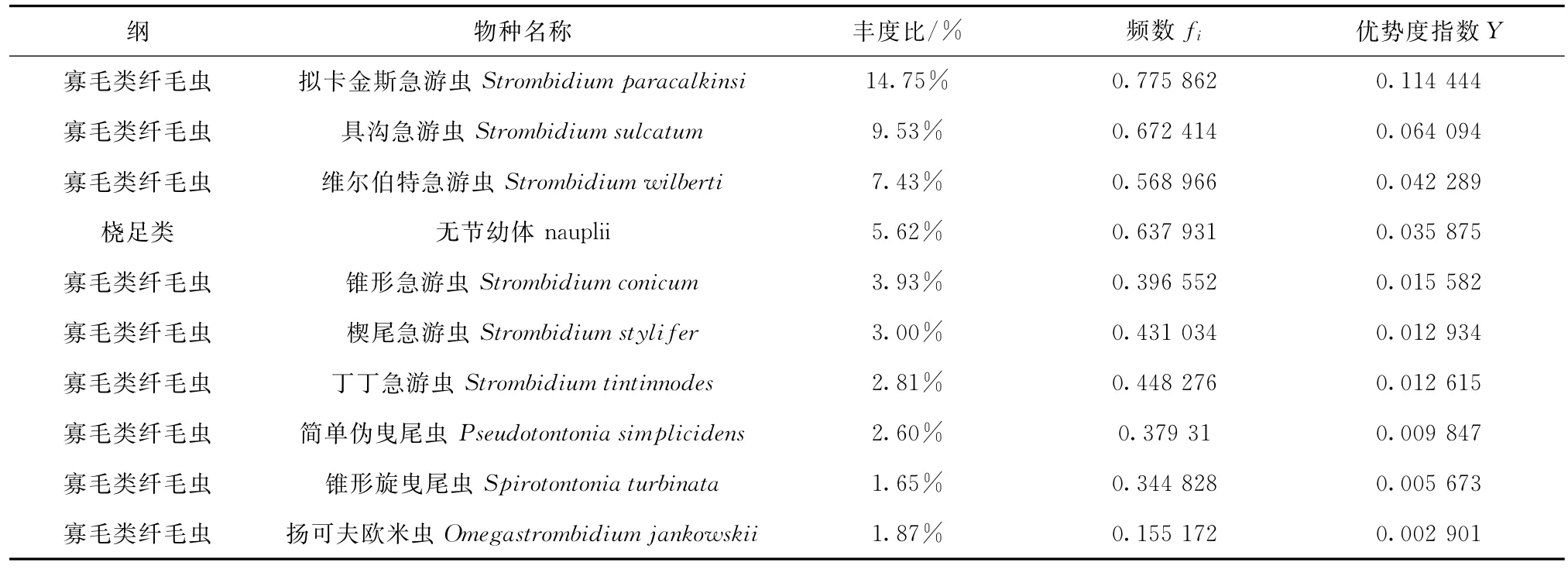
表1 2014夏季南海北部微型浮游动物优势类群Tab .1 Zooplankton dominant taxa in the north South China Sea in sum mer,2014
3.3.2微型浮游动物的垂直分布特征
微型浮游动物主要分布在中上层水体,50 m以深水层丰度随水深的增加而逐渐减小,丰度的高值区出现在J1、J5和I1站位的50 m水层;另外,微型浮游动物在J5 和I1站位表层水的丰度也较高(图3a)。在本次调查中发现,寡毛类纤毛虫对微型浮游动物的丰度贡献较大,故寡毛类纤毛虫的垂直分布特征与微型浮游动物的分布特征基本一致(图3c);砂壳纤毛虫的垂直分布特征虽然与寡毛类纤毛虫和微型浮游动物的分布特征呈大体一致的趋势,但是仍存在一些不同之处(图3b)。砂壳纤毛虫的整体丰度比寡毛类纤毛虫的整体丰度要低;高值区出现在J2、I1站位的表层和J4站位的50 m水层处;另外,砂壳纤毛虫在表层的分布除J2和I1站位外,于其他站位的表层分布都很低。
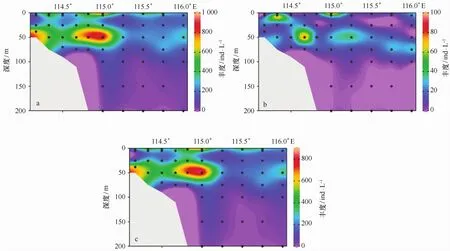
图3 微型浮游动物(a)、砂壳纤毛虫(b)及寡毛类纤毛虫(c)丰度的垂直分布Eig.3 Vertical distributions of microzooplanktons(a),tintinnid(b)and oligotrichs(c)abundances
在本次调查中,几种优势种分布情况大体趋势一致,最大丰度区都出现在50 m水层的J3—I1站位之间,表层水与50 m水层之间各优势种普遍丰度较低,50 m水层之下优势种的丰度皆随着水深的增加而减小(图4)。优势种拟卡金斯急游虫的最大丰度(212.5 ind/L)在J5站位的表层,另外50 m处也有较高的丰度(图4a);优势种具沟急游虫(Strombidium sulcatum)的最大丰度(118.5 ind/L)位于J3站位的50 m水层,SE ATS站位的表层与50 m水层处也有较高丰度出现(图4b);优势种维尔伯特急游虫(Strombidium wilberti)的最大丰度(135.74 ind/L)在J5的50 m水层处出现(图4c)。优势种无节幼体主要分布在距珠江口较近的站位,其丰度最大值(136.65 ind/L)位于J2的表层水,而距珠江口较远的站位无节幼体的分布整体较少(图4d)。优势种锥形急游虫(Strombidium conicum)的最大丰度(89.43 ind/L)在I1站位的50 m处(图4e);优势种楔尾急游虫(Strombidium stylifer)的最大丰度位于J5站位的50 m处(图4f)。
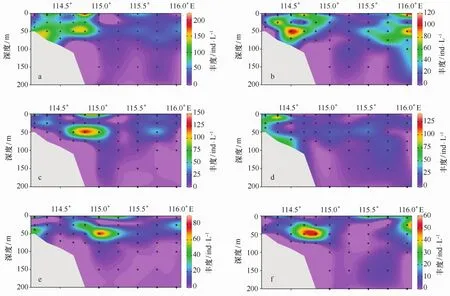
图4 优势物种丰度的垂直分布Eig.4 Vertical distributions of dominant species abundancesa.拟卡金斯急游虫;b.具沟急游虫;c.维尔伯特急游虫;d.无节幼体;e.锥形急游虫;f楔尾急游虫a.Strombidium paracalkinsi;b.Strombidium sulcatum;c.Strombidium wilberti;d.nauplii;e.Strombidium conicum;f.Strombidium stylifer
3.3.3微型浮游动物的群落特征
香农-威纳多样性指数是反应群落特征的重要参数之一。断面A的微型浮游动物的香农-威纳指数的范围在0.92~4.18之间,平均值为2.77。其中,多样性指数的高值出现在I1站位的25 m区域。与之相对应的,I1站位从表层至75 m层物种数从19种上升至25种,达到了所有样品中物种数的最高值。而低值区域除100 m水层以深外,J4和J5的表层多样性指数也偏低,但是微型浮游动物丰度并不低。从从原数据中可以看出,J4和J5站位的表层水样品中,具沟急游虫(Strombidium sulcatum)和拟卡金斯急游虫(Strombidium paracalkinsi)丰度分别在样品中较其他物种丰度高出很多。说明具沟急游虫(Strombidium sulcatum)和拟卡金斯急游虫(Strombidium paracalkinsi)分别在J4和J5站表层占有优势地位(图5a)。
本断面的均匀度指数在0.63~1之间,平均值为0.87。其中,均匀度指数的高值出现在SE ATS站位的200 m,在此站位,微型浮游动物的丰度较低(34.78 ind/L)。而相应的,微型浮游动物丰度较高的站位如J5和I1站位,其均匀度指数较低。
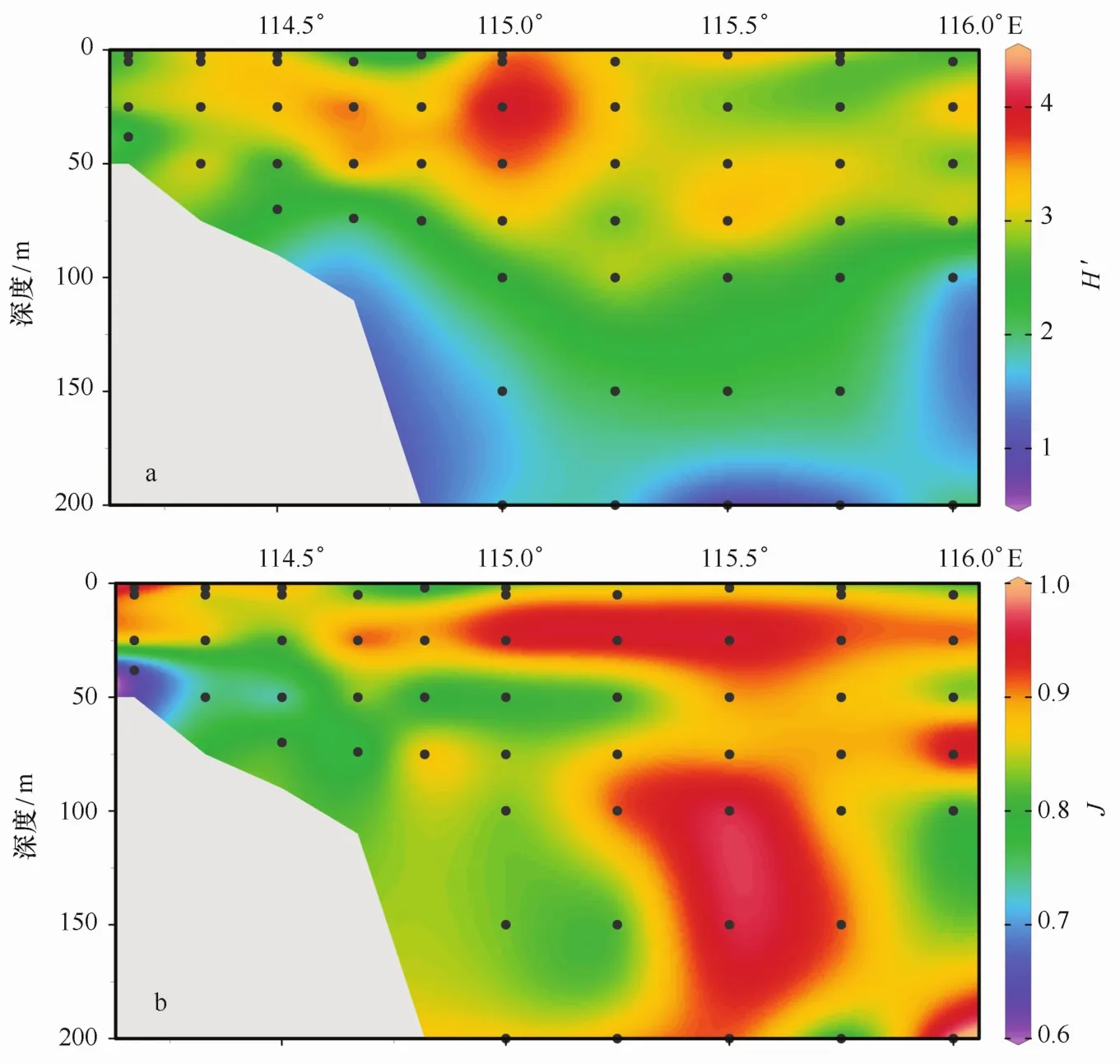
图5 微型浮游动物群落香农-威纳多样性指数(H′)(a)和均匀度指数(J)(b)的垂直分布Eig.5 Vertical distributions of Shannon-Wiener diversity indexes(a)and Pielou’s evenness indexes(b)
3.3.4微型浮游动物优势物种与环境因子的相关性分析
本次调查分析了前十位优势种(含A9站位)与环境因子的对应关系(图6),其中温度、盐度和磷酸盐靠近典范轴2,因此温度、盐度和磷酸盐是影响调查海区环境条件的重要因素。优势种拟卡金斯急游虫(A)接近原点,其丰度与环境因子的相关性不高;而放射虫(H)与盐度的相关性非常高,也许盐度是影响放射虫丰度的重要因子;维尔伯特急游虫(D)和楔尾急游虫(G)与温度和磷酸盐的相关性比较高,具沟急游虫(B)和锥形旋曳尾虫(Spirotontonia turbinata)(J)与温度和磷酸盐有一定的相关性。锥形急游虫(E)和硝酸盐、亚硝酸盐有一定的相关性,简单尾曳尾虫(Pseudotontoniasimplicidens)(E)则和硝酸盐、亚硝酸盐呈正相关,与盐度呈负相关,硝酸盐、亚硝酸盐可能是影响其丰度的因子,而盐度越高,简单尾曳尾虫的丰度可能会越低。丁丁急游虫(Strombidium tintinnodes)(I)和无节幼体(C)与硅酸盐有一定的相关性。
3.4连续追踪站微型浮游动物丰度的昼夜垂直变化
本次调查设置了两个连续追踪站,分别为J4 和SE A T S。每个连续追踪站进行了连续3天,每天2个时间点,2个时间点之间间隔12 h的标准层追踪采样。现将3天6个时间点的微型浮游动物丰度分布整合成1天的时间序列进行其昼夜垂直的变化分析。
3.4.1J4站位微型浮游动物丰度的昼夜垂直变化
从垂直分布上来看,J4站位微型浮游动物群落主要在表层水到60 m水层之间的水域活动,底层水域微型浮游动物群落的丰度较低且变化不大;从时间尺度上来看,2:00—6:00时段,群落整体有从50 m水层逐渐向上移到表层的趋势,10:00—14:00时段群落又逐渐从表层下移到50 m水层(图7a)。微型浮游动物群落中的砂壳纤毛虫群落则整体分布较为分散,高值区集中在50 m水层,然而在2:00—6:00时段整体仍有向上浮动的趋势,14:00前后则表层丰度比其他时段表层丰度要低(图7b)。由于寡毛类纤毛虫为本次调查中微型浮游动物的主要贡献类群,故寡毛类纤毛虫的昼夜垂直变化与微型浮游动物群落基本一致(图7c)。图中选取了6种微型浮游动物群落优势种(图7d-i),从图中可以看出,大部分优势种的高值区出现在50 m处,这与本站位的叶绿素浓度垂直分布相符[15](图7j)。从时间序列上看,优势种的昼夜垂直分布的变化并不规律,但大部分优势种在14:00前后都有整体向下移动的趋势。
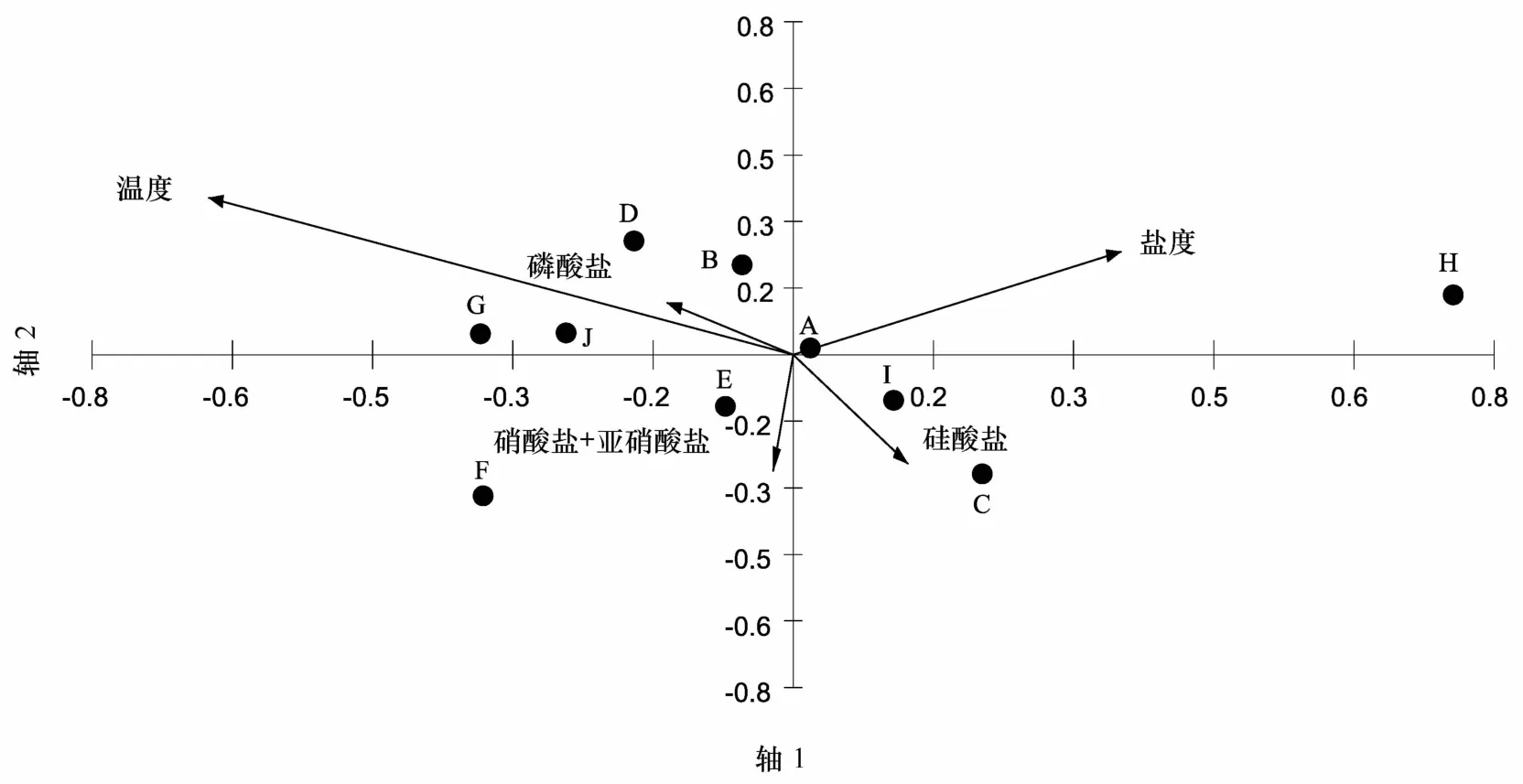
图6 优势物种的丰度与环境因子的典范对应分析Eig.6 The canonical correspondence analysis between dominant species abundances and environmental variablesA.拟卡金斯急游虫;B.具沟急游虫;C.无节幼体;D.维尔伯特急游虫;E.锥形急游虫;E.简单伪曳尾虫;G.楔尾急游虫;H.放射虫;I.丁丁急游虫;J.锥形旋曳尾虫A.Strombidium paracalkinsi;B.Strombidium sulcatum;C.nauplii;D.Strombidium wilberti;E.Strombidium conicum;E.Pseudotontoniasimplicidens;G.Strombidium stylifer;H.radiolarian;I.Strombidium tintinnodes;J.Spirotontoniaturbinata
3.4.2SE ATS站位微型浮游动物丰度的昼夜垂直变化
从垂直分布上来看,SE ATS站位微型浮游动物群落主要在表层水到100 m水层之间的水域活动,100 m水层以深微型浮游动物丰度随深度的增加而减少并且变化不大;从时间尺度上来看,微型浮游动物群落基本上位于在50~75 m水层之间,并无剧烈的上下迁移行为,但是在14:00前后群落在表层的丰度明显降低,于18:00之后有稍有上升(图8a)。微型浮游动物群落的主要组成类群砂壳纤毛虫群落与寡毛类纤毛虫群落在SE ATS站位的昼夜垂直变化与总群落大致相同,高值区都出现在75 m水层且14:00前后表层丰度都较低(图8b,c)图中同样选取了6中微型浮游动物群落优势种(图8d-i),从图中可以看出,大部分优势种的高值区出现在75 m处,即各优势种大部分聚集在本站位的D C M层,并且分布与叶绿素浓度的垂直分布相符[15](图8j)。从时间序列上看,优势种的昼夜垂直变化并不明显,但是可以看出大部分优势种在14:00前后表层的丰度都有所降低。
4 讨论
4.1夏季南海北部微型浮游动物群落与环境分析
在本次调查中发现,微型浮游动物群落的主要组成部分为砂壳纤毛虫和寡毛类纤毛虫,其他部分由桡足类无节幼体和放射虫组成。其中,砂壳纤毛虫的种类较多但是丰度较低;而寡毛类纤毛虫的种类略少于砂壳纤毛虫但是丰度较高,故本次调查的优势种多为寡毛类纤毛虫。
从垂直分布图上可以看出(图3,图4),微型浮游动物群落主要分布在50 m水层,表层及底层的分布都较少。结合温盐垂直分布图及优势物种与环境的典范对应分析(CC A)可以看出,温度、盐度对微型浮游动物群落的分布有着比较重要的影响,表层水的高温以及底层水的高盐都是该水层微型浮游动物分布较少的间接原因。由于食物对微型浮游动物的生长起着重要的作用,结合本次调查的叶绿素垂直分布情况[16]可以看出,微型浮游动物的垂直分布情况与叶绿素的垂直分布情况基本吻合。
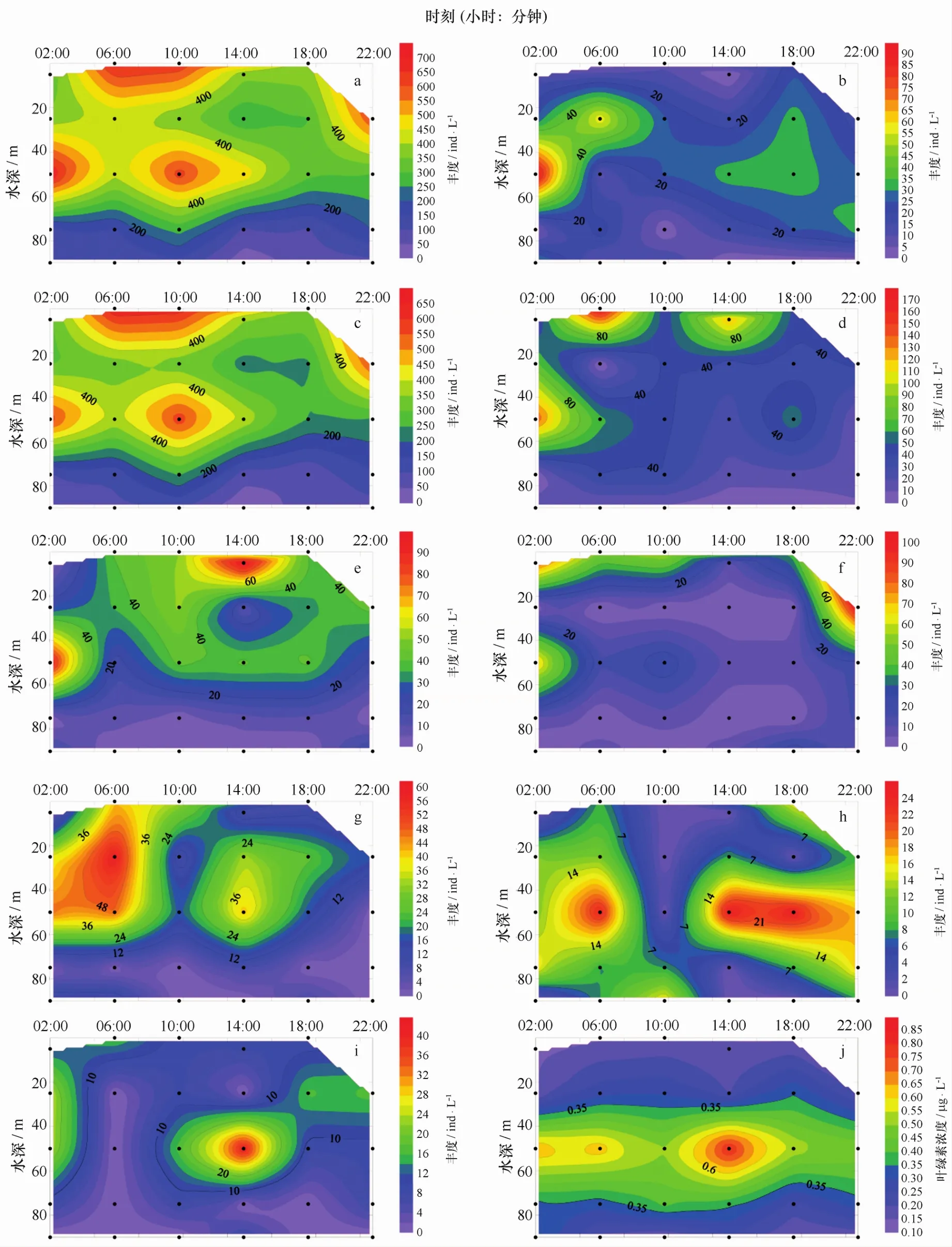
图7 J4微型浮游动物群落、优势种丰度和叶绿素浓度昼夜垂直变化Eig.7 Temporal distribution of microzooplankton dominant species abundances and Chl a concentration at mooring station J4a.微型浮游动物;b.砂壳纤毛虫群落;c.寡毛类纤毛虫;d.拟卡金斯急游虫;e.维尔伯特急游虫;f.具沟急游虫;g.楔尾急游虫;h.放射虫;i.无节幼体;j.叶绿素a.microzooplankton;b.tintinnid;c.oligotrichs;d.Strombidium paracalkinsi;e.Strombidium wilberti;f.Strombidium sulcatum;g.Strombidium stylifer;h.radiolarian;i.nauplii;j.Chl a
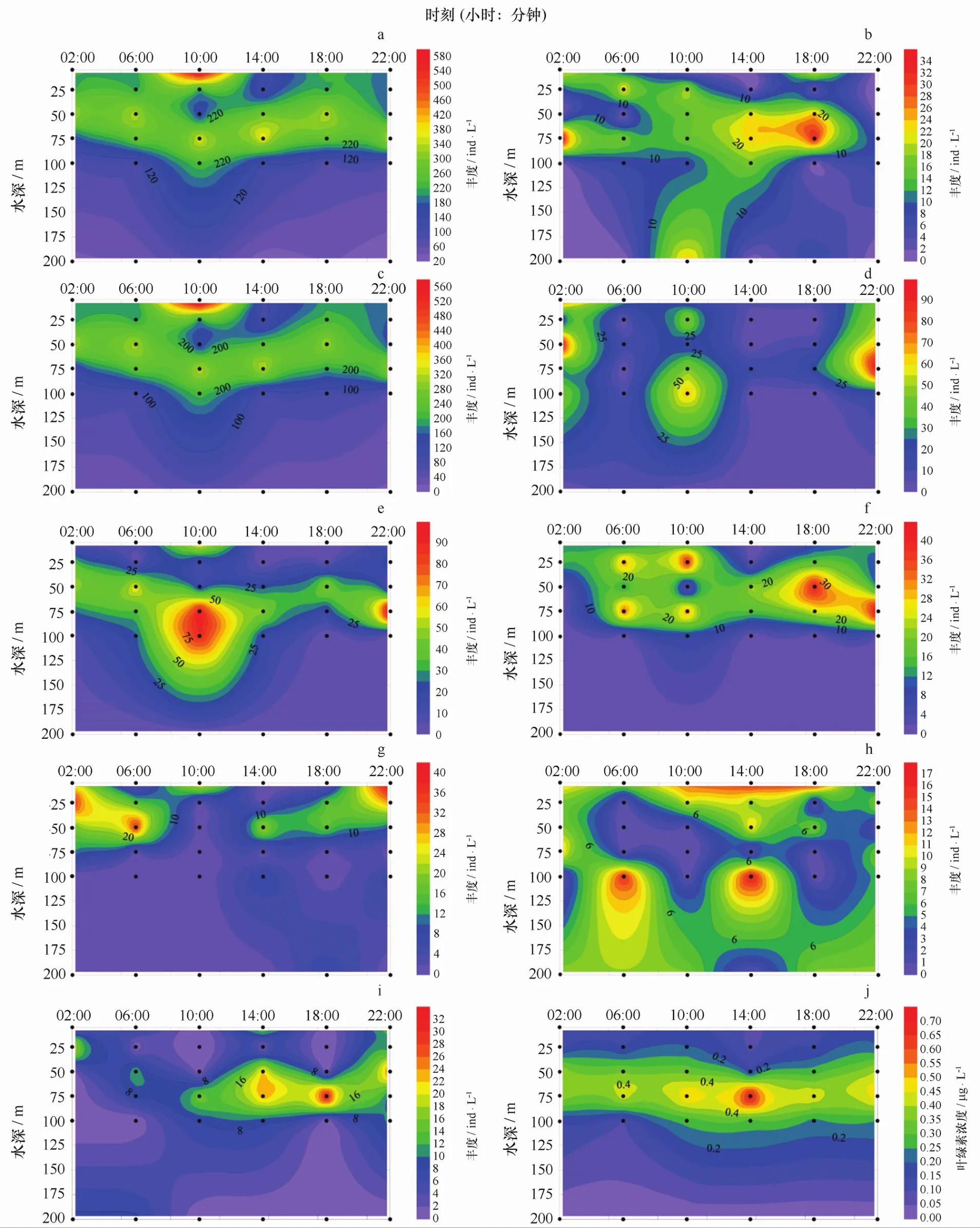
图8 SE ATS微型浮游动物群落、优势种丰度和叶绿素昼夜垂直变化Eig.8 Temporal distribution of microzooplankton dominant species abundances and Chl a at mooring station SE ATSa.微型浮游动物;b.砂壳纤毛虫群落;c.寡毛类纤毛虫;d.具沟急游虫;e.拟卡金斯急游虫;f.维尔伯特急游虫;g.楔尾急游虫;h.放射虫;i.无节幼体;j.叶绿素a.microzooplankton;b.tintinnid;c.oligotrichs;d.Strombidium sulcatum;e.Strombidium paracalkinsi;f.Strombidium wilberti;g.Strombidium stylifer;h.radiolarian;i.nauplii;j.Chl a
本研究结果与该海域微型浮游动物群落历史研究资料的总结见表2。已有研究表明,该海域微型浮游动物群落的主要组成部分为纤毛虫,其中冬季微型浮游动物群落中砂壳纤毛虫丰度较之夏季会有明显减少的趋势。从表中可以看出,微型浮游动物群落采用不同的采样方法与样本处理方法得到的结果存在着很大的差异;该海域中不同区域的微型浮游动物分布情况也不尽相同,所以,对于南海微型浮游动物群落变化的研究还需要更多后续的数据积累和分析。
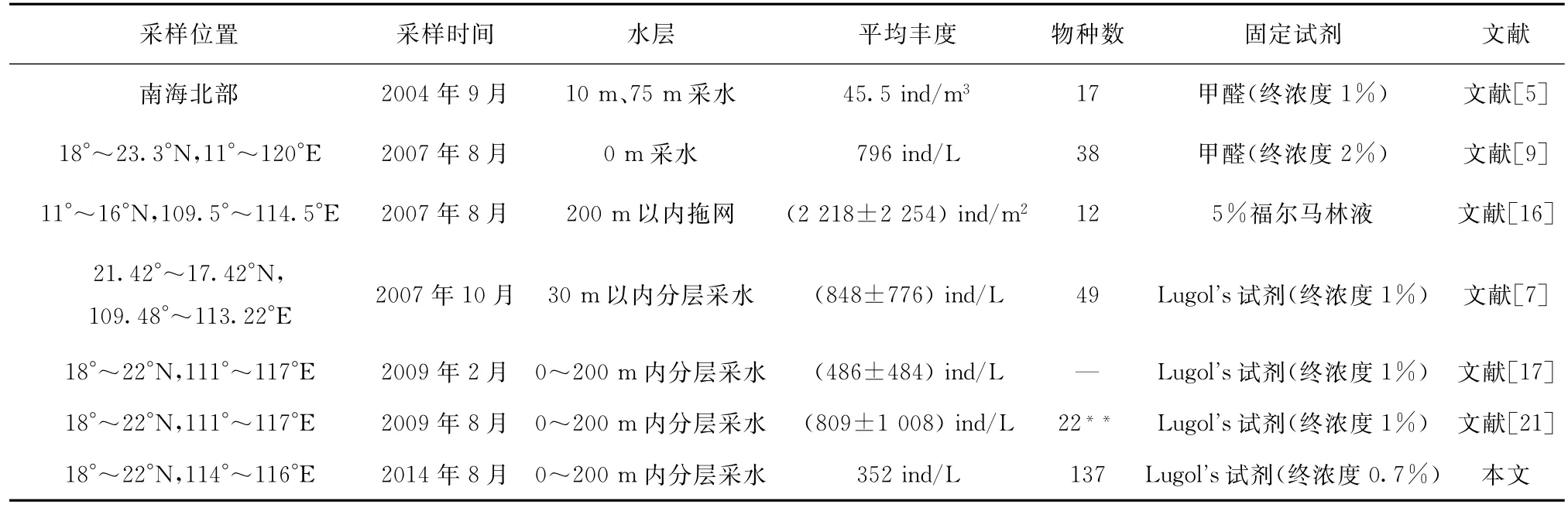
表2 南海微型浮游动物*群落历史资料总结Tab .2 Sum mary of previous studies on microzooplankton com munities in the South China Sea
本次调查中设置的站位横跨了近岸、陆架和大洋区域。其中,A9是近岸站位,由于站位距珠江口较近,受径流、潮流和南海近岸环流等综合影响,水动力条件复杂[18],江河水入海携带有大量有机质和海洋浮游生物残骸,会对海洋生态系会产生显著的影响,而陆架区和大洋区的环境则相对稳定。从本次调查的温盐图中可以看出,与其他陆架区和大洋区的站位相比,A9温度盐度都相对较低,盐度变化也较为明显。从丰度上看,A9站位表层水微型浮游动物总丰度为6 714.29 ind/L,25 m水层总丰度为1 008.33 ind/L,皆比其他站位平均总丰度(264.99 ind/L)高出非常多。所以,A9站位与其他站位的群落分布特征与环境特征皆不相同。
4.2连续追踪站微型浮游动物群落昼夜垂直分布变化分析
微型浮游动物群落昼夜垂直分布变化并不剧烈(图7,图8),这与体型稍大一些的中型浮游动物如桡足类不大相同。桡足类丰度的昼夜变化较为明显,光强较低的情况下桡足类群落上浮至中上水层,而光强较高的情况下桡足类群落会有向下迁移的现象[24]。而微型浮游动物的体型小,游泳能力较弱,迁移现象并不明显。但是,图中仍然显示出了一些与桡足类迁移行为相似的现象,如,微型浮游动物群落及大部分优势种(除放射虫外)在14:00前后,也就是光照较强的时段,表层的丰度会有降低的趋势,在2:00—10:00时段则会有不明显的上升趋势。但是,影响群落及优势种分布的主要因素仍然是食物,各群落及优势种的丰度高值区皆与相应站位的叶绿素浓度高值区分布相符(图7j,图8j)[15]。
致谢:同济大学张传伦教授提供营养盐数据,“实验1号”科研调查船为本次调查提供了宝贵的采样平台,谨致谢忱!
参考文献:
[1]Dolan J R,M ontagnes D J S,Agatha S,et al.The Biology and Ecology of Tintinnid Ciliates:M odels for M arine Plankton[M].Chichester:John Wiley&Sons,Ltd.,2012:1-296.
[2]Landry M R,Calbet A.Microzooplankton production in the oceans[J].ICES Journal of M arine Science,2004,61(4):501-507.
[3]Azam E,Eenchel T,Eield J G,et al.The ecologicalrole of water-colu mn microbesin the sea[J].M arine Ecology Progress Series,1983,10(3):257-263.
[4]Caron D A,H utchins D A.The effects of changing climate on microzooplankton grazing and com munity structure:drivers,predictions and knowledge gaps[J].Journal of Plankton Research,2013,35(2):235-252.
[5]Su Q,H uang L,Tan Y,et al.Preliminary study of microzooplankton grazing and com munity composition in the North of South China Sea in Autu mn[J].M arine Science Bulletin,2007,9:43-53.
[6]刘华雪,谭烨辉,黄良民,等.夏季南海北部纤毛虫群落组成及其水平分布[J].生态学报,2010,30(9):2340-2346.Liu H uaxue,Tan Yehui,H uang Liangmin,et al.Composition and distribution of ciliatesin northern South China Sea during su m mer[J].Acta Ecologica Sinica,2010,30(9):2340-2346.
[7]张翠霞,张武昌,肖天.2007年10月南海北部浮游纤毛虫的丰度和生物量[J].生态学报,2010,30(4):867-877.Zhang Cuixia,Zhang W uchang,Xiao Tian.Ciliate abundance and biomassin northern South China Sea in October 2007[J].Acta Ecologica Sinica,2010,30(4):867-877.
[8]孙军,刘东艳,钱树本.一种海洋浮游植物定量研究分析方法——Utermöhl方法的介绍及其改进[J].黄渤海海洋,2002,20(2):105-112.Sun Jun,Liu Dongyan,Qian Shuben.A quantative research and analysis method for marine phytoplankton:an introduction to Utermöhl method and its modification[J].Journal of Oceanography of H uanghai&Bohai Seas,2002,20(2):105-112.
[9]宋微波,沃伦A,胡晓钟.中国黄渤海的自由生纤毛虫[M].北京:科学出版社,2009.Song W eibo,W arren A,H u Xiaozhong.Eree-Living Ciliates in the Bohai and Yellow Seas,China[M].Beijing:Science Press,2009.
[10]张武昌,于莹,肖天.海洋浮游无壳寡毛类纤毛虫图谱[M].北京:科学出版社,2015.Zhang W uchang,Yu Ying,Xiao Tian.An Illustrated Guide to M arine Planktonic Aloricate Oligotrich Ciliates[M].Beijing:Science Press,2015.
[11]张武昌,丰美萍,于莹,等.砂壳纤毛虫图谱[M].北京:科学出版社,2012.Zhang W uchang,Eeng M eiping,Yu Ying,et al.An Illustrated Guide to Contemporary Tintinnidsin the W orld[M].Beijing:Science Press,2012.
[12]Shannon C E.A mathematicaltheory of com munication[J].A C M SIG M O BILE M obile Computing and Com munications Review,2001,5(1):3-55.
[13]Pielou E C.The Interpretation of Ecological Data:a Primer on Classification and Ordination[M].New York:Wiley,1984.
[14]孙军,刘东艳.多样性指数在海洋浮游植物研究中的应用[J].海洋学报,2004,26(1):62-75.Sun Jun,Liu Dongyan.The application of diversity indices in marine phytoplankton studies[J].Haiyang Xuebao,2004,26(1):62-75.
[15]Liu Haijiao,Xue Bing,Eeng Yuanyuan,et al.Size-fractionated Chlorophylla biomassin the northern South China Seain su m mer 2014[J].Chinese Journal of Oceanology and Limnology,2015,doi:10.1007/s00343-016-5017-1.
[16]丰美萍,张武昌,于莹,等.夏季南海西部砂壳纤毛虫水平分布[J].热带海洋学报,2013,32(3):86-92.Eeng M eiping,Zhang W uchang,Yu Ying,et al.H orizontal distribution oftintinnidsin the western South China Sea during su m mer 2007[J].Journal of Tropical Oceanography,2013,32(3):86-92.
[17]于莹,张武昌,蔡昱明,等.冬季和夏季南海北部浮游纤毛虫的分布特点[J].海洋与湖沼,2014,45(4):839-847.Yu Ying,Zhang W uchang,Cai Yu ming,et al.Distribution Patterns of Planktonic Ciliatesin the northern South China Seain Winter and Su m mer,2009[J].Oceanologia et Limnologia Sinica,2014,45(4):839-847.
[18]蔡树群,郑舒,韦惺.珠江口水动力特征与缺氧现象的研究进展[J].热带海洋学报,2013,32(5):1-8.Cai Shuqun,Zheng Shu,W ei Xing.Progress on the hydrodynamic characteristics and the hypoxia phenomenon in the Pearl River Estuary[J].Journal of Tropical Oceanography,2013,32(5):1-8.
[19]Lewis C N,Brown K A,Edwards L A,et al.Sensitivity to ocean acidification parallels natural pC O2gradients experienced by Arctic copepods under winter sea ice[J].Proceedings of the National Academy of Sciences of the U nited States of A merica,2013,110(51):E4960-E4967.
Microzooplankton com munitiesin the northern South China Sea in sum mer
Li Zhuo1,2,Sun Jun1,2,Liu Haijiao1,2,Xue Bing1,2,Zhang Cuixia1,2,Zhang Rui3
(1.Collegeof Marine and Environmental Sciences,Tianjin University of Science and Technology,Tianjin 300457,China;2. Tianjin Key Laboratory of Marine Resources and Chemistry,Tianjin University of Science and Technology,Tianjin 300457,China;3.State Key Laboratory of Marine Environmental Science,Xiamen University,Xiamen 361102,China)
Abstract:Microzooplankton com munities in the northern South China Sea(18°00′-22°00′N,114°00′-116°00′E)were investigated during August and September in 2014.With the analysis by Utermöhl method,a total of 142book=42,ebook=45taxa which belong to 44 genera of 2 phyla wereidentified.Tintinnid(28 genera and 78 species wereidentified)accounted for 54.93%of the species,41.55%were oligotrichs(14 genera and 59 species).Dominant taxa included Strombidium paracalkinsi,Strombidium sulcatum,Strombidium wilberti and the nauplii.Abundance of microzooplankton ranged from 11.43 ind/L to 959.35 ind/L,with an average of 264.99 ind/L.Microzooplankton were mainly concentrated at depths 50 m,and decreased gradually bellow 50 m.Microzooplankton in the surface water were mainly concentrated in the Station J5 and Station I1.Shannon-Wiener diversity index of vertical distributions ranged from 0.92 to 4.18,with an average of 2.77.Pielou’s evennessindex ranged from 0.63 to 1,with an average of 0.87.According to canonical correspondence analysis(CC A),temperature and salinity are important factors of microzooplankton com munities.In the time-series stations(J4 and SE ATS),the diurnal fluctuation of microzooplankton com munities changed lightly in the upper water but more stable in the lower water.Microzooplankton com munities temporal changes are generally coincide with chlorophyll a distributions.
Key words:microzooplankton;com munity structure;diurnal cycle;northern South China Sea
*通信作者:孙军,教授,从事海洋生态学研究。E-mail:phytoplankton@163.com
作者简介:李灼(1991—),女,天津市人,主要从事海洋浮游生物研究。
基金项目:海洋局公益性项目(201105021-03);国家重点基础研究发展计划(2015CB954002);教育部新世纪优秀人才计划(N CE T-12-1065);国家自然科学基金(41176136,41276124,41306119)。
收稿日期:2015-06-01;
修订日期:2015-10-25。
中图分类号:Q948.8
文献标志码:A
文章编号:0253-4193(2016)04-0031-12
