海洋生物泵研究进展
2016-05-28孙军李晓倩陈建芳郭术津天津科技大学海洋与环境学院天津300457天津科技大学天津市海洋资源与化学重点实验室天津300457国家海洋局第二海洋研究所国家海洋局海洋生态系统与生物地球化学实验室浙江杭州310012国家海洋局第二海洋研究所卫星海洋环境动力学国家重点实验室浙江杭州310012
孙军,李晓倩,陈建芳,郭术津(1.天津科技大学海洋与环境学院,天津300457;2.天津科技大学天津市海洋资源与化学重点实验室,天津300457;3.国家海洋局第二海洋研究所国家海洋局海洋生态系统与生物地球化学实验室,浙江杭州310012;4.国家海洋局第二海洋研究所,卫星海洋环境动力学国家重点实验室,浙江杭州310012)
海洋生物泵研究进展
孙军1,2,李晓倩1,2,陈建芳3,4,郭术津1,2
(1.天津科技大学海洋与环境学院,天津300457;2.天津科技大学天津市海洋资源与化学重点实验室,天津300457;3.国家海洋局第二海洋研究所国家海洋局海洋生态系统与生物地球化学实验室,浙江杭州310012;4.国家海洋局第二海洋研究所,卫星海洋环境动力学国家重点实验室,浙江杭州310012)
摘要:海洋生物泵是以一系列海洋生物为介质将大气中的碳输运到海洋深层的过程,是海洋碳循环的重要组成部分以及未来的研究重点。本文系统地描述了海洋生物泵碳汇几个主要阶段:浮游植物沉降,浮游动物粪球颗粒沉降,透明胞外聚合颗粒物(T EP)沉降和海雪沉降以及碳酸盐反向泵过程。同时,本文对南海生物泵的研究进展进行简要介绍,服务于中国海碳循环。
关键词:生物泵;南海;碳循环
孙军,李晓倩,陈建芳,等.海洋生物泵研究进展[J].海洋学报,2016,38(4):1—21,doi:10.3969/j.issn.0253-4193.2016.04.001
Sun Jun,Li Xiaoqian,Chen Jianfang,et al.Progress in oceanic biological pump[J].Haiyang Xuebao,2016,38(4):1—21,doi:10.3969/j.issn.0253-4193.2016.04.001
1 引言
目前,人为活动造成大气C O2的持续增高,全球海洋逐渐变暖,海洋生物泵过程受到严重影响。海洋生物泵是未来大气C O2的最终归宿,将大气中的无机碳通过光合作用生成有机碳,再通过物理下沉、溶解混合以及生物摄食和分解等过程最终将碳运输到海洋底层,是海洋碳循环的重要组成部分,对于研究全球气候具有重要贡献。因此,未来海洋碳循环的研究将重点放在海洋生物泵的过程上。
2 海洋生物泵的源起
海洋碳主要有3种存在形式:溶解无机碳(DIC)、溶解有机碳(DOC)和颗粒有机碳(POC),其大致比例是2 000∶38∶1(DIC:37 000 Gt[1—2],DOC:685 Gt[3],POC:13~23 Gt[4])。生物体产生和持有的碳主要为DOC和POC,基本上都是通过初级生产过程实现的。基于海洋对大气C O2的调节能力,海洋碳循环主要受两种机制调控:溶解泵(solubility pu mp,又称物理化学泵)和生物泵(biological pu mp)。溶解泵是一个生物地球化学概念,是将溶解无机碳从海洋表层传输到海洋体系中的过程。生物泵是以一系列生物为介质,通过光合作用将大气中的无机碳转化为有机碳,之后在食物网内转化、物理混合、输送及沉降将碳从真光层传输到深层中的过程。在早期碳循环研究中,溶解泵受到极大的重视,但随着大气C O2分压的持续增高,海洋表层的溶解泵趋于饱和,此时,生物泵过程却在持续不断地工作,因此,海洋生物泵日益成为科学家的研究热点。
3 海洋生物泵的定义
海洋生物泵(biological carbon pu mp,BCP),是指以一系列海洋生物为介质,将碳从大气层传输到海洋深层的过程。生存在海洋上层水体的生物通过光合作用将C O2固定为颗粒有机碳(POC),再通过一系列的食物网过程,将颗粒有机物质包括死亡的生物体、植物碎屑和聚合颗粒物质从上层水体运输到下层水体的过程,是全球碳循环的重要组成部分。
4 海洋生物泵的过程
海洋生物泵主要分为3个阶段:第一阶段,浮游植物通过光合作用将C O2固定为有机碳的过程。同时,一些海洋生物会将海水中充足的钙离子和溶解碳酸盐(碳酸根和碳酸氢根)结合形成碳酸钙(CaCO3)颗粒物作为自己身体的一部分,这将改变海水碳酸盐体系直接作用于海洋对大气C O2的吸收;第二阶段,在海洋真光层,这些通过C O2形成的海洋生物有机碳和CaC O3在真光层进一步通过生态系统的物质循环再分解为C O2,但是有一部分海洋生物来源的颗粒物通过沉降向海底输送,这其中主要由以下几条途径:(1)浮游植物细胞直接沉降,尤其是大细胞、群体的和链状的浮游植物死亡后快速沉降至海底;(2)浮游植物被浮游动物摄食,变成浮游动物的粪球颗粒,迅速沉降至海底;(3)浮游植物细胞会产生胞外多糖分泌物,在物理、化学和生物作用形成胶体状的透明胞外聚合颗粒物(transparent exopolymer particle,T EP),后者吸附聚集各种有机或无机颗粒物碎屑形成凝聚体沉降至海底;(4)浮游植物及其碎屑、动物、微生物和粪球颗粒等其他有机物聚合在一起形成大于500μm的有机物即海雪,在重力作用下沉降至海底;第三阶段,最终这些生物形成的颗粒物到达海洋底层,这样这些生源的碳会封存几千年以上,真正意义上降低了大气中的C O2。值得一提的是,形成碳酸钙的海洋生物最终将碳酸钙颗粒物沉降埋藏于海底的过程又叫碳酸盐反向泵(carbonate counter pu mp,CCP),它是生物泵的一部分,但是,它的作用最终会向大气中释放C O2。以下就海洋生源颗粒物主要的4种沉降途径:浮游植物沉降、浮游动物粪球颗粒沉降、透明胞外聚合颗粒物沉降和海雪沉降逐一展开介绍。
4.1浮游植物细胞直接沉降
浮游植物是海洋中重要的初级生产者,通过光合作用吸收C O2生产有机物,在全球海洋元素循环中发挥重要作用。浮游植物在其生长过程中,由于细胞积累蛋白质、核酸等物质,细胞密度大于海水,因此在重力作用下会有沉降的趋势。浮游植物的沉降是海洋上层有机碳向深层水体迁移的主要途径,是海洋生物碳汇的主要组成部分[5]。但是,由于进行光合作用的需要,浮游植物细胞必须停留在海洋上层水体接受光照,因此浮游植物经过长期的进化衍生出各种机制来抵御沉降。
4.1.1浮游植物抵御沉降的机制
4.1.1.1形成凝聚体或链状群体
浮游植物细胞在生长过程中会分泌多糖组分的胞外黏液[6],这种物质具有黏性,可以将浮游植物细胞互相黏连形成凝聚体。凝聚体比较蓬松,内部填充大量水分,因此会将浮游植物凝聚体的平均密度降低[7];但同时,凝聚体的体积大于浮游植物细胞。根据斯托克公式[8],当这种密度降低带来的效应超过体积增加带来的效应时,会表现为浮游植物沉降速率的降低。但是,如果浮游植物凝聚体吸附其他的高密度碎屑,会导致凝聚体平均密度上升,沉降速率就会增大。
很多硅藻物种可以通过角或刺等突出物结构连接形成链状群体。根据斯托克公式,当链状群体的等效密度等于或接近浮游植物细胞密度时,其沉降速率会加大;如果等效密度明显小于浮游植物细胞密度,则沉降速率可能会减小[9]。因此,浮游植物细胞的沉降速率由尺寸和密度共同决定,比如Peperzak研究发现,长链的浮动弯角藻(Eucampia zoodiacus)和斯氏根管藻(Rhizosoleniastolterforthii)沉降速率反而与链长呈反比[10]。但由于细胞密度难以测量,细胞的尺寸比较容易测得,因此前人的研究多集中于浮游植物沉降速率和细胞尺寸的关系上。如果忽略对细胞密度的考虑,那么对浮游植物沉降速率的认识将是不全面的。
4.1.1.2离子的选择性吸收
浮游植物细胞可以选择性的吸收“重”或“轻”的离子,来改变其细胞密度,从而调节沉降速率。早在1948年,Gross和Zeuthen便提出离子选择性吸收的理论,他们认为太阳双尾藻(Ditylum brightwellii)可以通过对“轻”离子(Na+,K+)选择吸收而替换掉(Ca2+,M g2+)等“重”离子来达到上浮的目的[11]。Anderson和Sweeney也用实验证明在双尾藻细胞中确实存在对Na+和K+的选择吸收,会让细胞密度有一定程度的减小[12]。Kahn和Swift研究发现在甲藻物种夜光梨甲藻(Pyrocystisnoctiluca)中也存在这种现象[13]。
4.1.1.3油脂的积累
浮游植物细胞质中含有蛋白质、碳酸盐和核酸等比海水密度大的物质;另外,像颗石藻和硅藻等类群具有碳酸钙外壳和硅质外壳等高密度的细胞结构。因此,正常来讲浮游植物的细胞密度理应大于海水。为停留在上层水体,浮游植物细胞可以通过油脂的积累来降低密度[14]。油脂可以占到浮游植物细胞干质量的2%~20%,在衰亡的细胞中可能会占到40%[15-16]。研究发现,绿藻Botryococcus可以通过油脂的积累来获得上浮[17]。但也有研究认为,有些浮游植物如硅藻物种,单纯通过油脂的积累来达到上浮是比较困难的[18]。
4.1.1.4气泡调节
蓝细菌可以在原生质内产生气泡(gas voleocu),来降低细胞的密度,从而在水体中漂浮,甚至在表层形成水华。这种结构在很多淡水湖藻类细胞里含有,如Anabaena flosaquae[19]、Microcystisaeruginosa[20]、Planktothrix sp.[21]、Anabaena lemmermanni[22]等。W alsby系统地总结了气泡在调节浮游植物沉降中的作用[23]。浮游细胞通过气泡可以很有效的调节细胞密度,这在蓝藻中也很常见[24—25]。在铁氏束毛藻的群体束丝间,也含有气泡[26],这可能是光合作用产生的O2气泡,使藻束能够上浮。这是不同于细胞内气泡的一种调节方式。
4.1.1.5细胞的运动性
有些浮游植物类群如甲藻具有鞭毛,可以自主运动。Pitcher等通过现场实验发现,当浮游植物群落以鞭毛藻为主时,沉降速率明显小于以硅藻为主的群落的沉降速率[27]。研究显示,微型鞭毛藻的游动速率为3~30μm/s;尺寸大一些的甲藻,如梭角藻和原多甲藻[28—29]以及裸甲藻和舌甲藻移动速率可以高达200~500 μm/s[30];大的团藻群体可以高达1 m m/s[31]。总之,不同浮游植物类群的运动性具有差异,其调节沉降的能力也不同(图1)。
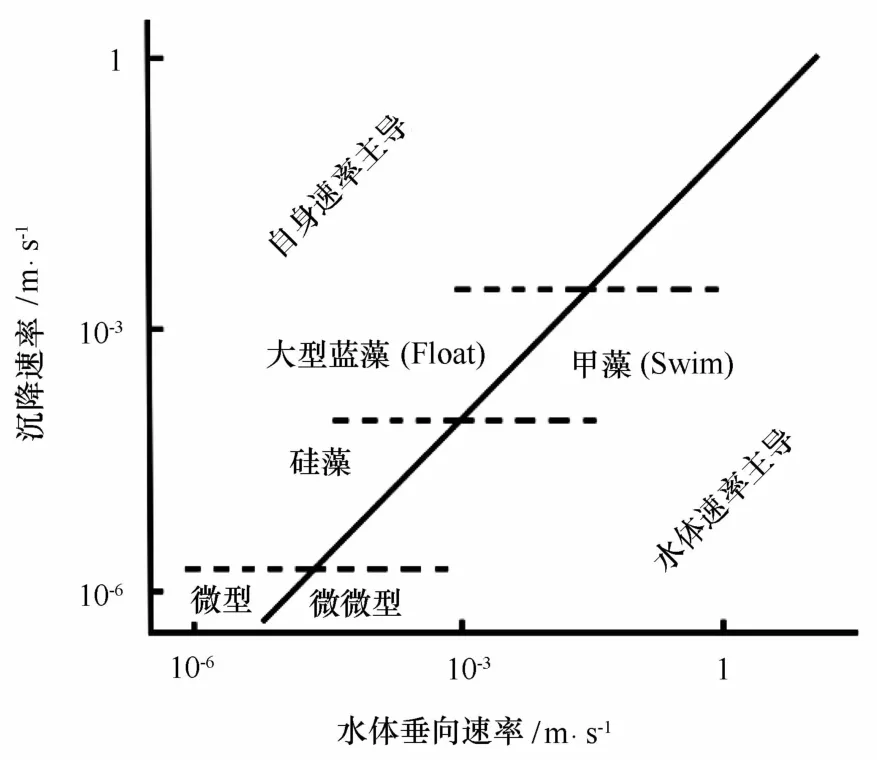
图1 海洋不同类群浮游植物沉降速率比较[9]Eig.1 Sinking rates of various phytoplankton group in the ocean[9]
4.1.2沉降速率的测定方法
浮游植物快速的沉降是碳汇的主要途径,而慢速的沉降会导致浮游植物细胞被细菌裂解或浮游动物摄食,这样浮游植物的有机碳会停留在海洋上层水体再循环,对于碳汇贡献较小[5]。因此,浮游植物细胞的沉降速率对于碳汇效率是一个非常重要的影响因素,了解其沉降速率对于我们了解碳汇具有重要意义。1851年,Stokes提出了著名的斯托克公式:
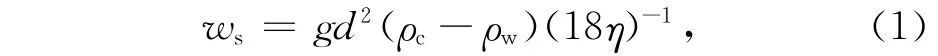
式中,ws为沉降速率,g为重力加速度(g=9.808 1 m/s2),d为球体的直径,ρc和ρw分别为球体和液体的密度,η为液体的黏性[8]。该公式被作为研究颗粒
物质在水体中沉降的理论基础。然而,该公式在应用到浮游植物沉降的研究中需要谨慎对待,因为浮游植物形态不是简单的球体,另外,其生物特性产生的沉降速率的变化也不是用公式计算可以解决的。浮游植物细胞个体微小,且沉降缓慢,直接测量它们的沉降速率比较困难。因此,需要借助其他间接的方法来进行测定。同测定浮游植物的生长率一样,其沉降速率也是通过对其群体的沉降速率测定来获得的。目前常见的浮游植物沉降速率测定方法有如下几种。
4.1.2.1显微镜直接观测法
这是一种最原始的方法,早在20世纪30年代就已经使用[32—36],利用倒置显微镜直接观测细胞沉降(图2)。该方法比较直观,但操作工作量大,需要每隔一定时间对视野进行扫描式观测;同时,由于显微镜操作对稳定性有很高的要求,该方法不适宜现场使用。
4.1.2.2荧光检测法
最早由Steele和Yentsch[37]提出,随后Eppley等[38]和Titman[39]进行了改进。该方法通过将浮游植物细胞注入沉降柱上端,然后检测沉降柱下端浮游植物细胞开始出现的时间,计算其沉降速率(图3)。
相对于早期的显微镜直接观测法[32—34],该方法更加方便和灵敏,同时可以应用于现场状况,但由于测定叶绿素需要现场海水中浮游植物细胞丰度超过一定阈值,即对生物量有一定要求,因此该方法可能只限制于水华状态下应用。另外,虽然减省了显微镜观测法繁冗的操作,但该方法丢失了很多其他的信息,比如细胞的形态信息。
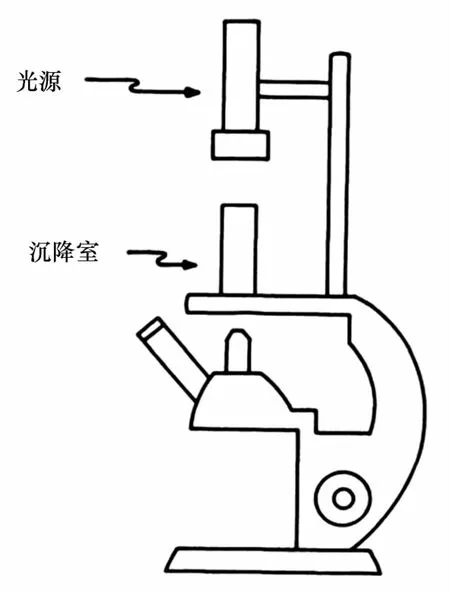
图2 显微镜直接观察法测沉降速率[34]Eig.2 Direct observation of phytoplankton sedimentation with inverted microscope[34]

图3 荧光检测法测沉降速率[38]Eig.3 M easuring phytoplankton sinking rates with a fluoromete[38]
4.1.2.3沉降柱(SE T C O L)法
这是一种通过测定一定时间内沉降柱中浮游植物生物量的变化来计算其沉降速率的方法(图4),由Bienfang创立[40]。
本方法的特点,操作简单,系统误差较小。另外,相对其他方法,该方法可以通过镜检沉降柱不同段沉降后收集的水样,获得不同物种的沉降信息。目前为止,SE T C O L方法是作为海洋生态学现场测量浮游植物沉降速率的一种常用手段[10,41—43]。近些年来,随着研究的深入,陆续有几种新的测定浮游植物沉降速率的方法被发明[44—46],然而这些方法都由于复杂的仪器或操作过程而不适宜用于现场的研究,大多被应用于室内研究。
4.1.3浮游植物沉降速率的影响因素
4.1.3.1生理状态
早在1960年,Steele通过实验发现,在衰亡状态下的中肋骨条藻的培养液中加入营养盐后,其沉降速率会明显降低[37];1967年,Eppley发现,布氏双尾藻在衰亡状态下沉降速率是生长状态下的3~4倍[38];1991年,Passow发现,海链藻在生长活跃状态下沉降速率低于1 m/d,在衰亡状态下则高达50 m/d[47];1996年,M uggli发现,幅环藻(Actinocyclus sp.)的培养液在加入铁盐后生理状态良好时,其沉降速率明显较缺铁时低[48]。因此,大量的室内实验结果显示,浮游植物细胞的沉降速率与细胞的生理活性有关:当细胞处于指数生长期时,生理状态最好,沉降速率最慢;当其处于衰亡期时,生理状态最差,沉降速率最快[12,15,37,49—51](图5)。
4.1.3.2光照
Bienfang在亚热带海域的研究发现,浮游植物细胞在晚间的沉降速率是白天的两倍[52]。很多其他的研究也发现,在低的日照强度下,浮游植物沉降速率会增加[53—55]。
4.1.3.3营养盐
1976年,Titman通过室内实验发现,Asterionella formosa、Melosira agassizii、Cyclotella meneghiniana 和Scenedesmusquadricauda四株藻在营养盐缺乏的条件下,细胞沉降速率明显高于营养盐充分条件下的沉降速率[56]。
除了N、P和Si等大量元素外,微量元素Ee等营养盐成分对沉降速率也有影响。1996年,亚北极太平洋海域的施铁实验显示,相对于施铁海域,未施铁海域硅藻的沉降速率更大[48];南大洋施铁实验也证实施铁可以让浮游植物沉降速率减小[42]。
4.1.3.4细胞形态
McNown模拟浮游植物细胞不同形态的金属片在油液中的沉降,发现沉降速率存在差异[57];随后,H utchinson和Komar对圆柱体形态[58—59]、Davey和W alsby对链珠状形态[60]、Padisák对多种不同浮游植物细胞形态[61]的沉降速率都进行了实验,研究均证实,细胞形态能够明显影响浮游植物细胞的沉降速率。另外,像细胞的沉降角度等也会对其沉降速率有影响[62]。
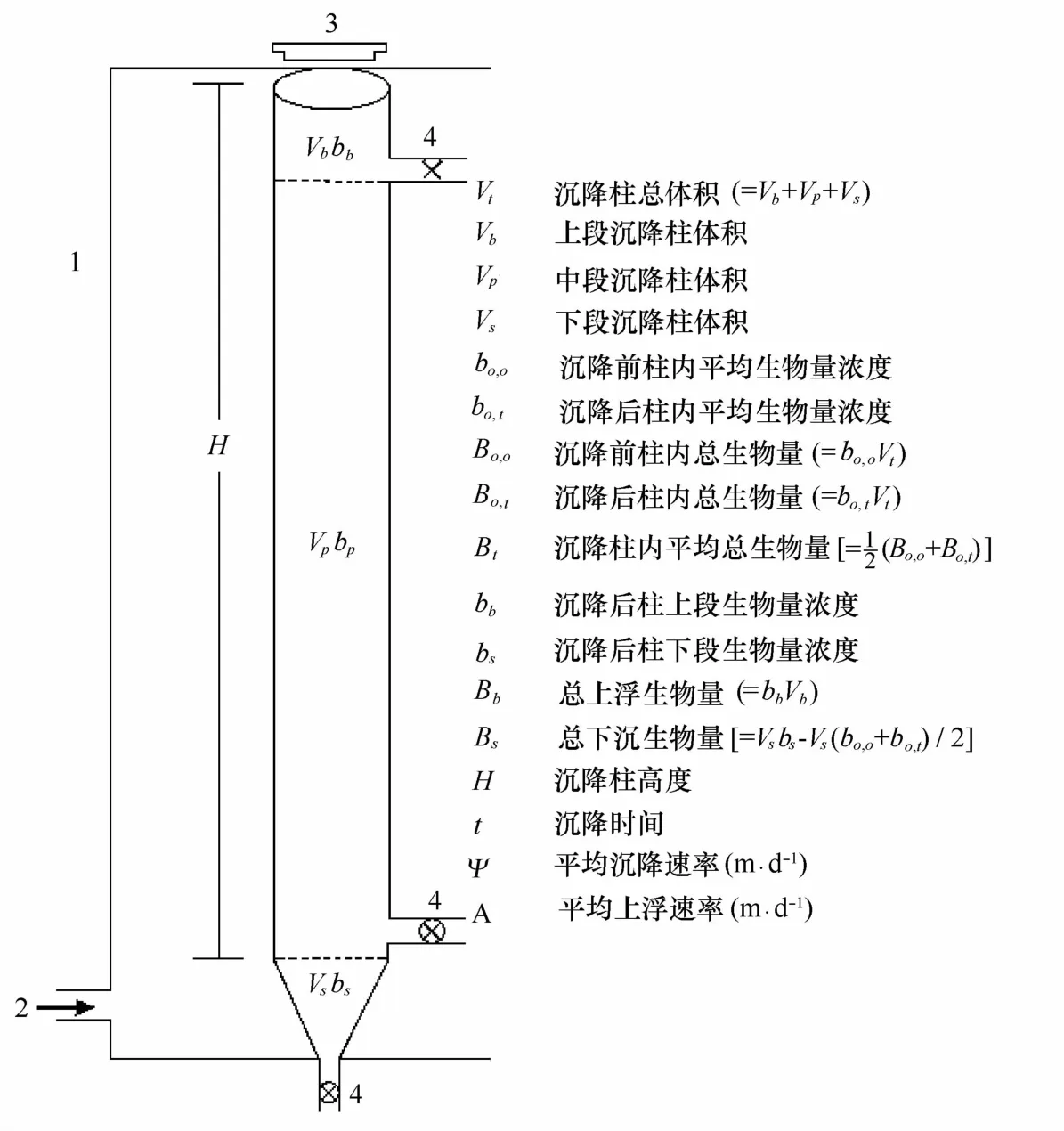
图4 SE T C O L法测沉降速率示意图[40]Eig.4 M easuring phytoplankton sinking rates with SE T C O L method[40]
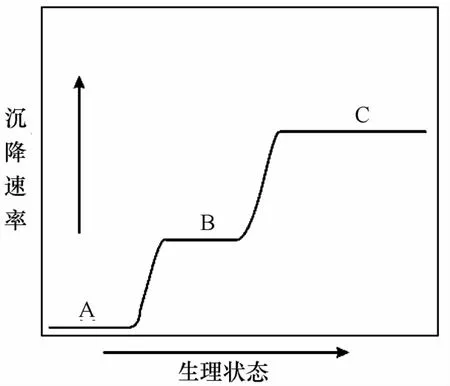
图5 浮游植物细胞沉降速率与生理状态关系图Eig.5 The relationship between phytoplankton physiological state and their sinking ratesA指数期;B稳定期;C衰亡期A:Logarith mic phase;B:stagnate phase;C:decline phase
海洋浮游植物尤其很多硅藻物种如角毛藻、骨条藻等是链状群体的,从进化意义上来说链状群体可能利于其抵御摄食。同时,链状群体间隙一般较大,使其平均密度减小,由斯托克公式可知,密度的减小会减小沉降速率[9]。
4.1.3.5水体运动
作为缺乏运动能力的浮游植物来说,水流对他们的影响不可避免。在水体中,浮游植物细胞的沉降速率受两个因素影响:本身的沉降速率和水流运动的速率,两者结合起来才是其实际的沉降速率。多数观点认为,水体的扰动可以保持浮游植物细胞停留在上层水体,也就是降低其沉降速率[63—64]。但也有研究发现,水体扰动有时可能不利于浮游植物停留在真光层,反而会增加浮游植物细胞的沉降速率[65—66]。H uisman等研究则发现,浮游植物在扰动大的水体中沉降速率会降低,而在稳定的水体中则容易达到高的沉降速率[67]。M axey则认为,从长时间尺度看,在均匀扰动的水体中,浮游植物的平均沉降速率实际是不受水体影响的,因为水体自身在垂直方向的运动会相互抵消[68]。
4.2浮游动物粪便颗粒打包沉降
除浮游植物细胞直接沉降外,另外一条和浮游植物相关的碳沉降途径为浮游动物粪便颗粒打包沉降。浮游动物粪便颗粒,是浮游动物摄食浮游植物或其他生物后产生的颗粒状排泄物,是海水中一种常见的颗粒态有机物。由于尺寸较大、密度较高,浮游动物粪便颗粒的沉降速率较快,可达几十到几百米每天[69]。浮游动物粪便颗粒的沉降是碳从海洋表层向底层输出的重要途径之一[70]。以下就浮游动物粪便颗粒的丰度和生物量、生产速率、沉降速率、通量和分解等方面进行简要介绍。
4.2.1丰度和生物量
用孔径为20μm的筛绢过滤大量的水体,可以估算水体中粪便颗粒的丰度。在挪威海,水体中粪便的丰度介于0~10 000 m-3,最大碳浓度达15 mg/m3;在大西洋中部的一个海湾,粪便丰度介于0~30 L-1,转化为碳浓度为0~2μg/L(以碳计)[71]。在南印度洋,粪便颗粒丰度介于0~2 500 m-3,转换为碳浓度为0~14μg/m3[72]。W exels Riser等研究发现,Iberian陆架海粪便颗粒的浓度介于0~4.3 mg/m3[73];巴伦海3月水体中的粪便颗粒浓度低于0.1 mg/m3[74]。W assmann等研究发现,水体中粪便颗粒的含碳量仅占POC总量的0.1%~6.1%[75]。
4.2.2生产速率
浮游动物粪便生产速率的研究起始于20世纪40年代[76—77],早期的研究以室内培养实验为主,饵料为培养的浮游植物藻液。研究发现,有的浮游动物的粪便生产率随饵料的浓度增加而增加,当饵料浓度达到某一阈值后便不再变化[78—80];有的浮游动物的粪便生产率随着饵料浓度的增大而一直增加[81]。
早期的室内培养所获得的浮游动物粪便生产率的数据很难应用到自然海区,因为自然海区的饵料状况及其他环境因子与实验室内存在较大区别。比如,现场自然海水培养的Calanustypicus的粪便产率为2.3个/d,实验室内的结果可以高达10个/d[71];现场海水培养Calanus finmarchicus的排粪速率为2.2个/d,室内培养的结果为1~150个/d[82]。
随后,基于现场培养的浮游动物排粪率实验陆续展开,并积累了大量的资料。在北海夏季,在水体叶绿素a浓度为6 mg/m3的时候,桡足类的粪便生产率是2~10个/d[83];在春季硅藻水华期间,粪便生产率可以高达40 pellets/(ind·d)[84]。在北冰洋,虽然温度很低,春季水华期间的粪便生产率可以达到50 pellets/(ind·d)[85—86]。W exels Riser等研究了浮游动物粪便颗粒在巴伦海的生产速率,为20~55 pellets/(ind·d)[74]。Beau mont等计算了East Antarctic fjord浮游动物粪便的生产速率为8 pellets/(ind·d)[87]。Urban-Rich总结了已发表的粪便生产率数据,介于2 ~100 pellets/(ind·d)[88];Blaxter将这一范围扩展为8~225 pellets/(ind·d)[89]。
4.2.3沉降速率
浮游动物粪便颗粒的沉降速率较高。Turner和Eerrante总结了粪便颗粒的沉降速率介于十到几百米每天[69],随后的研究扩展了这一范围(表1)。
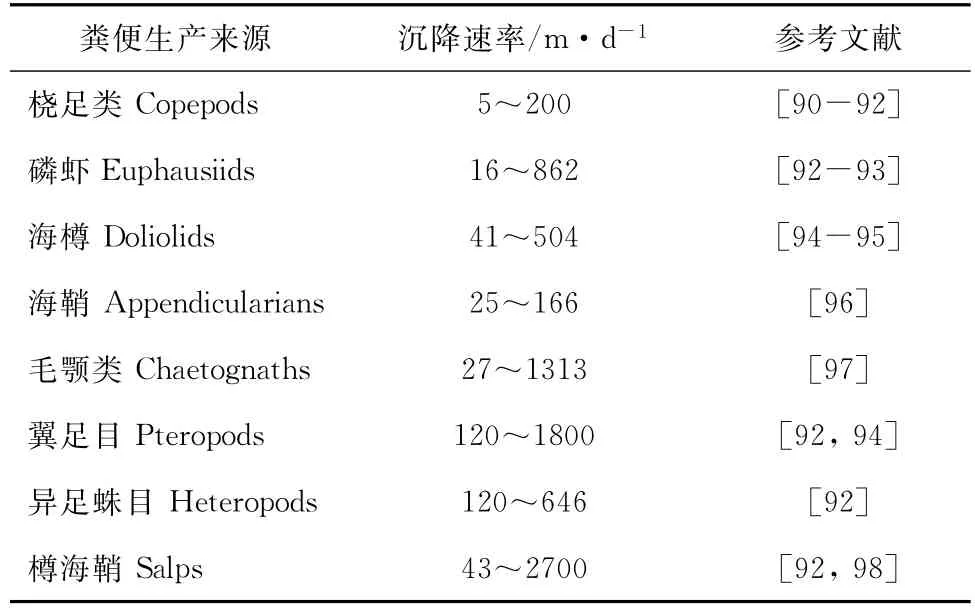
表1 浮游动物粪便颗粒沉降速率Tab .1 Sinking rates of zooplankton fecal pellets
饵料的不同会对粪便颗粒的沉降速率产生影响。S mall等研究发现,生存在自然水体中的桡足类的粪便颗粒的沉降速率较室内培养以纯浮游植物为摄食对象时产生的粪便颗粒的沉降速率高,这主要是由于粪便颗粒的密度差异所致,因为自然环境中摄食浮游植物和其它高密度的的物质产生的粪便颗粒比单纯摄食浮游植物产生的粪便颗粒的密度高[99]。Bienfang发现桡足类Calanus finmarchicus产生的粪便,以硅藻为食时的沉降速率高于以甲藻为食时的沉降速率,并认为这主要是由于摄食硅藻外壳产生的粪便颗粒的密度较大所致[100]。Erangoulis等研究发现,当从硅藻向棕囊藻水华转变期间,桡足类粪便颗粒的沉降速率会从100 m/d降到70 m/d,并认为这主要是由于粪便颗粒密度和体积减小所致[84]。
桡足类粪便颗粒沉降速率受尺寸影响也较大,后者与食物浓度、组成和摄食率有关。Dagg和W alser研究发现,粪便颗粒尺寸随着叶绿素a浓度增加而变大,直到叶绿素a浓度达到3μg/L;在这个浓度以下,摄入率和排泄率平衡,桡足类肠道没有填满,所以粪便颗粒尺寸较小;这个浓度以上,则肠道填满,会产生大粒径的粪便颗粒[101]。因此,Dagg和W alser认为桡足类在高浓度饵料情况下产生的粪便颗粒,由于尺寸较大,沉降速率会高于在低浓度饵料情况下产生的粪便颗粒的沉降速率[101]。Ayukai和Nishizawa研究发现类似的情形[81]。Tsuda和Nemoto也发现摄食率、粪便颗粒生产率和粪便颗粒体积随饵料密度增加而增大[102]。
4.2.4沉降通量
研究发现,浮游动物粪便颗粒的沉降通量变化较大(表2)。Bishop等估计,在热带大西洋海域的400 m层以上水体,浮游动物粪便颗粒只占悬浮颗粒有机碳的4%,但占到通量的99%[103]。Urrère和Knauer研究发现,浮游动物粪便颗粒的通量随水深会发生变化,在上层水体(35~150 m)占总碳通量的10%到19%,在500 m处降低到9.7%,在1 500 m处降低到3.4%[104]。但Eowler等研究发现,粪便颗粒通量会随水深增加,占总有机碳通量的比例在50 m、150 m 和250 m层分别为25%、29%和33%[105]。Graf研究发现,在春季水华后的北大西洋,Calanus finmarchicus产生的粪便颗粒占总碳沉降通量的92%[106]。
也有研究发现,粪便颗粒在通量中的比例较小。Pilskaln和H onjo研究发现,粪便颗粒在沉降通量中仅占小于5到10%的比例[107]。M aita等研究发现,在Panama Basin的74 m层,粪便颗粒在夏季的通量仅占总颗粒有机碳通量的2%~4%[108]。在Panama Basin的390 m层,颗粒有机碳通量主要由海雪贡献,粪便颗粒所占比例不大[109]。Taylor研究发现,粪便颗粒通量在北太平洋200 m层占总颗粒有机碳通量的6%[110]。Lane等研究发现,桡足类粪便颗粒通量在Virginia陆架海42 m层的通量仅占POC总通量的1%[71]。Roman和Gauzens计算得到桡足类粪便颗粒在热带太平洋碳通量的比例很小,认为大多数真光层生产的粪便颗粒在向深海沉降的过程中被分解和再摄食掉了[111]。
4.2.5分解和再摄食
大部分的浮游动物粪便颗粒在沉降过程中会受其他浮游动物再摄食和细菌分解的影响。很多研究发现,沉积物捕捉器中的粪便颗粒远远低于上层水体粪便颗粒的生产量[128],这表明粪便颗粒在沉降过程中产生了消耗。由于粪便颗粒的沉降速率较快,细菌分解的可能性不大[129]。研究发现,粪便颗粒在上层水体的消耗主要是由其他浮游动物的活动所致,主要是桡足类[128],产生的截留率可以高达30%~98%[130]。

表2 浮游动物粪便颗粒在总有机碳通量中的比例Tab .2 Zooplankton fecal pellet contribution to total particulate organic carbon flux
Gowing和Wishner在深海桡足类的肠道里发现了粪便颗粒,表明其对粪便颗粒的摄食[131]。Green等发现大型桡足类Calanus helgolandicus摄食小型桡足类Pseudocalanus elongatus产生的粪便[132]。Lampitt等研究发现,桡足类会破碎它们自己生产的粪便颗粒,并且摄食一小部分[133]。另外,桡足类Oithonasimilis可以摄食多种镖水蚤产生的粪便[134]。剑水蚤对镖水蚤粪便颗粒的摄食也被发现[135]。
Noji等将桡足类摄食粪便颗粒的行为划分为3种:裂粪性行为(coprorhexy),将大的粪便颗粒分解为小的粪便颗粒;食粪性行为(coprophagy),可以直接吞噬粪便颗粒;清粪性行为(coprochaly),是指桡足类摄食粪便的围食膜,导致粪便颗粒的破碎[136]。Noji等认为这些过程对粪便颗粒的破坏会阻碍其向海洋深层的输出[136]。
4.3透明胞外聚合颗粒物沉降
4.3.1定义
透明胞外聚合颗粒物(transparent exopolymer particles,T EP)是海洋中可被爱尔新蓝染色剂染色的由酸性多糖组成的透明胶状颗粒物的统称[137]。在海洋生态系统中,T EP是溶解有机物的重要组分,主要产生于浮游植物,少数来自于细菌等其他生物[6,138]。早期由于研究方法的限制,这类透明状的物质一直被人们忽视。一旦T EP的检测方法被发现,对这类物质的认识迅速增加[7]。
T EP具有溶解有机物和颗粒有机物的双重特性,由于具有黏性,可以将水体中的溶解态或小颗粒物转化成大颗粒物,提高海洋中小颗粒物向大颗粒物的转化速率[6]。与固体颗粒物不同的是,T EP又具有胶体的特性,它们的体积和表面积随环境因子的变化而改变。T EP在沉降过程中,可以大量吸附环境水体中的POC和DOC,形成的聚集体的C/N比值远远高于Redfield比值,是一种有效的碳沉降的途径[139]。
T EP和浮游植物的关系非常密切。研究发现,T EP的前体物质主要是由浮游植物产生。浮游植物水华特别是硅藻水华发生时,水体中的T EP含量往往较高[119,140];其他水华如棕囊藻(Phaeocystis spp.)水华[141]、甲藻水华[142—143]和蓝藻水华[144]发生时,水体中的T EP浓度也会很高。
4.3.2T EP的形成
4.3.2.1形成原理
TEP是由海水中的溶解有机物通过一系列的物理和化学作用而形成的,它是介于溶解态和颗粒态有机物之间的一种形态。传统的观点认为,溶解态的有机物转化为颗粒态的有机物的主要途径是细菌吸收。后来的研究发现,由于T EP的大量存在,并且T EP可以通过起泡作用这种物理方式直接形成颗粒物[145—146],证实T EP的形成才是溶解态有机物转化为颗粒态有机物的主要步骤[6]。T EP的形成一般分为两个步骤:先由浮游生物主要是浮游植物释放T EP前体;然后,T EP前体通过非生物作用如凝结化、凝胶化和退火等过程聚集成T EP。T EP前体是100 n m,直径为1~3 n m的纤维[147],主要由浮游植物和细菌分泌释放到水体中[148—151];另外,细菌和病毒引起的细胞裂解也会释放T EP前体[152—153]。这些T EP前体先通过凝结化[154—155]、凝胶化和退化等作用[156]形成亚微米级颗粒,然后再次絮凝形成更大的微米级颗粒,最终形成T EP[138]。
4.3.2.2T EP的来源
现场T E P的浓度高值经常出现于浮游植物水华期间,特别是硅藻水华[119,140,157—158]或棕囊藻水华[54,141]。另外,T E P的高浓度在甲藻水华[142—143,157]、蓝藻水华[144,159]和隐藻水华[160—161]中也有出现。培养实验则表明浮游植物是T E P的主要来源[6,157]。
在培养过程或现场的浮游植物水华过程中,T EP往往跟Chl a浓度相关[6]。在一场水华中,T EP的浓度(μg/L)可以通过叶绿素a的浓度(μg/L)进行推算,公式如下:
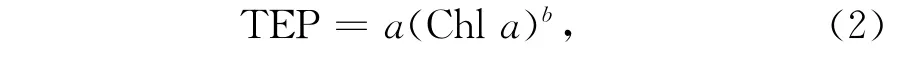
式中,对于不同的水华,a和b都会不同。b的值小于1,表明随着水华的进展T E P的生产速率呈降低趋势。
细菌也可以生产T EP[151],但虽然培养的细菌会生产大量的T EP[151],在现场它们的生产贡献往往不大[162]。除了浮游植物和细菌,其他生物也生产T EP,比如大型藻类[163]和珊瑚[164]。
4.3.3T EP的测定方法
4.3.3.1显微镜直接计数法
这种方法由Alldredge等创立[137]。基本原理:T EP经爱尔新蓝溶液染色后,在显微镜下直接进行丰度计数和尺寸测量,然后推算总表面积和总体积。
操作流程:用孔径0.2μm或0.4μm的聚碳酸酯滤膜过滤海水,蒸馏水洗涤去除盐分,然后用爱尔新蓝溶液染色。将滤膜上的颗粒物定量转移到载玻片上,凝胶封片,或直接将滤膜转移到无细胞的载玻片上,用浸镜油和盖玻片覆盖,利用手动或半自动的图像分析软件进行T EP计数和粒径分析[137]。该方法的缺点在于,直接用肉眼观测,比较费时费力;如果用图像分析软件进行分析,难以分辨染色和未染色颗粒物之间的界限,误差较大[165]。
4.3.3.2 比色法
Passow等提出了测定T EP含量的比色法[165]。比色法是半定量的方法,原理与显微镜计数法的前半部分类似,但是该方法是建立在对染色剂和T EP结合形成的物质的比色分析基础上。该方法操作便捷,已成为常规方法。目前,已积累了大量的研究[6]。
基本操作:同显微镜直接观测法的前半部分类似,首先对海水进行过滤和染色处理,然后过滤的聚碳酸酯滤膜放到80%的浓硫酸,最后测吸光值[165]。每个处理组至少3~4个平行样,并且需要设置空白组。
4.3.3.3顺磁性功能化微球体法
该方法基本原理是利用顺磁性微球体对T EP的黏附性来浓缩T EP。首先将T EP和1μm的微球体混合并通过强磁场,由此将附着了T EP的微球体浓缩于强磁场中。根据微球体的体积可以计算出T EP的体积[166]。
4.3.3.4T EP的碳含量
T E P的碳含量可以通过比色法的结果进行推算:
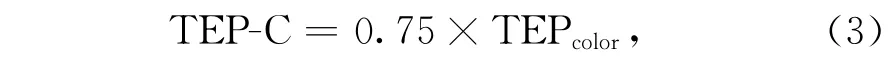
式中,T EP-C的单位为μg,而T EPcolor的单位为μg Xeq.[139]。T EP-C(μg)和T EP(μg Xeq.)的比例介于0.51~0.88[139]。
4.3.4T EP的含量与分布
T EP的测定方法的发现,使人们对这种透明的物质在海洋中的含量和分布有了越来越深的了解。T EP在淡水和海洋中都有分布,粒径大于5μm的丰度从1到8 000 m L-1,粒径大于2μm的丰度介于3 000到40 000 m L-1[31]。一般情况下,T EP的浓度峰值往往出现于浮游植物的水华期间[119,142,167],另外大型藻的生长旺盛期也会出现T EP的峰值[163]。总体来看,T EP的含量与浮游植物的生物量密切相关:真光层水体中的T EP含量一般比真光层以深的水体高,近岸水体的T EP含量一般比开阔大洋高[6]。
T EP浓度的最高值11 000μg Xeq./L是在A-driatic Sea发现的,这个区域以高产胶状物质闻名。在大多数海域,T EP浓度的峰值约为1 000μg Xeq./L,多发生在水华期间[6]。在海冰中的T EP浓度也往往很高,介于1 000~7 700μg Xeq./L[168]。T EP的丰度和大小与浮游植物相似,表明T EP对颗粒有机碳的贡献不容忽视。由于它们的大量分布,在海洋物质循环中的作用值得探索。
对目前世界各海域海水中T EP含量的报道进行了总结(表3)。T EP在不同海域差别较大,即使同一海域不同季节的差异也会较大。

表3 TEP在世界不同海域含量汇总Tab .3 Sum mary of TEP concentrations around the world
4.3.5T EP在海洋中的作用
T E P的碳含量的测定表明,虽然其主要由水分组成,但是其碳含量很高。通过显微镜观测和比色法测得的T E P的碳含量与浮游植物的碳含量在一个数量级,表明T E P对海域有机碳库的贡献不容忽视[139,181]。
由于T EP具有黏性,可以吸附环境中的溶解态或颗粒态有机碳,从而加速了有机碳的沉降。T EP在有机碳沉降过程中的作用体现在两个方面:(1)T EP通过黏性吸附其他颗粒态有机物,促进其沉降迁出;(2)T EP自身可直接沉降。由于T EP的碳含量与浮游植物在一个数量级[139,181],其沉降代表的碳输出也不容忽视。在Santa Barbara海峡,通过T EP沉降输出的碳占颗粒有机碳总输出通量的30%[119]。
4.3.6国内关于T EP的研究进展
国外对T E P的研究较早,起步于20世纪90年代。自从Alldredge等[137]以及Passow和Alldredge[165]建立了有关T E P的测定方法后,对T E P的研究才正式展开。国外目前对海洋T E P的研究已经积累了很多,对T E P的形成、丰度以及在生物地球化学循环中的作用都取得了一定的认识。但在我国,关于T E P的研究仍然较少。彭安国和黄奕普对九龙江河口区T E P的含量分布及其与238U、234U、238T h、232T h、230T h、228 Th和210Po的放射性比活度相关性进行了研究,表明T E P对这些放射性核素的地球化学行为有一定的影响,同时研究了T E P和Chl a含量的关系[177]。孙军综述了T E P在海洋生态系统中的作用[138]。孙翠慈等对珠江口的T E P进行了研究,发现珠江口T E P的含量介于85.0~1 234.9μg Xeq./L之间,平均值为690.9μg Xeq./L[180,182]。总体来说,我国关于T E P的研究较少,尤其是其相关的生物地球化学方面的研究比较匮乏。
4.4海雪沉降
4.4.1海雪的来源、丰度和分布
海雪是指海洋中肉眼可见的尺寸大于500μm的聚合物,可以直接沉降至海底,是海洋生物泵的重要组成部分。海雪来源于聚集的浮游植物、尾海鞘纲动物的壳、粪便颗粒或者其他颗粒物质。浮游植物分泌的胞外粘液与植物碎屑、微生物、病菌粘在一起形成海雪。海雪的形状大都不规则,但也有聚成球形和成串排列的[183]。因此,浮游植物是海雪的主要组成部分,浮游动物粪便、浮游植物碎屑等聚集在一起形成海雪,微生物和病菌附着其上生长。
海雪的形成主要受3个因素控制:(1)颗粒的浓度、密度、尺寸和形状;(2)剪切力和不同的沉降速率;(3)颗粒分解后再形成的可能性,在大洋中,剪切力是控制海雪聚合物的主要因素[184]。因此,物理环境对海雪沉降过程具有很大的影响,同时海雪的积累在某种程度上也影响着海洋的物理环境,比如形成海雪薄层。
海雪在水体中的分布比较广泛,目前,海雪的研究主要集中在大陆架边缘和生产力相对较高的远洋区域,比如巴拿马海、北大西洋、赤道太平洋和黑海等[185]。海雪在近岸和深海中都有发现,但是深海的丰度相对低些,丰度一般介于1~100 aggregates/L。望角湾的海雪的平均丰度为125 aggregates/L,平均沉降速率为74 g/(m2·d),并指出海雪占水体总沉降颗粒物的90%[186]。在北冰洋副热带环流寡营养区,通过照相系统和远程遥控操作对上层水体的海雪丰度进行测定,发现研究区域的西部和东部海雪的丰度最高,达到6.0~13.0×103aggregates/L,而在中部地区海雪丰度为0.5~1.0×103aggregates/L[185]。在地中海西部的研究发现,粒径在150μm~1 m m之间的海雪基本上是悬浮在近岸水体中,而大于1 m m的海雪大多聚集在锋面上,可能与锋面的物理环境和生物的传输作用有关[187]。
4.4.2海雪的沉降速率和研究方法
在巴拿马盆地的研究中表明,尺寸小的海雪(1~2.5 m m)的沉降速率较快,为36 m/d,尺寸大的海雪(4~5 m m)的沉降速率较慢,为1 m/d。Alldredge和Gotschalk在没有物理扰动的现场条件下,对不同尺寸的海雪的沉降速率进行测定,表明2.4~75 m m范围内的海雪的平均沉降速率为(74±39)m/d[142]。在一些大洋和近岸区域,Oikopleura dioica和Oikopleuralongicauda两物种丰度较高,由它们的壳形成的海雪的碳沉降通量为1~1 200 mg/(m2·d)。在富营养近岸区域和寡营养大洋区域,它们的碳通量占总颗粒有机碳碳通量的12%~83%,如果将其他海雪的碳通量计算出来,海雪的碳通量占颗粒有机碳碳通量的比重应该更大[188]。研究发现,海雪的密度越大,沉降速率越快,但是当海雪沉降到高密度水层的时候,会出现沉降速率降低的现象[189]。此外,海雪可以被浮游动物或者桡足类分解为尺寸较小的海雪,这也将降低其沉降速率,进而降低碳通量[190—191]。
虽然海雪在海洋碳循环中占主导地位,但是沉积物中的海雪很难鉴定[188]。因此,目前海雪研究的工作中遇到的主要问题是用合适的技术测定海雪的丰度和特性。浮游植物群落组成,浮游动物对海雪的产生速率和生物过程对海雪的加强过程还不清楚,但是这个过程对研究海雪的沉降速率很重要。海雪中存在的生物胶质物,包括细菌聚合物,浮游植物胞外物质和细胞溶解作用,例如D N A,在这个过程中可能具有重要的意义。
4.4.3海雪和生源颗粒物质
海雪主要是植物碎屑或者生物颗粒的聚集体,可以为微生物或病毒提供生存所需的营养条件,甚至比周围海水中包含的营养物质更充分[192]。和海雪有联系的生物体和颗粒主要包括细菌、微生物、微型浮游植物、原生动物、浮游动物、浮游动物粪便颗粒、幼形动物脱去的壳、浮游植物碎屑以及无机矿物颗粒等[184,191]。研究发现,来自不同水体的海雪上附着多种病菌和微生物[193]。海雪不仅可以为微生物提供稳定的化学环境,是细菌主要的生活场所,还可以作为浮游动物和鱼类的食物来源[194—195],是海洋碳在食物网中循环的重要环节。
4.4.4海雪的分解和摄食
海雪在沉降的过程中,大部分会被微生物和病毒分解或者被浮游动物和鱼类摄食。很多研究发现,浮游动物主要是磷虾和桡足类摄食海雪,Dilling和Brzezinski通过硅同位素实验证实Euphausia pacific摄食海雪[196]。Sano等人通过EP M A分析(电子探针显微分析)发现海洋中层的桡足类选择性摄食矿物颗粒含量高的海雪[197]。海雪也可以被磷虾等浮游动物分解为尺寸较小的海雪或者碎片颗粒[190],沉降速率降低甚至溶解到周围的海水[191,198]。研究发现,在自然环境下生活的鱼类,偏重摄食海雪[199],其中有些鱼类喜欢摄食附着在海雪上的细菌或者其他微生物[200]。沉降到海底的海雪是底栖生物的食物来源[190],Newell等人实施现场实验表明海雪的含量和底栖生物摄食活动成正相关关系[201]。实际上大部分摄食海雪的浮游动物、鱼类和底栖动物主要是因为超微型浮游植物、细菌或者微生物附着在海雪上[202—203]。因此,海雪对海洋食物网中碳循环具有一定的作用。
4.5颗石藻和碳酸盐反向泵
今生颗石藻(living coccolithophorid)是浮游植物中重要的一类功能群,在海洋碳循环中具有重要的作用,主要通过生物泵和碳酸盐反向泵两个过程对海洋生态系统碳循环起重要作用,从而对全球C O2循环产生重要影响。
4.5.1颗石藻的结构、丰度和分布
颗石藻在分类上属于定鞭藻门(Prymnesiophyta)定鞭藻纲(Prymnesiophyceae)[204],外壳由碳酸钙组成,细胞外有颗石粒(鳞片状颗粒)[205],死亡后沉降至海底。颗石藻个体微小,属于微型浮游植物,大多数物种小于20μm,其丰度或生物量巨大,是大洋和高纬度海洋发生水华的常见类群,在上升流区[206]和热带寡营养盐区域中其含量很丰富[207]。
4.5.2颗石藻碳酸盐反向泵
颗石藻即可通过光合作用将无机碳固定为有机碳,又可进行钙化作用,将有机碳和碳酸盐紧密的链接起来[208],调节海洋生物泵和碳酸盐反向泵两个过程。和生物泵不同,碳酸盐反向泵将颗粒无机碳输送到海洋表层[209]。颗石藻可以在体表沉积CaC O3,将溶解无机碳(DIC)转换到颗粒态CaC O3,一方面,由于CaC O3的密度较大,使颗石藻迅速沉降至海底,加强海洋生物泵的过程;另一方面,CaC O3在沉降过程可以驱动碳酸盐反向泵,将无机碳转化为溶解气体,最终导致溶解在海水中的C O2释放到大气中[205,210—211]。Salter等在南大洋颗石藻钙化机制的研究中表明,当海水中铁含量较高时,可以刺激碳酸盐反向泵,降低碳酸盐从海洋表层向海洋底层的输送[212]。因此颗石藻的钙化作用对调节颗石藻的生物泵和碳酸盐反向泵过程具有重要作用。
5 南海海洋生物泵
南海是中国最大的边缘海,对我国的碳循环和气候变化起到至关重要的作用。目前南海海洋生物泵的研究主要包括浮游植物初级生产、有机颗粒物形态及转化、有机颗粒物沉降、碳酸盐反向泵等方面。
5.1南海生物泵效率
目前,对南海碳含量的研究方法很多,常使用的方法为放射性同位素示踪法、沉积物捕获器和卫星遥感法对南海的初级生产力以及碳输出量进行估算,南海每天碳输出量为20~255.6 m g/(m2·d)(表4)。对生物泵效率的估算可以用真光层以下生源颗粒物的输出通量来表示。虽然运用的方法不同,但不同的研究结果表明的南海生物泵的效率大致一致。
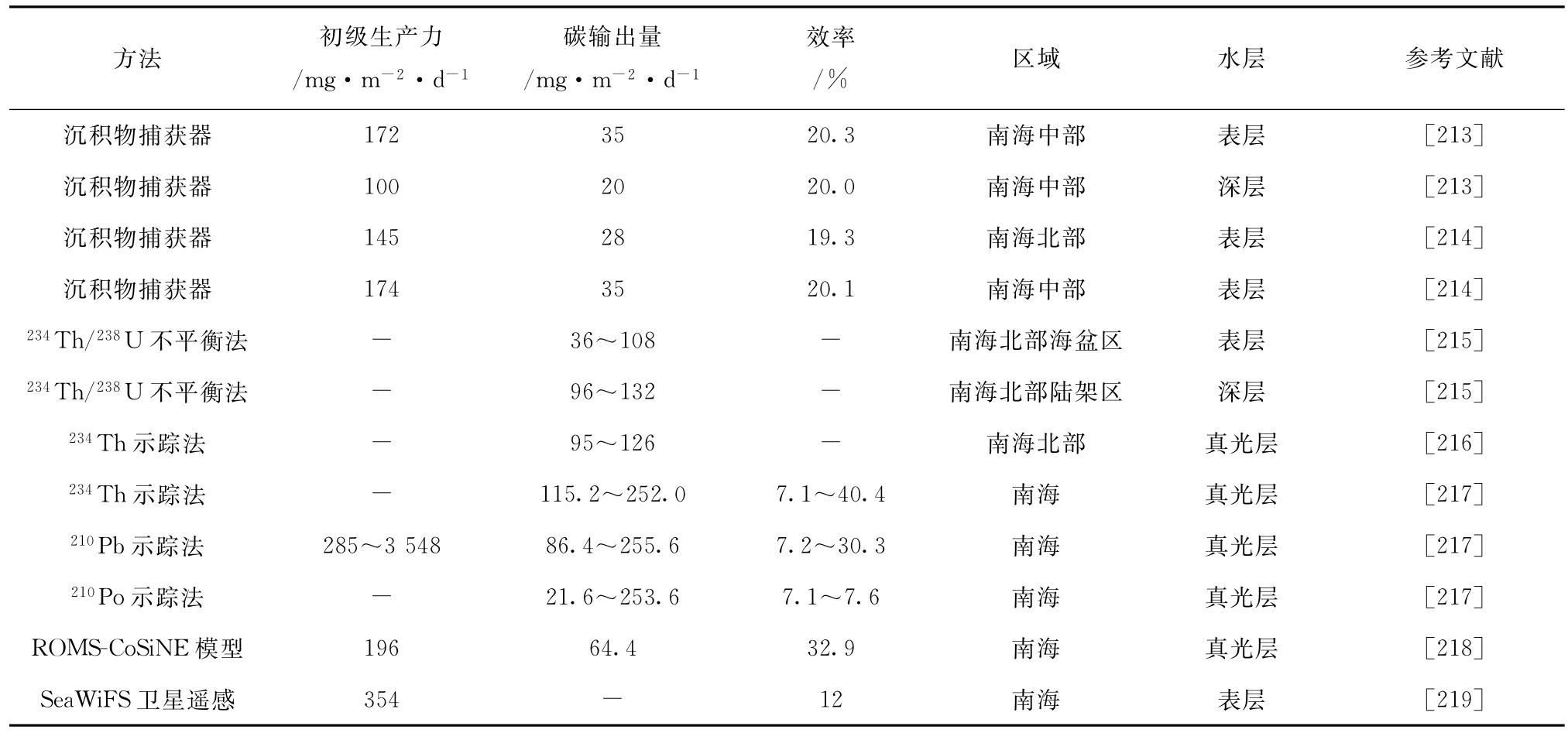
表4 南海生物泵效率历史资料统计Tab .4 The efficiency of the biological pump in the South China Sea
5.2南海生物泵模型
海洋生物泵模型主要基于物理环境条件,依据初级生产力、有机颗粒物质的沉降、食物网以及动物的垂直迁移等进行构建。最早的海洋生物泵模拟研究多采用初级生产力和输出生产力之间的经验关系,但其应用具有区域性,误差较大。随后的食物网结构模型对POC的输出通量显示较好的结果。物理-生物海洋生物泵模型连接物理、生态和碳循环过程,在时间上和空间上对碳通量进行估算,为研究调节海气界面C O2通量的变化因子提供良好的方法。Chai等建立R O M S-CoSIN E模型对南海的物理变化、生态响应和碳循环进行研究,表明南海是一个相对较弱的C O2源区域[220],其中微型浮游植物对初级生产力的贡献较大。M a等人建立三维物理-生物地球化学模型,研究南海浮游植物功能群和初级生产之间的关系,结果表明初级生产力主要受东亚季风的影响,其中硅藻对碳的贡献最大[221]。随着卫星遥感技术和计算机科学的发展,应用遥感技术对南海浮游植物生物量和初级生产力开展的研究较多[208]。Liu等人利用Sea W-iES卫星遥感资料建立三维数值模型,对南海的初级生产力进行估算,结果与现场观测一致[219]。
6 海洋生物泵与浮游植物
浮游植物在海洋生态系统中分布广泛,是海洋生物有机碳库的重要组成,在整个海洋生物泵过程中起到相当大的作用,一方面海洋浮游植物是海洋生源颗粒物最主要的起点,通过各种食物网过程,最终死亡的生物体或有机碎屑会在重力作用下沉降,即为“海洋生物泵”过程[5];另一方面它的生物量占到整个海洋颗粒物生物量的大部分,再一方面浮游植物几乎参与了整个生物泵的所有过程,此外,海洋碳酸盐反向泵主要受浮游植物中的一类重要功能群——今生颗石藻控制。因此,浮游植物在海洋生物泵中扮演举足轻重的角色,不同的浮游植物功能群对海区的碳贡献不同。
7 海洋生物泵的生态功能及研究前景
在地球过去的几十亿的时间里,海洋生物泵与全球气候之间相互作用、相互影响。海洋生物泵是全球碳循环的重要组成部分,调节上层海洋有机碳颗粒向下层海洋的传输,对维持大气C O2浓度具有重要作用。目前,对海洋生物泵组成结构和时空变化的研究有初步认识,主要是对浮游植物、海雪等颗粒物质的碳通量进行的估算,但是对于T EP的研究还很缺乏,今后需要更多的关注。尽管我们对海洋生物泵的功能有一定的研究,但是很难真正的去衡量生物泵的作用。深海有机碳的输出和埋藏是我们关注的重点,碳酸盐反向泵的作用机制也需要进一步的探索。因此,研究海洋生物泵的效率和机制是未来科研工作的重点,对于预测全球海洋变暖具有重要的意义。
参考文献:
[1]Ealkowski P,Scholes R,Boyle E,et al.The globalcarbon cycle:a test of our knowledge of earth as a system[J].Science,2000,290(5490):291 -296.
[2]Sarmiento J L,Gruber N.Ocean Biogeochemical Dynamics[M].Cambridge U niv Press,2006,503.
[3]Hansell D A,Carlson C A.Deep-ocean gradients in the concentration of dissolved organic carbon[J].Nature,1998,395(6699):263-266.
[4]Eglinton T,Repeta D.Organic matterin the contemporary ocean[M]//Treatise on Geochemistry.H olland H D,Turekian K K.The Oceans and M arine Geochemistry,Elsevier Pergamon,A msterdam,2004,6,145-180.
[5]孙军.海洋浮游植物与生物碳汇[J].生态学报,2011,31(18):5372-5378.Sun Jun.M arine phytoplankton and biological carbon sink[J].Acta Ecologica Sinica,2011,31(18):5372-5378.
[6]Passow U.Transparent exopolymer particles(T EP)in aquatic environ ments[J].Progress in Oceanography,2002,55(3/4):287-333.
[7]Reynolds C S,Jaworski G H M,C miech H A,et al.On the annualcycle ofthe blue-green alga Microcystis aeruginosa Kutz.emend.Elenkin[J].Philosophical Transactions of the Royal Society of London B:Biological Sciences,1981,293(1068):419-477.
[8]Stokes G G.On the effect of the internalfriction of fluids on the motion of pendulu ms[M].Cambridge:Pitt Press,1851.
[9]Reynolds C S.The ecology of phytoplankton[M].Cambridge:Cambridge U niversity Press,2006.
[10]Peperzak L,Colijn E,Koeman R,et al.Phytoplankton sinking rates in the Rhine region of freshwater influence[J].Journal of Plankton Research,2003,25(4):365-383.
[11]Gross E,Zeuthen E.The buoyancy of plankton diatoms:a problem of cell physiology[J].Proceedings ofthe Royal Society of London B:Biological Sciences,1948,135(880):382-389.
[12]Anderson L W J,Sweeney B M.Role ofinorganicionsin controlling sedimentation rate of a marine centric diatom ditylu m brightwell[J].Journal of Phycology,1978,14(2):204-214.
[13]Kahn N,Swift E.Positive buoyancy through ionic controlin the non motile marine dinoflagellate Pyrocystisnoctiluca M urray ex Schuett[J].Limnology and Oceanography,1978,23(4):649-658.
[14]M alins D C,Sargent J R.Biochemical and biophysical perspectives in marine biology[M].New York:Academic Press,1974.
[15]S mayda T J.The suspension and sinking of phytoplankton in the sea[J].Oceanography and M arine Biology,1970,8:353-414.
[16]Eogg G E,Thake B.Algal cultures and phytoplankton ecology[M].Wisconsin:U niversity of Wisconsin Press,1987.
[17]Belcher J H.Notes on the physiology of Botryococcus braunii Kützing[J].Archives of Microbiology,1968,61(4):335-346.
[18]Reynolds C S.The ecology of freshwater phytoplankton[M].Cambridge:Cambridge U niversity Press,1984.
[19]Dinsdale M T,W alsby A E.Theinterrelations of cellturgor pressure,gas-vacuolation,and buoyancy in a blue-green alga[J].Journal of Experimental Botany,1972,23(2):561-570.
[20]Thomas R H,W alsby A E.Buoyancy regulation in a strain of Microcystis[J].Microbiology,1985,131(4):799-809.
[21]Utkilen H C,Oliver R L,W alsby A E.Buoyancy regulation in a red Oscillatoria unable to collapse gas vacuoles by turgor pressure[J].Archiv für H ydrobiologie,1985,102(3):319-329.
[22]W alsby A E,Kinsman R,Ibelings B W,et al.Highly buoyant colonies of the cyanobacteriu m Anabaena-Lem mermanniiform persistent surface waterblooms[J].Archiv für H ydrobiologie,1991,121(3):261-280.
[23]W alsby A E.Gas vesicles[J].Microbiological Reviews,1994,58(1):94-144.
[24]Reynolds C S.Cyanobacterial water-blooms[J].Advances in Botanical Research,1987,13:67-143.
[25]Krom kamp J C,M ur L R.Buoyant density changesin the cyanobacteriu m Microcystisaeruginosa due to changesin the cellular carbohydrate content[J].EE M S Microbiology Letters,1984,25(1):105-109.
[26]W alsby A E.The properties and buoyancy-providing role of gas vacuolesin Trichodesmiu m Ehrenberg[J].British Phycological Journal,1978,13 (2):103-116.
[27]Pitcher G C,W alker D R,Mitchel-Innes B A.Phytoplankton sinking rate dynamicsin the southern Benguela upwelling system[J].M arine Ecology Progress Series,1989,55(2/3):261-269.
[28]Talling J E.U nderwater light climate as a controlling factorin the production ecology offreshwater phytoplankton[C]//Proceedings ofthe International Association of Theoretical and Applied Limnology Symposiu m,Eactors Regul W ax W ane Algal Pop.1971.
[29]Pollingher U.Ereshwater armored dinoflagellates:growth,reproduction strategies,and population dynamics[M]//Sandgren C.Growth and Reproductive Strategies of Ereshwater Phytoplankton.Cambridge:Cambridge U niversity Press,1988:134-174.
[30]S mayda T J.Turbulence,watermass stratification and harmful algal blooms:an alternative view and frontal zones as“pelagic seed banks”[J].Harmful Algae,2002,1(1):95-112.
[31]Som mer U.The periodicity of phytoplankton in Lake Constance(Bodensee)in comparison to other deep lakes of central Europe[J].H ydrobiologia,1986,138(1):1-7.
[32]Bienfang P,Laws E,Johnson W.Phytoplankton sinking rate determination:technical and theoretical aspects,an improved methodology[J].Journal of Experimental M arine Biology and Ecology,1977,30(3):283-300.
[33]Riley G A,Stom mel H M,Bu mpus D E.Quantitative ecology of the plankton of the western North Atlantic[M].Bingham:Bingham Oceano-graphic Laboratory,1949.
[34]S mayda T J,Boleyn B J.Experimental observations on the flotation of marine diatoms.Ⅰ.Thalassiosira nana,Thalassiosira rotula and Nitzschia seriata[J].Limnology and Oceanography,1965,10(4):499-509.
[35]S mayda T J,Boleyn B J.Experimental observations on the flotation of marine diatoms.Ⅱ.Skeletonema costatu m and Rhizosolenia setigera[J].Limnology and Oceanography,1966,11(1):18-34.
[36]S mayda T J,Boleyn B J.Experimental observations on the flotation of marine diatoms.Ⅲ.Bacteriastru m hyalinu m and Chaetoceros lauderi[J].Limnology and Oceanography,1966,11(1):35-43.
[37]Steele J H,Yentsch C S.The vertical distribution of chlorophyll[J].Journal of the M arine Biological Association of the U nited Kingdom,1960,39(2):217-226.
[38]Eppley R W,H olmes R W,Strickland J D H.Sinking rates of marine phytoplankton measured with a fluorometer[J].Journal of Experimental M arine Biology and Ecology,1967,1(2):191-208.
[39]Titman D.A fluorometric technique for measuring sinking rates of freshwater phytoplankton[J].Limnology and Oceanography,1975,20(5):869-875.
[40]Bienfang P K.SE T C O L-a technologically simple and reliable method for measuring phytoplankton sinking rates[J].Canadian Journal of Eisheries and Aquatic Sciences,1981,38(10):1289-1294.
[41]Lännergren C.Buoyancy of natural populations of marine phytoplankton[J].M arine Biology,1979,54(1):1-10.
[42]W aite A M,Nodder S D.The effect ofin situ iron addition on the sinking rates and exportflux of Southern Ocean diatoms[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2001,48(11/12):2635-2654.
[43]M ei Zhiping,Legendre L,Gratton Y,et al.Phytoplankton production in the North W ater Polynya:size-fractions and carbon fluxes,Aprilto July 1998[J].M arine Ecology Progress Series,2003,256:13-27.
[44]O’brien K R,W aite A M,Alexander B L,et al.Particle tracking in a salinity gradient:A method for measuring sinking rate ofindividual phytoplankton in the laboratory[J].Limnology and Oceanography:M ethods,2006,4(9):329-335.
[45]W alsby A E,H olland D P.Sinking velocities of phytoplankton measured on a stable density gradient by laser scanning[J].Journal of the Royal Society Interface,2006,3(8):429-439.
[46]Bach L T,Riebesell U,Sett S,et al.An approach for particle sinking velocity measurementsin the 3-400μm size range and considerations on the effect of temperature on sinking rates[J].M arine Biology,2012,159(8):1853-1864.
[47]Passow U.Species-specific sedimentation and sinking velocities of diatoms[J].M arine Biology,1991,108(3):449-455.
[48]M uggli D L,Lecourt M,Harrison P J.Effects ofiron and nitrogen source on the sinking rate,physiology and metalcomposition of an oceanic diatom from the subarctic Pacific[J].M arine Ecology Progress Series,1996,132(1):215-227.
[49]Anderson L,Sweeney B.Diel changes in sedimentation characteristics of Ditylum brightwelli:Changesin cellularlipid and effects of respiratory inhibitors and ion-transport modifiers[J].Limnol Oceanogr,1977,22(3):539-552.
[50]Bienfang P K,Harrison P J,Quarmby L M.Sinking rate response to depletion of nitrate,phosphate and silicatein four marine diatoms[J].M arine Biology,1982,67(3):295-302.
[51]Culver M E,S mith W O.Effects of environ mental variation on sinking rates of marine phytoplankton[J].Journal of Phycology,1989,25(2):262-270.
[52]Bienfang P K.Size structure and sinking rates of various microparticulate constituents in oligotrophic Hawaiian waters[J].M arine Ecology Progress Series,1985,23(2):143-151.
[53]Johnson T O,S mith W O.Sinking rates of phytoplankton assemblagesin the weddell sea marginalice-zone[J].M arine Ecology Progress Series,1986,33(2):131-137.
[54]Riebesell U.Comparison of sinking and sedimentation rate measurements in a diatom winter/spring bloom[J].M arine Ecology Progress Series,1989,54(1/2):109-119.
[55]W aite A,Bienfang P K,Harrison P J.Spring bloom sedimentation in a subarctic ecosystem.Ⅰ.Nutrient sensitivity[J].M arine Biology,1992,114(1):119-129.
[56]Titman D,Kilham P.Sinking in freshwater phytoplankton:some ecologicalimplications of cell nutrient status and physical mixing processes[J].Limnology and Oceanography,1976,21(3):409-417.
[57]Mcnown J S,M alaika J.Effects of particle shape on settling velocity atlow Reynolds nu mbers[J].Eos,Transactions A merican Geophysical U-nion,1950,31(1):74-82.
[58]H utchinson G E.A Treatise on Limnology.Ⅱ.Introduction to lake biology and their limnoplankton[M].New York:Wiley,1967.
[59]Komar P D.Settling velocities of circular cylinders at low Reynolds nu mbers[J].The Journal of Geology,1980,88(3):327-336.
[60]Davey M C,W alsby A E.The form resistance of sinking algal chains[J].British Phycological Journal,1985,20(3):243-248.
[61]Padisák J,Soróczki-Pintér É,Rezner Z.Sinking properties of some phytoplankton shapes and the relation ofform resistance to morphological diversity of plankton-an experimental study[J].H ydrobiologia,2003,500(1/3):243-257.
[62]H olland D P.Sinking rates of phytoplankton filaments orientated at different angles:theory and physical model[J].Journal of Plankton Research,2010,32(9):1327-1336.
[63]M orris I.The physiological ecology of phytoplankton[M].Oxford:Blackwell,1980.
[64]Lande R,W ood A M.Suspension times of particlesin the upper ocean[J].Deep-Sea Research Part A Oceanographic Research Papers,1987,34 (1):61-72.
[65]Ruiz J,García C M,Rodríguez J.Sedimentation loss of phytoplankton cells from the mixed layer:effects of turbulence levels[J].Journal of Plankton Research,1996,18(9):1727-1734.
[66]Ruiz J,M acías D,Peters E.Turbulence increases the average settling velocity of phytoplankton cells[J].Proceedings of the National academy of Sciences of the U nited States of A merica,2004,101(51):17720-17724.
[67]H uisman J,Som meijer B.M aximal sustainable sinking velocity of phytoplankton[J].M arine Ecology Progress Series,2002,244:39-48.
[68]M axey M R.The gravitational settling of aerosol particles in homogeneous turbulence and random flow fields[J].Journal of Eluid M echanics,1987,174:441-465.
[69]Turner J T,Eerrante J G.Zooplankton fecal pellets in aquatic ecosystems[J].BioScience,1979,29(11):670-677.
[70]张武昌,张芳,王克.海洋浮游动物粪便通量[J].地球科学进展,2001,16(1):113-119.Zhang W uchang,Zhang Eang,W ang Ke.M arine zooplankton fecal pellets flux[J].Advances in Earth Science,2001,16(1):113-119.
[71]Lane P V Z,S mith S L,Urban J L,et al.Carbon flux and recycling associated with zooplanktonicfecal pellets on the shelf ofthe Middle Atlantic Bight[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,1994,41(2/3):437-457.
[72]Møller E E,Borg C M A,Jónasdóttir S H,et al.Production and fate of copepod fecal pellets across the Southern Indian Ocean[J].M arine Biology,2011,158(3):677-688.
[73]Riser C W,W assmann P,Olli K,et al.Production,retention and export of zooplankton faecal pellets on and off the Iberian shelf,north-west Spain[J].Progress in Oceanography,2001,51(2/4):423-441.
[74]Riser C W,W assmann P,Olli K,et al.Seasonal variation in production,retention and export ofzooplankton faecal pelletsin the marginalice zone and central Barents Sea[J].Journal of M arine Systems,2002,38(1/2):175-188.
[75]W assmann P,Hansen L,Andreassen I J,et al.Distribution and sedimentation offaecal on the Nordvestbanken shelf,northern Norway,in 1994 [J].Sarsia,1999,84(3/4):239-253.
[76]Raymont J E G,Gross E.X X.On thefeeding and breeding of Calanusfinmarchicus underlaboratory conditions[J].Proceedings ofthe Royal Society of Edinburgh Section B Biology,1942,61(3):267-287.
[77]M arshall S M,Orr A P.On the biology of Calanusfinmarchicus VIII.Eood uptake,assimilation and excretion in adult and stage V Calanus[J].Journal of the M arine Biological Association of the U nited Kingdom,1955,34(3):495-529.
[78]Paffenhöfer G A,Knowles S C.Ecologicalimplications of fecal pellet size,production and consu mption by copepods[J].J M ar Res,1979,37 (1):35-49.
[79]Butler M,Dam H G.Production rates and characteristics offecal pellets ofthe copepod Acartiatonsa under simulated phytoplankton bloom conditions:implications for verticalfluxes[J].M arine Ecology Progress Series,1994,114(1/2):81-91.
[80]Corner E D S,Head R N,Kilvington C C.On the nutrition and metabolism of zooplankton.VIII.The grazing of Biddulphia cells by Calanus helgolandicus[J].Journal of the M arine Biological Association of the U nited Kingdom,1972,52(4):847-861.
[81]Ayukai T,Nishizawa S.Defecation rate as a possible measure ofingestion rate of Calanuspacificuspacificus(Copepoda:Calanoida)[J].Bulletin of the Plankton Society of Japan,1986,33(1):3-10.
[82]Gamble J C.Copepod grazing during a declining spring phytoplankton bloom in the northern North Sea[J].M arine Biology,1978,49(4):303-315.
[83]Poulsen L K,Kiørboe T.Verticalflux and degradation rates of copepod fecal pelletsin a zooplankton com munity dominated by smallcopepods[J].M arine Ecology Progress Series,2006,323:195-204.
[84]Erangoulis C,Belkhiria S,Goffart A,et al.Dynamics of copepod faecal pelletsin relation to a Phaeocystis dominated phytoplankton bloom:characteristics,production and flux[J].Journal of Plankton Research,2001,23(1):75-88.
[85]Juul-Pedersen T,Nielsen T G,Michel C,et al.Sedimentation following the spring bloom in Disko Bay,W est Greenland,with special emphasis on the role of copepods[J].M arine Ecology Progress Series,2006,314:239-255.
[86]Riser C W,Reigstad M,W assmann P,et al.Export or retention?Copepod abundance,faecal pellet production and verticalflux in the marginal ice zone through snap shots from the northern Barents Sea[J].Polar Biology,2007,30(6):719-730.
[87]Beau mont K L,Plu m mer A J,H osie G W,et al.Production and fate offaecal pellets during su m merin an East Antarctic fjord[J].H ydrobiologia,2001,453-454(1):55-65.
[88]Urban-Rich J L.Latitudinal variationsin the contribution by copepod fecal pellets to organic carbon and amino acid flux[M].College Park,M d.:U niversity of M aryland,1997.
[89]Blaxter J H,Douglas B,Tyler P A,et al.The biology of calanoid copepods:the biology of calanoid copepods[M].New York:Academic Press,1998.
[90]S mayda T J.Normal and accelerated sinking of phytoplankton in the sea[J].M arine Geology,1971,11(2):105-122.
[91]Turner J T.Sinking rates of fecal pellets from the marine copepod Pontella meadii[J].M arine Biology,1977,40(3):249-259.
[92]Yoon W,Kim S,Han K.M orphology and sinking velocities offecal pellets of copepod,molluscan,euphausiid,and salp taxa in the northeastern
tropical Atlantic[J].M arine Biology,2001,139(5):923-928.
[93]Eowler S W,S mall L E.Sinking rates of euphausiid fecal pellets[J].Limnology and Oceanography,1972,17(2):293-296.
[94]Bruland K W,Silver M W.Sinking rates offecal pellets from gelatinous zooplankton(salps,pteropods,doliolids)[J].M arine Biology,1981,63 (3):295-300.
[95]Deibel D.Still-water sinking velocity offecal materialfrom the pelagic tunicate Doliolettagegenbauri[J].M arine Ecology Progress Series,1990,62:55-60.
[96]Gorsky G,Eisher N S,Eowler S W.Biogenic debris from the pelagic tunicate,Oikopleura dioica,and its role in the vertical transport of a transuraniu m element[J].Estuarine,Coastal and Shelf Science,1984,18(1):13-23.
[97]Dilling L,Alldredge A L.Can chaetognath fecal pellets contribute significantly to carbon flux?[J].M arine Ecology Progress Series,1993,92:51-58.
[98]M adin L P.Production,composition and sedimentation of salp fecal pellets in oceanic waters[J].M arine Biology,1982,67(1):39-45.
[99]S mall L E,Eowler S W,Ünlü M Y.Sinking rates of natural copepod fecal pellets[J].M arine Biology,1979,51(3):233-241.
[100]Bienfang P K.Herbivore diet affects fecal pellet settling[J].Canadian Journal of Eisheries and Aquatic Sciences,1980,37(9):1352-1357.[101]Dagg M J,W alser Jr W E.The effect offood concentration on fecal pellet sizein marine copepods[J].Limnology and Oceanography,1986,31 (5):1066-1071.
[102]Tsuda A,Nemoto T.The effect offood concentration on the faecal pellet size of the marine copepod Pseudocalanus new mani Erost[J].Bulletin of the Plankton Society of Japan Hiroshima,1990,37(1):83-90.
[103]Bishop J K B,Edmond J M,Ketten D R,et al.The chemistry,biology,and verticalflux of particulate matter from the upper 400 m of the equatorial Atlantic Ocean[J].Deep-Sea Research,1977,24(6):511-548.
[104]Urrère M A,Knauer G A.Zooplankton fecal pellet fluxes and vertical transport of particulate organic materialin the pelagic environ ment[J].Journal of Plankton Research,1981,3(3):369-387.
[105]Eowler S W,S mall L E,Larosa J L.Seasonal particulate carbon flux in the coastal northwestern mediterranean-sea,and the role of zooplankton fecal matter[J].Oceanologica Acta,1991,14(1):77-85.
[106]Graf G.Benthic-pelagic coupling in a deep-sea benthic com munity[J].Nature,1989,341(6241):437-439.
[107]Pilskaln C H,H onjo S.Thefecal pelletfraction of biogeochemical particlefluxesto the deep sea[J].Global Biogeochemical Cycles,1987,1(1):31-48.
[108]M aita Y,Odate T,Yanada M.Verticaltransport of organic carbon by sinking particles and the role of zoo-and phytogenic mattersin neritic waters[J].Bulletin of the Eaculty of Eisheries H okkaido U niversity,1988,39(4):265-274.
[109]Asper V L.M easuring the flux and sinking speed of marine snow aggregates[J].Deep-Sea Research Part A Oceanographic Research Papers,1987,34(1):1-17.
[110]Taylor G T.Variability in the verticalflux of microorganisms and biogenic materialin the epipelagic zone of a North Pacific central gyre station [J].Deep Sea Research Part A Oceanographic Research Papers,1989,36(9):1287-1308.
[111]Roman M R,Gauzens A L.Copepod grazing in the equatorial Pacific[J].Limnology and Oceanography,1997,42(4):623-634.
[112]Roy S,Silverberg N,Romero N,et al.Importance of mesozooplankton feeding forthe downward flux of biogenic carbon in the Gulf of St.Lawrence(Canada)[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2000,47(3/4):519-544.
[113]S mall L E,Eowler S W,M oore S A,et al.Dissolved and fecal pellet carbon and nitrogen release by zooplankton in tropical waters[J].Deep Sea Research Part A Oceanographic Research Papers,1983,30(12):1199-1220.
[114]W assmann P,Ypma J E,Tselepides A.Verticalflux offaecal pellets and microplankton on the shelf ofthe oligotrophic Cretan Sea(N E M editerranean Sea)[J].Progress in Oceanography,2000,46(2/4):241-258.
[115]Lapoussière A,Michel C,Gosselin M,et al.Spatial variability in organic materialsinking exportin the H udson Bay system,Canada,during fall [J].Continental Shelf Research,2009,29(9):1276-1288.
[116]Juul-Pedersen T,Michel C,Gosselin M.Sinking export of particulate organic material from the euphotic zone in the eastern Beaufort Sea[J].M arine Ecology Progress Series,2010,410:55-70.
[117]Gleiber M R.Time series of verticalflux of zooplankton fecal pellets on the continental shelf of the western Antarctic Peninsula[D].Williamsburg:The College of William and M ary,2010.
[118]Ayukai T,Hattori H.Production and downward flux of zooplankton fecal pellets in the anticyclonic gyre off Shikoku,Japan[J].Oceanologica Acta,1992,15(2):163-172.
[119]Passow U,Shipe R E,M urray A,et al.The origin oftransparent exopolymer particles(T EP)and their rolein the sedimentation of particulate matter[J].Continental Shelf Research,2001,21(4):327-346.
[120]Olli K,W assmann P,Reigstad M,et al.The fate of production in the central Arctic Ocean-top-down regulation by zooplankton expatriates?[J].Progress in Oceanography,2007,72(1):84-113.
[121]Goldthwait S A,Steinberg D K.Elevated biomass of mesozooplankton and enhanced fecal pellet flux in cyclonic and mode-water eddies in the Sargasso Sea[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2008,55(10/13):1360-1377.
[122]Tamelander T,Aubert A,W exels Riser C.Export stoichiometry and contribution of copepod faecal pellets to verticalflux of particulate organiccarbon,nitrogen and phosphorus[J].M arine Ecology Progress Series,2012,459:17-28.
[123]Carroll M L,Miquel J C,Eowler S W.Seasonal patterns and depth-specific trends of zooplankton fecal pellet fluxesin the Northwestern M editerranean Sea[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1998,45(8):1303-1318.
[124]Miquel J C,Eowler S W,La Rosa J,et al.Dynamics of the downward flux of particles and carbon in the open northwestern M editerranean Sea [J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1994,41(2):243-261.
[125]Gowing M M,Garrison D L,Kunze H B,et al.Biological components of Ross Sea short-term particle fluxesin the austral su m mer of 1995-1996[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2001,48(12):2645-2671.
[126]M anno C,Tirelli V,Accornero A,et al.Importance of the contribution of Limacinahelicina faecal pellets to the carbon pu mp in Terra Nova Bay(Antarctica)[J].Journal of Plankton Research,2010,32(2):145-152.
[127]Lalande C,Bauerfeind E,Nöthig E M,et al.Impact of a warm anomaly on exportfluxes of biogenic matterin the eastern Eram Strait[J].Progress in Oceanography,2013,109:70-77.
[128]Turner J T.Zooplankton fecal pellets,marine snow,phytodetritus and the ocean’s biological pu mp[J].Progressin Oceanography,2015,130:205-248.
[129]Turner J T.Zooplankton fecal pellets,marine snow and sinking phytoplankton blooms[J].Aquatic Microbial Ecology,2002,27(1):57-102.
[130]Svensen C,Riser C W,Reigstad M,et al.Degradation of copepod faecal pellets in the upper layer:Role of microbial com munity and Calanus finmarchicus[J].M arine Ecology Progress Series,2012,462:39-49.
[131]Gowing M M,Wishner K E.Trophic relationships of deep-sea calanoid copepods from the benthic boundary layer of the Santa Catalina Basin,California[J].Deep-Sea Research Part A Oceanographic Research Papers,1986,33(7):939-961.
[132]Green E P,Harris R P,Duncan A.The production and ingestion offaecal pellets by nauplii of marine calanoid copepods[J].Journal of Plankton Research,1992,14(12):1631-1643.
[133]Lampitt R S,Noji T,Von Bodungen B.W hat happens to zooplankton faecal pellets?Implications for materialflux[J].M arine Biology,1990,104(1):15-23.
[134]González H E,S metacek V.The possible role ofthe cyclopoid copepod Oithonain retarding verticalflux of zooplankton faecal material[J].M arine Ecology Progress Series,1994,113(3):233-246.
[135]Svensen C,Nejstgaard J C.Is sedimentation of copepod faecal pellets determined by cyclopoids?Evidence from enclosed ecosystems[J].Journal of Plankton Research,2003,25(8):917-926.
[136]Noji T T,Estep K W,M acintyre E,et al.Image analysis offaecal material grazed upon by three species of copepods:evidence for coprorhexy,coprophagy and coprochaly[J].Journal of the M arine Biological Association of the U nited Kingdom,1991,71(2):465-480.
[137]Alldredge A L,Passow U,Logan B E.The abundance and significance of a class oflarge,transparent organic particlesin the ocean[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1993,40(6):1131-1140.
[138]孙军.海洋中的凝集网与透明胞外聚合颗粒物[J].生态学报,2005,25(5):1191-1198.Sun Jun.Transparent Exopolymer Particles(T EP)and aggregation web in marine environ ments[J].Acta Ecologica Sinica,2005,25(5):1191 -1198.
[139]Engel A.Carbon and nitrogen content of transparent exopolymer particles(T EP)in relation to their Alcian Blue adsorption[J].M ar Ecol Prog Ser,2001,219(8):1-10.
[140]M ari X,Kiørboe T.Abundance,size distribution and bacterial colonization of transparent exopolymeric particles(T EP)during spring in the Kattegat[J].Journal of Plankton Research,1996,18(6):969-986.
[141]H ong Y,S mith W O,W hite A M.Studies on transparent exopolymer particles(T EP)produced in the ross sea(Antarctica)and by Phaeocystis Antarctica(Prymnesiophyceae)[J].Journal of Phycology,1997,33(3):368-376.
[142]Alldredge A L,Passow U,Haddock H D.The characteristics and transparent exopolymer particle(T EP)content of marine snow formed from thecate dinoflagellates[J].Journal of Plankton Research,1998,20(3):393-406.
[143]Berman T,Viner-M ozzini Y.Abundance and characteristics of polysaccharide and proteinaceous particlesin Lake Kinneret[J].Aquatic Microbial Ecology,2001,24(3):255-264.
[144]Grossart H P,Simon M,Logan B E.Eormation of macroscopic organic aggregates(lake snow)in a large lake:the significance of transparent exopolymer particles,plankton,and zooplankton[J].Limnology and Oceanography,1997,42(8):1651-1659.
[145]Riley G A.Organic aggregates in seawater and the dynamics of their formation and utilization[J].Limnology and Oceanography,1963,8(4):372-381.
[146]Johnson B D,Cooke R C.Organic particle and aggregateformation resulting from the dissolution of bubblesin seawater[J].Limnology and Oceanography,1980,25(4):653-661.
[147]Leppard G G,W est M M,Elannigan D T,et al.A classification scheme for marine organic colloids in the Adriatic Sea:colloid speciation by transmission electron microscopy[J].Canadian Journal of Eisheries and Aquatic Sciences,1997,54(10):2334-2349.
[148]Leppard G G.The characterization of algal and microbial mucilages and their aggregatesin aquatic ecosystems[J].Science ofthe Total Environment,1995,165(1/3):103-131.
[149]Leppard G G,Heissenberger A,Herndl G J.Ultrastructure of marine snow.I.Transmission electron microscopy methodology[J].M arine E-cology Progress Series,1996,135:289-298.
[150]Leppard G G,M assalski A,Lean D R S.Electron-opaque microscopic fibrils in lakes:their demonstration,their biological derivation and their potential significance in the redistribution of cations[J].Protoplasma,1977,92(3/4):289-309.
[151]Stoderegger K,Herndl G J.Production and release of bacterial capsular material and its subsequent utilization by marine bacterioplankton[J].Limnology and Oceanography,1998,43(5):877-884.
[152]Baldi E,Minacci A,Saliot A,et al.Celllysis and release of particulate polysaccharidesin extensive marine mucilage assessed by lipid biomarkers and molecular probes[J].M ar Ecol Prog Ser,1997,153:45-57.
[153]Shibata A,Kogure K,Koike I,et al.Eormation of sub micron colloidal particlesfrom marine bacteria by viralinfection[J].M arine Ecology Progress Series,1997,155:303-307.
[154]W ells M L,Goldberg E D.Colloid aggregation in seawater[J].M arine Chemistry,1993,41(4):353-358.
[155]Kepkay P E.Particle aggregation and the biological reactivity of colloids[J].M arine Ecology Progress Series,1994,109:293-304.
[156]Chin W C,Orellana M V,Verdugo P.Spontaneous assembly of marine dissolved organic matter into polymer gels[J].Nature,1998,391 (6667):568-572.
[157]Passow U.Distribution,size,and bacterial colonization of transparent exopolymer particles(T EP)in the ocean[J].M ar Ecol Prog Ser,1994,113:185-198.
[158]Passow U,Alldredge A L.Aggregation of a diatom bloom in a mesocosm:The role of transparent exopolymer particles(T EP)[J].Deep-Sea Research Part II:Topical Studies in Oceanography,1995,42(1):99-109.
[159]Grossart H P,Simon M.Bacterialcolonization and microbial decomposition oflimnetic organic aggregates(lake snow)[J].Aquatic Microbial E-cology,1998,15(2):127-140.
[160]Kozlowski W,Vernet M,Lamerdin S.Predominance of cryptomonads and diatomsin Antarctic coastal waters[J].Antarctic Journal ofthe U nited States,1995,30:267-268.
[161]Passow U,Kozlowski W,Vernet M.Distribution of Transparent Exopolymer Particles(T EP)during su m mer at a permanent station in Antarctica[J].Antarctic Journal of the U nited States,1995,30:265-266.
[162]Schuster S,Herndl G J.Eormation and significance of transparent exopolymer particles in the Northern Adriatic Sea[J].M arine Ecology Progress Series,1995,124(1/3):227-236.
[163]Ramaiah N,Yoshikawa T,Euruya K.Temporal variationsin transparent exopolymer particles(T EP)associated with a diatom spring bloom in a subarctic ria in Japan[J].M arine Ecology Progress Series,2001,212(1):79-88.
[164]Wild C.Effekte von“marine snow”-Sedimentation auf Steinkorallen(Hexacorallia,Scleractinia)des Great Barrier Reef,Australia[D].Bremen:U niversity of Bremen,Dept of Biology and Chemistry,2000.
[165]Passow U,Alldredge A L.A dye-binding assay forthe spectrophotometric measurement oftransparent exopolymer particles(T EP)[J].Limnology and Oceanography,1995,40(7):1326-1335.
[166]M ari X,Dam H G.Production,concentration,andisolation oftransparent exopolymeric particles using paramagneticfunctionalized microspheres [J].Limnology and Oceanography,2004,2(1):13-24.
[167]M ari X,Burd A.Seasonalsize spectra oftransparent exopolymeric particles(T EP)in a coastalsea and comparison with those predicted using coagulation theory[J].M arine Ecology Progress Series,1998,163:63-76.
[168]Krembs C E,Eicken H,Junge K,et al.High concentrations of exopolymeric substancesin Arctic winter seaice:implicationsforthe polar ocean carbon cycle and cryoprotection of diatoms[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2002,49(12):2163-2181.
[169]Engel A.Direct relationship between C O2uptake and transparent exopolymer particles production in natural phytoplankton[J].Journal of Plankton Research,2002,24(1):49-53.
[170]García C M,Prieto L,Vargas M,et al.H ydrodynamics and the spatial distribution of plankton and T EP in the Gulf of Cádiz(S W Iberian Peninsula)[J].Journal of Plankton Research,2002,24(8):817-833.
[171]Eabricius K E,Wild C,W olanski E,et al.Effects of transparent exopolymer particles and muddy terrigenous sediments on the survival of hard coral recruits[J].Estuarine,Coastal and Shelf Science,2003,57(4):613-621.
[172]Engel A.Distribution of transparent exopolymer particles(T EP)in the northeast Atlantic Ocean and their potential significance for aggregation processes[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2004,51(1):83-92.
[173]Radifl T,Kraus R,Euks D,et al.Transparent exopolymeric particles’distribution in the northern Adriatic and their relation to microphytoplankton biomass and composition[J].Science of the Total Environ ment,2005,353(1/3):151-161.
[174]Corzo A,Rodríguez-Gálvez S,Lubian L,et al.Spatial distribution of transparent exopolymer particles in the Bransfield Strait,Antarctica[J].Journal of Plankton Research,2005,27(7):635-646.
[175]Prieto L,Navarro G,Cózar A,et al.Distribution of T EP in the euphotic and upper mesopelagic zones ofthe southern Iberian coasts[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2006,53(11/13):1314-1328.
[176]Bhaskar P V,Bhosle N B.Dynamics of transparent exopolymeric particles(T EP)and particle-associated carbohydratesin the Dona Paula bay,west coast of India[J].Journal of Earth System Science,2006,115(4):403-413.
[177]彭安国,黄奕普.九龙江河口区T EP及其与铀、钍、钋同位素相关性的研究[J].厦门大学学报:自然科学版,2007,46(增刊1):38-42.Peng Anguo,H uang Yipu.Study on T EP and its relationships with uraniu m,thoriu m,poloniu m isotopesin Jiulong estuary[J].Journal of Xiamen U niversity(Natural Science),2007,46(S1):38-42.
[178]Ortega-Retuerta E,Reche I,Pulido-Villena E,et al.U ncoupled distributions oftransparent exopolymer particles(T EP)and dissolved carbohydrates in the Southern Ocean[J].M arine Chemistry,2009,115(1/2):59-65.
[179]W etz M S,Robbins M C,Paerl H W.Transparent Exopolymer Particles(T EP)in a river-dominated estuary:spatial-temporal distributions and an assessment of controls upon T EP formation[J].Estuaries&Coasts,2009,32(3):447-455.
[180]孙翠慈,王友绍,吴梅林,等.夏季珠江口透明胞外聚合颗粒物分布特征[J].热带海洋学报,2010,29(5):81-87.Sun Cuici,W ang Youshao,W u M eilin,et al.Distribution oftransparent exopolymer particlesin the Pearl River Estuary in su m mer[J].Jouenal of Tropical Oceanography,2010,29(5):81-87.
[181]M ari X.Carbon content and C:N ratio oftransparent exopolymeric particles(T EP)produced by bubbling exudates of diatoms[J].M arine Ecology Progress Series,1999,183(3):59-71.
[182]Sun C C,W ang Y S,Li Q P,et al.Distribution characteristics oftransparent exopolymer particlesin the Pearl River estuary,China[J].Journal of Geophysical Research Biogeosciences,2012,117(G4):200-209.
[183]Alldredge A L,Silver M W.Characteristics,dynamics and significance of marine snow[J].Progressin Oceanography,1988,20(1):41-82.
[184]Simon M,Grossart H P,Schweitzer B,et al.Microbial ecology of organic aggregates in aquatic ecosystems[J].Aquatic Microbial Ecology,2002,28(2):175-211.
[185]Pilskaln C H,Villareal T A,Dennett M,et al.High concentrations of marine snow and diatom algal matsin the North Pacific Subtropical Gyre:Implications for carbon and nitrogen cycles in the oligotrophic ocean[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2005,52 (12):2315-2332.
[186]Shanks A L.The abundance,verticalflux,and still-water and apparent sinking rates of marine snow in a shallow coastal water colu mn[J].Continental Shelf Research,2002,22(14):2045-2064.
[187]Stem mann L,Prieur L,Legendre L,et al.Effects offrontal processes on marine aggregate dynamics and fluxes:An interannual study in a permanent geostrophic front(N W M editerranean)[J].Journal of M arine Systems,2008,70(1/2):1-20.
[188]Alldredge A L.The contribution of discarded appendicularian houses to the flux of particulate organic carbon from oceanic surface waters[M]//Gorsky G,Youngbluth M J,Deibel D.Response of M arine Ecosystems to Global Change:Ecological Impact of Appendicularians.Paris:G B Scientific Publisher,2005:309-326.
[189]Prairie J C,Ziervogel K,Arnosti C,et al.Delayed settling of marine snow at sharp density transitions driven by fluid entrain ment and diffusionlimited retention[J].M ar Ecol Prog Ser,2013,487:185-200.
[190]Goldthwait S,Yen J,Brown J,et al.Quantification of marine snow fragmentation by swim ming euphausiids[J].Limnology and Oceanography,2004,49(4):940-952.
[191]Lombard E,Kiørboe T.M arine snow originating from appendicularian houses:age-dependent settling characteristics[J].Deep-Sea Research Part I:Oceanographic Research Papers,2010,57(10):1304-1313.
[192]Lyons M M,Dobbs E C.Differential utilization of carbon substrates by aggregate-associated and water-associated heterotrophic bacterialcom munities[J].H ydrobiologia,2012,686(1):181-193.
[193]Lyons M M,Lau Y T,Carden W E,et al.Characteristics of marine aggregates in shallow-water ecosystems:implications for disease ecology [J].Eco Health,2007,4(4):406-420.
[194]Kiørboe T.Colonization of marine snow aggregates by invertebrate zooplankton:abundance,scaling,and possible role[J].Limnology and Oceanography,2000,45(2):479-484.
[195]Green E P,Dagg M J.M esozooplankton associations with mediu m to large marine snow aggregatesin the northern Gulf of M exico[J].Journal of Plankton Research,1997,19(4):435-447.
[196]Dilling L,Brzezinski M A.Quantifying marine snow as a food choice for zooplankton using stable silicon isotope tracers[J].Journal of Plankton Research,2004,26(9):1105-1114.
[197]Sano M,M aki K,Nishibe Y,et al.Eeeding habits of mesopelagic copepodsin Sagami Bay:Insightsfrom integrative analysis[J].Progressin O-ceanography,2013,110:11-26.
[198]Goldthwait S A,Carlson C A,Henderson G K,et al.Effects of physicalfragmentation on remineralization of marine snow[J].M arine Ecology Progress Series,2005,305:59-65.
[199]Larson E T,Shanks A L.Consu mption of marine snow by two species ofjuvenile mullet andits contribution to their growth[J].M arine Ecology Progress Series,1996,130(1):19-28.
[200]Kamjunke N,M ehner T.Coupling the microbialfood web with fish:are bacteria attached to cyanobacteria an important food source for underyearling roach?[J].Ereshwater Biology,2001,46(5):633-639.
[201]Newell C R,Pilskaln C H,Robinson S M,et al.The contribution of marine snow to the particle food supply of the benthic suspension feeder,Mytilusedulis[J].Journal of Experimental M arine Biology and Ecology,2005,321(2):109-124.
[202]Kach D J,W ard J E.The role of marine aggregatesin theingestion of picoplankton-size particles by suspension-feeding molluscs[J].M arine Biology,2008,153(5):797-805.
[203]W ard J E,Kach D J.M arine aggregates facilitateingestion of nanoparticles by suspension-feeding bivalves[J].M arine Environ mental Research,2009,68(3):137-142.
[204]Jordan R W,Kleijne A.A classification system for living coccolithophores[M]//Winter A,Siesser W G.Coccolithophores.Cambridge:Cambridge U niversity Press,1994:83-105.
[205]孙军.今生颗石藻的有机碳泵和碳酸盐反向泵[J].地球科学进展,2007,22(12):1231-1239.Sun Jun.Organic carbon pu mp and carbonate counter pu mp ofliving coccolithophorid[J].Advances in Earth Science,2007,22(12):1231-1239.
[206]Bau mann K H,Böckel B,Erenz M.Coccolith contribution to South Atlantic carbonate sedimentation[M].Coccolithophores.Springer.2004:367-402.
[207]Balch W M,Kilpatrick K.Calcification ratesin the equatorial Pacific along 140 W[J].Deep-Sea Research PartⅡ:Topical Studiesin Oceanography,1996,43(4):971-993.
[208]De Vargas C,Aubry P,Probert I,et al.Origin and Evolution of Coccolithophores:Erom Coastal H unters to Oceanic Earmers[J].Evolution of primary producers in the sea,2007,12:251-285.
[209]Passow U,Carlson C A.The biological pu mp in a high C O2 world[J].M ar Ecol Prog Ser,2012,470(2):249-271.
[210]Schneider B,Bopp L,Gehlen M.Assessing the sensitivity of modeled air-sea C O2exchange to the remineralization depth of particulate organic and inorganic carbon[J].Global Biogeochemical Cycles,2008,22(3):1-13.
[211]Rost B,Riebesell U.Coccolithophores and the biological pu mp:responses to environ mental changes[M].Coccolithophores.Springer.2004:99 -125.
[212]Salter I,Schiebel R,Ziveri P,et al.Carbonate counter pu mp stimulated by naturaliron fertilization in the Polar Erontal Zone[J].Nature Geoscience,2014,7(12):1-5.
[213]王汝建,林隽,郑连福,等.1993~1995年南海中部的硅质生物通量及其季节性变化:季风气候和El Niňo的响应[J].科学通报,2000,45(9):974-978.W ang Rujian,Lin Jun,Zhang Lianfu,et al.Siliceous microplankton fluxes and seasonal variationsin the central South China Sea during 1993—1995:monsoon climate and El Niňo responses[J].Chinese Science Bulletin,2000,45(23):2168-2172.
[214]陈建芳,郑连福,Wiesner M G,等.基于沉积物捕获器的南海表层初级生产力及输出生产力估算[J].科学通报,1998,43(6):639-642.Chen Jianfang,Zheng Lianfu,Wiesner M G,et al.Estimations of primary production and export production in the South China Sea based on sediment trap experiments[J].Chinese Science Bulletin,1998,43(7):583-586.
[215]陈蔚芳.南海北部颗粒有机碳输出通量、季节变化及其调控过程[D].厦门:厦门大学,2008.Chen W eifang.On the export flux,seasonality and controls of particulate organic carbon in the northern South China Sea[D].Xiamen:Xiamen U niversity,2008.
[216]H ung C C,Gong G C.POC/234Th ratios in particles collected in sediment traps in the northern South China Sea[J].Estuarine,Coastal and Shelf Science,2010,88(3):303-310.
[217]W ei C L,Lin S Y,Sheu D D,et al.Particle-reactive radionuclides(234Th,210Pb,210Po)astracersforthe estimation of export production in the South China Sea[J].Biogeosciences,2011,8(12):3793-3808.
[218]Liu Guimei,Chai Eei.Seasonalandinterannual variability of primary and export production in the South China Sea:a three-dimensional physicalbiogeochemical model study[J].ICES Journal of M arine Science,2009,66(2):420-431.
[219]Liu K K,Chao S Y,Shaw P T,et al.M onsoon-forced chlorophyll distribution and primary production in the South China Sea:observations and a nu merical study[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2002,49(8):1387-1412.
[220]Chai E,Liu G,Xue H,et al.Seasonal and interannual variability of carbon cyclein South China Sea:A three-dimensional physical-biogeochemical modeling study[J].Journal of Oceanography,2009,65(5):703-720.
[221]M a W,Chai E,Xiu P,et al.M odeling thelong-term variability of phytoplankton functional groups and primary productivity in the South China Sea[J].Journal of oceanography,2013,69(5):527-544.
Progressin oceanic biological pump
Sun Jun1,2,Li Xiaoqian1,2,Chen Jianfang3,4,Guo Shujin1,2
(1.Collegeof Marine and Environmental Sciences,Tianjin University of Science and Technology,Tianjin 300457,China;2.Tianjin Key Laboratory of Marine Resourcesand Chemistry,Tianjin University of Science and Technology,Tianjin 300457,China;3.State Oceanic Administration Key Laboratory of Marine Ecosystemsand Biogeochemistry,SecondInstituteof Oceanography,State Oceanic Administration,Hangzhou 310012,China;4.State Key Laboratory of Satellite Ocean Environment Dynamics,Second Institute of Oceanography,State Oceanic Administration Hangzhou 310012,China)
Abstract:Oceanic biological pu mp,as an important component of oceanic carbon cycle,transfers the atmospheric carbon into the deep ocean.In this paper,the processesin oceanic carbon sink and biological pu mp are discussed,including sinking of phytoplankton cells,zooplankton fecal pellet package effects,transparent exopolymer particles (T EP)sinking,marine snow sinking and carbonate counter pu mp.M eanwhile,the present paper attempts to state the progress and perspectives ofthe biological pu mp in the South China Sea,which contributes to the carbon cycle in China Seas.
Key words:biological pu mp;the South China Sea;carbon cycle
作者简介:孙军(1972—),甘肃省华亭县人,教授,从事海洋生态学研究。E-mail:phytoplankton@163.com
基金项目:国家重点基础研究发展计划(2015CB954002);全球变化与海气相互作用专项(G ASI-03-01-03-03);教育部新世纪优秀人才计划(N CE T-12-1065);国家自然科学基金(91128212,41176136,41276124,41306118)。
收稿日期:2016-01-20;
修订日期:2016-03-31。
中图分类号:Q948.8
文献标志码:A
文章编号:0253-4193(2016)04-0001-21
