白细胞介素1β和核因子κB相关免疫通路在冠状动脉粥样硬化性心脏病合并抑郁中的作用
2016-05-28潘江其唐鲜娥马文林石炜祺赵翠梅
潘江其 于 璐 唐鲜娥 马文林 石炜祺 邓 良 赵翠梅 杨 凡
200092上海,同济大学医学院(潘江其,于 璐,唐鲜娥);200065上海,同济大学附属同济医院心内科
白细胞介素1β和核因子κB相关免疫通路在冠状动脉粥样硬化性心脏病合并抑郁中的作用
潘江其于璐唐鲜娥马文林石炜祺邓良赵翠梅杨凡
200092上海,同济大学医学院(潘江其,于 璐,唐鲜娥);200065上海,同济大学附属同济医院心内科
【摘要】目的:通过检测冠状动脉粥样硬化性心脏病(coronary artery disease, CAD)合并抑郁患者的免疫功能,探索疾病之间的免疫学关系。方法:连续收集173例CAD患者,运用患者健康量表-9(patient health questionnaire-9, PHQ-9)对已确诊的CAD患者进行抑郁症状评估。根据PHQ-9评分将患者分为情绪正常组(0≤PHQ-9评分<5)、轻度抑郁组(5≤PHQ-9评分<10分)、中度抑郁组(10≤PHQ-9评分≤14分)、中重度及重度抑郁组(15≤PHQ-9评分≤27),同期检测所有入组者免疫功能指标。将不同程度抑郁患者血清与人脐静脉内皮细胞(HUVEC)共培养,采用荧光素酶报告基因检测系统检测白细胞介素1β(IL-1β)和核因子κB(NF-κB)基因表达量的变化。结果:CAD伴中重度以上抑郁患者的 IL-1β血清水平[11.73(9.40,17.46) ng/L]显著高于轻度抑郁[8.97(6.07, 11.28)ng/L]及情绪正常患者[8.14(6.17, 9.80)ng/L], P<0.05。CAD伴中重度抑郁患者的血清可激活HUVEC细胞,且其IL-1β、NF-κB基因表达水平显著升高。结论:炎性免疫机制可能为CAD与伴发抑郁之间的内在联系之一,IL-1β、NF-κB相关免疫通路可能为核心机制。
【关键词】冠状动脉粥样硬化性心脏病;抑郁;白细胞介素-1β
抑郁是冠状动脉粥样硬化性心脏病(CAD)的独立危险因子,可显著降低患者的生活质量,增加CAD发病率和死亡率[1-3]。CAD合并抑郁尚缺乏有效治疗方法,其发病机制尚未阐明。研究显示,CAD和抑郁患者均伴有免疫反应异常[4-5]。本研究通过检测CAD合并抑郁患者的免疫功能,在细胞水平探讨两者的免疫学联系。
1对象及方法
1.1研究对象
连续收集2011年1月至2014年5月在同济大学附属同济医院心内科住院的CAD患者173例,平均年龄(68.20±11.02)岁,男性112例(64.7%)。入选标准:(1)CAD诊断标准遵循指南,即冠状动脉造影显示冠状动脉狭窄程度>50%,或既往有明确心肌梗死病史;(2)合并抑郁标准为患者健康量表-2(patient health questionnaire-2,PHQ-2)中任一个问题回答“是”。排除标准:(1)既往有精神疾病史,认知功能异常;(2)有自杀倾向;(3)严重肝肾功能不全;(4)单纯焦虑状态;(5)左室射血分数<45%,血流动力学不稳定;(6)急、慢性炎性免疫性疾病;(7)活动性肝病或不明原因血氨基转移酶持续升高以及出凝血功能障碍;(8)甲状腺功能减退。
1.2研究方法
1.2.1CAD患者抑郁筛查及抑郁程度评估使用PHQ-2对所有入组的CAD患者进行抑郁筛查,对其中任何1个问题回答“是”则提示该患者有抑郁症状。抑郁程度评估依据PHQ-9评分标准,将研究对象分为情绪正常组(PHQ-9评分<5分)、轻度抑郁组(PHQ-9评分为5~9分)、中度抑郁组(PHQ-9评分为10~14分)、中重度及重度抑郁组(PHQ-9评分15~27分)[6]。
1.2.2免疫功能检测患者病情稳定后,于清晨抽取空腹静脉血,以乙二胺四乙酸-钠盐(EDTA-Na)抗凝管于-80℃保存。采用免疫比浊法分析免疫球蛋白(Ig)G、IgM、IgA、补体3(C3)、补体4(C4),采用化学发光免疫分析白细胞介素(IL)-1β、IL-2、IL-4、IL-6、肿瘤坏死因子α(TNF-α),流式细胞术测定白细胞分化抗原(CD)3、CD4、CD8、CD4/CD8、自然杀伤细胞(NK)、CD19、CD25、CD28。1.2.3细胞实验包括转染质粒构建、细胞培养以及转染后荧光素酶报告基因检测3个部分。分别从人基因组中扩增IL-1β及核因子κB(NF-κB)DNA启动子序列,克隆至pGL3荧光素酶报告载体中。IL-1β正向引物序列为CGC CTCGAG CTGGAGCAGGCACTTTGCTGGTGTC, IL-1β反向引物序列为CGC CTCGAG GTGCCTTGTGCCTCGAAGAGGTTTG。NF-κB质粒由杨江华实验室惠赠。在24孔培养板中,利用含10%胎牛血清的DMEM高糖培养基培养人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)。当每孔细胞数为4×104时进行质粒转染,每孔细胞转染液包含100 μL的Opti-MEM培养液,200 ng的pGL3荧光素酶报告载体,以10 ng的海胆荧光素酶报告基因作为对照,用Lipofectamine 2000转染试剂(Invitrogen, Carlsbad, CA)进行转染。转染报告质粒后,取10 μL各组患者血清,加入细胞培养皿中共培养。最后通过双荧光素酶报告基因检测系统 (http://www.promega.com)检测细胞裂解产物中IL-1β和NF-κB荧光素酶的活性。
1.3统计学分析

2结果
2.1一般资料
在173例CAD患者中,急性心肌梗死者61例(男性72.0%),不稳定心绞痛69例(男性63.7%),稳定心绞痛43例(男性53.5%)。其中伴高血压者140例(80.9%),糖尿病者71例(40.6%),高脂血症者73例(41.7%)。入组CAD患者中情绪正常患者90例,平均年龄(67.04±10.41)岁,构成比52.0%,男性70.0%;轻度抑郁患者47例,平均年龄(68.36±11.99)岁,构成比27.1%,男性55.3%;中度抑郁患者23例,平均年龄(72.30±10.04)岁,构成比13.3%,男性65.2%;中重度及重度抑郁组13例,平均年龄(68.33±12.68)岁,构成比7.5%,男性61.5%。4组患者年龄、性别、既往病史、家族史、CAD严重程度均无显著性差异。
2.2CAD与抑郁的免疫学关系
4组患者的IL-1β水平有显著差异,在CAD合并抑郁患者中, 血清IL-1β水平随抑郁程度的增加而升高。其中CAD伴中重度以上抑郁患者的血清IL-1β水平显著高于轻度抑郁及情绪正常患者(P<0.05)。其他免疫功能指标IgG、IgM、IgA、IL-2、IL-4、IL-6、TNF-α、C3、C4、活化T细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+、NK细胞(CD16+CD56+)、CD19+、 CD25+、CD28+在4组患者中均无统计学差异(P均>0.05,见表1)。

表1 不同程度抑郁CAD患者与CAD情绪正常患者免疫功能指标的比较
2.3细胞内炎性免疫通路的表达
荧光素酶报告基因分析显示,加入中度抑郁及以上的CAD患者血清共培养后,HUVEC细胞IL-1β和NF-κB基因表达水平显著升高(见图1)。
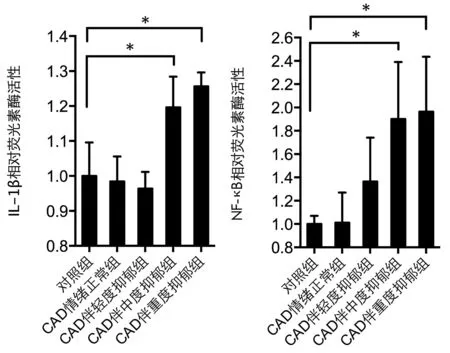
注:*P<0.05图1 不同抑郁组患者血清与HUVEC细胞共培养后IL-1β和NF-κB表达水平的变化
3讨论
CAD合并抑郁的发病机制有多种假说,其中炎症反应机制为研究的热点之一,但仍有一定争议[7-11]。本研究显示,CAD伴抑郁患者的IL-1β水平显著高于CAD情绪正常者,且随抑郁程度增加而升高,这与Dowlati等[12]的研究结果一致。有多项研究显示,CAD伴抑郁患者血清TNF-α、IL-6显著升高[13-15],而本研究并未观察到了TNF-α、IL-6、IL-2、IL-4的组间差异。这可能与各研究的入选患者种族、入组标准、抑郁评价方法、生物指标检测方法等不同有关。CAD伴抑郁患者的血清可激活HUVEC细胞IL-1β的基因表达及NF-κB信号通路,且IL-1β及NF-κB表达水平随抑郁程度的增加而升高。
IL-1β主要来自于激活的单核/巨噬细胞、上皮细胞和内皮细胞,是重要的前炎症细胞因子,在细胞功能调节和免疫炎症反应等过程中发挥重要作用[16]。有研究发现,氟西汀难治性抑郁大鼠的外周血和海马IL-1β水平显著高于氟西汀治疗有效的抑郁大鼠和对照组大鼠,同时氟西汀难治性抑郁大鼠海马环氧化酶2的表达及前列腺素E2水平均显著高于对照组大鼠和氟西汀治疗有效大鼠[17]。Lawson等[18]发现,对IL-1β转化酶基因敲除小鼠的侧脑室注射脂多糖(LPS)后,在蔗糖偏好实验和强迫游泳实验中未观察到抑郁样行为改变。基于上述动物实验以及我们的研究结果,可推测IL-1β相关免疫通路可能为CAD与抑郁之间的内在联系之一,其确切机制有待进一步研究。
参考文献
[1]Meijer A, Conradi HJ, Bos EH, et al. Prognostic association of depression following myocardial infarction with mortality and cardiovascular events: a meta-analysis of 25 years of research[J]. Gen Hosp Psychiatry,2011,33(3):203-216.
[2]Ma W, Hu D, Liu G, et al. Predictors of quality of life in Chinese patients with acute coronary syndrome[J]. Asian Cardiovasc Thorac Ann,2010,18(5):469-475.
[3]马文林,徐颖,李美婧,等. 急性冠脉综合征伴发焦虑抑郁情绪患者生活质量的研究[J]. 中华行为医学与脑科学杂志,2008,17(4):318-319.
[4]Raison CL, Capuron L, Miller AH. Cytokines sing the blues: inflammation and the pathogenesis of depression[J]. Trends Immunol,2006,27(1):24-31.
[5]Pan A, Lucas M, Sun Q, et al. Increased mortality risk in women with depression and diabetes mellitus[J]. Arch Gen Psychiatry,2011,68(1):42-50.
[6]Kroenke K, Spitzer RL, Williams J B. The PHQ-9: validity of a brief depression severity measure[J]. J Gen Intern Med,2001,16(9):606-613.
[7]Whooley MA, Wong JM. Depression and cardiovascular disorders[J]. Annu Rev Clin Psychol,2013,9(1):327-354.
[8]刘德彬,孙晓宁,张振刚. 抑郁与缺血性心脏病[J]. 国际心血管病杂志,2007,34(2):129-132.
[9]许晶晶. 焦虑抑郁情绪对冠心病患者血清炎症因子及血管内皮功能的影响[J]. 中国循环杂志,2011(06):426-429.
[10]Mazereeuw G, Herrmann N, Bennett SA, et al. Platelet activating factors in depression and coronary artery disease: a potential biomarker related to inflammatory mechanisms andneurodegeneration[J]. Neurosci Biobehav Rev,2013,37(8):1611-1621.
[11]Mommersteeg PM, Meeuwis SH, Denollet J, et al. C-reactive protein and fibrinogen in non-obstructive coronary artery disease as related to depressive symptoms and anxiety: findings from the TweeSteden Mild Stenosis Study (TWIST)[J]. J Psychosom Res,2014,77(5):426-429.
[12]Dowlati Y, Herrmann N, Swardfager W, et al. A meta-analysis of cytokines in major depression[J]. Biol Psychiatry,2010,67(5):446-457.
[13]Neznanov NG, Kozlova SN, Mazo GE,et al. Comorbidity of depressive disorders and coronary heart disease: general aspects of pathogenesis[J]. Zh Nevrol Psikhiatr Im S S Korsakova, 2015,115(5):20-26.
[14]Leo R, Di Lorenzo G, Tesauro M, et al. Association between enhanced soluble CD40 ligand and proinflammatory and prothrombotic states in major depressive disorder: pilot observations on the effects of selective serotonin reuptake inhibitor therapy [J]. J Clin Psychiatry, 2006,67(11):1760-1766.
[15]Tajfard M, Latiff LA, Rahimi HR, et al. Serum inflammatory cytokines and depression in coronary artery diseas[J]. Iran Red Crescent Med J, 2014,16(7):e17111.
[16]刘莹,吴爵非,刘俭,等. 肿瘤坏死因子-α和白介素-1β对小鼠腹主动脉炎症反应及内皮P-选择素表达的影响[J]. 实用医学杂志,2010,26(20):3688-3691.
[17]王莹. 药物难治性抑郁形成的炎症机制研究[D]. 第四军医大学,2011.
[18]Lawson MA, Mccusker RH, Kelley KW. Interleukin-1 beta converting enzyme is necessary for development of depression-like behavior following intracerebroventricular administration of lipopolysaccharide to mice[J]. J Neuroinflammation,2013,10(1):54.
(收稿:2015-09-29 修回:2016-02-01)
(本文编辑:丁媛媛)
Study of immunologic relationship between depression and coronary artery disease
PANJiangqi1,YULu1,TANGXian’e1,MAWenlin2,SHIWeiqi2,DENGLiang2,ZHAOCuimei2,YANGFan3.
1MedicalSchoolofTongjiUniversity,Shanghai200092; 2DepartmentofCardiology,TongjiHospitalaffiliatedtoTongjiUniversity,Shanghai200065; 3DepartmentofClinicalLaboratory,TongjiHospitalaffiliatedtoTongjiUniversity,Shanghai200065,China
【Abstract】Objective: To explore the immunologic relationship between depression and coronary artery disease (CAD). Methods: A total of 175 patients were enrolled continuously, and were divided into 4 groups according to the scores of patient health questionnaire-9 (PHQ-9). Immunological function was assessed by measuring serum levels of immunologic factors and immunological cells. The relationship between serum level of immunological factors and degree of depression was analyzed. The human umbilical vein endothelial cells (HUVEC) were co-cultured with the serum of depressed CAD patients, and the expressions of interleukin (IL)-1β and nuclear factor (NF)-κB in HUVEC were measured by luciferase reporter gene detection system.Results: The serum levels of IL-1β were significantly different among 4 groups of patients. Patients with moderate to severe depression have a higher level of IL-1β than those of CAD patients with minimal depression or without depression [11.73(9.40,17.46) ng/L vs. 8.97(6.07, 11.28) ng/L and 8.14(6.17, 9.80) ng/L, P<0.05]. HUVEC co-cultured with the serum of moderate to severely depressed CAD patients expressed greater IL-1β and NF-κB.Conclusion: Immunological inflammation may be one of the pathogenic mechanisms accounting for CAD and depression. IL-1β and NF-κB related pathways may play a key role.
【Key words】Coronary artery disease; Depression; Interleukin-1β
doi:10.3969/j.issn.1673-6583.2016.02.017
通信作者:马文林,Email:mawenlin@medmail.com.cn
基金项目:上海市卫生局课题(20114322 )
(马文林,石炜祺,邓 良,赵翠梅);检验科放射免疫室(杨 凡)
