巴西橡胶树胶乳和悬浮细胞中MVA和MEP代谢途径基因的表达分析
2016-05-27邓小敏吴绍华戴雪梅田维敏
邓小敏, 吴绍华, 戴雪梅, 田维敏
( 中国热带农业科学院橡胶研究所/农业部橡胶树生物学重点开放实验室/省部共建国家重点实验室培育基地—海南省热带作物栽培生理学重点实验室, 海南 儋州 571737 )
巴西橡胶树胶乳和悬浮细胞中MVA和MEP代谢途径基因的表达分析
邓小敏, 吴绍华, 戴雪梅, 田维敏*
( 中国热带农业科学院橡胶研究所/农业部橡胶树生物学重点开放实验室/省部共建国家重点实验室培育基地—海南省热带作物栽培生理学重点实验室, 海南 儋州 571737 )
摘要:MVA和MEP代谢途径是植物类异戊二烯代谢途径的两条重要次生代谢途径。 该研究利用荧光定量PCR技术,分析了橡胶树胶乳和橡胶树花药愈伤组织来源的悬浮细胞中MVA代谢途径和MEP代谢途径中关键基因的表达水平,同时分析了茉莉酸的结构类似物冠菌素(coronatine,COR)对悬浮细胞中HbAACT3,HbHMGR4,HbHMGR5,HbDXS2,HbDXR和HbSQS1基因表达的调节作用。结果表明:在MVA代谢途径中,基因HbAACT1,HbAACT2,HbHMGS1,HbHMGS2,HbHMGR1,HbHMGR3,HbMVK,HbPMK,HbMVD1,HbMVD2和IPP下游代谢基因HbIPPI1和HbFDPS1在胶乳中的表达量要相对高于其在悬浮细胞中的表达量,然而橡胶树悬浮细胞中MEP代谢途径基因HbDXS1,HbDXS2,HbDXR,HbCMS1,HbCMS2,HbCMK,HbMCS1,HbMCS2,HbHDS,HbHDR和鲨烯合酶基因HbSQS1的表达水平要相对高于胶乳。而且COR能不同程度地上调HbHMGR5,HbHMGR4,HbSQS1,HbDXS2和HbDXR基因的表达水平。该研究结果为探索利用橡胶树悬浮细胞体系研究次生代谢合成调控以及生产活性次生代谢产物奠定了基础。
关键词:巴西橡胶树, 甲羟戊酸, 脱氧木酮糖-5-磷酸, 冠菌素, 鲨烯合酶基因
甲羟戊酸(mavalonic acid,MVA)途径和脱氧木酮糖-5-磷酸(DXP)或甲基赤藓醇-4-磷酸(methylerythritol phosphate,MEP)途径是植物细胞类异戊二烯代谢途径中合成异戊烯基焦磷酸(isopenteny lpyrophosphate,IPP)的两条重要来源。其中,MVA代谢途径位于细胞质中,以乙酰辅酶A 为代谢原料;而MEP代谢途径则位于质体中,以丙酮酸和甘油醛-3-磷酸为代谢原料(王凌健等,2013;Chow et al,2007,2012)。异戊烯基焦磷酸是合成植物萜类次生代谢物的重要原料,而且异戊烯基焦磷酸的合成和利用效率将直接影响到下游重要次生代谢产物的产率。
巴西橡胶树是工业原料天然橡胶的主要来源。乳管细胞细胞质——胶乳是合成天然橡胶(顺式异戊二烯链)的主要场所。天然橡胶生物合成是乳管细胞中典型的植物类异戊二烯代谢途径,乳管细胞中也存在MVA和MEP代谢途径,其中MVA代谢途径是胶乳中合成天然橡胶的主要途径 (Chow et al,2007, 2012)。最近的研究发现胶乳中除了主要合成天然橡胶分子外,同时还合成一些重要的萜类分子,比如含量较高的角鲨烯 (梅志刚等,2011)(图1),并且胶乳中合成角鲨烯的关键基因HbSQS1已被鉴定(张志平等,2014)。
橡胶树花药愈伤组织来源的悬浮细胞培养体系已经成功建立。目前主要用于原生质体融合和植株再生研究(戴学梅等,2013),其用于橡胶树次生代谢研究还未见报道。在同为天然橡胶合成(反式异戊二烯链)的杜仲树中,已经有利用悬浮细胞生产绿原酸的初步研究(王亚琴等,2008)。同时也有研究表明茉莉酸作为诱导子能诱导重要次生代谢物的合成(孙彬贤等,2000;王焕等,2014)。因此,本文重点研究橡胶树胶乳和悬浮细胞中MVA和MEP代谢途径重要基因的表达模式,以及在悬浮细胞中茉莉酸类似物——COR对关键酶编码基因的表达调控作用,为今后利用胶乳和悬浮细胞研究次生代谢调控,同时为利用悬浮细胞生产生物活性物质奠定前期实验基础。
1材料与方法
1.1 材料与试剂
橡胶树胶乳采集于中国热带农业科学院试验场的橡胶树无性系热研8-79,橡胶树无性系热研8-79花药愈伤组织来源的悬浮细胞由戴雪梅老师馈赠。本实验所用生化试剂冠菌素为Sigma分析纯,所用试剂盒为天根植物总RNA提取试剂盒,Fermentas cDNA反转录试剂盒,Takara SYBR Premix EX荧光定量PCR试剂盒为,引物为英骏公司合成。
1.2 方法
1.2.1 材料处理将终浓度为1 μm·L-1的茉莉酸生理活性类似物冠菌素 (coronatine,COR) 添加至橡胶树悬浮细胞培养液中分别处理8 h,1 d,3 d,5 d和7 d,对照不添加COR,为正常的悬浮细胞培养液。每个时间点取样后置于1 000 r·min-1轻柔离心,收集悬浮细胞放置液氮中速冻并保存于-80 ℃备用。割胶后收集胶乳到预先添加提取液的无RNase污染的离心管中,混匀置于-20 ℃保存备用。
1.2.2 RNA提取与cDNA合成胶乳样品和悬浮细胞样品的RNA提取利用天根植物总RNA提取试剂盒,参照说明书上方法提取,所提取的RNA经过琼脂糖凝胶电泳确定完整性和无DNA污染,同时利用Nano drop核酸定量仪鉴定RNA的含量和纯度,其中OD260/OD280为1.8~2.0,表明所提RNA纯度较高,符合后续实验要求。cDNA第一链合成利用Fermentas cDNA第一链反转录试剂盒参照使用说明书合成。
1.2.3 荧光定量PCR本实验涉及到的MVA和MEP代谢途径基因和橡胶树鲨烯合酶基因HbSQS1的引物序列(表1)主要来源于5篇已报道的文献(Chow et al,2007, 2012;张志平等,2014;Sando et al,2008a,b),另外HbMVD1和HbMVD2基因序列来源于NCBI数据库,序列号分别为JN036537和JN036539,其特异性已经过序列比对,琼脂糖电泳和测序分析,均为正确可用。其中,内参基因的选择参照伯乐CFX系列荧光定量PCR仪中的分析软件说明,选取两个内参基因(Hb18S和HbActin基因)用于分析其他待研究基因的相对表达量。

表 1 该研究使用的引物信息
续表1

路径名Pathwayname基因名Genename引物名称Primername引物序列(5'-3')Primersequences(5'-3')HbHDSHbHDRHbHDS-qFWGCTGACAAAGCCATTACCCAATHbHDS-qRVCGTGTACCTTCTGGCAAAAGCHbHDR-qFWTTCCTACCAGAAGGTCCCATTACHbHDR-qRVATATCCAACCACTAATTGCAGCTCIPP下游代谢基因和内参基因IPPdownstreammetabolicgenesandinternalcontrolgenesHbIPPI1HbIPPI2HbFDPS1HbSQS1Hb18SHbACTINHbIPPI1-qFWACCTTGGTTTAGACTAGTTGTGGACHbIPPI1-qFVAACTCGTTTACAACTGACATTACCAHbIPPI2-qFWACACGTTGAAAAGGGGACACTCHbIPPI2-qFVCCAGACTAAGAATACTGAATGCCGHbFDPS1-qFWTAACCTCTATTGAAGCTCATCCTAGHbFDPS1-qFVTTCAGCGTCATCCAGTCTTTGHbSQS1-qFWGATTTGGCACCAGATGTCCTHbSQS1-qRVGCCAAAACATGCGTGACTTAHb18S-qFWCCATAAACGATGCCGACCAGHb18S-qRVCAGCCTTGCGACCATACTCHbACTIN-qFWGATTCCGTTGCCCAGAAGTCHbACTIN-qFVCACCACTCAGCACAATGTTACC
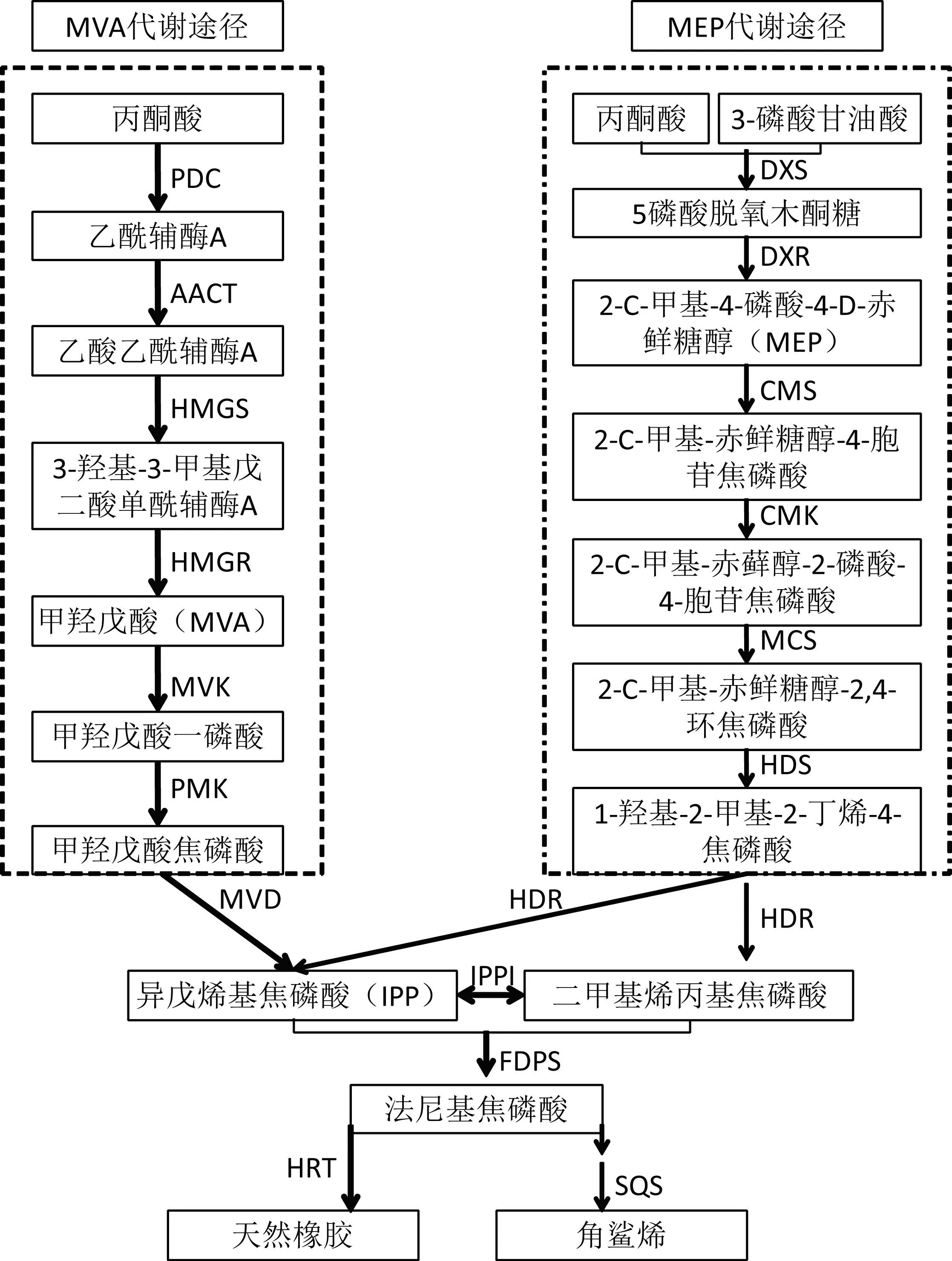
图 1 橡胶树胶乳中MVA和MEP代谢途径 引自Sando et al,2008a,b, 略有改动。Fig. 1 MVA and MEP metabolic pathways in latex of Hevea brasiliensis This map was draw based on Sando et al, 2008a, b, with some modification.
荧光定量PCR反应的反应体系为10 μL:水 3 μL,2×Takara SYBR Premix EX Taq 5 μL,正反向引物(10 μm·L-1)各0.5 μL,cDNA模板1 μL。荧光定量PCR反应在伯乐CFX系列荧光定量PCR仪上运行,PCR反应程序为95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火15 s,72 ℃延伸30 s,40个循环;实验设3个重复。利用仪器自带分析软件分析基因的表达水平(ΔΔCT法),其中以悬浮细胞为对照样品检测所研究的目标基因与内参基因的相对表达量作为目标基因的表达水平。
2结果与分析
2.1 MVA代谢途径基因的表达分析
MVA代谢途径就是将初始原料蔗糖转化为异戊烯基焦磷酸IPP的代谢途径,利用橡胶树在该代谢通路中已发表的基因表达检测引物和新登录的基因序列设计的引物,在胶乳和悬浮细胞中检测这些基因的表达模式,结果发现MVA代谢途径基因HbAACT1,HbAACT2,HbHMGR1,HbHMGR3,HbHMGS1,HbHMGS2,HbMVK,HbPMK,HbMVD1和HbMVD2在胶乳中的表达量高于其在悬浮细胞中的表达量(图2)。这表明至少与悬浮细胞相比,橡胶树乳管细胞的胶乳中MVA途径基因的表达占优势,表明在胶乳中相比MEP代谢途径,MVA代谢途径是主要的IPP代谢途径。而且IPP下游代谢基因HbIPPI1和HbFDPS1在胶乳中的表达量也高于悬浮细胞,这些结果表明胶乳中对蔗糖的转化利用效率可能要高于悬浮细胞。另外部分MVA代谢途径基因如HbAACT3,HbHMGR4,HbHMGR5和HbIPPI2在悬浮细胞中的表达量却相对高于其在胶乳中的表达量,说明MVA代谢途径部分基因的同源基因在悬浮细胞中可能也发挥着重要的作用(图2)。
2.2 MEP代谢途径基因的表达分析
定位于质体或叶绿体中的脱氧木酮糖-5-磷酸(DXP)或甲基赤藓醇-4-磷酸(methylerythritol phosphate, MEP)途径是将初始原料丙酮酸和甘油醛-3-磷酸转化为异戊烯基焦磷酸IPP。同样地,利用橡胶树该代谢通路中已发表的基因表达检测引物和新登录的基因序列设计的引物,在胶乳和悬浮细胞中检测这些基因的表达模式,结果发现MEP代谢途径基因HbDXS1,HbDXS2,HbDXR,HbCMS1,HbCMS2,HbCMK,HbMCS1,HbMCS2,HbHDR和HbHDS在悬浮细胞中的表达量均高于其在胶乳中的表达量(图3)。这说明悬浮细胞在离体培养条件下MEP代谢途径基因的表达相比MVA代谢途径基因更占优势,悬浮细胞可能更倾向于利用MEP途径生产其所需的IPP原料。同时对IPP下游代谢基因鲨烯合酶基因HbSQS1的表达检测发现其在悬浮细胞中的表达量也高于其在胶乳中的表达量(图3),这些结果说明胶乳系统中由于将IPP主要用于合成天然橡胶,一些其他的萜类化合物合成酶基因如鲨烯合酶基因的表达可能会受到一定程度的抑制。然而悬浮细胞因为不能合成橡胶,其IPP代谢流将转向其他代谢分支,鲨烯合酶基因HbSQS1的表达量可能由此升高,以上结果表明悬浮细胞中的两条IPP代谢途径与胶乳系统相比进行了调整,使得MEP代谢途径可能成为优势代谢途径,并且同时也加强了合成下游次生代谢物比如角鲨烯的鲨烯合酶基因的表达。

图 2 橡胶树胶乳和悬浮细胞中MVA代谢途径基因的表达分析 LT代表胶乳; SUS代表橡胶树花药愈伤组织来源的悬浮细胞。下同。Fig. 2 Expression analysis of genes involved in MVA metabolic pathway in latex and suspension cells of Hevea brasiliensis LT represents latex, SUS represents suspension cells of Hevea brasiliensis. The same below.
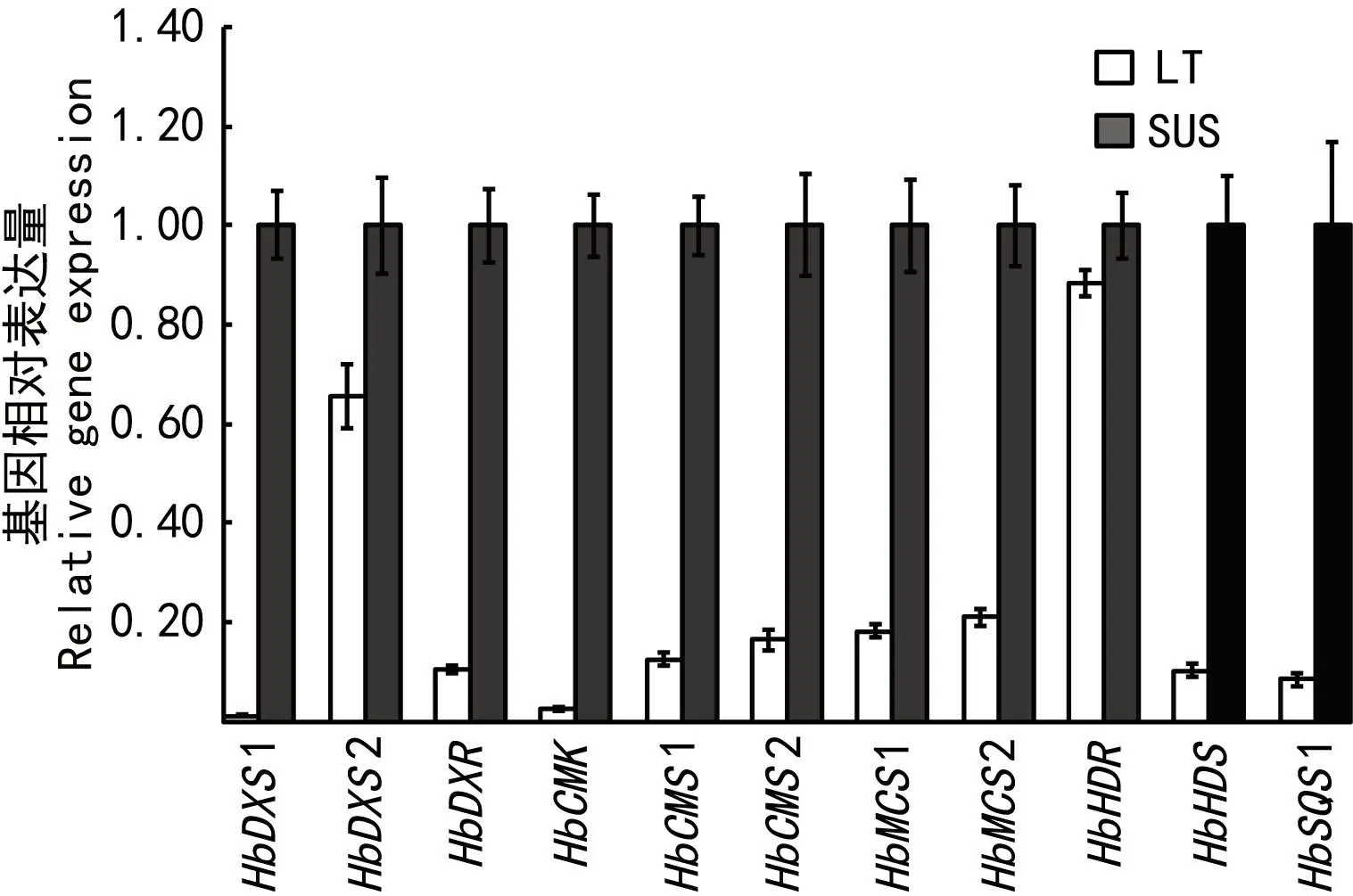
图 3 橡胶树胶乳和悬浮细胞中MEP代谢途径基因的表达分析Fig. 3 Expression analysis of genes involved in MEP pathway in latex and suspension cells of Hevea brasiliensis
2.3 COR对橡胶树悬浮细胞中MEP代谢途径关键基因和MVA代谢途径中优势表达基因的影响
茉莉酸及其结构类似物被证明通过上调植物次生代谢物合成关键酶基因的表达,进而诱导次生代谢物的合成(王焕等,2014;魏洁书等,2014)。本研究分析茉莉酸的活性结构类似物COR对橡胶树悬浮细胞中MEP代谢途径关键基因HbDXS1,HbDXS2和HbDXR,MVA代谢途径中上调表达的基因HbAACT3,HbHMGR4和HbHMGR5,以及角鲨烯合成途径重要基因HbSQS1表达的影响。结果发现,1 μm·L-1COR对HbHMGR5基因表达的诱导最强,其次是HbHMGR4基因,而对HbSQS1,HbDXS2和HbDXR基因的诱导作用相对较弱。HbAACT3基因的表达呈现“振荡表达模式”,其诱导作用也较弱(图4)。这表明COR对橡胶树悬浮细胞MEP代谢通路关键基因具有一定程度的诱导作用,而且COR对悬浮细胞中MEP和MVA代谢通路内部分基因都能诱导表达,不局限于特定诱导或调控其中一种代谢通路。通过对这两条代谢通路基因的诱导,特别是诱导鲨烯合酶基因HbSQS1的表达,COR很有可能有助于提高橡胶树悬浮细胞中角鲨烯或其他次生代谢物质的合成。
3讨论
橡胶树乳管是橡胶树树皮中的一种特化组织,具有抵御外界刺激的作用,因此是一种重要的保护组织。胶乳是乳管中的细胞质组分,其中主要合成天然橡胶分子(何康和黄宗道,1987)。胶乳中虽然存在MEP代谢途径基因表达,但是MVA代谢途径仍然是胶乳中合成天然橡胶分子的主要途径(Chow et al,2007, 2012)。橡胶树花药愈伤组织来源的悬浮细胞体系实验系统已经成功建立,但尚不清楚MVA代谢途径在橡胶树悬浮细胞中是否也是主要异戊二烯代谢途径。本研究对MVA和MEP代谢途径基因在胶乳系统和悬浮细胞系统中的表达水平进行比较,发现了新的现象:与胶乳系统不同,体外离体培养的橡胶树悬浮细胞中MEP代谢途径基因的表达量比MVA代谢途径基因的表达量高,说明不是所有的组织都主要采用MVA代谢途径来生产IPP原料分子,悬浮细胞作为离体组织细胞有它自身的内在特征,利用这一体系进行实验需要先了解这个体系的本身特征,而不能照搬已有的认识。因此,本研究有助于对橡胶树悬浮细胞和胶乳中差异代谢途径特征的认识,对其他植物悬浮细胞体系的研究和利用也具有一定的借鉴意义。
悬浮细胞已经被用来研究和生产重要次生代谢产物(孙彬贤等,2000;王亚琴等,2008)。为提高所需次生代谢物质的含量需要添加各种诱导物,其中茉莉酸及其类似物是广泛使用的诱导剂,能够促进次生代谢物合成基因的表达,并提高其含量。如茉莉酸能促进南方红豆杉(Taxuschinensisvar.meirei)悬浮细胞中抗癌物质紫杉醇的积累(孙彬贤等,2000)。本研究分析了茉莉酸活性结构类似物——COR对在橡胶树悬浮细胞中优势表达和一些关键酶编码基因的转录调节作用,结果发现COR能同时诱导MEP和MVA代谢途径的基因, 表明这种诱导效应不仅仅局限于某一个基因或某一类代谢途径,这样可能更有利于增强植物的次生代谢。因此相比某一特定次生代谢产物的积累,茉莉酸及其结构类似物可能更多的是一种通用的促进剂或诱导剂。
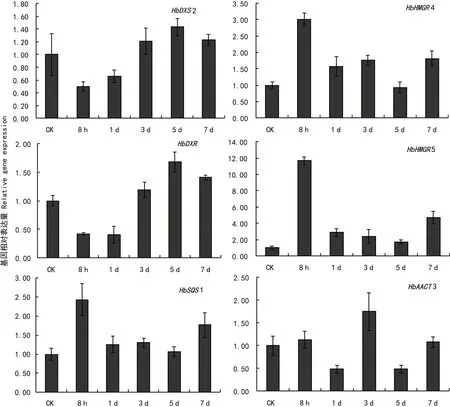
图 4 COR对MEP代谢途径关键基因和其它在悬浮细胞中富集表达基因的调节Fig. 4 Regulatory effects of COR on expression of key genes involved in MEP metabolic pathway or enriched expressed genes in suspension cells
角鲨烯虽然在胶乳中的含量已被测定,但是胶乳中提取利用该物质目前还有一定的难度。而橡胶树悬浮细胞也检测到鲨烯合酶基因HbSQS1的表达,同时也受COR诱导,这些实验结果将为利用悬浮细胞体系生产角鲨烯等活性次生代谢物质奠定重要的前期研究基础。
参考文献:
CHOW KS,MAT-ISA MN,BAHARI A,et al, 2012. Metabolic routes affecting rubber biosynthesis inHeveabrasiliensislatex [J]. J Exp Bot,63(5):1 863-1 871.
CHOW KS,WAN KL,ISA MN,et al, 2007. Insights into rubber biosynthesis from transcriptome analysis ofHeveabrasiliensislatex [J]. J Exp Bot,58(10):2 429-2 440.
DAI XM,LI Z,HUA YW,et al, 2013. Plant regeneration from protoplast culture of Reyan 8-79 (HeveabrasiliensisMüll. Arg.) [J]. J Southern Agric,44(12):2 040-2 045. [戴雪梅,李哲,华玉伟,等, 2013. 橡胶树热研879原生质体培养再生植株 [J]. 南方农业学报,44(12):2 040-2 045.]
(Continueonpage396)(Continuefrompage455)
HE K,HUANG ZD,1987. Rubber culture in the northern part of tropical area [M].Guangzhou:Guangdong Science & Technology Press:407-410. [何康,黄宗道,1987. 热带北缘橡胶树栽培 [M]. 广州:广东科技出版社:407-410.]
MEI ZG,LIU SZ,XIAO XZ,et al,2014. Analysis of chemical components of the latex fromHeveabrasiliensisby GC-MS [J]. Chin J Trop Crops,32(2):315-319. [梅志刚,刘实忠,校现周,等,2014. 巴西橡胶树胶乳化学成分的GC-MS分析 [J]. 热带作物学报,32(2):315-319.]
SANDO T,TAKAOKA C,MUKAI Y,et al,2008a. Cloning and characterization of mevalonate pathway genes in a natural rubber producing plant,Heveabrasiliensis[J]. Biosci Biotechnol Biochem, 72(8):2 049-2 060.
SANDO T,TAKENO S,WATANABE N,et al,2008b. Cloning and characterization of the 2-C-methyl-D-erythritol 4-phosphate (MEP) pathway genes of a natural-rubber producing plant,Heveabrasiliensis[J]. Biosci Biotechnol Biochem,72(11):2 903-2 917. SUN BX,WEN YQ,LIU D,et al,2000. Influence of metabolic intermediate products on culture cell growth and Taxol content ofTaxuschinensisvar.mairei[J]. Acta Univ Trad Med Sin Pharmacol Shanghai,14(3):54-56. [孙彬贤,翁颖琦,刘涤,等,2000. 代谢中间产物和诱导子对南方红豆杉培养细胞生长和紫杉醇含量的影响 [J]. 上海中医药大学学报,14(3):54-56.]
WANG H,YANG JF,DENG KE,et al,2014. Methyl jasmonate affects metabolism and gene transcription of volatile terpenoids fromAmomumvillosumLour [J]. World Sci Technol Mod Trad Chin Med Mat Med,16(7): 1 528-1 536. [王焕,杨锦芬,邓可,等,2014. 茉莉酸甲酯影响阳春砂挥发性萜类代谢和基因转录 [J]. 世界科学技术—中医药现代化专题讨论,16(7):1 528-1 536.]
WANG LJ,FANG X,YANG CQ,et al,2013. Biosynthesis and regulation of secondary terpenoid metabolism in plants [J]. Sci Chin Life Sci,43(12):1 030-1 046. [王凌健,方欣,杨长青,等,2013. 植物萜类次生代谢及其调控 [J]. 中国科学:生命科学,43(12):1 030-1 046.]
WANG YQ,YE QH,ZHU Y,2008. Preliminary study on the cell suspension culture ofEucommiaulmoidesand secondary metabolite-chlorogenic acid [J]. Guihaia,28 (5):671-674. [王亚琴,叶青华,朱媛,2008. 杜仲悬浮培养生产绿原酸的初步研究 [J]. 广西植物,28 (5):671-674.]
WEI JS,YANG JF,LING M,et al,2013. Regulatory effect of methyl jasmonate onHGMR,DXR,DXSgenes expression inAmomumvillosumLour [J]. J Guangzhou Univ Trad Chin Med,30(1):88-92. [魏洁书,杨锦芬,凌敏,等,2013. 茉莉酸甲酯调控阳春砂HMGR、DXR和DXS基因表达 [J]. 广州中医药大学学报,30(1):88-92.]
ZHANG ZP,QIU J,YANG WF,et al,2014. Cloning and bioinformatics analysis of squalene synthase gene(SQS) fromHeveabrasilinesis[J]. Guihaia,34(2):235-241. [张志平,仇键,杨文风,等,2014. 巴西橡胶树鲨烯合酶基因的克隆与序列分析 [J]. 广西植物,34(2):235-241.]
Expression analysis of MVA and MEP metabolic pathways genes in latex and suspension cells ofHeveabrasiliensis
DENGXiao-Min,WUShao-Hua,DAIXue-Mei,TIANWei-Min*
( Key Laboratory for Rubber Biology, Ministry of Agriculture/State Key Laboratory Incubation Base for Cultivation and Physiology of Tropical Crops/Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences,Danzhou571737,China)
Abstract:The MVA and MEP metabolic pathways are two important plant isoprenoid metabolic pathways in plants. The expression of genes respectively in MVA and MEP secondary metabolic pathways were analyzed in the latex and suspension cells from anther-derived callus of Hevea brasiliensis by using qRT-PCR technology. In addition, expression changes of HbAACT3, HbHMGR4, HbHMGR5, HbDXS2, HbDXR and HbSQS1 genes were further analyzed in the suspension cells under COR treatment. The results demonstrated that expressions of HbAACT1,HbAACT2,HbHMGS1,HbHMGS2,HbHMGR1,HbHMGR3,HbMVK,HbPMK,HbMVD1,HbMVD2 in MVA metabolic pathway and HbIPPI1 and HbFDPS1 genes involved in IPP utilization were relatively higher in latex than that in suspension cells, while HbDXS1,HbDXS2,HbDXR,HbCMS1,HbCMS2,HbCMK,HbMCS1,HbMCS2,HbHDS and HbHDR in MEP metabolic pathway and HbSQS1 were relatively higher in suspension cells than that in latex. Moreover, HbHMGR5, HbHMGR4, HbSQS1, HbDXS2 and HbDXR genes were induced highly or to some degree in suspension cells by COR application. This study lays a foundation for further utilization of suspension cells to analyze secondary metabolism regulation as well as to produce bioactive compounds from anther-derived callus of Hevea brasiliensis in the future.
Key words:Hevea brasiliensis, mavalonic acid, methylerythritol phosphate, coronatine, squalene synthase
中图分类号:Q945.4,Q786
文献标识码:A
文章编号:1000-3142(2016)04-0449-07
作者简介:邓小敏 (1985-), 男, 湖北荆州监利人, 博士研究生, 助理研究员, 主要从事橡胶树分子生物学和次生代谢调控研究, (E-mail) dxmbio822@163.com。*通讯作者: 田维敏,博士,教授,主要从事橡胶树发育生物学研究,(E-mail)wmtian@163.com。
基金项目:国家自然科学基金(31170642);中国热带农业科学院橡胶研究所基本科研业务费(1630022015010)[Supported by the National Natural Science Foundation of China(31170642); the Fundamental Research Fund for Rubber Research Institute, CATAS(NO.1630022015010)]。
*收稿日期:2015-10-13修回日期: 2015-12-08
DOI:10.11931/guihaia.gxzw201510013
邓小敏,吴绍华,戴雪梅,等. 巴西橡胶树胶乳和悬浮细胞中MVA和MEP代谢途径基因的表达分析[J]. 广西植物, 2016, 36(4):449-455
DENG XM,WU SH, DAI XM, et al. Expression analysis of MVA and MEP metabolic pathways genes in latex and suspension cells ofHeveabrasiliensis[J]. Guihaia, 2016, 36(4):449-455
