Cl-、SO42-和PO43-对异养反硝化污泥的胁迫效应
2016-05-27许少怡戴陈琳AbbasGhulam浙江大学环境工程系浙江杭州310058
王 茹,郑 平,杨 程,许少怡,戴陈琳,Abbas Ghulam (浙江大学环境工程系,浙江 杭州 310058)
Cl-、SO42-和PO43-对异养反硝化污泥的胁迫效应
王 茹,郑 平*,杨 程,许少怡,戴陈琳,Abbas Ghulam (浙江大学环境工程系,浙江 杭州 310058)
摘要:反硝化菌是反硝化作用的驱动者,探明Cl-、S O42-和PO43-对异养反硝化污泥(HDS)的胁迫效应,有助于含盐废水生物脱氮技术的研发和优化.选用硝酸盐还原酶(周质酶)和碱性磷酸酯酶(胞内酶)作为指标,考察了不同Cl-、SO42-和PO43-浓度对HDS酶活的影响;通过观测HDS中的活菌水平和细胞形态,考察了不同Cl-、SO42-和PO43-浓度对HDS微生物细胞结构的影响.结果表明,Cl-、SO42-和PO43-对HDS硝酸盐还原酶的半抑制浓度分别为0.15、0.12和0.05mol/L,对碱性磷酸酯酶的半抑制浓度为1.14、0.75和0.49mol/L;高浓度Cl-、SO42-和PO43-导致HDS微生物细胞膜结构破损,通透性增加,细胞物质外泄.阴离子对HDS的胁迫可分为渗透胁迫和电荷胁迫,渗透胁迫造成HDS中功能酶失活,电荷胁迫造成HDS中细胞膜破损,细胞物质外泄.
关键词:阴离子;异养反硝化污泥;渗透胁迫;电荷胁迫
* 责任作者, 教授, pzheng@zju.edu.cn
生物反硝化是废水生物脱氮的重要组成部分,广泛应用于废水脱氮除碳处理.然而在工业废水生物脱氮中,经常面临高盐的困扰[1-3].印染、腌制、制药、化工和农药等行业,排放大量高盐含氮有机废水[4-6].据报道,某印染厂对氨基偶氮苯酸盐生产废水的Cl-浓度高达100g/L,某炼钢厂酸洗废水的SO42-浓度高达80g/L,某制药厂咪唑醛水解废水的PO43-达95g/L[7-9].高浓度阴离子的存在严重干扰了反硝化菌的功能,限制了高效反硝化工艺的应用[10-11].
盐离子对微生物的胁迫可从两个方面考虑:一是渗透胁迫,二是电荷胁迫.Jin等[12]以渗透压表征盐离子,研究了气升式反应器中渗透压对硝化作用的影响,发现当渗透压从4.3×105Pa升为19.2×105Pa时,氨去除率从100%降为69.2%; Glass等[13]以离子强度表征反应器进水总溶解盐度,研究了含氮高盐废水中离子强度对反硝化作用的影响.盐离子对生物的胁迫效应并非单一的渗透胁迫或电荷胁迫,而是两者的协同作用[14-15].但迄今为止,还未见有关阴离子对反硝化菌渗透胁迫与电荷胁迫的文献报道.
本文以Cl-、SO42-和PO43-为废水中常见的阴离子代表,在保证阳离子浓度相同的情况下探索了不同阴离子浓度渗透胁迫对异养反硝化污泥(HDS)酶活性的影响,观测了不同阴离子浓度电荷胁迫下HDS中活菌水平及细胞形态的变化,以期探明阴离子对HDS的胁迫效应及其机理.
1 材料与方法
1.1 异养反硝化污泥(HDS)
异养反硝化污泥(HDS)取自本实验室高效反硝化脱氮反应器.脱氮反应以乙酸钠为电子供体、硝酸盐为电子受体.HDS的总固体含量(Total solids, TS)和挥发性固体含量(volatile suspended solid, VSS)分别为136.68g/L和52.89g/L[16].试验所用HDS均经0.9% NaCl溶液清洗3次.
1.2 模拟废水
试验所用的无机盐为NaCl、Na2SO4和Na3PO4.设置的Cl-梯度浓度为:0.10、0.24、0.34、0.68、1.03、1.37、1.71mol/L;SO42-梯度浓度为: 0.05、0.10、0.17、0.34、0.51、0.68、0.85mol/L;PO43-梯度浓度为:0.04、0.08、0.11、0.23、0.34、0.45、0.57mol/L.
试验所用的模拟废水基础组成为:NaNO37.14mmol/L, CH3COONa 7.80mmol/L, KH2PO30.37mmol/L, CaCl23.60mmol/L,MgSO4·7H2O 0.41mmol/L, 微量元素液1mL/L.
试验所用的微量元素液组成为:EDTA 17.12mmol/L, MnCl2·4H2O 25.25mmol/L, FeSO4· 7H2O 10.79mmol/L, CoCl2·6H2O 0.21mmol/L, NiCl2·6H2O 0.17mmol/L, H3BO30.32mmol/L, (NH4)6Mo7O2·4H2O 0.02mmol/L, CuSO4·5H2O 0.04mmol/L, ZnSO40.02mmol/L.
1.3 硝酸盐还原酶活性
采用65mL厌氧血清瓶进行批次试验,测定电荷胁迫下HDS中硝酸盐还原酶活性[17].称取5g HDS于50mL一定浓度Cl-、SO42-或PO43-模拟废水中,30℃、120rmp摇床培养5h,测定硝氮浓度.根据HDS中VSS含量,计算HDS的硝酸盐还原酶活性(式1).每组试验设置两个平行,CK对照组采用基础模拟废水,不额外添加盐类.
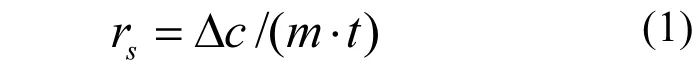
其中,rs为硝酸盐还原酶活性(g N/(L·g VSS·h),△c为硝氮浓度变化值(g N/L),m为VSS质量(g),t为反应时间(h).
1.4 活死细胞观察
取批次培养后的HDS,经研磨后以细胞破碎仪对其进行超声破碎(功率为50W,超声时间为30s),获得菌悬液.采用Live & Dead试剂盒(Molecular Probes, USA)中的核酸染料SYTO○R9 和PI对样品进行染色,在Leica荧光显微镜下观察、拍照;利用Image-Pro Plus 6.0计数活菌、死菌,算出活细胞比例[18].
1.5 透射电镜观察
取适量批次培养后的HDS,浸泡于2.5%戊二醛溶液中4℃固定过夜;倾弃固定液,用0.1M,pH7.0的磷酸缓冲液漂洗3次,每次15min; 用1%锇酸溶液固定样品1~2h;倾弃锇酸废液,用0.1M、pH7.0磷酸缓冲液漂洗样品3次,每次15min;用梯度浓度(30%、50%、70%、80%、90% 和95%)的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%乙醇处理20min,最后过渡到纯丙酮处理20min;用包埋剂与丙酮的混合液(V/V=1/1)处理样品1h;用包埋剂与丙酮的混合液(V/V=3/1)处理样品3h;纯包埋剂处理样品过夜;LEICA EM UC7型超薄切片机中切片,经柠檬酸铝溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10min,即可用Hitachi H-7650型透射电镜观察.
1.6 碱性磷酸酯酶活性
取批次培养后的HDS适量,将其悬浮于1mL pH 8.0的PBS溶液.经研磨后采用细胞破碎仪破碎(功率为100W,超声时间为1min),获得ALP提取液.以对硝基邻苯酸二钠(pNPP)为底物,测定单位时间内pN的生成量[19].计算方法如式2所示.
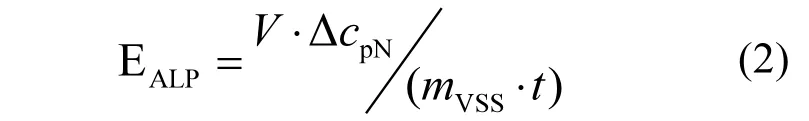
其中:EALP为碱性磷酸酯酶活性,µmol/(gVSS⋅min);V为反应体系体积,mL;△cpN为pN的摩尔浓度增量,µmol/mL;mVSS为HDS样品中VSS质量,g;t为反应时间,min.
1.7 分析项目及方法
硝氮(NO3--N):紫外分光光度法[20];二价铁:1,10-啉菲啰啉分光光度法;总铁:1,10-啉菲啰啉分光光度法;pH:pHS-9V型酸度计;TS和VSS:重量法.
2 结果与讨论
2.1 阴离子胁迫下的硝酸盐还原酶活性
锁定溶液中阳离子浓度,采用批次试验考察了不同Cl-、SO42-和PO43-浓度对HDS硝酸盐还原酶活性的胁迫效应,结果如图1所示.3种阴离子影响HDS硝酸盐还原酶活性的趋势一致,均经历快速下降区段和缓慢下降区段.在快速下降区段,阴离子浓度与HDS硝酸盐还原酶活性下降呈线性相关,而在缓慢下降区段,HDS硝酸盐还原酶活性随阴离子浓度的升高而趋缓下降.
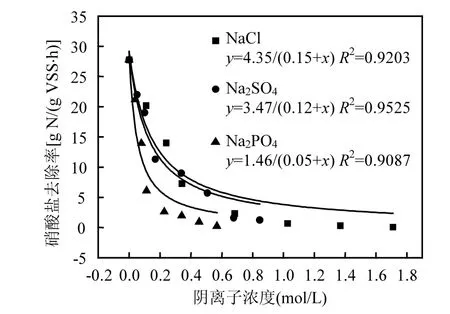
图1 不同阴离子浓度胁迫下硝酸盐还原酶活性Fig.1 Nitrate removal rate of HDS versus concentration of anion
采用式(3)[21]对图1数据进行拟合.
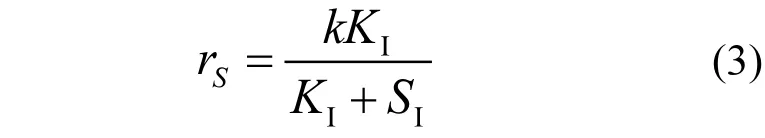
式中: rs为硝酸盐还原速率,g N/(g VSS·h);KI为半抑制浓度, mol/L;k为基质反应常数;SI为抑制物浓度,mol/L.
根据拟合结果,Cl-、SO42-和PO43-对HDS硝酸盐还原酶活性的半抑制浓度分别为0.15、0.12 和0.05mol/L,与文献报道值相当[22-23];相应的抑制强度依次为PO43->SO42->Cl-,与阴离子Kosmotropic序列相符[24].
2.2 阴离子胁迫下的碱性磷酸酯酶活性
以碱性磷酸酯酶(参与蛋白磷酸化和去磷酸化调控)作为胞内酶代表,研究了不同Cl-、SO42-和PO43-浓度对HDS碱性磷酸酯酶的胁迫效应.对照组中,HDS碱性磷酸酯酶活性为1.23µmol/(g VSS⋅min),以该值为参比,计算获得各试验组的相对碱性磷酸酯酶活性,如图2所示.在测试范围内, 3种阴离子对HDS碱性磷酸酯酶活性的胁迫效应随离子浓度的增加呈线性增强.
对3组数据分别进行线性拟合,相关性良好(R2>0.9784).计算获得Cl-、SO42-和PO43-对HDS碱
性磷酸酯酶活性的半抑制浓度依次为1.14、0.75和0.49mol/L,相应的抑制强度依次为PO43-> SO42-> Cl-.

图2 不同阴离子浓度胁迫下碱性磷酸酯酶活性Fig.2 Relative ALP activity of HDS versus concentration of anion
2.3 阴离子胁迫下的活菌水平
采用Live/Dead试剂盒对HDS中微生物细胞进行染色,在荧光显微镜下观察了Cl-、SO42-和PO43-对HDS中活菌水平的影响,荧光显微照片如图3所示.对照组中,显微视野下大多微生物为活菌,少量死菌;而暴露于高阴离子浓度(1.71mol/L Cl-、0.85mol/L SO42-或0.57mol/L PO43-)中5h后,显微视野下大多微生物为死菌,少量活菌.结果表明,高浓度阴离子胁迫下HDS中活菌水平显著下降.
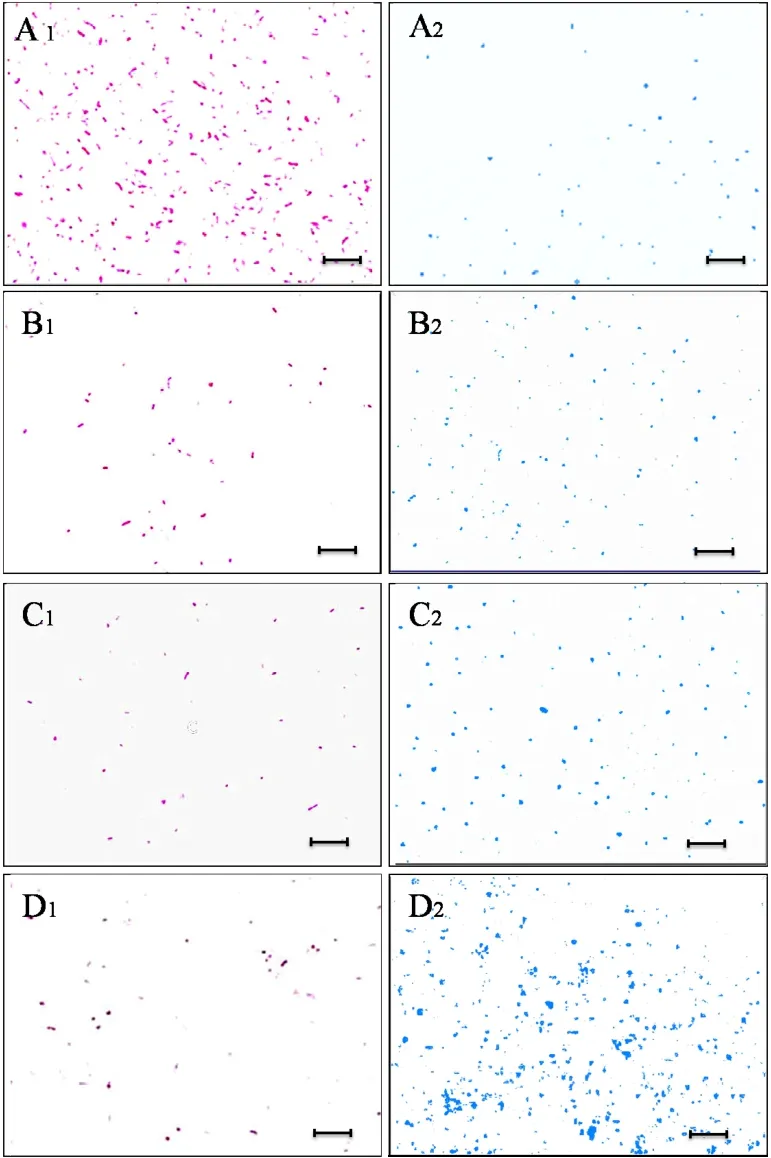
图3 荧光显微镜下HDS活菌/死菌照片Fig.3 Fluorescence microscopic images of microorganisms in HDSA:对照组;B: 1.71mol/L Cl-; C: 0.85mol/L S O42-; D: 0.57mol/L PO43-.红色为活细胞,蓝色为死细胞.标尺为200µm

表1 不同Cl-、SO42-和PO43-浓度对HDS中活菌水平的影响Table 1 Live/Dead cell versus different salt concentrations
采用Image-Pro Plus 6.0对荧光显微照片中活菌和死菌进行计数,对照组HDS活菌个数比例为99.60%,试验组结果如表1所示.
2.4 阴离子胁迫下的细胞形态
采用透射电镜观察Cl-、SO42-和PO43-胁迫下HDS中微生物细胞形态结构的变化,结果如图4所示.在对照组中,细胞呈规则球形,拟核处于细胞中部,细胞物质分散均匀,细胞壁和细胞膜结构完整(图4A);暴露于高阴离子浓度(1.71mol/L Cl-、0.85mol/L SO42-或0.57mol/L PO43-)中5h后,细胞形态改变,细胞脱水致使原生质体聚缩,质壁分离,甚至细胞破裂,细胞物质(包括拟核)外泄(图4B、C、D). 2.5

图4 透射电镜下HDS细胞形态Fig.4 Transmission electron microscopy (TEM) of microorganism in HDSA:对照组B: 1.71mol/L Cl-; C: 0.85mol/L SO42-; D: 0.57mol/L PO43-红色箭头为细胞壁,蓝色箭头为细胞膜,白色箭头为核酸
阴离子对HDS的胁迫机理
阴离子对微生物细胞的胁迫效应主要包括渗透胁迫作用和电荷胁迫作用.
在阴离子渗透胁迫下,HDS细胞周质酶和胞内酶均失活.硝酸盐还原酶结合在细胞膜上,但活性中心朝向细胞周质空间,可作为周质酶的代表;碱性磷酸酯酶位于细胞内,可作为胞内酶的代表.以硝酸盐还原酶和碱性磷酸酯酶为指标,考察了不同Cl-、SO42-和PO43-浓度对HDS酶活的胁迫效应,如3.1和3.2所示.结果表明,阴离子胁迫下HDS中的硝酸盐还原酶和碱性磷酸酯酶活性显著下降.据此认为,阴离子不仅直接影响膜外酶活性,也可进入细胞而间接影响胞内酶活性.溶液中带电阴离子可结合自由水而降低水活度,并通过渗透作用而减少细胞内自由水,致使胞内酶及核酸分子由溶胶态转变为凝胶态,丧失活性[25-26].
在阴离子胁迫下,HDS细胞结构发生变化.Live/Dead试剂盒鉴定活/死细胞的原理基于细胞膜通透性的改变,活细胞具有完整细胞膜,物质通透性稳定;死细胞细胞膜受到损伤,物质通透性显著增大.如图3和图4所示,在高阴离子浓度(1.71mol/L Cl-、0.85mol/L SO42-或0.57mol/L PO43-)胁迫下,HDS中活细胞比例下降,细胞结构严重破损.据此认为,阴离子不仅可致细胞膜通透性增强,甚至导致细胞死亡.溶液中带电阴离子可产生静电力,破坏原有的细胞电荷平衡,造成细胞膜破损,甚至破裂[27-28].

图5 阴离子对HDS胁迫机理Fig.5 Mechanism of the stress by anion on HDS
综合渗透胁迫和电荷胁迫,提出阴离子对HDS的胁迫机理如图5所示.正常条件下,HDS细胞结构完整,活性较高(图5A);置于阴离子胁迫环境中,阴离子可进入细胞周质空间抑制硝酸盐还原酶活性,进入细胞抑制碱性磷酸酯酶活性(图5B);高浓度阴离子还可通过渗透压导致细胞原生质体失水,质膜皱缩(图5C);高浓度阴离子积累负电荷,则可产生强静电力,致使细胞膜破损(图5D),细胞内含物(包括核酸和胞内酶)外泄(图5E),造成细胞死亡.
3 结论
Cl-、SO42-和PO43-对HDS的胁迫效应可分为渗透胁迫作用和电荷胁迫作用.渗透胁迫作用可抑制HDS硝酸盐还原酶和碱性磷酸酯酶活性,电荷胁迫作用可引起HDS中微生物细胞膜通透性增加,甚至导致细胞膜破裂,细胞质外泄.
参考文献:
[1] Glass C, Silverstein J. Denitrification of high-nitrate, highsalinity wastewater [J]. Water Research, 1999,33:223-229.
[2] Hamoda M, Al-Attar I. Effects of high sodium chloride concentrations on activated sludge treatment [J]. Water Science and Technology, 1995,31:61-72.
[3] Wen X, Zhan X, Wang J, et al. Review of the biological treatment of salinity wastwater [J]. Environmental Science, 1999,20:104-106.
[4] Dincer A, Kargi F. Salt inhibition of nitrification and denitrification in saline wastewater [J]. Environmental Technology, 1999,20:1147-1153.
[5] 何 健,李顺鹏,崔中利,等.含盐工业废水生化处理耐盐污泥驯化及其机制 [J]. 中国环境科学, 2002,22(6):546-550.
[6] 谭淞文,李维国,公天齐,等.新型活性污泥的培养及其处理高盐有机废水 [J]. 环境工程学报, 2012,6(11):4059-4064.
[7] 谢小兰,余光伟,种云霄,等.污染河流底泥亚铁氧化硝酸盐还原菌分离及代谢特性 [J]. 中国环境科学, 2015,35(5):1554-1562.
[8] 王 慧,王建龙,占新民,等.电化学法处理含盐染料废水 [J]. 中国环境科学, 1999,19(5):441-444.
[9] 陈婷婷,唐崇俭,郑 平.制药废水厌氧氨氧化脱氮性能与毒性机理的研究 [J]. 中国环境科学, 2010,30(4):504-509.
[10] 张宇坤,王淑莹,董怡君,等.NaCl盐度对氨氧化细菌活性的影响及动力学特性 [J]. 中国环境科学, 2014,35(2):465-470.
[11] 穆 军,章非娟,黄翔峰,等.含硫酸盐高浓度有机废水酸化规律研究 [J]. 中国环境科学, 2005,25(2):241-244.
[12] Jin R C, Zheng P, Mahmood Q, et al. Osmotic stress on nitrification in an airlift bioreactor [J]. Journal of Hazardous Materials, 2007,146(1):148-154.
[13] Glass C, Silverstein J. Denitrification of high-nitrate, highsalinity wastewater [J]. Water Research, 1999,33(1):223-229.
[14] Greenway H, Munns R. Mechanism of salt tolerance in nonhalophytes [J]. Annual Review of Plant Biology, 1980,31: 149-190.
[15] Storey R. Salt tolerance, ionrelations and the effect of root medium on the response of citrus to salinity [J]. Australian Journal of Plant Physiology, 1995,22:101-114.
[16] Li W, Zheng P, Wang L, et al. Physical characteristics and formation mechanism of denitrifying granular sludge in high-load reactor [J]. Bioresource Technology, 2013,142:683-687.
[17] Wang R, Zheng P, Xing YJ, et al. Anaerobic ferrous oxidation by heterotrophic denitrifying enriched culture [J]. Journal of Industrial Microbiology and Biotechnology, 2014,41:803-809.
[18] Wu J, Xi C. Evaluation of different methods for extracting extracellular DNA from the biofilm matrix [J]. Applied and Environmental Microbiology, 2009,75:5390-5395.
[19] Yao YL, Guan J, Tang P, et al. Assessment of toxicity of tetrahydrofuran on the microbial community in activated sludge [J]. Bioresource Technology, 2010,101(14):5213-5221.
[20] APHA. Standard Methods for the Examination of Water and Wastewater. A.P.H. Association, Washington, DC, USA. 2005.
[21] Mogens H, van Loosdrecht M, A.Ekama G, et al. Biological wastewater treatment: principles, modelling and design [M]. London: IWA publishing, 2010:237-248.
[22] Mariangel L, Aspe E, Cristina M, et al. The effect of sodium chloride on the denitrification of saline fishery wastewaters [J]. Environmental Technology, 2008,29:871-879.
[23] Panswad T, Anan C. Impact of high chloride wastewater on an anaerobic/anoxic/aerobic process with and without inoculation of chloride acclimated seeds [J]. Water Research, 1999,33:1165-1172.
[24] Zhao H, Olubajo O, Song ZY, et al. Effect of kosmotropicity of ionic liquids on the enzyme stability in aqueous solutions [J]. Bioorganic Chemistry, 2006,34:15-25.
[25] Zhao H. Effect of ions and other compatible solutes on enzyme activity, and its implication for biocatalysis using ionic liquids [J]. Journal of Molecular Catalysis B:Enzymatic, 2005,37:16-25.
[26] Dinçer AR, Kargi F. Salt inhibition kinetics in nitrification of synthetic saline wastewater [J]. Enzyme and Microbial Technology, 2001,28:661-665.
[27] Guseva K. Assembly and Fragmentation of Tat Pores, in: Formation and Cooperative Behaviour of Protein Complexes on the Cell Membrane [M]. Berlin: Springer-Verlag Berlin, 2012: 69-78.
[28] Mendis DA, Rosenberg M, Azam F. A note on the possible electrostatic disruption of bacteria [J]. IEEE Transactions on Plasma Science, 2000,28:1304-1306.
Stress of Cl-, SO42-and PO43-on the heterotrophic denitrifying sludge.
WANG Ru, ZHANG Ping*, YANG Cheng, XU Shao-yi, DAI Chen-lin, Abbas Ghulam (Department of Environmental Engineering, Zhejiang University, Hangzhou 310058, China). China Environmental Science, 2016,36(4):1039~1044
Abstract:As the functional part of denitrification, denitrifier was obviously stressed by anions. To investigate the effects and the mechanism of anions on heterotrophic denitrifying sludge (HDS) are of great significance for the practical application of high-rate denitrification in saline nitrogen-rich wastewater treatments. Nitrate reductase and alkaline phosphatase were chosen as the indices to determine the effects of Cl-, SO42-and PO43-on the enzyme activities in HDS, while the ratios of live/dead cells and cellular morphology were examined and observed to characterise the effects of Cl-, SO42-and PO43-on the cell structures in HDS. Results showed that, the IC50values of Cl-, SO42-and PO43-for nitrate reductase were 0.15, 0.12 and 0.05mol/L respectively, while the IC50values of Cl-, SO42-and PO43-for alkaline phosphatase were 1.14, 0.75 and 0.49mol/L, respectively. Anions with high concentrations (1.71mol/L Cl-, 0.85mol/L SO42-, 0.57mol/L PO43-) resulted in the damage of cell membranes, and caused the leakage of cell inclusion. In conclusion, the effects of anions on HDS were attributed to the osmotic stresses which affected the enzyme activities, and the ion stresses which caused the damage of cell membranes.
Key words:anion;heterotrophic denitrifying sludge;osmotic stresses;ion stresses
作者简介:王 茹(1989-),女,山西长治人,浙江大学博士生在读,主要从事废水生物处理技术研究.
基金项目:国家自然科学基金(51278457);国家科技支撑项目(2013BAD21B04);浙江省创新团队(2013TD12).
收稿日期:2015-09-23
中图分类号:X703
文献标识码:A
文章编号:1000-6923(2016)04-1039-06
