大豆中硝磺草酮的残留量测定
2016-05-26王晓环王德飘吴玉娥张侃侃胡德禹
王晓环,康 頔,王德飘,吴玉娥,曾 松,张侃侃,胡德禹
(贵州大学 精细化工研究开发中心,贵州 贵阳 550025)
大豆中硝磺草酮的残留量测定
王晓环,康頔,王德飘,吴玉娥,曾松,张侃侃*,胡德禹
(贵州大学 精细化工研究开发中心,贵州 贵阳 550025)
摘要:为快速检测大豆中硝磺草酮残留量建立了高效液相色谱-串联质谱的新方法。大豆样品采用乙腈提取,NaCl盐析,十八 (烷)基硅烷 (C18)和石墨化炭黑 (GCB)分散固相萃取净化,以phenomenex Luna 3u C18(2) 100A柱为分离柱,用乙腈和0.1%氨水溶液进行梯度洗脱,电喷雾负离子 (ESI-)多反应监测,高效液相色谱-串联质谱 (HPLC-MS/MS)测定。本方法条件下,硝磺草酮在0.0075-0.75 μg/mL浓度范围内呈良好的线性关系 (R2>0.997),方法检出限 (LOD)和定量限 (LOQ)分别为0.0009和0.003 mg/kg。在0.003、0.03和0.3 mg/kg添加水平下,硝磺草酮的日内平均回收率为83.84-96.24%,日内相对标准偏差 (RSD)为1.99-3.78%,日间平均回收率为85.13-95.25%,日间RSD为2.11-3.47%,能满足大豆中硝磺草酮检测的要求。
关键词:硝磺草酮;大豆;QuEChERS法;高效液相色谱—串联质谱法
大豆是全世界种植面积最广的油料作物。来自美国农业部的数据表明,2013-2014年的全球大豆产量达2839.5亿公吨[1-2]。由于富含丰富的蛋白质、脂肪、维生素、矿物质和纤维素,大豆能被制备成各种豆制品。然而,豆田中杂草众多致使大豆产量受到严重影响,除草就显得至关重要。
硝磺草酮 (mesotrione),化学名2-(4-甲磺酰基-2-硝基苯甲酰基)环己烷-1,3-二酮,又名甲基磺草酮,是瑞士先正达公司开发的芽前和苗后广谱选择性的新型三酮类除草剂。通过抑制对羟苯基丙酮酸双加氧酶的活性而抑制植物类胡萝卜素和叶绿素的合成,使植物产生白化症状而缓慢死亡[3-5]。但最近研究发现,由于硝磺草酮高效的起始活性和残留活性,长期食用含有硝磺草酮残留的食物有致癌和致畸的风险[6-7]。2015年国际食品法典委员会 (CAC)规定硝磺草酮在大豆上的最大残留限量值 (MRL)为0.03 mg/kg[8]。
硝磺草酮是难挥发性化合物,对热不稳定,无法进行气相色谱分析。目前,硝磺草酮在多种基质上的残留分析都有报道,检测的方法主要是高效液相色谱法[9-13]和液相色谱-串联质谱法[14-18],硝磺草酮在大豆上残留分析方法未见报道。本研究参考QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe)方法,对硝磺草酮在大豆上的前处理方法进行了优化改进,通过高效液相色谱-串联质谱法 (HPLC-MS/MS)检测,建立了简单、快速、准确的残留分析方法。
1材料和方法
1.1材料
1.1.1仪器
LC-20AD-XR高效液相色谱仪 (日本岛津公司)和4000 QTRAP三重四极杆质谱仪 (美国AB SCIEX公司),配电喷雾离子源 (ESI);TGL-10B型离心机 (上海安亭科学仪器厂);BUCHI R-210型旋转蒸发仪 (瑞士BUCHI公司);QL-901型涡旋混合器 (江苏海门市麒麟医用仪器厂)。
1.1.2试剂
硝磺草酮标准品 (纯度≥99.0%,德国Dr. Ehrenstorfer公司);质谱乙腈、色谱甲酸和色谱氨水均购置于美国Fisher Scientific公司;纯净水 (屈臣氏集团 (香港)有限公司);尼龙滤膜 (0.22 μm,美国Millipore公司);N-丙基乙二胺 (PSA),十八 (烷)基硅烷 (C18)和石墨化炭黑 (GCB)均为分析纯,购于天津博纳艾杰尔科技有限公司。
大豆样品来源于贵州、江西、黑龙江和浙江4省的抽样调查,每个省设置10个不同的抽样地点,主要是菜市场、农贸市场和超市。将大豆样品用粉碎机粉碎,分装好以待测样。
1.2方法
1.2.1标准溶液的配制
准确称取0.0200 g (精确至0.0001 g)硝磺草酮标准样品于100 mL容量瓶中,用色谱乙腈溶解并定容,配置成200 μg/mL的标准储备液。再逐级稀释成所需系列的标准工作溶液,-20℃避光保存。
1.2.2样品前处理
称取5.0 g (精确至0.1 g)处理好的大豆样品于50 mL聚四氟乙烯离心管中,加入20 mL乙腈涡旋提取1 min,加入1 g NaCl,涡旋1 min,6000 rpm/min条件下离心5 min。取10 mL上清液于50 mL梨形瓶中并在45℃旋转浓缩蒸发至近干。1 mL色谱乙腈再溶解,转移至装有30 mg GCB 和20 mg C18的2 mL离心管中,涡旋30 s,然后在10000 rpm/min 条件下离心3 min。上清液过0.22 μm滤膜,HPLCMS/MS检测。
1.3分析条件
1.3.1液相色谱条件
液相色谱柱:Luna 3u C18(2) 100A色谱柱 (150×3.0 mm,美国Phenomenex公司);柱温:40℃;流速:0.5 mL/min;进样量:5 μL;流动相:A为乙腈溶液,B为0.1%氨水溶液 (v/v);梯度洗脱条件:0-3.0 min,保持5%A+95%B;3.0-3.5 min,5%A+95%B变为80%A+20%B;3.5-6.0 min,保持80%A+20%B;6.0-6.5 min,80%A+20%B变为5%A+95%B;6.5-9.0 min,保持5%A+95%B。
1.3.2质谱条件
离子化模式:电喷雾离子源,负离子模式 (ESI-)质谱扫描方式;多反应监测 (MRM);气帘气压力:25 kPa;离子喷雾电压:-4500 V;辅助气压1 (N2):50 kPa;辅助气压2 (N2):50 kPa;离子源温度:600℃。硝磺草酮的检测离子、去簇电压和碰撞电压等质谱参数如表1所示。

表1 硝磺草酮的串联质谱测定参数
注:*定量离子 。
2结果与分析
2.1液相色谱条件的优化
电喷雾质谱的电离是在溶液状态电离,流动相的组成会影响到目标化合物的峰形和离子化效率,进而影响灵敏度[19]。本试验研究了乙腈-水、乙腈-0.1%甲酸 (v/v)和乙腈-0.1%氨水 (v/v)3种流动相体系,结果表明,在ESI-电离模式下,0.1%氨水溶液有利于硝磺草酮离子化,提高硝磺草酮的响应值。然后,对比了流动相乙腈-5%,50%和95%氨水溶液对色谱峰面积的影响。结果表明,随着氨水含量增加,峰面积逐渐增大,响应增强。因此,最终确定乙腈-95%氨水溶液作为流动相 (图1)。

图1 流动相对目标化合物色谱峰面积的影响
(A:乙腈∶水=50∶50;B:乙腈∶0.1%甲酸=50∶50;C:乙腈∶0.1%氨水=95∶5;D:乙腈∶0.1%氨水=50∶50;E:乙腈∶0.1%氨水=5∶95,体积比)
2.2样品前处理方法的优化
2.2.1提取溶剂的优化
提取溶剂在前处理过程中是一个重要的影响因素,本试验根据不同溶剂的物理化学特性,比较了甲醇、乙酸乙酯、丙酮、二氯甲烷和乙腈的提取效果。结果表明,随着硝磺草酮在不同溶剂中溶解度的增大,回收率依次增大,分别为2.97、57.19、62.85、72.07和93.51%。因此,选择乙腈作为最佳提取溶剂 (图2)。
2.2.2提取溶剂用量和提取时间的优化
试验考察了乙腈用量 (10、20和30 mL)对回收率的影响。结果表明,随着溶剂量增大,回收率也逐渐增大。然而,当提取溶剂为20和30 mL时,回收率没有显著差别。因此,为了节省溶剂,选择20 mL作为最佳提取溶剂。提取时间也是影响回收率的重要因素,在该项研究中,对比了1、2、3和4 min的提取效果。大豆富含油脂和蛋白,是一种复杂的基质,如果涡旋时间太长,会提取出更多的杂质。由图3可知,提取溶剂为20 mL时,涡旋2和3 min时的回收率差别不大,涡旋4 min时回收率反而降低。因此,为了兼顾回收率、节约时间和尽量减小基质干扰,选择2 min作为最佳提取时间。
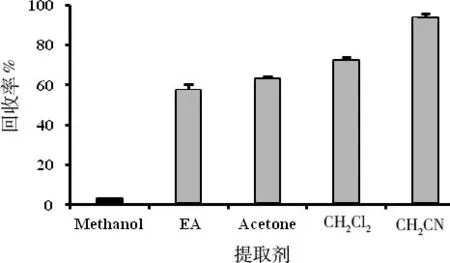
图2 提取剂对大豆中硝磺草酮回收率的影响

图3 提取剂用量和提取时间对大豆中硝磺草酮
2.2.3吸附剂的优化
目前,QuEChERS常用的吸附剂主要有PSA、C18和GCB。C18比较适合去除脂类等疏水性杂质;PSA是一种弱阴离子交换剂,主要用于去除脂肪酸,但干扰物在ESI负离子模式下会对目标物产生严重的离子抑制现象;GCB主要用于去除色素类物质,对于芳香族化合物具有较强的去除能力[20]。在该项研究中,分别考察了10、20、30、40和50 mg 的PSA、C18或GCB 对回收率的影响。发现经PSA、C18和GCB净化后的回收率分别为1.49-12.32%,80.97-104.19%和93.23-99.68%。表明PSA作为吸附剂时,硝磺草酮的质谱响应被抑制。因此,20 mg C18和30 mg GCB作为吸附剂是去除干扰物、保证灵敏度的最佳选择 (图4)。
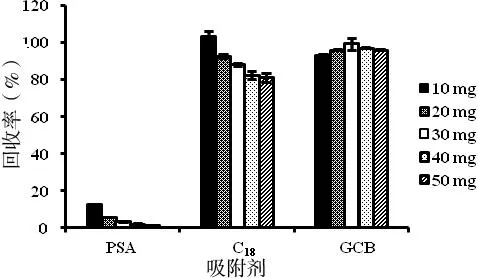
图4 不同吸附剂对大豆中硝磺草酮
2.3基质效应的考察
基质效应 (ME)通过以下公式进行计算[21-22]:
m基质和m溶剂分别为目标物基质标准曲线的斜率和溶剂标准曲线的斜率。ME为零时表明没有基质效应存在,ME为正值时表明存在基质增强效应,ME为负值时表明存在基质减弱效应。
按照优化的前处理方法制备大豆基质标准溶液,在优化的色谱条件下进行分析检测并绘制出溶剂标准曲线和基质标准曲线,线性方程分别为y= 11431953x+ 123565 (R2= 0.9975)和y= 13525586x+ 88645 (R2= 0.9994)。计算得ME = 0.18,表明硝磺草酮在大豆中存在基质增强效应。因此,为了确保结果的准确性,在实际样品检测过程中,采用基质标准曲线进行定量分析。
2.4方法确证
2.4.1线性关系、检出限和定量限
以基质标准溶液浓度为横坐标,硝磺草酮定量离子的色谱峰峰面积为纵坐标,绘制基质标准曲线。结果表明,硝磺草酮在0.0075-0.75 μg/mL的浓度范围内呈良好的线性关系,相关系数>0.999。方法的检出限 (LOD,S/N=3)和定量限 (LOQ,S/N=10)分别为0.0009和0.003 mg/kg,能够满足大豆中硝磺草酮的残留检测。
2.4.2准确度和精密度
用空白大豆样品进行加标回收率实验,分别在0.003、0.03和0.3 mg/kg水平下加标,每个浓度水平重复5次实验。由表2可知,本方法的日内平均回收率为83.84-96.24%,日内相对标准偏差 (RSD)为1.99-3.78%;日间平均回收率为85.13-95.25%,日间RSD为2.11-3.47%,可以满足实际样品的测定需要。

表2 硝磺草酮在大豆上的添加回收率和精密度实验结果
2.5实际样品检测
为验证本方法的适用性和实用性,对采自贵州、江西、黑龙江和浙江四省不同地区市场上的40份大豆样本进行检测。检测结果表明,样本中硝磺草酮的含量均低于方法检出限。
3结论
通过对流动相组分和流速的考察,建立了检测大豆中硝磺草酮的HPLC-MS/MS分析方法。同时通过改进的QuEChERS前处理方法处理大豆样品,重点考察了提取溶剂、提取溶剂用量、提取时间和吸附剂对回收率的影响,简化了前处理步骤。试验结果表明,本方法具有准确、简单、灵敏、快速等优点,能有效满足大豆样本中硝磺草酮的残留测定要求,为硝磺草酮在大豆上的残留分析及市场监测提供一种可靠的分析方法。下一步的研究重点是硝磺草酮在大豆上的消解动态情况。
参考文献:
[1]Capriotti A L, Caruso G, Cavaliere C,etal. Identification of potential bioactive peptides generated by simulated gastrointestinal digestion of soybean seeds and soy milk proteins [J].JournalofFoodCompositionandAnalysis, 2015(44):205-213.
[2]Dagostin J L A, Carpiné D, Corazza M L. Extraction of soybean oil using ethanol and mixtures with alkyl esters (biodiesel) as co-solvent: Kinetics and thermodynamics [J].IndustrialCropsandProducts, 2015(74):69-75.
[3]Sutton P, Richards C, Buren L,etal. Activity of mesotrione on resistant weeds in maize [J].PestManagementScience, 2002, 58(9):981-984.
[4]Mccurdy J D, Mcelroy J S, Kopsell D A,etal. Effects of Mesotrione on Perennial Ryegrass (Lolium perenne L.) Carotenoid Concentrations under Varying Environmental Conditions [J].JournalofAgricultureandFoodChemistry, 2008(56):9133-9139.
[5]高爽,张宗俭,安伟良,等. 玉米田除草剂甲基磺草酮的生物活性及安全性 [J]. 农药,2004,43(10): 469-471.
[6]Castorina R, Bradman A, Fenster L,etal. Comparison of Current-Use Pesticide and Other Toxicant Urinary Metabolite Levels among Pregnant Women in the CHAMACOS Cohort and NHANES [J].EnvironmentalHealthPerspectives, 2010(118):856-863.
[7]Oluwole O, Cheke R A. Health and environmental impacts of pesticide use practices: a case study of farmers in Ekiti State [J].InternationalJournalofAgriculturalSustainability, 2009(7):153-163.
[8]CodexAlimentarius Committee (CAC). http://www.codexalimentarius.net/mrls/pestdes/jsp/pest_q-e.jsp.
[9]Barchanska H, Rusek M, Szatkowska A. New procedures for simultaneous determination of mesotrione and atrazine in water and soil. Comparison of the degradation processes of mesotrione and atrazine [J].EnvironmentalMonitoringandAssessment, 2012(184):321-334.
[10]Halle A T, Lavieille D, Richard C. The effect of mixing two herbicides mesotrione and nicosulfuron on their photochemical reactivity on cuticular wax film [J].Chemosphere, 2010(79):482-487.
[11]Alferness P, Wiebe L. Determination of Mesotrione Residues and Metabolites in Crops, Soil, and Water by Liquid Chromatography with Fluorescence Detection [J].JournalofAgricultureandFoodChemistry, 2002(50):3926-3934.
[12]HalleA T, Richard C. Simulated solar light irradiation of mesotrione in natural waters [J].EnvironmentalScience&Technology, 2006(40):3842-3847.
[13]Chen X X, Li W M, Wu Q,etal. Dissipation and Residues of the Herbicide Mesotrione in Maize and Soil in Open Field [J].BulletinofEnvironmentalContaminationandToxicology, 2012(88):772-775.
[14]Pang N N, Wang T L, Hu J Y. Method validation and dissipation kinetics of four herbicides in maize and soil using QuEChERS sample preparation and liquid chromatography tandem mass spectrometry [J].FoodChemistry, 2015(190):793-800.
[15]张代,滕国生,李正强,等. 高效液相色谱-串联质谱法测定食品中硝磺草酮[J]. 分析化学,2012(5):811-812.
[16]邓立刚,李增梅,赵善仓,等. 超高效液相色谱-串联质谱法测定玉米中硝磺草酮及其代谢物残留量[J]. 分析化学,2013, 41(8):1269-1273.
[17]Sun Y B, Xu Y M, Sun Y,etal. Dissipation and Dynamics of Mesotrione in Maize and Soil Under Field Ecosystem [J].BulletinofEnvironmentalContaminationandToxicology, 2013(90):242-247.
[18]储晓刚,雍炜,凌云,等. 超高效液相色谱一电喷雾串联质谱法同时测定大豆中107种除草剂残留[J]. 分析化学,2008,36(3):325-329.
[19]Ramalhosa M J, Paiga P, Morais S,etal. Oliveira M B. Analysis of polycyclic aromatic hydrocarbons in fish: evaluation of a quick, easy, cheap, effective, rugged, and safe extraction method [J].JournalofSeparationScience, 2009(32):3529-3538.
[20]Utture S C, Banerjee K, Dasgupta S,etal. Dissipation and Distribution Behavior of Azoxystrobin, Carbendazim, and Difenoconazole in Pomegranate Fruits [J].JournalofAgricultureandFoodChemistry, 2011(59):7866-7873.
[21]Huan Z B, Xu Z, Lv D Z,etal. Dissipation and Residues of Difenoconazole and Azoxystrobin in Bananas and Soil in Two Agro-Climatic Zones of China [J].BulletinofEnvironmentalContaminationandToxicology, 2013(91):734-738.
A novel QuEChERSmethod to determine the mesotrioneresidue in soybean
WANGXiao-huan,KANGDi,WANGDe-piao,WUYu-e,ZENGSong,ZHANGKan-kan*,HUDe-yu*
(CenterforResearchandDevelopmentofFineChemicals,GuizhouUniversity,Guiyang,Guizhou550025,China)
Abstract:A novel QuEChERS method was developed for the rapid determination of mesotrione residue in soybean using high performance liquid chromatography tandem-mass spectrometry (HPLC-MS/MS). The samples were extracted with acetonitrile, then salted out with NaCl, purified with GCB and Cl8, separated on a phenomenex Luna 3u C18 (2) 100A column with gradient elution by using acetonitrile and 0.1% ammonia aqueous as eluant, and detected by HPLC-MS/MS under negative electrospray ionization (ESI-) and multiple-reaction monitoring (MRM) models. Under these conditions, mesotrione showed a good linear relationship (R2>0.997) in the concentration range of 0.0075-0.75 μg/mL, and the limit of quantification (LOQ) and limit of detection (LOD) in soybean were 0.003 and 0.0009 mg/kg, respectively. Three spiked levels at 0.003, 0.03 and 0.3 mg/kg were investigated, and the intra-day average recoveries ranged from 83.84% to 96.24%, with intra-day relative standard deviations (RSDs) of 1.993.78%, the inter-day average recoveries ranged from 85.13% to 95.25%,inter-day RSDs of 2.113.47%, which met the requirement of mesotrione determination in soybean.
Key words:Mesotrione; Soybean; QuEChERS (Quick, Easy, Cheap, Effective, Rugged, and Safe); High performance liquid chromatography-tandem mass spectrometry
文章编号:1008-0457(2016)01-0029-05国际DOI编码:15958/j.cnki.sdnyswxb.2016.01.007
中图分类号:O658
文献标识码:A
*通讯作者:胡德禹(1965-),女,研究员,主要研究方向:农药残留分析研究,E-mail:fcc.dyhu@gzu.edu.cn;张侃侃(1984-),男,副教授,主要研究方向:农药残留分析研究,E-mail:kankan16@126.com。
基金项目:公益性行业(农业)科研专项 (201203022);贵州省重大科技专项项目 (黔科合重大专项字[2013]6024号);贵州大学研究生创新基金项目 (研理工2015052)。
收稿日期:2015-01-11;修回日期:2016-02-10
