新型钌配合物通过内源性线粒体凋亡通路诱导Bel-7402细胞凋亡的机制
2016-05-26王金全薄华本陈启助
王金全,薄华本,陈启助
(广东药科大学 广东省生物技术候选药物研究重点实验室,广东 广州 510006)
新型钌配合物通过内源性线粒体凋亡通路诱导Bel-7402细胞凋亡的机制
王金全,薄华本,陈启助
(广东药科大学 广东省生物技术候选药物研究重点实验室,广东 广州 510006)
摘要:目的 研究钌配合物Ru-HMIP对肝癌细胞Bel-7402的抑制作用及其机制。方法 MTT法检测Ru-HMIP对Bel-7402细胞的杀伤作用;流式细胞术检测其诱导细胞凋亡情况;JC-1荧光探针检测线粒体膜电位;DCFH-DA荧光探针检测细胞内活性氧(ROS);Western blot检测细胞凋亡相关蛋白。结果 Ru-HMIP对Bel-7402细胞有较强的杀伤效果;其对细胞毒性作用是通过诱导细胞凋亡方式;Ru-HMIP在Bel-7402细胞中产生过量ROS,并且这种作用及其细胞毒性都可被还原剂乙酰半胱氨酸(NAC)所阻断。Ru-HMIP可以破坏Bel-7402细胞线粒体膜电位;上调Bax,下调Bcl-2,同时激活Caspase-9及Caspase-3。结论 Ru-HMIP可以在体外有效抑制Bel-7402细胞增殖,其作用机制是在细胞内诱发过量ROS,继而通过内源性线粒体凋亡通路诱导细胞凋亡。
关键词:钌配合物; Bel-7402细胞; ROS; 凋亡通路
肝癌是临床最为常见的恶性肿瘤之一,其发病率逐年上升,每年全世界新增约63万例肝癌患者[1]。目前肝癌的治疗效果并不理想,且病死率高,所以亟需研发新的治疗药物。近些年,基于金属钌的配合物由于具有更强的抗肿瘤活性和较低的系统毒性,成为最有可能应用于临床的新一代金属抗肿瘤药物[2]。至今已经有3种金属钌抗肿瘤药物NAMI-A、KP1019和NKP1339进入了临床研究阶段,并且得到了较好的研究结果[3]。钌配合物的抗肿瘤作用机制呈现多靶点和多机制的特点,其中包括抑制DNA拓扑异构酶,产生活性氧(ROS),蛋白激酶抑制,通过稳定G-四链体DNA而抑制端粒酶活性等[4- 5]。本课题组前期设计合成并筛选出一系列具有高活性、相对低毒性的手性钌多吡啶配合物,它们对多种癌细胞表现出良好的杀伤活性,并且对正常肝细胞L02表现较低的毒性,有可能成为新型的选择性化疗候选药物[6]。为了探明其抗瘤谱及研究相关作用机制,本次研究选取活性较好的钌配合物Ru-HMIP为研究对象,以人肝癌细胞Bel-7402为研究模型,探讨Ru-HMIP对Bel-7402的抗肿瘤效果及相关作用机制,以期为肝癌的治疗及Ru-HMIP的进一步研究和开发提供参考。
1材料与方法
1.1主要材料、试剂及仪器
Ru-HMIP合成方法参照本课题组已发表文献[6],用DMSO配制成20 mmol/L储备液,4 ℃存放备用。DMEM细胞培养基、胎牛血清(Hyclone公司);MTT、Annexin V-FITC/PI试剂盒、JC-1试剂盒、DCFH-DA(Invitrogen公司);Western blot 抗体(Abcam公司);其他常用生化试剂如PBS及蛋白提取试剂盒及测定试剂(碧云天生物科技公司);550型酶标仪(Bio-rad,美国);高速冷冻离心机(Eppendorf centrifuge 5430,美国);倒置荧光显微镜(Zeiss Axio D1,德国);FACSCanto II流式细胞仪(BD Biosciences,美国);Western blot小型电泳系统(Bio-rad mini,美国)。
1.2肿瘤细胞培养
肝癌细胞株Bel-7402为本实验室保存。细胞置于37 ℃,5%(φ)CO2饱和湿度的培养箱中,在含有10%(φ)新生胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养基中培养和传代。如无特殊说明,实验所用细胞均处于对数生长期。
1.3噻唑蓝比色法(MTT法)检测Ru-HMIP对Bel-7402细胞杀伤活性
实验细胞置于37 ℃,5%CO2饱和湿度的培养箱中生长至对数期,0.25%胰酶消化收集细胞,调整细胞悬液浓度,使细胞密度大约在1×104/mL,每孔100 μL接种于96孔板,置于培养箱中培养24 h。换液,加入不同浓度的Ru-HMIP,每个浓度做3个平行样,设置空白调零组(培养基、MTT、DMSO),空白组(培养基、细胞、相同浓度的药物溶解介质、MTT、DMSO),继续孵育24 h。吸去上清,每孔加入90 μL新鲜培养液,再加入10 μL MTT溶液(5 mg/mL,即0.5%MTT),培养4 h。终止培养,弃去孔内培养液,每孔加入150 μL DMSO,置于摇床上低速振荡30 min,使结晶物充分溶解,酶标仪检测490 nm波长各孔的A值。相关的细胞增殖的抑制率及半数抑制浓度(IC50)用下面的公式进行计算:生长抑制率=(A对照-A实验)/(A对照-A空白),所有A值均减去空白调零组A值。将抑制率与药物浓度作图,得出剂量反应曲线,计算IC50值。
1.4Annexin V-FITC/PI双染检测Ru-HMIP诱导Bel-7402细胞凋亡
收集Bel-7402细胞,调整细胞悬液浓度,6孔板中每孔接种约2×105个细胞,置于培养箱中培养约24 h。换液,加入不同浓度Ru-HMIP,孵育24 h。小心吸去上清,0.25%胰酶消化收集细胞,1 000 r/min,离心5 min,去上清,加入100 μL PBS重悬,用滤网过滤。1 000 r/min,离心5 min,去上清,加入100 μL 1× Binding Buffer重悬细胞,分别加入5 μL Annexin V-FITC和1 μL PI,室温孵育15 min,加入400 μL 1× Binding Buffer,用FACSCanto II流式细胞仪上机检测。
1.5细胞内ROS检测
收集Bel-7402细胞,调整细胞悬液浓度,6孔板中每孔接种约2×105个细胞,置于培养箱中培养约24 h。换液,加入不同浓度的Ru-HMIP及H2O2,孵育12 h。吸去上清,0.25%胰酶消化收集细胞,然后各孔加入10 μmol/L DCFH-DA荧光探针,37 ℃孵育30 min。离心去上清,PBS重悬,用FACSCanto Ⅱ流式细胞仪检测分析,激发波长488 nm。为观察ROS清除剂N-乙酰半胱氨酸(NAC)对Ru-HMIP诱发ROS或者细胞毒性的影响,另外设NAL干预组,在加入Ru-HMIP或者H2O2前1 h加入浓度为10 mol/L的NAC,孵育相应时间,流式细胞术检测ROS,MTT法检测细胞毒性。
1.6JC-1荧光染色检测Ru-HMIP对Bel-7402线粒体膜电位影响
收集Bel-7402细胞,调整细胞悬液浓度,将细胞接种于6孔板,每孔2 mL,每孔接种约2×105个细胞。置于37 ℃、5%CO2饱和湿度的培养箱中培养12 h。换液,加入不同浓度Ru-HMIP,每一个浓度设3个平行孔,同时设置加入相同浓度药物溶解介质的空白对照孔,继续培养12 h。吸出上清,PBS洗涤2次,加入500 μL JC-1工作液,37 ℃,室温暗处孵育15 min,吸出工作液,PBS洗涤2次,荧光倒置显微镜下观察拍照。
1.7蛋白免疫印迹(Western blot)技术检测细胞凋亡信号通路
蛋白样品制备,收集Bel-7402细胞,调整细胞悬液浓度,6孔板中每孔接种约2×105个细胞,置于培养箱中过夜。换液,加入不同浓度Ru-HMIP孵育24 h,收集细胞,按试剂盒步骤提取蛋白(其中细胞色素C的分析提取是细胞质蛋白,其他蛋白分析提取的为总细胞蛋白)。测量提取蛋白浓度,将各组蛋白浓度用提取液调至相同。取适量的蛋白样品,加入上样缓冲液稀释,100 ℃加热5 min使蛋白变性,20 000 r/min离心,取上清待用。SDS-PAGE电泳,转到PVDF膜,转膜结束后取出膜用TBST冲洗一遍,浸没于封闭液封闭1 h。把膜从封闭液里取出,用TBST冲洗一遍后,浸没于一抗里,置于4 ℃孵育过夜。一抗孵育结束后,用TBST洗膜3次,每次6 min。加入相应二抗室温摇床孵育1 h。二抗孵育结束后,用TBST洗膜3遍,每次5 min。然后将ECL均匀滴加到PVDF膜,覆盖上保鲜膜,置于曝光盒内后曝光显影。根据目的蛋白信号强弱选择曝光时间以获得最佳效果,扫描胶片,保存分析结果。
2结果
2.1Ru-HMIP对Bel-7402细胞的抑制作用
体外实验显示(表1),不同实验浓度的Ru-HMIP均能够有效杀伤Bel-7402肝癌细胞,且随着剂量的增大抑制率增高,存在剂量-效应关系,其半数抑制浓度为6.98 μmol/L,95%可信区间为5.97~8.17 μmol/L。
2.2Ru-HMIP对Bel-7402细胞凋亡的影响
剂量为5 μmol/L的Ru-HMIP作用Bel-7402细胞24 h后,检测到9.4%的细胞发生早期凋亡,11.6%发生晚期凋亡;作用浓度为10 μmol/L时,34.3%的细胞处于早期凋亡状态,19.7%的细胞处于晚期凋亡状态。当作用浓度提高到20 μmol/L时,共有71%的细胞处于凋亡状态(图1)。
表1Ru-HMIP作用24 h 后对Bel-7402细胞增殖的影响
Table 1Effect of Ru-HMIP on Bel-7402 cell proliferation

组别剂量/(μmol·L-1)抑制率/%IC50/(μmol·L-1)对照组-00.1%DMSO-2.21±0.65Ru-HIMP2.520.56±3.466.98545.23±4.661056.34±4.6595%可信区间=2082.38±5.47(5.97~8.17)4092.13±6.65
2.3Ru-HMIP对Bel-7402细胞内ROS水平及其对细胞毒性的影响
Ru-HMIP作用于Bel-7402细胞12 h后,可以产生剂量依赖的ROS,其水平与阳性对照H2O2相当。同时,NAC可以完全抑制Ru-HMIP或者H2O2在Bel-7402细胞中诱发的ROS(图 2A)。进一步研究了Ru-HMIP产生的ROS与其细胞毒性的相关性,结果显示,在将Bel-7402细胞预先用NAC处理之后,可以明显降低H2O2或者Ru-HMIP对Bel-7402产生的细胞毒性(图 2B)。
2.4Ru-HMIP对Bel-7402细胞线粒体膜电位影响
荧光倒置显微镜检测细胞线粒体膜电位结果显示(图3),Ru-HMIP作用Bel-7402细胞12 h后,由于其线粒体去极化导致线粒体膜电位的下降,JC-1在线粒体基质中形成的聚集体减少,导致在给药组细胞内的绿色荧光增强,相对于对照组的荧光曲线截面发生偏移。随着Ru-HMIP浓度的增加,细胞内绿色荧光强度逐渐增加,说明Ru-HMIP的确引起了Bel-7402细胞线粒体膜电位的下降。
2.5Ru-HMIP对Bel-7402细胞凋亡通路的影响
Ru-HMIP作用于Bel-7402细胞24 h后,细胞中非活化的Caspase-9含量降低,而活化型Caspase-9含量增加,且呈现良好的剂量-效应关系。相应地,细胞中非活化的Caspase-3表达量降低,活化的Caspase-3表达量上调。同时,Ru-HMIP作用于Bel-7402后,细胞质中细胞色素C的含量明显升高。另外,另一组重要的与凋亡相关的Bcl蛋白家族分子检测结果显示,Ru-HMIP明显抑制了抗凋亡蛋白Bcl-2的表达,并增加了促凋亡蛋白Bax的表达水平。见图4。
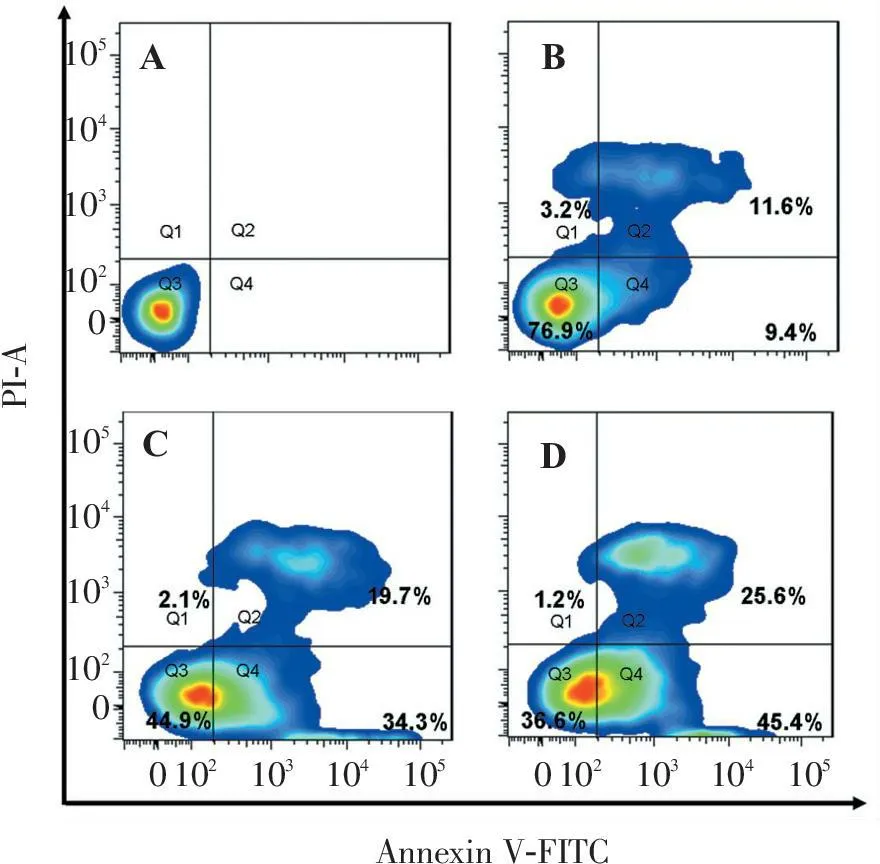
PI-A10510410310201051041031020AnnexinV-FITCABCD01021031041050102103104105
A. 空白对照细胞; B. Ru-HMIP(5 μmol/L)处理24 h;
C. Ru-HMIP(10 μmol/L)处理24 h; D. Ru-HMIP(20 μmol/L)处理24 h。Q3.存活细胞; Q4.早期凋亡细胞; Q2.晚期凋亡细胞。
图1Annexin V-FITC/PI双染检测Ru-HMIP诱导Bel-7402细胞凋亡
Figure 1Apoptosis of Bel-7402 cells induced by Ru-HMIP detected by annexinV-FITC/PI assay
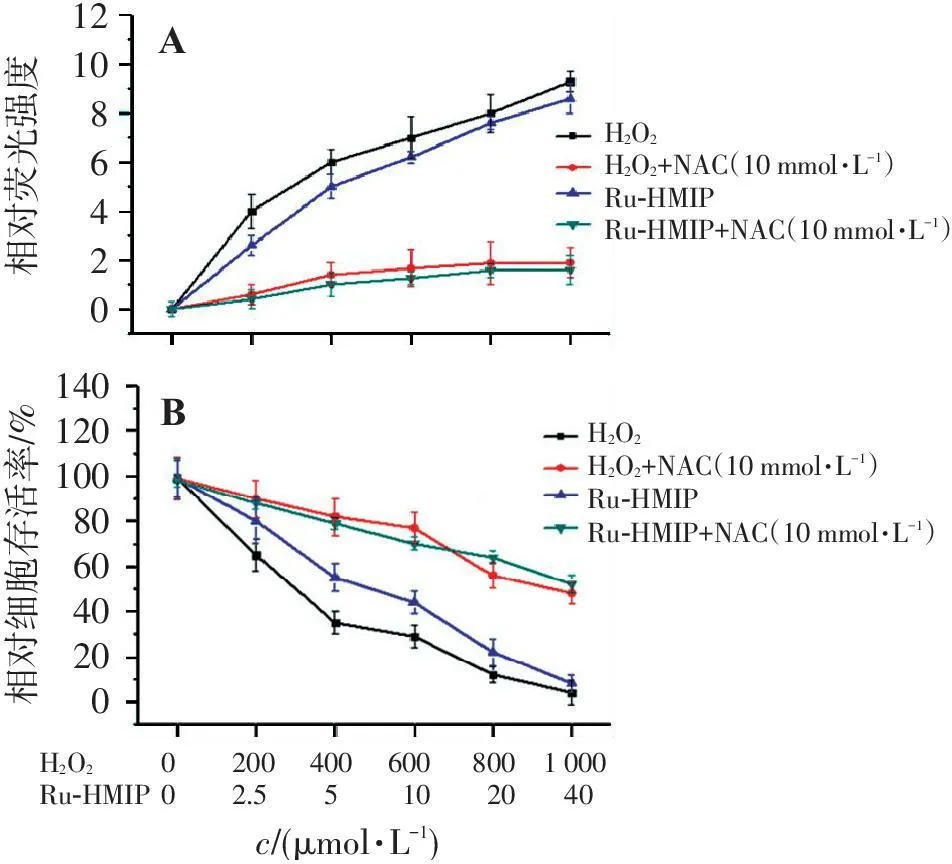
121086420140120100806040200AB相对荧光强度相对细胞存活率/%h1O2h1O2+NAC(10mmol?L-1)Ru-HMIPRu-HMIP+NAC(10mmol?L-1)h1O2h1O2+NAC(10mmol?L-1)Ru-HMIPRu-HMIP+NAC(10mmol?L-1)h1O2Ru-HMIP0200400600800100002.55102040c/(μmol?L-1)
A. Ru-HMIP或者H2O2作用于Bel-7402细胞后ROS水平及NAC对其影响; B. Ru-HMIP或者H2O2对Bel-7402的细胞毒性以及NAC对其影响。
图2Ru-HMIP诱发Bel-7402细胞内ROS及其细胞毒性
Figure 2ROS and cytotoxicity on Bel-7402 cells induced by Ru-HMIP

A.空白对照细胞; B. Ru-HMIP(5 μmol/L)处理12 h; C. Ru-HMIP(10 μmol/L)处理12 h; D. Ru-HMIP(20 μmol/L)处理12 h。
图3Ru-HMIP对Bel-7402细胞线粒体膜电位作用 (JC-1染色,200×)
Figure 3Effect of Ru-HMIP on mitochondrial membrane potential of Bel-7402 cells(JC-1,200×)

Bcl-2BaxCaspase-9C-Caspase-9Caspase-3C-Caspase-3Cyto-Cβ-actin1234
1. Con; 2. 5 μmol/L Ru-HMIP; 3. 10 μmol/L Ru-HMIP;
4. 20 μmol/L Ru-HMIP。
图4不同配合物浓度作用细胞凋亡通路相关蛋白WB结果Figure 4Effect of Ru-HMIP at different concentrations on the expression of cell apoptotic proteins
3讨论
线粒体中的一系列代谢过程与细胞发生凋亡密切相关,一些外源性化合物可以诱导呼吸链中ROS的过度生成,通过内源性线粒体凋亡通路诱导细胞发生凋亡[9]。本研究显示,Ru-HMIP可以在Bel-7402细胞中诱导产生大量ROS,继而导致线粒体的内外膜间膜电位崩坍,期间伴随着Bax表达上调,Bcl-2表达下调(图4)。Bcl-2家族成员是线粒体通透性的关键调节者。其中抗凋亡蛋白Bcl-2可以抑制线粒体的通透性,阻滞细胞色素C从线粒体释放,Bax可以与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,是促凋亡蛋白。此消彼长导致线粒体内膜非特异性孔道产生,导致线粒体膨大,细胞色素C从内膜脱落并流失到胞浆中,激活了相应的Caspase蛋白(图4)。Caspase蛋白家族是细胞凋亡通路重要的蛋白因子,其中Caspase-9活化剪切Caspase-3是线粒体凋亡通路中重要环节[10]。Ru-HMIP作用于Bel-7402后,细胞中非活化的Caspase-9含量降低,而活化型Caspase-9增多。相应地,细胞中非活化的Caspase-3含量下调,活化的Caspase-3上调,而Caspase-3的激活被认为是细胞发生不可逆凋亡的标志。
综上所述,Ru-HMIP能够有效诱导肝癌细胞Bel-7402发生凋亡,其作用机制是在细胞内产生过量的ROS,导致线粒体膜电位下降,继而影响Bcl-2蛋白家族表达量的变化,引起线粒体膜通透性的增强,细胞色素C渗漏到细胞浆中,最后激活了Caspases家族,最终导致细胞发生凋亡。
参考文献:
[1] 李新建,陈保华,姚斌,等.下调UHRF1的表达在抑制肝癌进展中的作用 [J]. 肿瘤防治研究,2015,42(7):666-670.
[2] BERGAMO A,GAIDDON C,SCHELLENS J H,et al. Approaching tumour therapy beyond platinum drugs:status of the art and perspectives of ruthenium drug candidates [J]. J Inorg Biochem,2012,106(1):90-99.
[3] ZHANG Yao,HO A,YUE Jiping,et al. Structural basis and anticancer properties of ruthenium-based drug complexed with human serum albumin[J]. Eur J Med Chem,2014,86(347):449-455.
[4] JAROSZ M,MATCZUK M,PAWLAK K,et al. Molecular mass spectrometry in metallodrug development:a case of mapping transferrin-mediated transformations for a ruthenium(Ⅲ) anticancer drug [J]. Anal Chim Acta,2014,851(6):72-77.
[5] BRUIJNINCX P C,SADLER P J. Controlling platinum,ruthenium and osmium reactivity for anticancer drug design [J]. Adv Inorg Chem,2009,61(1):1-62.
[6] WANG J Q,ZHANG P Y,Qian C,et al. Mitochondria are the primary target in the induction of apoptosis by chiral ruthenium(Ⅱ) polypyridyl complexes in cancer cells [J]. J Biol Inorg Chem,2014,19(3):335-348.
[7] XIANG T,DU L,PHAM P,et al. Nelfinavir,an HIV protease inhibitor,induces apoptosis and cell cycle arrest in human cervical cancer cells via the ROS-dependent mitochondrial pathway [J]. Cancer Lett,2015,364(1):79-88.
[8] SHIMAMOTO K,HAYASHI H,TANIAI E,et al. AntioxidantN-acetyl-L-cysteine(NAC) supplementation reduces reactive oxygen species(ROS)-mediated hepatocellular tumor promotion of indole-3-carbinol(I3C) in rats [J]. J Toxicol Sci,2011,36(6):775-786.
[9] KIAZAKI M,XIAN M,SAGAWA M,et al. Induction of apoptosis via the modulation of reactive oxygen species(ROS) production in the treatment of myeloid leukemia [J]. Curr Pharm Biotechnol,2006,7(5):323-329.
[10] FIANDALO M V,KYPRIANOU N. Caspase control:protagonists of cancer cell apoptosis [J]. Exp Oncol,2012,34(3):165-175.
(责任编辑:幸建华)
Mechanism of novel ruthenium complex on induction of intrinsic mitochondria-mediated apoptosis in Bel-7402 cells
WANG Jinquan,BO Huaben,CHEN Qizhu
(GuangdongProvincialKeyLaboratoryofBiotechnologyCandidateDrugResearch,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Abstract:Objective To study the cytotoxicity and its mechanism of ruthenium complex Ru-HMIP on liver cancer Bel-7402 cells. Methods MTT assay was employed to determine the cytotoxicity of Ru-HMIP. The apoptosis was detected by flow cytometry. The mitochondrial membrane potential was determined by JC-1 probe and the formation of intracellular ROS was measured by DCFH-DA probe. Western blot was performed to study the apoptosis pathway. Results Ru-HMIP inhibited effectively the growth of Bel-7402 cells by induction of cell apoptosis. Ru-HMIP enhanced the production of ROS in Bel-7402 cells,which could be inhibited by NAC. In addition,the cytotoxicity of Ru-HMIP was prohibited by NAC. After treated by Ru-HMIP,the collapse of the mitochondrial membrane potential was found. Meanwhile,the upregulation of Bax,down-regulation of Bcl-2,and activation of Caspase-9 and Caspase-3 were observed. Conclusion Ru-HMIP inhibits the growth of Bel-7402 cells in vitro. The mechanism of Ru-HMIP cytotoxicity is attributed to excess ROS induction in Bel-7402 cells,which destroys the mitochondrial membrane potential and triggers intrinsic mitochondria-mediated apoptosis.
Key words:ruthenium complex; Bel-7402 cells; ROS; apoptosis pathway
DOI:10.16809/j.cnki.1006-8783.2016011702
中图分类号:R730.2
文献标志码:A
文章编号:1006-8783(2016)02-0238-03
作者简介:王金全(1979—),男,博士,讲师,主要从事抗肿瘤药物研究,Email:solo_wjq@126.com。
基金项目:国家自然科学基金项目(81403317);广东省科技计划项目(2015A020211037)
收稿日期:2016-01-17
网络出版时间:2016-04-11 17:03网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160411.1703.005.html
