17-β-雌二醇对人肝细胞癌细胞MHCC97H侵袭转移的作用及其机制
2016-05-25邹三鹏沙焕臣广东医学院附属惠东医院肿瘤内科惠州56300西安交通大学第一附属医院肝胆外科通讯作者mailshahuanchen963com
邹三鹏, 沙焕臣 (广东医学院附属惠东医院肿瘤内科,惠州 56300; 西安交通大学第一附属医院肝胆外科;通讯作者,E-mail: shahuanchen9@63.com)
17-β-雌二醇对人肝细胞癌细胞MHCC97H侵袭转移的作用及其机制
邹三鹏1, 沙焕臣2*(1广东医学院附属惠东医院肿瘤内科,惠州516300;2西安交通大学第一附属医院肝胆外科;*通讯作者,E-mail: shahuanchen229@163.com)
摘要:目的观察17-β-雌二醇对人MHCC97H肝癌细胞侵袭转移的作用,探讨其相应机制。方法用不同浓度17-β-雌二醇(0,0.1,1,10 μmol/L)干预MHCC97H肝癌细胞24 h。Transwell小室法检测17-β-雌二醇干预后MHCC97H肝癌细胞侵袭能力的改变。利用real-time PCR和Western blot法检测17-β-雌二醇干预对MHCC97H肝癌细胞中E-cadherin和Vimentin RNA和蛋白表达水平的改变。Western blot检测17-β-雌二醇对MHCC97H细胞中Smad2和p-Smad2蛋白表达水平的影响。结果17-β-雌二醇能够有效抑制MHCC97H肝癌细胞的侵袭能力,随着浓度的升高抑制能力逐渐增强(P<0.05)。当浓度超过0.1 μmol/L 时,17-β-雌二醇能够有效抑提高MHCC97H肝癌细胞中E-cadherin的转录和蛋白表达,并同时抑制细胞中Vimentin蛋白的表达(P<0.05);当浓度超过0.2 μmol/L 时,17-β-雌二醇能够有效抑制Vimentin的转录(P<0.05)。进一步的检测发现当浓度超过0.1 μmol/L 时,17-β-雌二醇能够有效抑制MHCC97H细胞中Smad2的磷酸化水平(P<0.05)。结论17-β-雌二醇能够有效抑制MHCC97H肝癌细胞的侵袭,这种作用可能与其通过抑制Smad2的磷酸化进一步调节E-cadherin和Vimentin的表达有关。
关键词:17-β-雌二醇;肝细胞癌;MHCC97H细胞;细胞侵袭;Smad 2;E-cadherin;Vimentin
肝细胞癌是临床常见的恶性肿瘤之一,具有高死亡率和治疗手段有限的特点。流行病学调查显示,肝癌在男性中的发病率明显高于女性[1]。同时又有研究发现,在从慢性肝病向肝癌发展的过程中男性患者的进展速度也明显快于女性,且预后较差[2],男性慢性肝病患者发生肝癌的风险是女性患者的3-5倍,在用啮齿类动物构建的肝癌模型中,雄性动物发生肝癌的风险明显高于雌性。关于雄激素的研究发现,雄性激素能够诱导并加快肝癌的发展进程[3],异常的雄性激素的代谢改变也与肝癌的发生相关[4]。侵袭转移是造成肝癌患者术后复发、治疗失败和死亡的主要原因[1-3],抗肝癌侵袭转移新药的开发意义重大,是延长肝癌患者生存期、提高远期疗效的重要措施。但至今仍缺乏有效的防治手段。关于17-β-雌二醇与肝癌关系,当前的研究还没有得到一致的结论[3,5-9]。基于以上本研究拟探讨17-β-雌二醇与肝癌侵袭转移的关系,并进一步探讨其可能的作用机制。
1材料与方法
1.1材料
人高侵袭性MHCC97H肝癌细胞株购于上海市复旦大学肝癌研究所。DMEM和胎牛血清购自Sigma 公司,相关引物由TaKaRa公司合成构建。Smad 2和p-Smad2购于Cellsignal公司,E-cadherin 和Vimentin 抗体购于Abcam公司,beta-actin购自Santa-Crus公司。17-β-雌二醇(Estradiol)为Sigma公司产品,RT-PCR试剂均购自RT-PCR公司。
1.2细胞培养与干预
MHCC97H肝癌细胞购于上海市复旦大学肝癌研究所,使用含有100 ml/L胎牛血清的DMEM培养基培养,当细胞融合率达到70%-80%时进行传代,传代间隔约为2-3 d。17-β-雌二醇利用二甲基亚砜(DMSO)溶解,DMSO的最终浓度<0.1%,其后用PBS稀释至工作浓度。待MHCC97H细胞长到融合后,PBS洗涤3次,加入无血清DMEM培养基培养24 h,其后按照实验要求加入相应浓度17-β-雌二醇和含有相应浓度DMSO的PBS(对照)。17-β-雌二醇的浓度均为0,0.1,1,10 μmol/L,处理时间为24 h。其后提取总RNA和蛋白进行real time PCR和免疫印迹分析。
1.3细胞侵袭试验
取对数生长期MHCC97H肝癌细胞,胰酶常规消化后利用含有20 ml/L血清浓度的培养基制成5×105细胞/ml的细胞悬液,在Tranwell小室上室中加入含有不同浓度17-β-雌二醇的细胞悬液0.5 ml,下室中加入1 ml血清浓度为100 ml/L的常规培养基。培养24 h,然后取出小室对细胞进行固定,用棉签去除上室中残留细胞并对小室底部的细胞进行固定、染色和拍照,并在显微镜下进行计数。
1.4实时定量PCR检测苦参碱对E-cadherin 和Vimentin转录的影响
Trizol法提取各组细胞中总RNA,根据TaKaRa公司PrimeScript RT-PCR Kit试剂说明书进行反转录cDNA。以cDNA为模板进行real-time PCR反应并对结果进行分析,引物设计:E-cadherin为5′-TACACTGCCCAGGAGCCAGA-3′和3′-TGGCACCAGTGTCCGGATTA-5′,Vimentin 为5′-TGAGTACCGGAGACAGGTGCAG-3′和3′-TAGCAGCTTCAACGGCAAAGTTC-5′,β-actin 为5′-CCATCGTCCACCGCAAAT-3′和3′-CATGCCAATCTCATCTTGTTT-5′。
1.5免疫印迹试验
17-β-雌二醇处理MHCC97H肝癌细胞24 h,常规消化细胞后冰PBS洗涤2次,加入裂解液裂解细胞,离心提取细胞总蛋白。利用BCA蛋白定量试剂盒检测蛋白浓度,并根据蛋白提取物浓度确定上样量。每次试验之前将蛋白煮沸变性、然后在SDS凝胶中每孔加入等量蛋白,根据目的蛋白的分子量调整电泳时间和电压,电泳结束后转膜,将PVDF膜置于在50 g/L脱脂牛奶中封闭1 h。根据抗体说明书配置一抗浓度,然后将膜封闭于含有各种抗体的溶液中,4 ℃摇床过夜。次日PBST洗膜3次,然后常温封闭相应二抗1 h、再次用PBST洗涤3次,最后一次用PBS洗涤,洗涤时间均为15 min。最后利用成像系统对结果图像进行采集,并对数据进行分析。
1.6统计学分析
2结果
2.117-β-雌二醇对MHCC97H肝癌细胞侵袭的影响
MHCC97H肝癌细胞的侵袭能力较强,对照组培养24 h,穿过基质胶到达小室底端的细胞较多。在17-β-雌二醇干预后,MHCC97H肝癌细胞的侵袭能力受到明显抑制,穿过基质胶到达小室底端的肝癌细胞数量明显减少,随着17-β-雌二醇浓度的增加,穿过基质胶到达小室底端的MHCC97H肝癌细胞的数目逐渐减少(见图1A),0.1,1,10 μmol/L浓度组MHCC97H肝癌细胞穿过基质胶到达小室底端的细胞数目,分别为对照组的(70.11±9.11)%、(49.34±10.52)%和(43.32±14.63)%,具有明显的剂量效应关系(P<0.05,见图1B)。
2.217-β-雌二醇对E-cadherin和Vimentin的转录水平的影响
为了进一步检测17-β-雌二醇抑制MHCC97H肝癌细胞侵袭转移的机制,我们利用real-time PCR技术检测了17-β-雌二醇对E-cadherin和Vimentin mRNA转录水平的影响,结果发现17-β-雌二醇能够在RNA水平明显抑制Vimentin的转录,同时能够有效增强E-cadherin的转录差异具有统计学意义(P<0.05,见图2)。在17-β-雌二醇作用后,E-cadherin的表达水平逐渐降低,而Vimentin的表达水平逐渐升高。
2.317-β-雌二醇对MHCC97H肝癌细胞中E-cadherin和N-cadherin表达的影响
E-cadherin和Vimentin在肝癌的侵袭转移过程中发挥重要作用。在17-β-雌二醇干预后,MHCC97H肝癌细胞中,Vimentin的蛋白表达水平明显降低(P<0.05),而E-cadherin的蛋白表达水平逐渐升高(P<0.05),差异均具有统计学意义(见图3)。

图1 不同浓度17-β-雌二醇对MHCC97H细胞侵袭转移能力的影响 Figure 1 The inhibition effect of 17-β-oestrogen on the invasion of MHCC97H cells
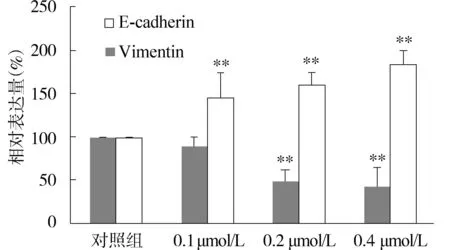
与对照组(0 μmol/L)比较,**P<0.01图2 17-β-雌二醇对MHCC97H细胞中E-cadherin和Vimentin转录水平的影响Figure 2 The effect of 17-β-oestrogen on the expression of E-cadherin and Vimentin in HeLa cells
2.417-β-雌二醇对MHCC97H肝癌细胞中Smad2和p-Smad2的影响
Smad2的磷酸化水平的改变,能够通过调节上皮间质转化过程,调节肿瘤细胞的侵袭转移。我们的结果显示,在17-β-雌二醇作用后Smad2的磷酸化水平明显降低,0.1 μmol/L组、1 μmol/L组和10 μmol/L组分别为对照组的(81.92±23.94)%、(65.38±22.39)%和(47.06±1.47)%,差异具有统计学意义(P<0.05,见图4)。

图3 不同浓度17-β-雌二醇对MHCC97H细胞中E-cadherin和Vimentin蛋白表达水平的影响Figure 3 The inhibition effect of 17-β-oestrogen on the expression of E-cadherin and Vimentin of protein level in MHCC97H cells
3讨论
关于17-β-雌二醇在肝癌发生发展过程中作用至今尚未有定论,但是流行病学调查显示,肝癌在男性患者中的发病率明显较高且预后较差。而侵袭转移是造成肝癌患者死亡主要原因,所以明确17-β-雌二醇在肝癌细胞侵袭转移过程的作用具有重要的理论价值和社会意义。我们的研究结果显示,17-β-雌二醇能够有效抑制MHCC97H肝癌细胞的体外迁移和侵袭能力,提示17-β-雌二醇在肝癌的侵袭转移过程中发挥重要作用。

图4 不同浓度17-β-雌二醇对Smad2和p-Smad2表达的影响 Figure 4 The effect of 17-β-oestrogen on the expression of Smad2 and p-Smad2
近年来研究发现,上皮间质转化(epithelial-mesenchymal transition,EMT)与多种肿瘤密切相关,在肝癌等多种癌症的原位浸润和远处转移中发挥重要作用[4]。此外,EMT在肝癌的发生发展过程中发挥极为重要的作用,在肝炎病毒感染阶段,病毒的感染会导致正常肝细胞通过EMT转化为成纤维细胞等能够促进肝纤维化的细胞,从而引起肝纤维化和肝硬化。同时病毒合成的蛋白还能够通过上调TGF-β相关信号通路的活性,促进EMT的发生从而使得肝细胞变成无限增殖的肿瘤细胞成为可能[5]。在肝癌发生的早期,许多肝癌细胞能够通过EMT获得较强的侵袭能力,从而从原发肿瘤脱离发生侵袭转移,这也是肝癌患者容易发生早期转移的重要原因之一[6]。研究发现EMT在肝癌早期播散过程中发挥重要作用,而twist和vimentin可以作为肝癌发生侵袭转移的早期诊断指标[7]。最近的研究发现vimentin高表达和E-cadherin低表达与肝癌的恶性特征相关,该研究还认为E-cadherin可以作为判断肝癌预后的一个独立指标[8]。通过对肝癌患者的标本检测发现,E-cadherin低表达与肝癌患者的预后较差相关[9]。总之,EMT在肝癌发生发展的整个过程中均发挥重要作用,在肝癌细胞发生EMT的过程中,肝癌细胞会发生上皮标记的丢失(E-cadherin)及间质标记的获得(N-cadherin 和 Vimentin等)。其中E-cadherin的丢失或者破坏是EMT进程的标志[4,10]。Vimentin是EMT的一个重要间质标记,是间质细胞迁徙的重要调节者之一。在关于乳腺癌的研究中发现,Vimentin在Slug诱导的乳腺癌EMT进程中发挥重要作用[11]。而作为EMT过程中重要的间质标记,N-cadherin在肿瘤细胞EMT及肿瘤细胞EMT相关的化疗耐药发挥重要作用[12,13]。本研究的结果显示,17-β-雌二醇能够有效抑制Vimentin的表达,同时提高E-cadherind的表达,提示17-β-雌二醇对肝癌细胞侵袭转移的抑制作用可能与其对肝癌细胞EMT进程的调节作用相关。
TGF-β1是TGF中的一类,是EMT发生的一个重要的诱导因子,已经证实,在多种高表达TGF-β1的肿瘤中,TGF-β1可以自分泌和旁分泌的形式作用于肿瘤细胞,与肿瘤细胞表面的TGF-β2受体结合,其后TGF-β2受体通过直接磷酸化的方式活化TGF-β1受体,其后细胞内Smad2 和 Smad3受体发生磷酸化,然后与Smad4形成三聚体入核调节EMT相关基因的表达,从而诱导和维持细胞EMT[14]。我们的研究发现,17-β-雌二醇能够抑制Smad2的磷酸化,提示其对E-cadherin和Vimentin的调节作用可能与其对TGF/Smad信号通路的调节作用相关。
综上所述,我们的研究发现17-β-雌二醇能够有效抑制MHCC97H肝癌细胞的侵袭转移,而这种作用可能是通过调节TGF/Smad信号通路的活性进一步调节E-cadherin和Vimentin的表达来实现的。我们的研究结果为进一步明确17-β-雌二醇在肝癌发生发展中的作用提供了新的实验依据。
参考文献:
[1]Akahoshi H,Taura N,Ichikawa T,etal.Differences in prognostic factors according to viral status in patients with hepatocellular carcinoma[J].Oncol Rep,2010,23(5):1317-1323.
[2]Uchino K,Tateishi R,Shiina S,etal.Hepatocellular carcinoma with extrahepatic metastasis clinical features and prognostic factors[J].Cancer,2011,117(19):4475-4483.
[3]游川,李敬东,程蕾.肝癌围手术期健康教育研究现状与进展[J].川北医学院学报,2014,29(1):113-115.
[4]Thiery JP,Acloque H,Huang RY,etal.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[5]Akkari L,Gregoire D,Floc’h N,etal.Hepatitis C viral protein NS5A induces EMT and participates in oncogenic transformation of primary hepatocyte precursors[J].J Hepatol,2012,57(5):1021-1028.
[6]van Zijl F,Zulehner G,Petz M,etal.Epithelial-mesenchymal transition in hepatocellular carcinoma[J].Future Oncol,2009,5(8):1169-1179.
[7]Li YM,Xu SC,Li J,etal.Epithelial-mesenchymal transition markers expressed in circulating tumor cells in hepatocellular carcinoma patients with different stages of disease[J].Cell Death Dis,2013,4:e831.
[8]Zhai X,Zhu H,Wang W,etal.Abnormal expression of EMT-related proteins,S100A4,vimentin and E-cadherin,is correlated with clinicopathological features and prognosis in HCC[J].Med Oncol,2014,31(6):970.
[9]Hashiguchi M,Ueno S,Sakoda M,etal.Clinical implication of ZEB-1 and E-cadherin expression in hepatocellular carcinoma(HCC)[J].BMC Cancer,2013,13:572.
[10]Huber MA,Kraut N,Beug H.Molecular requirements for epithelial-mesenchymal transition during tumor progression[J].Curr Opin Cell Biol,2005,17(5):548-558.
[11]Vuoriluoto K,Haugen H,Kiviluoto S,etal.Vimentin regulates EMT induction by Slug and oncogenic H-Ras and migration by governing Axl expression in breast cancer[J].Oncogene,2011,30(12):1436-1448.[12]Chen L,Munoz-Antonia T,Cress WD.Trim28 contributes to EMT via regulation of E-cadherin and N-cadherin in lung cancer cell lines[J].PLoS One,2014,9(7):e101040.
[13]Zhang X,Liu G,Kang Y,etal.N-cadherin expression is associated with acquisition of EMT phenotype and with enhanced invasion in erlotinib-resistant lung cancer cell lines[J].PLoS One,2013,8(3):e57692.
[14]Katsuno Y,Lamouille S,Derynck R.TGF-beta signaling and epithelial-mesenchymal transition in cancer progression[J].Curr Opin Oncol,2013,25(1):76-84.
Effect of 17-β-oestrogen on invasion of hepatocellular carcinoma cell line MHCC97H cells and its mechanism
ZOU Sanpeng1, SHA Huanchen2*
(1DepartmentofOncology,AffiliatedHuidongHospitalofGuangdongMedicalCollege,Huizhou516300,China;2DepartmentofHepatobiliarySurgery,FirstAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:shahuanchen229@163.com)
Abstract:ObjectiveTo explore the anti-metastatic effect of oestrogen on invasion of human hepatocellular carcinoma cell line MHCC97H cells and its possible mechanism.MethodsMHCC97H cells were treated with different concentrations of oestrogen(0, 0.1,1,10 μmol/L)for 24 h. The inhibitory effects of oestrogen on the migration and invasion of MHCC97H cells were measured by Transwell assay. Moreover, real time PCR and Western blot were used for investigating the expression of E-cadherin, Vimentin, Smad 2 and p-Smad 2.ResultsThe 17-β-oestrogen significantly inhibited the migration and invasion of MHCC97H cells in a dose-dependent manner(P<0.05). When the concentration was above 0.1 μmol/L, 17-β-oestrogen significantly down-regulated protein expression of Vimentin, the phosphorylation level of Smad 2, and up-regulated the RNA and protein levels of E-cadheirn(P<0.05). When the concentration was above 0.2 μmol/L, 17-β-oestrogen significantly down-regulated RNA level of Vimentin(P<0.05).ConclusionThe results suggest that oestrogen may effectively inhibit the epithelial-mesenchymal transition(EMT) of HCC, which may be related to the regulation of E-cadherin and Vimentin in MHCC97H cells through inhibiting the phosphorylation of Smad 2.
Key words:17-β- oestrogen;hepatocellular carcinoma;MHCC97H cells;cell invasion;Smad 2;E-cadherin;Vimentin
[收稿日期:2015-10-12]
作者简介:邹三鹏,男, 1969-10生,博士,副主任医师,E-mail:zspdoctor@163.com.
中图分类号:R735.7
文献标志码:A
文章编号:1007-6611(2016)01-0014-05
DOI:10.13753/j.issn.1007-6611.2016.01.004
