大肠癌肝脏转移患者同期切除效果与相关因素研究
2016-05-25牛林王锋苏鹏宵宋哲武鼎华戚兵
牛林,王锋,苏鹏宵,宋哲,武鼎华,戚兵
(西安交通大学医学部附属红会医院普通外科,陕西西安710054)
大肠癌肝脏转移患者同期切除效果与相关因素研究
牛林,王锋,苏鹏宵,宋哲,武鼎华,戚兵
(西安交通大学医学部附属红会医院普通外科,陕西西安710054)
摘要:目的探讨同期手术切除治疗大肠癌肝转移患者的疗效,并分析其相关影响因素。方法收集2007 年3月-2009年12月西安交通大学医学部附属红会医院行同期切除治疗的86例同时性结直肠癌肝转移患者的临床资料,观察患者术后的近期及远期疗效,采用Logistic回归分析与预后相关的危险因素。结果86例患者围手术期无死亡病例,术后5例患者出现切口感染,2例吻合口瘘,1例吻合口出血,3例发生胆漏。术后并发症发生率为12.79%(11/86),经腹腔引流和抗感染等对症支持治疗后获得治愈或明显缓解。至随访结束共42例患者死亡,中位生存时间为60个月,51例患者出现肿瘤复发或远处转移,其中肝内复发38例,肺内转移7例,其他部位转移者6例。患者1、3及5年总生存率分别为93.84%、75.58%及50.74%,无瘤生存率分别为88.37%、61.10%及31.80%。Logistic多因素回归模型结果显示:淋巴结转移阳性、肝脏转移灶数≥4个、肝切缘阳性及术前癌胚抗原水平≥100μg/L是影响患者预后的主要危险因素;术前新辅助化疗可以改善患者的预后。结论采用同期切除治疗大肠癌肝脏转移患者安全可行,淋巴结转移阳性、肝脏转移灶数≥4个、肝切缘阳性及术前癌胚抗原水平≥100μg/L是影响患者长期预后的主要因素,术前给予新辅助化疗对提高患者生存率有一定积极作用。
关键词:结直肠肿瘤;肝脏转移;同期切除;预后
大肠癌是消化道肿瘤中最常见的恶性肿瘤,我国结肠癌发病率呈逐年上升趋势。复发和肝肺等转移是大肠癌治疗效果不理想的主要原因。由于直结肠血流的主要汇入门静脉,且肝脏血供丰富,肿瘤细胞易通过门静脉进入肝脏而引起肝转移[1]。研究报道15%~25%的直结肠癌患者在确诊时已出现肝转移[2],25%~50%的患者在术后3年内可发生肝转移[3]。虽然目前针对结直肠癌肝转移的治疗方法有很多种,但手术切仍除被认为是目前唯一能部分达到彻底治愈的有效方法。随着围手术期治疗方案及手术技术的不断发展,同期手术和分期手术在安全性上并无差异,且同期手术可缩短患者的住院时间,降低医疗费用,在技术条件允许的情况下推荐采用同期手术[4-5]。本研究观察大肠癌肝脏转移患者行同期切除治疗的近远期疗效,旨在探讨同期手术治疗结直肠癌肝转移的安全性和有效性,并分析影响患者预后的相关因素,报道如下。
1 资料与方法
1.1一般资料
选择2007年3月-2009年12月于西安交通大学医学部附属红会医院肿瘤防治中心住院行同期切除治疗的86例同时性结直肠癌肝转移患者为研究对象。其中,男性54例,女性32例;年龄32~71岁,平均(51.6±10.3)岁;术前肝脏CT检测显示:肝转移病灶数为1~8个,平均(2.7±1.5)个;转移灶最大直径为0.4~13.7 cm,平均(4.1±2.7)cm;其中49例患者肝脏转移灶分布于肝脏单叶,37例患者分布于肝脏双叶。所有纳入研究的患者术前均由同一组治疗团队(由结直肠外科专家及医生和肝外科专家及医师共同组成)对患者的一般情况及检查结果进行评价,根据评价结果制定具体治疗方案。
1.2纳入及排除标准
纳入标准:①病理学诊断明确,原发病灶位于结直肠的患者;②肝转移经超声、CT或病理学确诊;③原发病灶及肝转移灶均可切除,肝外转移灶可以达到R0切除标准;④术后肝容量≥50%,保留肝脏解剖功能;⑤所有纳入者均经本人知情同意,签署知情同意书。本研究通过本院伦理委员会的批准。排除标准:①排除合并原发性肝硬化等造成肝功能损伤疾病的患者;②排除本次手术前接受过肝脏切除或射频消融治疗等其他治疗手段的患者;③排除随访资料不全的患者。
1.3手术治疗方法
86例患者中,57例为结肠癌根治术,29例为直肠癌根治术,其中65例患者采用开腹手术,16例患者采用腹腔镜手术,5例患者腹腔镜肠切除后转为开腹肝脏转移灶切除。肝脏转移灶切除时64例患者采用了楔形切除,16例患者采取了半肝切除,6例患者采用了扩大切除。21例患者给予了术前新辅助化疗,62患者于术后均给予辅助化疗。
1.4随访及观察指标
主要采用门诊及电话随访的形式,术后前2年每3个月进行1次随访,2年后每6个月进行1次随访,随访内容主要包括患者术后并发症的发生情况、肿瘤标志物的检测结果、胸部CT检查、肝脏超声或CT检查结果。随访终止时间为2015年1月31日,以患者死亡或肿瘤复发/转移为随访终点事件。
1.5统计学方法
应用SPSS 19.0统计软件对本研究数据进行数据分析。计量资料以均数±标准差(±s)表示,两组间计量资料采用t检验;分类变量用率表示,采用χ2检验。采用Kaplan-Meier法计算生存率,采用Logistic多因素回归分析患者死亡的危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1手术情况及近期疗效评价
86例患者于结直肠癌根治术中平均出血量为(128.4±58.1)ml,平均清扫淋巴个数为(14.5±3.2)个,术后活组织病理检查所有结直肠癌标本的远、近端切缘及环周切缘均为阴性,术后3例患者出现切口感染、2例吻合口瘘、1例吻合口出血。肝脏手术平均出血量(231.5±112.9)ml,每例患者切除病灶1~5个,平均最大直径为(3.7±1.8)cm。3例患者术后发生胆漏,2例发生切口感染,患者均未发生肝功能衰竭。术后并发症经腹腔引流和抗感染等对症支持治疗后获得治愈或明显缓解。
2.2术后长期疗效随访结果
86例采用同期切除治疗的大肠癌肝转移患者,随访时间为5~60个月,中位随访时间为38个月。至随访结束共42例患者死亡,中位生存时间为60个月,51例患者出现肿瘤复发或远处转移,其中肝内复发38例,肺内转移7例,其他部位转移者6例。86例患者1、3及5年总生存率分别为93.84%、75.58%及50.74%,患者1、3及5年无瘤生存率分别为88.37%、61.10%及31.80%。见附图。
2.3大肠癌肝转移患者预后的单因素分析
单因素分析结果显示:原发肿瘤分化程度、术前新辅助化疗、淋巴结转移、血管浸润、肝脏转移灶个数、肝脏转移灶分布、肝切缘阳性、术后辅助化疗及术前癌胚抗原水平是影响患者死亡的因素。见表1。
2.4影响患者预后的多因素分析
将上述有差异的单因素作为自变量,将患者是否死亡作为因变量纳入Logistic多因素回归模型结果显示:淋巴结转移阳性、肝脏转移灶数≥4个、肝切缘阳性及术前癌胚抗原水平≥100μg/L影响患者预后的主要危险因素;术前新辅助化疗可以改善患者的预后。见表2。
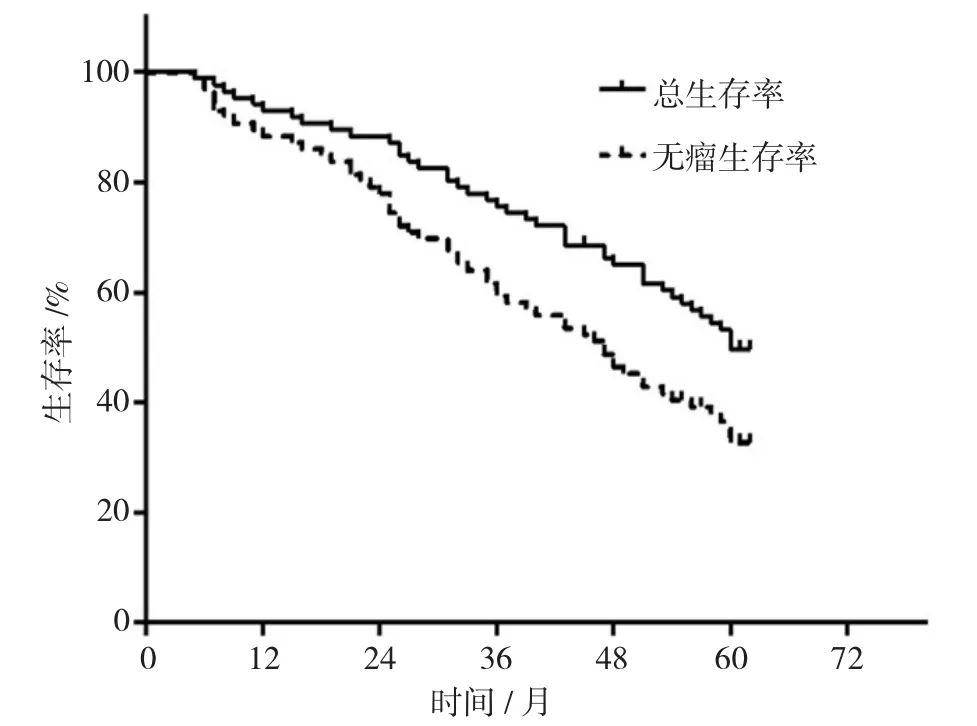
附图 患者总生存曲线及无瘤生存曲线
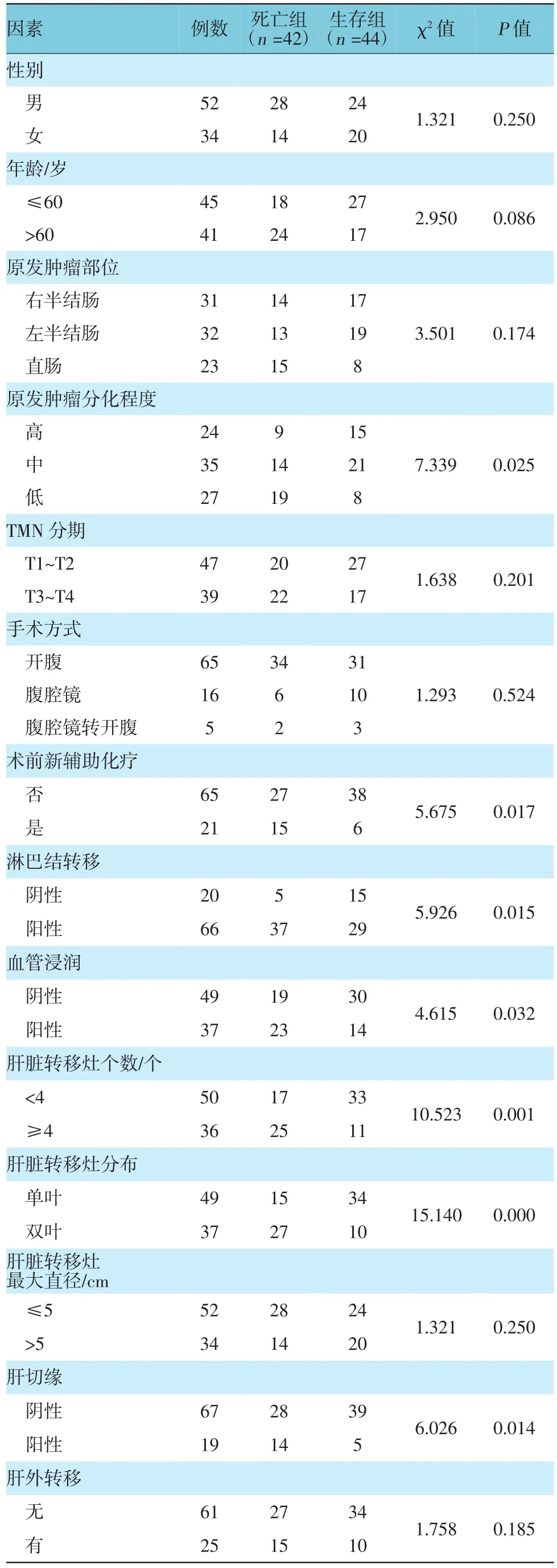
表1 大肠癌肝转移患者预后的单因素分析
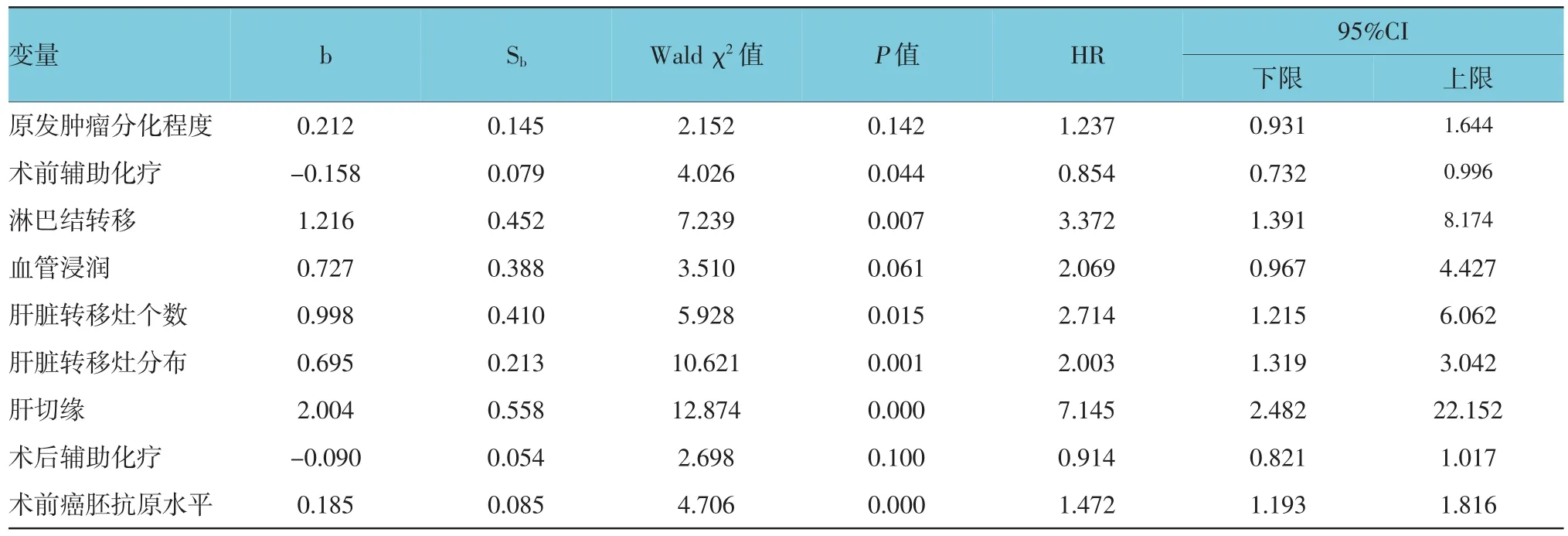
表2 大肠癌肝转移患者预后相关危险因素的Logistic回归分析
3 讨论
肝转移是结直肠癌患者死亡的主要原因之一,50%的患者在患病期间会发生肝转移,不接受任何治疗的肝转移患者中位生存期约为4~21个月[6]。研究报道其术后5年生存率可达34%~58%,中位生存期为28~46个月,疗效明显优于其他非手术治疗方法[7]。虽然仅有10%~20%的患者可获得手术根治的机会,但肝转移灶根治性切除是大肠癌肝转移患者获得长期生存机会的唯一选择[8-9]。早期研究者认为若肝转移灶>4个、病灶直径>4 cm、存在肝外病变和切除边缘<1 cm是手术的禁忌证,然而随着外科技术的不断发展,手术的指征也在逐渐放宽,目前认为肝功能正常,肝组织保留>25%~30%,手术切除则是安全可行的[10-11]。目前对于具有手术条件的同时性结肠癌肝转移患者选择同期肝切除还是分期肝切除仍存在一定的争议[12-13]。
随着本院麻醉技术和重症监护技术的进步,本研究将原发大肠癌病灶与肝脏转移灶同期切除应用于同时性大肠癌肝转移患者。结果显示:术后并发症发生率为12.79%(11/86),经腹腔引流和抗感染等对症支持治疗后获得治愈或明显缓解。这一结果说明同期切除对于治疗同时性大肠癌肝转移患者的治疗是安全有效的。患者的1、3及5年总生存率分别为93.84%、75.58%及50.74%,患者1、3及5年无瘤生存率分别为88.37%、61.10%及31.80%,从远期疗效判断同期切除也是可行的。
研究报道术后肿瘤复发、肿瘤病理类型、分化程度、浸润深度与淋巴结转移浸润深度及血管淋巴管侵犯等是影响预后的重要因素[14]。近期研究发现肝转移灶个数≥4个、最大肝转移灶直径≥5 cm、肝外转移和肝转移灶非手术治疗等因素是影响肠癌同时性肝转移患者预后的独立危险因素[15]。本研究结果显示,淋巴结转移阳性、肝脏转移灶数≥4个、肝切缘阳性及术前癌胚抗原水平≥100μg/L影响患者预后的主要危险因素。术前新辅助化疗是保护性因素。
综上所述,随着对大肠癌肝转移治疗的不断深入研究,手术切除、新辅助化疗、放射疗法、射频消融术、冷冻疗法及中医药治疗等多学科综合治疗是其新的发展方向,多种方法联合应用可明显提高患者的生存率并改善生活质量[8,16]。而在手术方案选择时,同期切除大肠癌肝转移是安全可行的,长期生存也较佳。
参考文献:
[1]陈洪兴.肝动脉灌注化疗及栓塞联合口服希罗达对大肠癌伴肝转移患者的疗效观察[J].中国现代医学杂志, 2015, 25(4): 48-51.
[2] Lupinacci RM, Andraus W, De Paiva Haddad LB, et al. Simultaneous laparoscopic resection of primary colorectal cancer and associated liver metastases: a systematic review[J]. Tech Coloproctol, 2014, 18(2): 129-135.
[3] Jones RP, Jackson R, Dunne DF, et al. Systematic review and meta-analysis of follow-up after hepatectomy for colorectal liver metastases[J]. Br J Surg, 2012, 99(4): 477-486.
[4] Ejaz A, Semenov E, Spolverato G, et al. Synchronous primary colorectal and liver metastasis: impact of operative approach on clinical outcomes and hospital charges[J]. HPB(Oxford), 2014, 16(12): 1117-1126.
[5] Yoshioka R, Hasegawa K, Mise Y, et al. Evaluation of the safety and efficacy of simultaneous resection of primary colorectal cancer and synchronous colorectal liver metastases[J]. Surgery, 2014, 155 (3): 478-485.
[6]李宇杰,车向明,甘建新,等.同时性结直肠癌肝转移同期与分期手术疗效的Meta分析[J].西安交通大学学报:医学版, 2012, 33(3):365-369.
[7]李华山,李宇飞.结直肠癌肝转移治疗的研究进展[J].世界华人消化杂志, 2012, 20(36): 3754-3760.
[8]左朝晖,邱晓昕,许若才,等.结直肠癌肝转移的综合治疗研究的进展[J].中华临床医师杂志(电子版), 2013, 7(1): 139-140.
[9] Smith JJ, D'Angelica MI. Surgical management of hepatic metastases of colorectal cancer [J]. Hematol Oncol Clin North Am, 2015, 29(1): 61-84.
[10] Sadot E, Groot KB, Leal JN, et al. Resection margin and survival in 2368 patients undergoing hepatic resection for metastatic colorectal cancer: surgical technique or biologic surrogate[J]. Ann Surg, 2015, 262(3): 476-485.
[11] Postriganova N, Kazaryan AM, Rosok BI, et al. Margin status after laparoscopic resection of colorectal liver metastases: does a narrow resection margin have an influence on survival and local recurrence[J]. HPB (Oxford), 2014, 16(9): 822-829.
[12] Patrono D, Paraluppi G, Perino M, et al. Posthepatectomy liver failure after simultaneous versus staged resection of colorectal cancer and synchronous hepatic metastases[J]. G Chir, 2014, 35 (3/4): 86-93.
[13]苏向前,杨宏.结直肠癌肝转移的手术治疗决策:同期切除还是分期切除[J].中国实用外科杂志, 2013, 33(8): 665-667.
[14]李世正,张俊华,董哲,等.大肠癌T分期及N分期相关因素分析[J].中国现代医学杂志, 2014, 24(26): 64-66.
[15]朱德祥,林奇,钟芸诗,等.同时性结直肠癌肝转移患者的生存分析[J].中华结直肠疾病电子杂志, 2014, 3(2): 26-32.
[16] Adam R, De Gramont A, Figueras J, et al. Managing synchronous liver metastases from colorectal cancer: A multidisciplinary international consensus[J]. Cancer Treat Rev, 2015, 41 (9): 729-741.
(张西倩编辑)
Study of outcomes and risk factors in patients undergoing simultaneous resection with colorectal liver metastases
Lin Niu, Feng Wang, Peng-xiao Su, Zhe Song, Ding-hua Wu, Bing Qi
(Department of General Surgery, the Red Cross Hospital of Xi'an Jiao Tong University Faculty of Medicine, Xi'an, Shanxi 710054, China)
Abstract:Objective To investigate the clinical effect of simultaneous resection in patients with colorectal liver metastases, and to analyze the related risk factors. Methods Clinical data of 86 patients underwent simultaneous resection with colorectal liver metastases, from March 2007 to December 2009 in our hospital were collected, and risk factors related to prognostic were analyzed by logistic regression analysis. Results No perioperative death was found in 86 patients. The postoperative complication rate was 12.79% (11/86), including 5 patients with wound infection, 2 cases with anastomotic leakage, 1 case with anastomotic bleeding, 3 cases with bile leakage, which were cured or eased by drainage, antibiotics and other supportive treatments. Until the end of the follow-up, 42 patients died, and the median survival time was 60 months. A total of 51 cases had tumor recurrence or distant metastasis, including 38 cases had intrahepatic recurrence, 7 cases had lung metastasis and 6 cases had metastasis to other parts. The overall survival rates of 1-year, 3-year and 5-year were 93.84%, 75.58% and 50.74%, respectively, and the tumor-free survival rates were 88.37%, 61.10% and 31.80%. Logistic multivariate regression showed that lymph node metastasis, liver metastasis number≥4 months, liver positive margin and preoperative carcinoembryonic anti-book=110,ebook=115gen level≥100 μg/L were major risk factors related to prognosis; neoadjuvant chemotherapy improved outcomes of patients. Conclusions Simultaneous resection of synchronous colorectal liver metastases is safe and feasible. Positive Lymph node metastasis, liver metastasis number≥4 months, liver positive margin and preoperative carcinoembryonic antigen level≥100 μg/L are the main risk factors of poor prognosis. Neoadjuvant chemotherapy can improve the survival rate of patients.
Keywords:colorectal cancer; liver metastases; simultaneous resection; prognosis
收稿日期:2015-11-27
文章编号:1005-8982(2016)08-0109-05
DOI:10.3969/j.issn.1005-8982.2016.08.024
中图分类号:R735.3
文献标识码:B
