长链非编码GATS表达干扰质粒构建抑制乳腺癌细胞增殖和侵袭的研究
2016-05-25易剪梅钱立元陈学东
易剪梅,钱立元,陈学东
(中南大学湘雅三医院乳疝外科,湖南长沙410018)
长链非编码GATS表达干扰质粒构建抑制乳腺癌细胞增殖和侵袭的研究
易剪梅,钱立元,陈学东
(中南大学湘雅三医院乳疝外科,湖南长沙410018)
摘要:目的探讨长链非编码GATS对乳腺癌细胞增殖和侵袭的影响。方法构建的人LncRNA-GATS-shRNA1~4慢病毒载体转染乳腺癌MDA-MB-231细胞后,qPCR筛选出干扰效率为50.0%和54.0%的sh1组和sh3组,MTT法和Transwell实验分别检测转染后细胞增殖和侵袭能力;流式细胞术检测转染sh1组慢病毒后细胞周期分布及凋亡变化。结果测序证实,LncRNA-GATS的shRNA寡聚核苷酸序列已被克隆到pLV-GATS载体;转染MDA-MB-231细胞后,与阴性对照组比较,sh1组和sh3组的乳腺癌细胞增殖和侵袭能力均降低(P<0.01),以sh1组更显著;sh1组细胞周期被阻滞于S期(P<0.01);细胞凋亡率无明显变化(P> 0.05)。结论LncRNA-GATS可能下调乳腺癌细胞侵袭力,并通过抑制细胞周期进展降低细胞增殖能力。
关键词:人LncRNA-GATS;shRNA干扰载体;MDA-MB-231细胞;增殖;侵袭
乳腺癌是妇女发病率最高的恶性肿瘤,其发病率占全身各种恶性肿瘤的7%~10%,近年来发病率不断上升[1-3],其中三阴乳腺癌(triple negative breast cancer,TNBC)占20%[4]。三阴乳腺癌作为一种特殊的高危乳腺癌亚型,其侵袭性强、预后差、青年女性好发,寻找其有效治疗靶点迫在眉睫。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度> 200 nt的基因转录产物,占ncRNA的80%,既参与表观遗传、可变剪接、入核转运等过程,也能以细胞微结构原件、小RNA前体等发挥功能[5]。近年,大量研究证实lncRNA在白血病、前列腺癌、乳腺癌、结肠癌、神经胶质瘤、肺癌等多种肿瘤中异常表达[6-10]。课题组前期基因芯片筛选乳腺浸润性导管癌中18条差异表达人lncRNA(P<0.01),其中GATS较正常组织明显下调[11]。本试验构建GATS-lncRNA-shRNA慢病毒载体,转染人乳腺癌细胞MDA-MB-231,检测其对乳腺癌细胞增殖、侵袭的影响。
1 材料与方法
1.1材料
1.1.1细胞、菌株与质粒人乳腺癌细胞MDA-MB-231、HEK-293FT脂质体转染细胞、pLV-GATS-shRNA慢病毒载体及慢病毒包装系统、慢病毒对照LV-shNC等均由长沙赢润生物技术有限公司提供。
1.1.2主要仪器及试剂荧光定量PCR仪(BioRad公司)、总RNA提取试剂Trizo(l美国Invitrogen公司),Transwell小室(美国Corning costar公司)、流式细胞仪(美国BD公司),Annexin V-APC/PI双染细胞凋亡检测试剂盒(南京凯基生物公司),DMEM培养基(Gibco公司),胎牛血清(杭州四季青公司),THUNDERBIRD SYB R®qPCR Mix(日本TOYOBO公司)、dNTP、RevertAidTMReverse Transcriptase、RiboLockTMRNase Inhibitor、Taq DNA Polymerase(MBI公司)、培养基:RPMI 1640(美国Invitrogen公司)+10% FBS(美国Gibco公司)+1% p/s(双抗诱液,碧云天公司)、胰酶液(美国Gibco公司)。
1.2方法
1.2.1细胞培养MDA-MB-231细胞用含10%胎牛血清的DMEM培养基,在37℃饱和湿度、含5%二氧化碳CO2的孵箱中培养。
1.2.2构建慢病毒载体及细胞感染针对人GATS-lncRNA序列(NCBI Gen Bank,基因编号:NR028038),利用YRgene shRNA库设计干扰序列(见表1),构建慢病毒重组载体pLV-GATS-lncRNA-shRNA1~4。取重组载体转化至感受态细胞DH5α,同时设计空载体作为对照,挑选阳性克隆测序。将重组载体和包装质粒共转染HEK293FT细胞,包装慢病毒,4 d后用荧光显微镜技术观察荧光表达,计数病毒滴度。包装好的GATS-lncRNA-shRNA 1~4慢病毒和阴性对照组(NC-shRNA),以MOI值50转染MDA-MB-231细胞。

表1 GATS的lncRNA序列及人工合成的shRNA oligo序列
1.2.3逆转录(RT-PCR)检测lncRNA GATS表达按Trizol裂解液说明书进行细胞总RNA的抽提;按逆转录试剂盒说明进行逆转录。GAPDH为内参基因,GATS lncRNA的正向引物为5'-TAAGCAGAGGGCTACAGAA-3',反向引物5'-CAGGGAGATC AGGAGGAC-3';GAPDH的正向引物为5'-TGCACCACCAACTGCTTAGC-3',反向引物5'-GGCATGGAC TGTGGTCATGAG-3',按荧光定量PCR试剂盒说明配置反应体系,荧光信号实时检测,数据分析采用2-ΔΔCT(CT代表循环阈值)分析法。
1.2.4MTT法检测转染后MDA-MB-231细胞增殖筛选出干扰效率分别为50.0%和54.0%的sh1 和sh3组,取sh1、sh3及阴性对照组(NC组)3组MDA-MB-231细胞接种到96孔板,每孔接种8 000个细胞(100μl),每组设3个复孔。于慢病毒感染后48、72和96 h加入MTT溶液(20μl,5 mg/ml)。酶联免疫监测仪测定A490值。
1.2.5Transwell法检测转染后MDA-MB-231细胞侵袭转染24 h后将60μl基质胶稀释于300μl无血清培养基中,取上述稀释液100μl加入Transwell上室中,37℃培养箱中,孵育4~5 h。下室中加入600μl含有20%FBS的培养基。37℃培养箱孵育20~24 h,Transwell PBS洗2次,显微镜下计数5个高倍镜视野细胞,计算平均数。每组设2个复孔,实验重复3次。
1.2.6流式细胞仪检测细胞周期分布各组细胞慢病毒感染72 h后,经0.2%胰酶处理,离心收集细胞,用4℃预冷PBS洗涤2次,在离心管中留约0.5 ml PBS,加入预冷的70%乙醇1 ml混匀固定,4℃放置过夜;离心离去乙醇,PBS清洗1次,在离心管中留1 ml PBS,打散细胞团,加入Rnase 5μl(10 mg/ml),37℃放置1 h,400目筛网过滤,加入PI(100μg/ml)染液,室温避光染色30 min,流式细胞仪(FACS)检测细胞周期。实验重复3次。
1.2.7流式细胞仪检测细胞凋亡各组细胞慢病毒感染72 h后,经0.25%胰酶处理,离心收集细胞,用4℃预冷PBS洗涤2次,然后用500μl结合缓冲液重悬细胞,调节其浓度为106/ml,然后取100μl细胞悬浮于5 ml流式管中,加入5μl Annexin V-APC混匀后,加入5μl PI混匀,于室温避光孵育15 min,重悬于400μl PBS,400目筛网过滤,加样于流式细胞仪(FACS)检测细胞凋亡。激发波长Ex=488 nm,发射波长Em=530 nm。获得细胞凋亡数据后用Mod Fit LT软件进行细胞凋亡相对定量分析。实验重复3次。
1.3统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,各组间比较用单因素方差分析,两两比较用Dunnett法。方差不齐用非参数检验的Kruskal-Wallis H检验,两两比较用Dunnett's法,P<0.05为差异有统计意义。
2 结果
2.1重组人GATS-lncRNA-shRNA慢病毒载体测序和鉴定
经测序分析,比对4种重组载体中插入的片段序列与设计的pLV-GATS-lncRNA-shRNA寡核苷酸序列完全一致。荧光显微镜下同一视野的荧光和可见光照片比较,可见大部分细胞发出荧光,病毒滴度分别为2×109TU/ml、6×108TU/ml、2×109TU/ml 和4×108TU/ml。
2.2RT-qPCR检测GATS lncRNA表达
GATS-lncRNA-shRNA慢病毒转染人乳腺癌细胞MDA-MB-231细胞,荧光显微镜证实转染成功(见图1)。RT-qPCR结果显示,pLV-GATS-lncRNA-shRNA1~4慢病毒对GATS lncRNA干扰效率分别为50.0%、40.9%、54.0%和8.0%。
2.3MTT检测转染后MDA-MB-231细胞增殖能力变化
各组不同时相吸光度见表2,吸光度变化曲线见图2。MTT检测结果显示,转染后3组MDA-MB-231细胞的增殖水平在48、72和96 h差异有统计学意义(P<0.001);与对照组比较,sh1组的细胞增殖水平在48、72和96h差异有统计学意义(P=0.000),sh3组的细胞增殖水平除在72 h差异有统计学意义(P= 0.000),48和96 h差异无统计学意义(P=0.182和0.110)。
2.4Transwell法检测转染后MDA-MB-231细胞侵袭能力变化
非参数检验的Kruskal-Wallis H检验结果显示,慢病毒转染72 h后,3组的细胞侵袭力差异有统计学意义(P<0.01),两两比较结果显示与NC组比较,sh1组和sh3组的细胞侵袭能力有所下降(P<0.01),但差异无统计学意义(P>0.05)。见图3和表3。
2.5流式细胞仪分析细胞周期分布及凋亡
NC组细胞G1、S、G2期分别占(51.57±1.08)%、(28.04±1.23)%、(20.39±0.25)%,sh1组细胞G1、S、G2期分别占(37.60±1.00)%、(43.20±1.65)%、(19.20±0.66)%。与NC组比较,sh1组S期细胞比例明显增高(P<0.01),说明转染GATS-lncRNA-shRNA1后,MDA-MB-231细胞周期发生S期阻滞,见图4。慢病毒转染72 h后,3组的细胞凋亡率差异无统计学意义(P>0.05),不能认为转染GATS-lncRNA-shRNA会影响MDA-MB-231细胞的凋亡率。见表4。
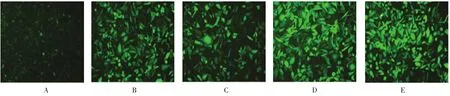
图1 GATS-lncRNA-shRNA慢病毒感染MDA-MB-231细胞(×200)
表2 各组不同感染时相细胞吸光值比较(n=3,±s)
表2 各组不同感染时相细胞吸光值比较(n=3,±s)
注:†与NC组比较,P=0.000
组别 细胞增殖48 h 72 h 96 h NC组 0.430±0.006 0.533±0.008 0.617±0.008 sh1组 0.349±0.010† 0.422±0.012† 0.504±0.007†sh3组 0.416±0.012 0.464±0.009† 0.602±0.009 F值 61.408 97.783 178.359 P值 0.000 0.000 0.000
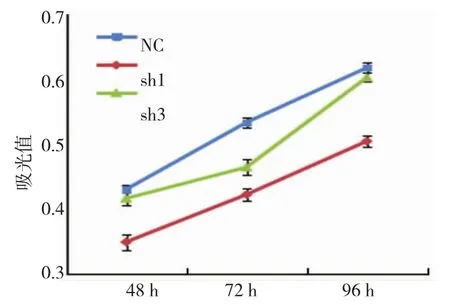
图2 MTT检测转染GATS-lncRNA-shRNA对MDA-MB-231细胞增殖的影响
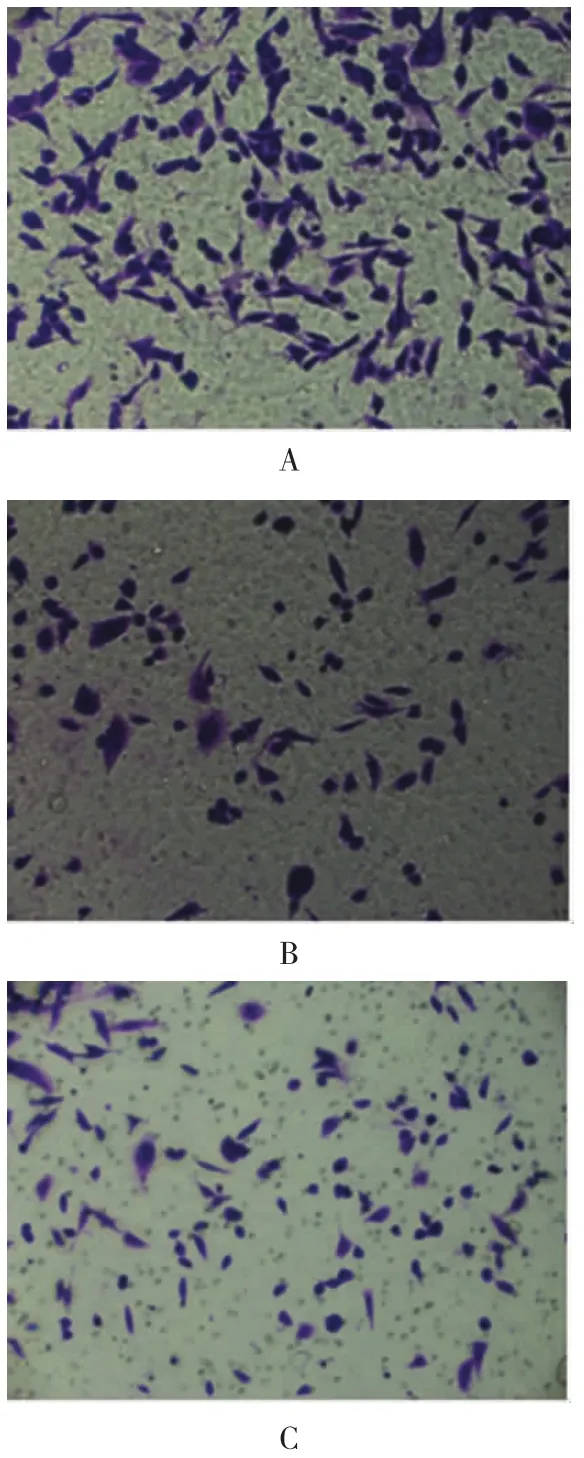
图3 转染GATS-lncRNA-shRNA对MDA-MB-231细胞侵袭力的影响
表3 各组穿膜细胞数比较(±s)
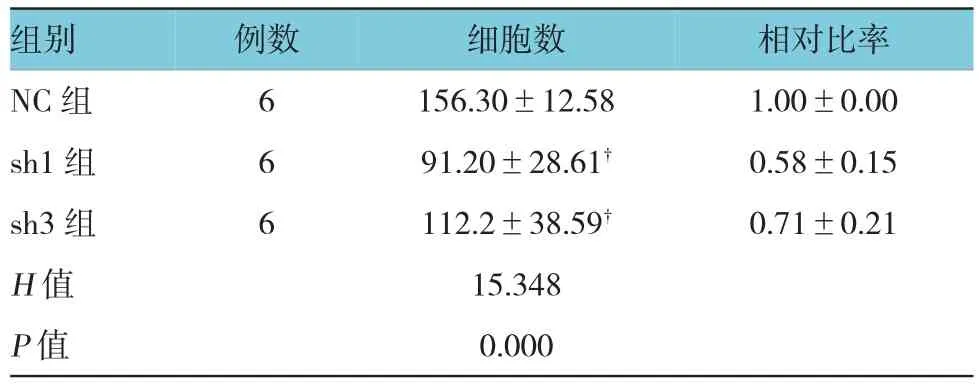
表3 各组穿膜细胞数比较(±s)
注:†与NC组比较,P<0.01
组别 例数 细胞数 相对比率NC组 6 156.30±12.58 1.00±0.00 sh1组 6 91.20±28.61† 0.58±0.15 sh3组 6 112.2±38.59† 0.71±0.21 H值 15.348 P值 0.000
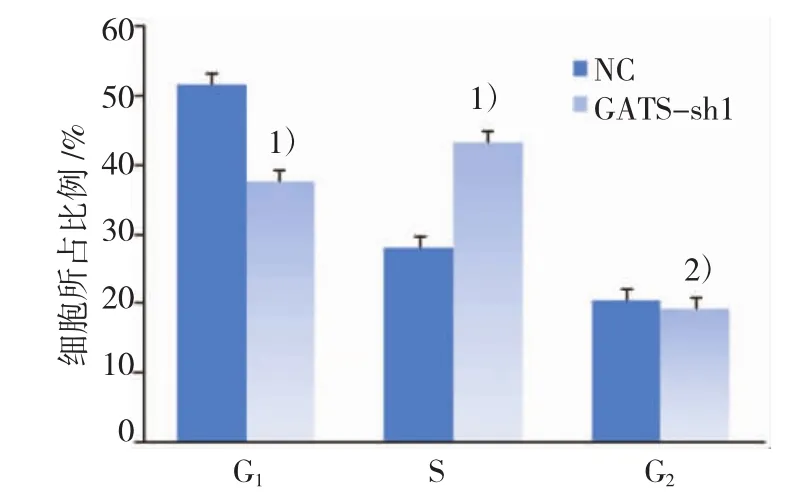
图4 转染GATS-lncRNA-shRNA1对MDA-MB-231细胞周期的影响
表4 各组细胞凋亡率的比较(±s)

表4 各组细胞凋亡率的比较(±s)
组别 例数 凋亡率/% NC组 3 1.94±0.32 sh1组 3 1.37±0.27 sh3组 3 1.93±0.24 F值 P值4.178 0.073
3 讨论
国内外学者认为,乳腺癌MDA-MB-231细胞系能较好反应TNBC特性[12-13],故本研究选择该细胞作为细胞模型。Jin等[14]研究发现,MALAT1在TNBC组织中上调,体外下调MALAT1可以抑制乳腺癌细胞增殖、迁移和增加癌细胞凋亡;在活体下调MALAT1抑制肿瘤生长和转移,其很可能通过miR-1/SLUG轴而产生作用。同源异型框基因反义基因间RNAs(HOX antisense intergenenic RNAs,HOTAIR),通过ERS和ER共调节因子,HOTAIR反转录的雌二醇诱导下的转录失衡,导致乳腺癌变,并发现HOTAIR在转录水平被E2调节,对于乳腺癌细胞的生存发育是必需的[15-16]。
人lncRNA-GATS为基质抗原3(stromal antigen 3,STAG3)基因的反向链(opposite strand),又名STAG3OS,定位于7q22.1,外显子计数为8,长度71 580 bp。STAG3含有C-末端结构域,一个28个氨基酸的保守的结构域和一个86个氨基酸的结构域。STAG3作为多亚基蛋白复合物的内聚蛋白,在同源染色体分离的关键步骤中装配/拆卸染色质,目前,确认其在偶线期复合物或着丝粒着丝点中的功能尚不明确,其在肿瘤中异常激活的相关机制待阐明[17-18]。
本实验成功构建人GATS-lncRNA-shRNA慢病毒载体[19-20],转染乳腺癌MDA-MB-231细胞,MTT实验和Transwell实验发现,GATS-lncRNA-shRNA1 和GATS-lncRNA-shRNA3组增殖和侵袭能力较均降低,以sh1组更为显著;流式分析发现转染GATS-lncRNA-shRNA1后细胞周期进展被阻滞于S期,细胞凋亡率无明显变化。该结果提示,GATS-lncRNA干扰后,细胞增殖受限可能并不是通过诱导凋亡来实现,而是影响细胞周期来实现。
综上所述,本研究首次探讨lncRNA GATS在乳腺癌MDA-MB-231细胞增殖和侵袭过程中发挥的作用,提示GATS-lncRNA可能为乳腺癌治疗的新的有效靶点。为进一步研究GATS-lncRNA与STAG3在乳腺癌发生、发展和转移的过程中的相互关系奠定基础。
参考文献:
[1] Chao YL, Shepard CR, Wells A. Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J]. Mol Cancer, 2010, 9(7): 179.
[2] Hou G, Zhang S, Zhang X, et al. Clinical pathological characteristics and prognostic analysis of 1013 breast cancer patients with diabetes[J]. Breast Cancer Res Treat, 2013, 137(3): 807-816.
[3] Hassan MS, Ansari J, Spooner D, et al. Chemotherapy for breast cancer (Review). Oncol Rep, 2010, 24(5): 1121-1131.
[4] Beg S, Siraj AK, Prabhakaran S, et al. Loss of PTEN expression is associated with aggressive behavior and poor prognosis in Middle Eastern triple-negative breast cancer [J]. Breast Cancer Res Treat, 2015, 151(3): 541-553.
[5] Di GF, Capaccioli S, Lulli M. A pathophysiological view of the long non-coding RNA world[J]. Oncotarget, 2014, 305(22): 10976-10996.
[6] Liu Y, Zhao J, Zhang W, et al. LncRNA GAS5 enhances G1cell cycle arrest via binding to YBX1 to regulate p21 expression in stomach cancer[J]. Sci Rep, 2015, 5(11): 10159.
[7] Kiren YU, Mark RP, Gwyn T. Williams. Reciprocal regulation of GAS5 lncRNA levels and mTOR inhibitor action in prostate cancer cells[J]. The Prostate, 2015, 75(7): 693-705.
[8] Dong S, Qu X, Li W, et al. The long non-coding RNA, GAS5, enhances gefitinib-induced cell death in innate EGFR tyrosine kinase inhibitor-resistant lung adenocarcinoma cells with wide-type EGFR via downregulation of the IGF-1R expression[J]. Hematol Oncol, 2015, 8: 43.
[9] Sun M, Liu XH, Wang KM, et al. Downregulation of BRAF activated non-coding RNA is associated with poor prognosis for non-small cell lung cancer and promotes metastasis by affecting epithelial-mesenchymal transition[J]. Mol Cancer, 2014, 13(1): 68.
[10] Sun T, Ye HH, Wu CL, et al. Emerging players in prostate cancer: long non-coding RNAs[J]. Am J Clin Exp Urol, 2014, 2(4): 294-299.
[11] Chen XD, Yang JY, Qian LY, et al. Aberrantly expressed mRNAs and long non-coding RNAs in patients with invasive ductal breast carcinoma: a pilot study[J]. Molecular medicine reports, 2015, 11(3): 2185-2190.
[12] Cailleau R, Olivé M, Cruciger QV. Long-term human breast carcinoma cell lines of metastatic origin: preliminary characterization[J]. In Vitro, 1978, 14(11): 911-915.
[13] Marc L, Guy L. Relevance of breast cancer cell lines as models for breast tumours: an update[J]. Breast Cancer Research and Treatment, 2004, 83(3): 249-289.
[14] Jin C, Yan BC, Qin L, et al. Reciprocal regulation of Hsa-miR -1 and long noncoding RNA MALAT1 promotes triple-negative breast cancer development[J]. Tumour Biol, 2015, (12): 1-12.
[15] Bhan A, Hussain I, Ansari K, et al. Antisense transcript long noncoding RNA(lncRNA) HOTAIR is transcriptionally induced by estradiol[J]. J Mol Biol, 2013, 425(19): 3707-3722.
[16] Bhan A, Mandal SS. Estradiol-Induced Transcriptional Regulation of Long Non-Coding RNA, HOTAIR [M]. 1st ed. Humanna Press, 2016: 395-412.
[17] Prieto I, Suja JA, Pezzi N, et al. Mammalian STAG3 is a cohesin specific to sister chromatid arms inmeiosis I[J]. Nat Cell Biol, 2001, 3(8): 761-766.
[18] Strunnikov A. Cohesin complexes with a potential to link mammalian meiosis to cancer[J]. Cell Regen (Lond), 2013, 2(1): 4.
[19] Heilbronn R, Weger S. Viral vectors for gene transfer: current status of gene therapeutics[J]. Handb Exp Pharmacol, 2010(197): 143-170.
[20]丁治国,何蓓,陈晓珩,等.人VEGF基因慢病毒介导RNA干扰有效靶点的设计及筛选[J].中国现代普通外科进展, 2013, 16(2): 85-88.
(张蕾编辑)
论著
Inhibitory regulation of human long non-coding RNA GATS on proliferation and invasion of breast cancer cells
Jian-mei Yi, Li-yuan Qian, Xue-dong Chen
(Department of Breast, Thyroid and Hernia Surgery, the 3rd Affiliated Hospital of Xiangya, Central South University, Changsha, Hunan 410018, China)
Abstract:Objective To investigate the effect of human long non-coding RNA GATS on proliferation and invasion of breast cancer MDA-MB-231 cells. Methods Four human GATS-lncRNA-specific oligonucleotide sequences were designed and synthesized previously, then were inserted into the pLV-GATS vector. After infecting the MDAMB-231 cells, transfection efficiencies of GATS-lncRNA-shRNA1 and GATS-lncRNA-shRNA3 were analyzed and screened by qPCR, which were 50.0% and 54.0% respectively. MTT and Transwell assays were used to detect the proliferation and invasion ability of the transfected cells, respectively. Flow cytometry was used to search the changes of cell cycle distribution and apoptosis of the MDA-MB-231 cells transfected GATS-lncRNA-shRNA1 lentiviral vector. Results Compared with the cells transfected with scrambled shRNA, the proliferation and invasion ability of cells the sh1 group and sh3 group was inhibited, especially t-hose the sh1 group. Flow cytometry showed the sh1 group cell cycle was arrested in S phase, and the cell apoptosis rate had no significant change (P > 0.05). Conclusions lncRNA GATS inhibits the invasion of breast cancer cells, and down regulates the proliferation of tumor cells through arresting cell cycle in S phase.
Keywords:Human lncRNA GATS; short hairpin RNA interference vector; MDA-MB-231 cells; proliferation; invasion
收稿日期:2016-01-27
文章编号:1005-8982(2016)08-0017-05
DOI:10.3969/j.issn.1005-8982.2016.08.004
中图分类号:R655.8
文献标识码:A
