过氧化物酶1对人肝癌细胞HepG2细胞皮下移植瘤生长的影响
2016-05-25涂青松何剪太
涂青松,何剪太
(中南大学湘雅医院,湖南长沙410008)
过氧化物酶1对人肝癌细胞HepG2细胞皮下移植瘤生长的影响
涂青松,何剪太
(中南大学湘雅医院,湖南长沙410008)
摘要:目的探讨过氧化物酶1(Prx 1)在肝癌形成和恶性进展中的作用。方法蛋白质印迹法(Western blot)检测远癌肝组织和近癌肝组织中Prx 1、pAkt及Akt表达差异。肝细胞饥饿培养24 h后,10 ng/ml表皮生长因子(EGF)处理10 min,提取总蛋白,Western blot检测Prx 1、pAkt、不同位点磷酸化表皮生长因子受体(EGFR)和总EGFR。Western blot检测检测未处理组、转染无义shRNA组及转染Prx 1 shRNA组HepG2细胞中Prx 1蛋白的表达。DCFH-DA法检测3种HepG2细胞中活性氧簇总量。转染无义shRNA组及转染Prx 1 shRNA组HepG2细胞皮下注射至SCID小鼠,注射后每周测量1次皮下肿瘤体积。Western blot检测两组小鼠皮下肿瘤组织中Prx 1和pAkt的表达情况。结果与正常肝细胞比较,Prx 1在肝转化细胞中表达升高。Prx 1增强了EGF介导的EGFR和Akt激活。Prx 1表达沉默抑制了HepG2体内成瘤能力。减少HepG2皮下移植瘤的肝转移。Prx 1表达沉默还抑制了Akt体内激活。结论Prx 1具有调控人肝细胞中EGFR介导信号通路的潜在作用。Prx 1能够通过EGFR-Akt信号通路介导细胞正常至异常转化、肿瘤形成及转移
关键词:过氧化物酶1;肝癌;移植瘤
全球原发性肝癌(以下简称肝癌)发病率及死亡率呈逐年上升趋势。尽管不断有新的肝癌治疗手段应用于临床,但是近几十年来肝癌患者5年期生存率仍未见明显提高[1]。由于早期肝癌患者的生存率明显好于晚期肝癌患者,早期检测肿瘤恶变前损伤是减少肝癌发病率和致死率的有效方法[1]。因此,研发新的检测手段提高肝癌的早期检出率是肝癌研究十分紧迫的工作。
过氧化物酶(peroxiredoxin,Prx)是具有过氧化物酶活性的巯基特异性抗氧化蛋白[2]。Prx 6个家族成员中,Prx1在包括肺癌在内的多种人类肿瘤中表达异常增加[3-4]。本研究主要分析正常肝细胞和肝癌前病变细胞中过氧化物酶1(peroxiredoxin 1,Prx 1)的表达情况,探讨Prx1通过表皮生长因子受体(epidermal growth factor receptor,EGFR)/Akt信号通路肝癌前病变细胞生长增殖情况。此外,本课题还在肝癌移植瘤模型中证实了Prx 1对肿瘤生长和恶性转化的影响。本研究结果表明肝癌前病变细胞中Prx 1表达增加,Prx 1能够促进肝癌前病变细胞中表皮生长因子(epidermal growth factor,EGF)表达,并激活EGFR/Akt信号通路,移植Prx 1表达能够抑制肝癌移植瘤模型中肿瘤生长和转移。
1 材料与方法
1.1细胞培养和EGF处理
在含10%(v/v)小牛血清、100 u/ml青霉素、100μg/ml链霉素的RPMI 1640培养基中培养人正常肝细胞株L02和CCL13细胞。所有细胞在37℃下含5%二氧化碳CO2和95%空气的培养箱中培养。细胞血清饥饿24 h后,用含10 ng/ml EGF的无血清培养基继续培养10 min。立即收获细胞并对其进行冷冻以用于后续实验。
1.2活性氧(reactive oxygen species,ROS)形成检测
使用二氯二氢荧光素-乙酰乙酸酯(2’,7’-Dichlorofluorescin diacetate,DCFH-DA)荧光染料分析细胞提取物中ROS形成速率。DCFH-DA通过与ROS反应氧化为二氯荧光素(fluorescent dichlorofluorescein,DCF)。从485 nm激发波长和530 nm发射波长上的荧光增加斜率计算ROS形成速率,使用标准DCF校正。
1.3肝组织活检
肝组织活检钳,检查肝癌患者血常规、肝功能、凝血酶原时间和活动度、B超、心电图,对患者进行屏气动作训练。B超术前定位,取右腋中线第8~9肋间或腋前线第9~10肋间隙为穿刺点,于患者深呼气末屏气时采用16号活检枪,1 s负压吸取肝组织,标本放入10%甲醛中固定、石蜡包埋,常规做苏木精一伊红(HE)染色、Masson及网状纤维染色,视临床病情需要加做免疫组织化学及特殊染色。术后予束腹带包扎4 h,卧床休息8 h,监测血压、脉搏,1周内避免剧烈活动。
1.4肝细胞原代培养
肝组织活检取下标本后,立即置入含青霉素(100 u/ml),链霉素(100μg/ml)的无血清DMEM培养基内,并于1 h内处理。组织块置于培养皿中,加入DMEM液,用眼科剪将不需要的血块和组织(坏死组织或结缔组织等)除去,再用DMEM液漂洗两次后剪成约1mm3大小,加入1g/L胶原酶Ⅵ消化液37℃消化30 min,细胞悬液纱布过滤,1 000 r/min5 min离心2次,弃上清;800 r/min 4 min离心2次,弃上清,每次以DMEM液重悬沉淀。细胞沉淀重悬于含100 ml/L FBS的DMEM中,测细胞活力,以>1×109个/L的浓度接种于25 ml培养瓶,50 ml/L二氧化碳CO2培养箱37℃孵育。24 h后换液,去除未贴壁细胞,加入DMEM液(含10 mg/L胰岛素,1 mmol/L谷氨酰胺,100 u/ml青霉素,100μg/ml链霉素,100 ml/L FBS)。37℃50 ml/L二氧化碳CO2培养箱内静置培养。每两天半换液,每天倒置显微镜观察,成纤维细胞通过反复贴壁分离法、机械刮除法去除,得到纯化的表皮样生长细胞,每3天传代1次。
1.5Prx 1短发卡RNA表达载体的构建
本研究构建了表达短发卡RNA(shRNA)的含人类u6启动子的自失活逆转录酶病毒表达载体。BamHⅡ/HindⅢ双酶切MSCV表达质粒和pMSCV-EGFP-Neo载体,双酶切获得片段链接重组,将识别Prx1或错义序列的短发卡RNA重组至pMSCV-EGFP-Neo载体。Prx1 shRNA能够识别人类Prx1 cDNA(NM002574)的474-492碱基对。寡核苷酸对的序列为:5'-GATCCGTTCTCACTTCTGTATCT ATTCAAGAGATAGATGACAGAAGTGAGAATTTTT TGGAAA-3'和5'-AGCTTTTCCAAAAAATTCTCACT TCTGTCATCTATCTCTTGAATAGATGACAGAATGA GAAC-3'。错义序列为:5'-GATCCCGTTCTCCGAAC GGTGCACGTTTCAAGAGAACGTGCACCGTTCGGA GAATTTTTTGGAAA-3'和5'-AGCTTTTCCAAAAAATTCTCCGAACGGTGCACGTTCTCTTGAAACGTGCA CCGTTCGGAGAACGG-3'。采用ABI 3700毛细管测序仪(Applied Biosystems)确认序列准确性。
1.6构建稳定表达细胞株
使用Lipofectamine 2000试剂将Prx 1或错义shRNA表达载体转染至Phoenix包装细胞。48 h后,收集上清液,0.45μm滤膜过滤,并于-80℃冰箱保存。将过滤后的Prx 1或错义shRNA病毒上清液与4μg/ml凝聚胺(脂质体转染增强剂)分别共同感染HepG2细胞。连续2 d每8 h将新鲜的病毒上清液加入到细胞中。含有2μg/ml嘌呤霉素的生长培养基中培养10 d,选取感染成功细胞用于后续实验。
1.7蛋白质印迹分析(Western blot)
弃去培养皿中DMEM培养基,用磷酸盐缓冲液(phosphate buffered solution,PBS)轻柔洗涤去除杂质,按每皿50 L加入含2%苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的蛋白裂解液,冰上裂解5 min,收集裂解产物超声破碎10 min后4℃12 000 rpm离心30 min。收集上清蛋白液,采用二喹啉甲酸(bicinchoninic acid,BCA)法对蛋白含量定量后备用。定量过的样品按每泳道30 g蛋白含量进行聚丙烯酰胺凝胶电泳,结束后用湿转法将蛋白转至硝酸纤维素膜上,5%脱脂奶粉室温下封闭1 h,加入一抗(兔抗小鼠Prx 1,1∶2000;β-actin,l∶1 000;兔抗小鼠p-Akt,1∶500),4℃过夜。山羊抗兔二抗(1∶20 000)室温下1 h,化学法发光,压片后分析结果。最后用SPSS 18.0图像分析系统测定各条带灰度值。
1.8体内成瘤实验及肝转移瘤确定
将培养至对数生长期的各组细胞用0.25%的胰酶消化,并将细胞浓度调整为106/ml,将500μl细胞悬液注射至非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠背部皮下。8周后引颈处死,分离肿瘤组织,并测量肿瘤组织体积,肿瘤组织制作成冷冻切片用于免疫荧光分析。使用游标卡尺每周2次测量分析肿瘤生长情况,肿瘤体积由公式(长度×宽度2)/2估算。
注射肿瘤细胞后8周后将小鼠处死。将每只小鼠的肝脏从周围组织中剖离,之后将肝脏横切。通过气管注射墨汁直至肝脏染黑。随后将肝脏切开,随后将标本放置在Fekete溶液中24 h漂白肝脏表明肿瘤结节。对比染色形成白色肝脏转移瘤和黑色正常肝脏组织之间的明确区分。
1.9统计学方法
采用SPSS19.0统计学软件包进行数据处理,计量资料以均数±标准差形式(±s)表示,进行描述性统计分析、样本的正态性检验、方差齐性检验、单因素方差分析(one-way ANOVA)及LSD-t检验(多个样本均数间两两比较采用)。除方差齐性检验时取P<0.10认为检验结果有统计学意义外,所有统计学分析均取P<0.05为差异有统计学意义。
2 结果
2.1异常肝细胞中Prx 1和pAkt上调
本实验通过获取配对肝细胞,并检测配对肝细胞中Prx 1蛋白表达差异情况,探讨癌前肝细胞中Prx 1的表达情况。原代肝细胞从肝癌组织、近癌肝组织和远癌肝组织中分离培养。与正常肝细胞比较,异常(癌前病变,源自近癌肝组织)肝细胞Prx 1表达上调(见表1、图1)。正常细胞到异常细胞的表型转化与Akt等细胞内信号分子变化有关,采用Pearson直线相关分析pAkt水平与Prx 1蛋白表达水平之间的关系,用相关系数r表示,结果显示:Akt水平与Prx 1蛋白表达水平呈正相关(r=0.863,P<0.01),提示pAkt水平上升与Prx1蛋白表达水平紧密相关。
提取远癌肝组织(正常肝组织)和近癌肝组织(恶性转化肝组织)蛋白,Western blot检测Prx 1、pAkt、Akt及β-actin在两组肝组织中的表达差异。
表1 远癌肝组织(正常肝组织)和近癌肝组织中Prx 1、pAkt、Akt相对表达情况(n=4,±s)

表1 远癌肝组织(正常肝组织)和近癌肝组织中Prx 1、pAkt、Akt相对表达情况(n=4,±s)
注:†两组间蛋白相对表达值比较采用t检验,两组间比较差异有统计学意义,P<0.05
组别 Prx 1/β-actin pAkt/β-actin Akt/β-actin远癌肝组织组 0.473±0.142 0.366±0.125 0.836±0.142近癌肝组织组 0.894±0.264† 0.748±0.214† 0.722±0.137 t值 7.182 6.483 0.182 P值 0.027 0.032 0.725
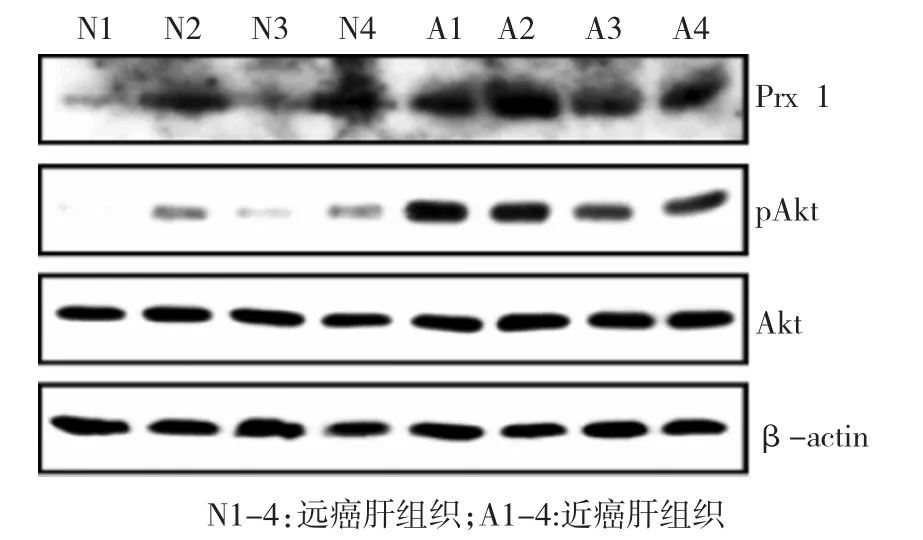
图1 Prx 1在肝细胞中的表达情况
2.2Prx 1增强EGF介导的EGFR与Akt激活
与空白对照组肝细胞株L02比较,癌前病变肝细胞(CCL13)中Prx 1蛋白表达明显上升,差异有统计学意义(t =5.738,P=0.037)。基线状态时,L02或CCL13细胞中均未检测到Akt激活(见图2A)。与Prx 1低水平表达的L02细胞比较,Prx 1表达较高的CCL13细胞中EGF介导的Akt激活明显增加,差异有统计学意义(t =8.412,P=0.001)(见图2B)。5种关键性EGFR磷酸化残基中,只有酪氨酸1173残基对EGF处理有反应;这种残基被称为导致Akt激活的磷酸化位点,结果提示原代肝细胞中,Prx 1水平较高增加了Akt信号,Prx 1可能与EGF介导的信号通路有关。
2.3Prx 1表达敲除对肿瘤生长和体内新陈代谢的影响
Western blot检测表明,转染稳定表达靶向Prx 1的短发卡RNA(shPrx-1)HepG2细胞中Prx 1表达明显受到抑制,与对照组比较,差异有统计学意义(t=12.341,P=0.000)(见图3A),证实shPrx 1转染成功,但是转染shPrx 1对HepG2细胞内ROS产生无影响,与对照组比较,差异无统计学意义(t = 0.124,P=0.892)(见图3B)。Prx 1表达敲除后显著地抑制了肿瘤生长,第24天开始,shPrx 1组肿瘤体积均明显比无义shRNA转染组小(均P<0.05)(见图4)。第56天时,在SCID鼠体中皮下注射每种细胞3×106个,并检查肝转移瘤确定远端转移特性。如图5所示,敲除Prx 1降低了HepG2移植瘤中肝转移瘤的发病率,shPrx 1组肝转移瘤数量明显少于无义shRNA转染组(t=6.132,P=0.035)。
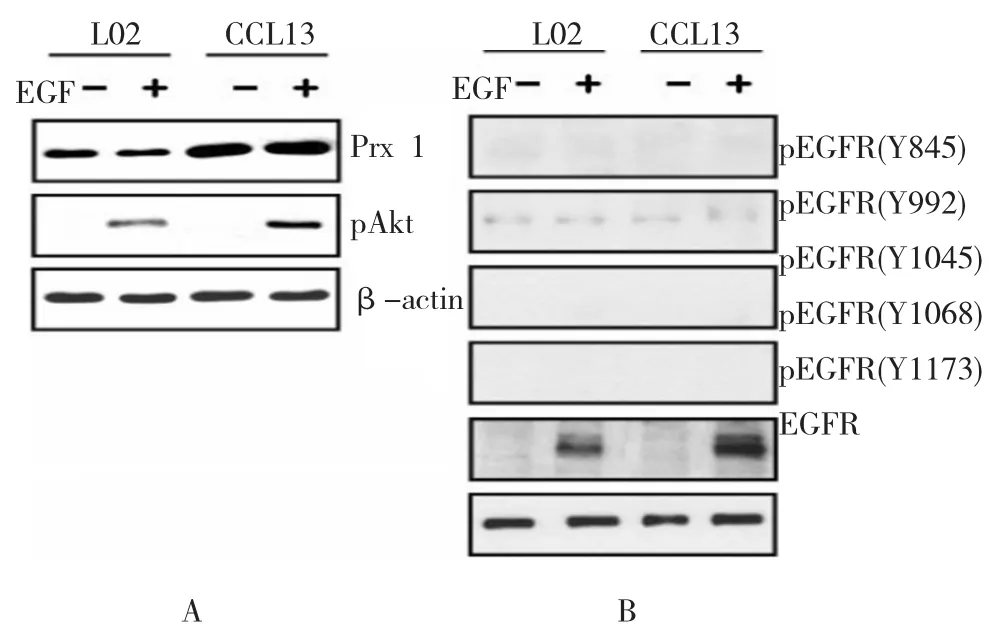
图2 Prx 1对EGF诱导的EGFR-Akt信号通路激活的影响
此外,磷酸化Akt程度与Prx 1蛋白表达水平密切相关,Pearson直线相关分析血清磷酸化Akt程度与Prx 1蛋白表达水平呈正相关(r=0.954,P<0.01)(见图6)。肿瘤中Prx 1表达敲除后的作用持续至首次注射肝癌细胞56d后,Prx 1表达敲除肝肿瘤pAkt表达水平较低,该结果表明,Prx 1在调节人类肝癌Akt激活中起主要作用。

图3 Prx 1表达下调使肝癌HepG2细胞内活性氧簇水平下降
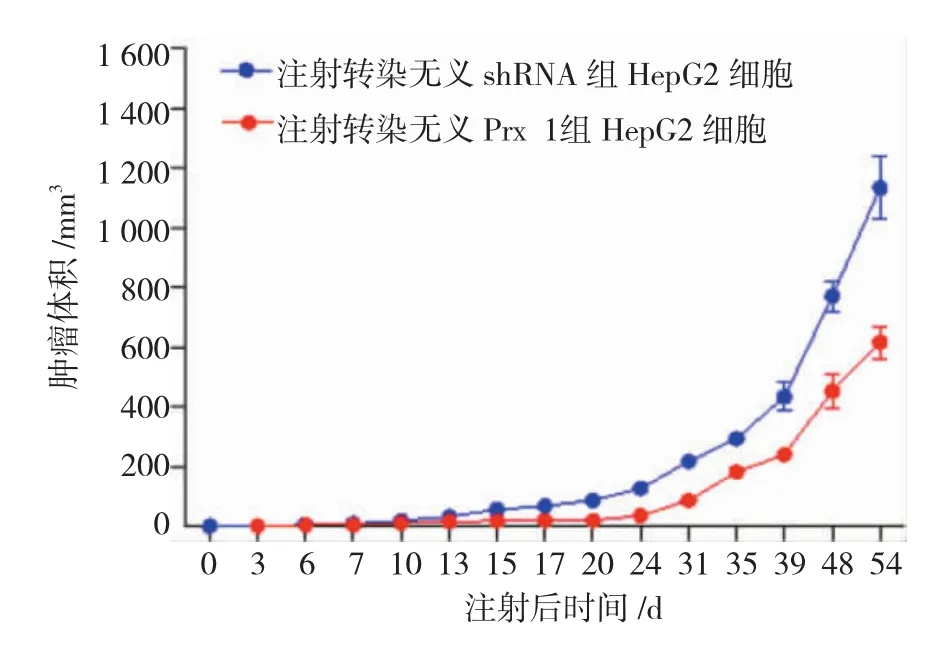
图4 Prx 1表达沉默抑制了HepG2细胞体内成瘤能力
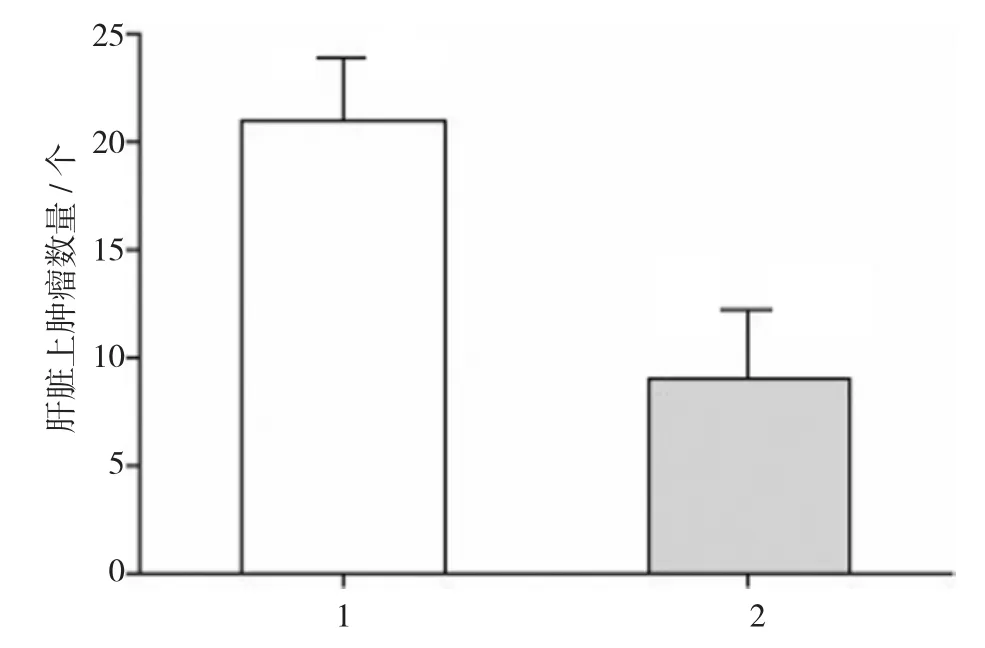
图5 Prx 1表达沉默抑制了HepG2移植瘤转移至肝脏的能力
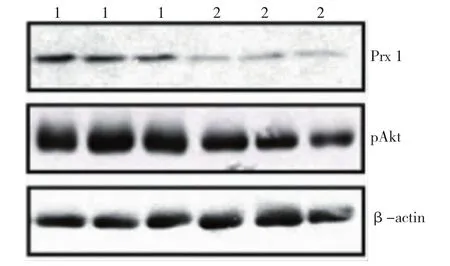
图6 Prx 1表达沉默抑制体内Akt激活
3 讨论
本文实验结果发现癌前病变肝细胞中Prx 1表达水平明显高于正常肝细胞,在恶性肝癌组织中Prx 1表达水平也显著升高。进一步研究发现,正常细胞向异常细胞转化过程中的Prx 1表达升高与Akt激活增加有关。采用shRNA抑制肝癌细胞中Prx 1表达后,肝癌细胞移植瘤模型中肿瘤生长和转移明显受到抑制,提示Prx 1可能与肿瘤进展和侵袭有关,而Akt激活降低与肿瘤发生减少显著相关。
以往研究认为Prx 1能够增强细胞生存能力,是因为Prx1具有抗氧化剂作用[5]。Prx1在N端(Cys52)含有具有催化作用的半胱氨酸,该半胱氨酸能够通过巯基氧化(Cys52-SOH,次磺酸)降低细胞内ROS水平。Cys52-SOH在C-端,Cys173能够通过保守解离的半胱氨酸形成一种分子间的双硫键,该双硫键通过硫氧还蛋白(Trx)/硫氧化还原蛋白还原酶(TR)等体系的电子供体还原为活性巯基形式,Cys52-SH[6-7]。体内外研究均表明抑制Prx 1表达能够增强肠癌肺癌放射治疗敏感行。这些研究均证实以下这一观点:Prx 1是抗氧化蛋白,因为抑制Prx 1表达引起放射敏感性增强是由于ROS产量升高。尽管以往体内外研究都发现抑制Prx 1表达能够显著增强POS产生,但是本研究中Prx 1表达下调肝癌细胞中ROS并未显著增加,本研究结果与Kim等[8]研究结果一致,Kim等发现放疗后,Prx 1过表达在抑制了c-Jun N-端激酶激活(c-Jun N-terminal kinase,JNK)和凋亡性细胞死亡。然而,Prx 1的抗氧化活性功能对于该过程并不是必需的,因为野生型Prx 1和缺少抗氧化活性的突变Prx 1(Prx-1C52S)都能通过与GSTpi-JNK复合物结合高效阻断JNK激活和细胞凋亡。
本研究结果还表明Prx 1具有调控人肝细胞中EGFR介导信号通路的潜在作用。Prx 1高表达细胞中配体诱导EGFR Tyr1173残基磷酸化增强,从而导致Akt激活。Prx 1增强EGFR信号功能的分子机制仍需进一步研究。近期研究表明,Prx 1具有分子伴侣的功能,且这一功能不依赖于Prx 1的过氧化物酶活性[9]。作为伴侣蛋白,Prx 1改变了各种细胞蛋白的功能和活性,包括c-Abl酪氨酸激酶、巨噬细胞移动抑制因子、c-Myc致癌基因、雄激素受体等。Prx 1具有多种生理功能的重要原因就是Prx 1能够与生长调节蛋白相互作用。近期蛋白质组学分析提示Prx 1能够与细胞内信号转导蛋白Ezrin相互作用。Ezrin是一种磷蛋白,能够增强生长因子诱导磷酸化,并将PI3K/Akt等信号通过蛋白间直接相互作用转导至下游。Ezrin是论证Prx 1增强EGFR-Akt生存信号通路功能的理想靶点。
本文研究结果进一步揭示Prx 1能够通过EGFR-Akt信号通路介导细胞正常至异常转化、肿瘤形成、转移,提示Prx 1可能是肝癌早期检测重要靶点。目前有许多研究致力于基于靶点策略进行肿瘤早期检测,但是这些靶点都专注于个别靶分子。随着Prx 1研究的深入,与Prx 1相互作用的靶分子/效应分子的范围可能进一步扩展。尽管这些相互作用的功能结果需要以细胞类型和组织环境限制模式进行检测和阐述,但抑制Prx 1表达能够同时作用多个靶点蛋白干预肝细胞癌形成。
参考文献:
[1]陈建国,陈万青,张思维.中国2003-2007年肝癌发病率与死亡率分析[J].中华流行病学杂志, 2012, 33(6): 547-553.
[2] Jeong W, Bae SH, Toledano MB, et al. Role of sulfiredoxin as a regulator of peroxiredoxin function and regulation of its expression[J]. Free Radical Biology and Medicine, 2012, 53(3): 447-456.
[3]段婷,姚兵.过氧化物还原酶蛋白家族与疾病[J].医学研究生学报, 2015, 28(1): 98-101.
[4] Martinez-Pinna R, Ramos-Mozo P, Madrigal-Matute J, et al. I-dentification of peroxiredoxin-1 as a novel biomarker of abdominal aortic aneurysm[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2011, 31(4): 935-943.
[5] Cao J, Schulte J, Knight A, et al. Prdx1 inhibits tumorigenesis via regulating PTEN/AKT activity [J]. EMBO J, 2009, 28 (10): 1505-1517.
[6] Shen J, Person MD, Zhu J, et al. Protein expression profiles in pancreatic adenocarcinoma compared with normal pancreatic tissue and tissue affected by pancreatitis as detected by twodimensional gel electrophoresis and mass spectrometry[J]. Cancer Res, 2004, 64(24): 9018-9026.
[7] Sobin LH, Compton CC. TNM seventh edition: what’s new, what’schanged: communication from the international union against cancer and the american joint committee on cancer [J]. Cancer, 2010, 116(22): 5336-5339.
[8] Kim YJ, Lee WS, Ip C, et al. Prx-1 suppresses radiation-induced c-Jun NH2-terminal kinase signaling in lung cancer cells through interaction with the glutathione STransferase Pi/c-Jun NH2-terminal kinase complex [J]. Cancer Res, 2006, 66 (11): 7136-7142.
[9] Chen MF, Keng PC, Shau H, et al. Inhibition of lung tumor growth and augmentation of radiosensitivity by decreasing peroxiredoxin I expression[J]. Int J Radiat Oncol Biol Phys, 2006, 64 (12): 581-591.
(张蕾编辑)
论著
Effect of Prx-1 on growth of hepatocellular carcinoma xenografts
Qing-song Tu, Jian-tai He (Xiangya Hospital, Central South University, Changsha, Hunan 410008, China)
Abstract:Objectives To investigate the role of Prx 1 in hepatocellular carcinoma. Methods The expression of Prx-1, pAkt and Akt in distal hepatocellular carcinoma and para- carcinoma tissue was detected by Western blot. Human liver cells were treated with 10 ng/ml EGF for 10 min after 24 hrs after serum starvation. Total proteins were extracted immediately after 10-min EGF treatment and used for Western blot. Equal amount of protein (20 μg) was separated by SDS-PAGE and probed with antibodies specific to Prx 1, pAkt, various phosphorylated forms of EGFR and total EGFR. Prx 1 protein levels in parental (untransfected), scramble, and Prx-1shRNA transfected HepG2 cells were measured by Western blot. Reactive oxygen species (ROS) levels determined from HepG2 sublines by using probe DCFH-DA. HepG2/Prx 1Sc and HepG2/Prx-1KD cells were injected into the dorsal flank of male SCID mice. Tumor size was measured every week after injection. Protein extracted from HepG2/Prx 1Sc and HepG2/Prx 1KD tumor tissues was subjected to Western blot analysis. Equal amount of protein (20 μg) was separated by SDS-PAGE and probed with antibodies specific to Prx-1and pAkt. Results Increased expression of Prx 1 was observed in abnormal (pre-malignant) liver cells compared to their paired normal liver cells. Prx 1 enhances EGF-mediated EGFR and Akt activation. Prx-1 knock-down inhibits tumor growth of HepG2 xenografts in vivo. Prx 1 knock-down reduces liver metastasis of HepG2 xenografts in vivo. Prx-1 knock-down inhibits Akt activation in vivo. Conclusions A potential role for Prx-1 in regulation of EGFR mediated signaling pathways in human liver cells. Prx-1 in mediates normal-to-abnormal cell transition, tumorigenesis, and metastasis through EGFR-Akt signaling pathways.
Keywords:peroxiredoxin-1; hepatocellular carcinoma; xenografts
收稿日期:2015-11-18
文章编号:1005-8982(2016)08-0011-06
DOI:10.3969/j.issn.1005-8982.2016.08.003
中图分类号:R735.7
文献标识码:A
