干细胞来源的外泌体:心肌梗死治疗新启示
2016-05-24宋菲综述俞梦越审校
宋菲 综述 俞梦越 审校
(1.北京协和医学院 中国医学科学院 阜外医院,北京100044;2.中国医学科学院 阜外医院,北京100044)
干细胞来源的外泌体:心肌梗死治疗新启示
宋菲1综述俞梦越2审校
(1.北京协和医学院 中国医学科学院 阜外医院,北京100044;2.中国医学科学院 阜外医院,北京100044)
【摘要】外泌体是在细胞间交流中起重要作用的外分泌纳米级磷脂双层囊泡,可由多种细胞分泌,在细胞间有效转运蛋白质、RNA等生命活性物质。值得注意的是,近期研究发现干细胞分泌的外泌体可以减少心肌细胞凋亡,促进心肌细胞、血管内皮细胞增殖分化,因而为心肌梗死提出了一种创新的生物分子治疗方式,现主要论述干细胞来源外泌体在治疗心肌梗死中的最新研究进展和对未来治疗应用的展望。
【关键词】外泌体;干细胞;心肌梗死
急性心肌梗死时冠状动脉急性闭塞和再灌注治疗时缺血-再灌注损伤均可引起心肌细胞急性缺血缺氧,触发炎症反应,心肌细胞坏死凋亡最终导致心肌重构和难以逆转的心脏功能下降。因此多项研究寄希望于干细胞增殖分化为新的心肌细胞来弥补损失的心肌,改善心肌梗死后的心脏功能[1-2]。但最近研究表明干细胞在移植心脏中的成活率和分化率很低,干细胞移植获益可能主要通过其外分泌作用[3]。而其中干细胞分泌的外泌体被认为可能是发挥主要作用的因子。近几年随着对干细胞来源外泌体研究的深入,发现外泌体不仅可以在心肌梗死后促进微血管增生、抑制纤维化改善心脏功能,在再灌注治疗中应用还可以减轻炎症反应和氧化应激损伤,抑制心肌细胞凋亡,减少心肌梗死面积。而且其易提取,易改造,与干细胞移植相比低风险的优势使其在心肌梗死治疗中有着良好的应用前景。现主要总结干细胞来源外泌体的最新研究进展及其在心肌梗死治疗中应用的展望。
1外泌体简介
外泌体(exosome)是细胞分泌的脂质双层膜囊泡。与其他直径为100~1 000 nm直接起源于细胞质膜的胞外膜泡(extracellular vesicles,EVs)不同,外泌体起源于细胞的内体系统。首先细胞膜内陷形成初级内体,内体膜再次内陷形成多个腔内小泡(intraluminal vesicles,ILVs),此时包含多个ILVs的内体即次级内体也叫做多泡体(muiltivesicular body,MVB)。MVB膜与细胞质膜融合而释放的直径为30~100 nm的脂质双层膜囊泡即为外泌体(图1)。研究表明,外泌体主要运载内源性蛋白、脂质、核酸等物质,通过靶细胞内化、受体-配体间相互作用或脂质膜融合在细胞间传递信息[4-5]。近几年在心血管方面的研究发现外泌体在心肌细胞间信息的传递对心血管系统有着重要的影响(图2)。
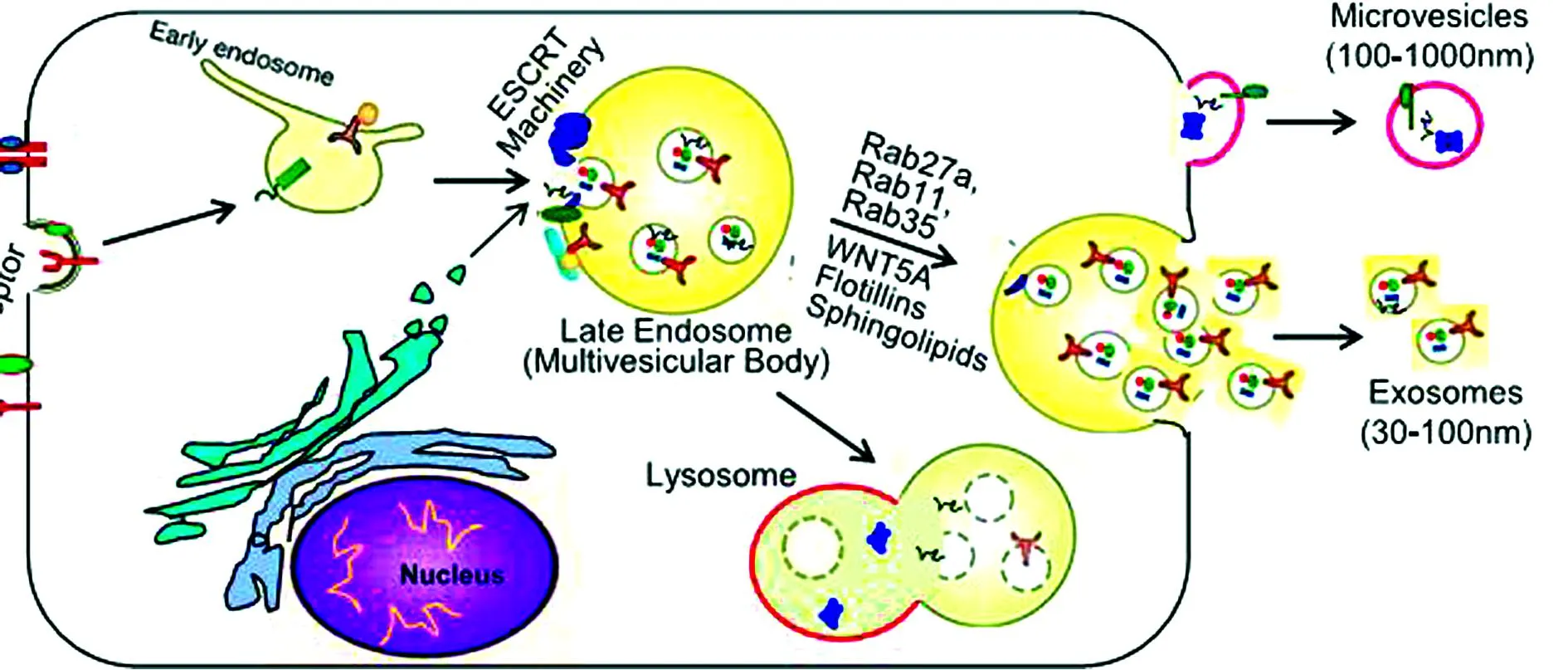
图片引自Ailawadi S,Wang X,Gu H,et al.Pathologic function and therapeutic potential of exosomes in cardiovascular disease[J].Biochim Biophys Acta,2015,1852(1):1-11.
图1微泡和外泌体的产生和分泌过程
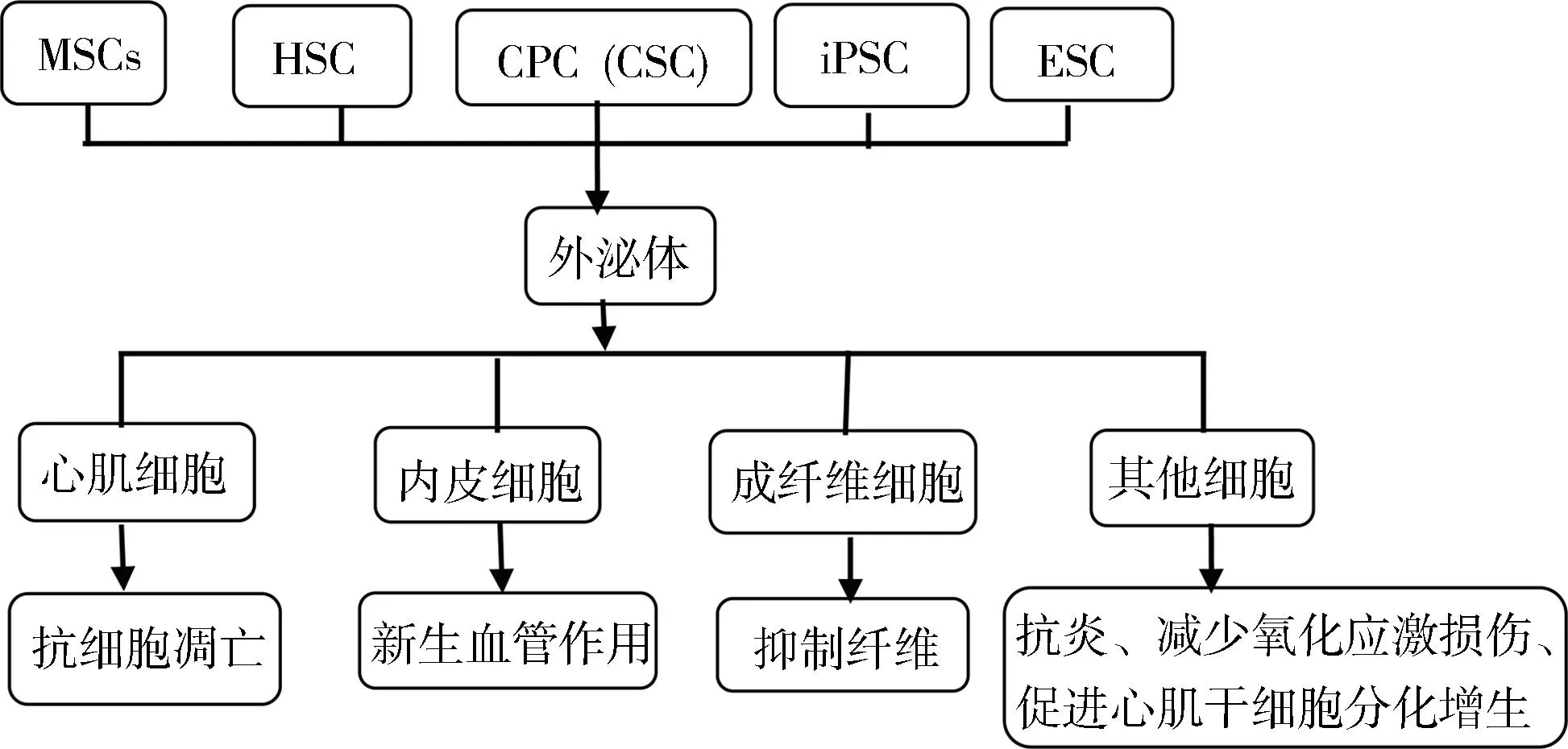
MSCs:mesenchymal stem cell,间充质干细胞;HSC: hematopoietic stem cell,造血干细胞;CPC:cardiac stem cell,心肌干细胞;CSC:cardiosphere cell,心肌球细胞;iPSC:induced pluripotent stem cell,诱导多能干细胞;ESC:embryonic stem,胚胎干细胞
图2多种干细胞来源的外泌体的心脏保护作用
2干细胞来源的外泌体
2.1间充质干细胞来源的外泌体
间充质干细胞(MSCs)在干细胞治疗心血管疾病中有着良好的应用前景,MSCs有多分化潜能,已经被证实移植到心脏的MSCs可以分化为心肌细胞、内皮细胞和血管平滑肌细胞[6-7],从而弥补心肌梗死后心肌细胞和血管的损失,改善心脏功能。同样其治疗中最大的困难为移植后的MSCs仅有少量存活并且分化。进一步研究发现MSCs可分泌丰富的外分泌因子发挥心血管保护作用[8],其中包括丰富的外泌体。外泌体对缺血性心脏病的保护作用及其作用机制引起了广泛的研究兴趣。
2.1.1抗细胞凋亡作用
Arslan等[9]研究均发现在活体小鼠心肌缺血-再灌注模型中,体外分离的外泌体注射到小鼠体内可以明显减少心肌梗死面积,并且Arslan等在外泌体治疗后28 d再次观察发现,心腔重构明显减轻,心脏功能明显增强,说明外泌体不仅可以在急性期减少心肌细胞凋亡,对心肌梗死后的长期预后也有明显的改善。
有文献认为MSCs来源的外泌体(MSC-exo)发挥抗细胞凋亡作用主要与外泌体中的miRNA(micro-RNA)-22和miRNA-221有关。MSCs分泌的外泌体中富含的miRNA-22,通过作用于目标细胞中的甲基化CpG结合蛋白发挥抗凋亡作用[10],同时miRNA-221通过抑制p53正向凋亡调控因子发挥抗细胞凋亡作用[11]。另有研究认为外泌体可能补充在心肌缺氧和再灌注时丢失的氧化磷酸化途径中的关键酶,从而恢复心肌能量储备,减少氧化应激,减少心肌细胞凋亡。研究证实外泌体与靶细胞结合后可以迅速调控细胞内与细胞凋亡密切相关的信号传导通路。例如通过激活IGF-1a/PI3K/Akt途径和抑制c-JNK的磷酸化阻止细胞凋亡[9]。最近有文献报道趋化因子受体CXCR4超表达的MSC-exo与普通MSC-exo相比大大增加IGF-1a/PI3K/Akt途径激活效率,减少细胞凋亡[12]。
2.1.2血管新生作用
不少研究通过体外内皮细胞培养实验已经证实各种来源的MSCs有促进血管内皮增生、迁移、新生血管的作用。例如,胚胎MSCs在缺氧状态下分泌的外泌体可促进胚胎微血管内皮细胞的迁移和血管化[13]。脂质间充质干细胞可促进人类微血管内皮的增生和迁移,并且血小板生长因子可以促进脂质MSCs释放富含促进血管增生分子的外泌体[14]。人脐带MSCs来源的外泌体在体外培养的人脐静脉内皮细胞(EA.hy926 cells)成管状结构和内皮细胞迁移中作用明显[15]。Kang等[12]在进一步研究中将预先用MSC-exo处理过的细胞补片系统(cell patch system)植入小鼠体内。4周后用免疫染色测定血管性血友病因子的含量明显增多,进一步证实了MSC-exo新生血管的作用。同时,Bian等[16]也发现在心肌梗死小鼠模型中心肌注射MSCs来源的微泡 (主要包括微粒和外泌体)可显著改善血流恢复。以上体外细胞培养和小鼠在体实验均表明MSC-exo可促进血管内皮细胞增生迁移,促进心肌梗死后的微血管增生。
2.1.3抗炎和抗纤维化作用
心肌梗死再灌注时,炎症细胞的浸润会造成心肌的进一步损害,有研究表明外周白细胞计数与心肌梗死面积、心脏功能和临床预后明显相关[9]。Arslan等[9]使小鼠心肌缺血30 min,于再灌注之前5 min注射外泌体或生理盐水,发现再灌注后1~3 d注射外泌体一组中性粒细胞和巨噬细胞局部浸润明显比生理盐水组要少,而且外周白细胞数量也明显减少。因此认为心肌梗死再灌注之前应用外泌体可减轻心脏和全身的炎症反应,保护心脏功能。
外泌体通过作用于成纤维细胞,可以减轻心肌缺血部位的纤维化。Zhao等[15]用Masson 三色染色法发现心肌梗死大鼠模型经外泌体治疗后的心肌纤维化明显减轻。
2.1.4缺血预适应
缺血预适应对缺血心肌的保护作用已经得到广泛证实[17]然而机制并未完全阐明。最近,Feng等[10]发现经过缺血预处理的MSC-exo在小鼠心肌梗死活体模型中与普通MSC-exo相比可进一步减少心肌细胞凋亡和纤维化。经过缺血预处理的MSC-exo中miRNA-22含量比普通MSC-exo高4.5倍或更高,提示这种作用可能主要由miRNA-22介导,然而是否与其他蛋白或分子有关尚不明了[10]。
2.2造血干细胞来源的外泌体
同MSCs一样,移植后的造血干细胞(hematopoietic stem cell,HSC)存活和分化率极低,但确实可以改善心脏功能,提示其是HSC的外分泌功能在发挥主要作用[18]。关于HSC来源的外泌体目前研究最清楚的为CD34+干细胞来源的外泌体在体外和体内实验均有显著的新生血管的作用,可加强内皮细胞活性,促进增生和形成管样结构。然而,CD34-的HSC来源的外泌体(HSC-exo)却无此功能[19],经过比较CD34+HSC-exo和CD34-HSC-exo内的成分,发现CD34+HSC-exo内miRNA-126和miRNA-130a含量明显较高,因此推测miRNA-126和miRNA-130a为促进血管新生的关键分子,但具体机制尚未清楚[19]。
Mackie等[20]将对CD34+细胞进行基因修饰,添加有生血管作用的音猬因子(Shh因子)的基因,发现CD34+(Shh)分泌的外泌体富含Shh因子,且生血管作用在活体心肌梗死小鼠模型中明显增强。该研究将有保护作用的基因植入干细胞中,通过外泌体与周围细胞之间的物质运输和信息交流作用,使目的基因在目标细胞内过表达,达到治疗效果,对外泌体治疗作用又有了新的启示。
2.3心脏祖细胞来源的外泌体
早在2010年,Vrijsen 等[21]就发现心脏祖细胞来源的外泌体(CPC-exo)在体外抓痕试验中可以促进内皮细胞的迁移。Barile等[22]在体外细胞培养实验中证实心肌干细胞(cardiac stem cell,CPC)可以促进人脐静脉内皮细胞的成管作用,并抑制心肌细胞凋亡。在体内实验中,研究者进一步向心肌梗死小鼠模型的梗死区域注射CPC-exo,证实CPC-exo可以减少心肌梗死面积,增加血管密度并改善心肌梗死后的心脏功能。
Chen等[23]发现CPC来源的外泌体可被H9C2细胞快速摄取,并且可以明显抑制H2O2刺激后的caspase 3/7活性,抑制细胞凋亡。同时,在小鼠急性心肌缺血-再灌注活体模型中,CPC-exo与对照组相比可大幅度减少心肌细胞凋亡(53%)。此外,该研究发现外泌体囊泡中富含miRNA-144,提示后者可能是心脏保护作用的主要原因[23]。
正常条件下分泌的CPC-exo对心肌的保护作用已有大量证据,缺血预适应处理过的CPC-exo的心脏保护作用近来也得到证实。Gray等[24]发现,缺血预适应处理过的CPC-exo与普通条件下相比,新生血管作用和抗纤维化作用更加明显。通过基因芯片和计算机建模分析比较显示,缺氧预处理的外泌体与常规条件下分泌的外泌体比较miRNA成分有明显变化,调节血管生成和抑制纤维化的miRNA明显增多。
心脏祖细胞可以分化为心球样细胞团[25],其中包含原始细胞和定向分化的三种祖细胞(心肌细胞、内皮细胞和平滑肌细胞)。有研究表明,心球样细胞团来源的外泌体同样可以促进CPC增生、血管新生和改善心脏功能[26]。
2.4胚胎干细胞和诱导多能干细胞来源的外泌体
关于胚胎干细胞和诱导多能干细胞来源的外泌体的研究很少。分化程度较低的干细胞虽然分化增生功能较强,但同时分化定向性差和伦理等问题使其应用受到局限,但其分泌的外泌体则可能保留较强的促心肌细胞增殖分化的能力同时可以避免干细胞移植体内带来的问题。最近,有研究证实胚胎干细胞来源的外泌体有良好的血管生成、抑制纤维化作用,最重要的是在心肌梗死后可以复苏心脏的增生反应,促进心肌干细胞增殖分化[27]。同时Wang等[28]也证实诱导多能干细胞来源的外泌体可以在心肌缺血-再灌注模型中起到保护心肌的作用,并且避免移植细胞带来的致瘤风险。
3干细胞来源的外泌体与miRNA
外泌体是细胞之间运输蛋白酶和miRNA的良好载体,因为这些活性成分一旦暴露于体液环境中,会很快降解失活。近年来,对外泌体研究热度增加的同时也引起了人们对其中包含的miRNA成分的关注,而且越来越多的证据表明miRNA可能在外泌体发挥心脏保护作用中起关键作用。如前文所述,MSCs分泌的外泌体中富含的miRNA-22和miRNA-221,通过作用于目标细胞中的甲基化CpG结合蛋白和抑制p53正向凋亡调控因子发挥抗细胞凋亡作用[10-11],而且经过缺血预处理的MSC-exo中miRNA-22含量是普通MSC-exo的4.5倍或更高,与普通MSCs-exo相比可进一步减少心肌细胞凋亡和纤维化[10];CD34+干细胞来源的外泌体在体外和体内实验中均有明显的血管生成作用,其中富含的miRNA-126和miRNA-130a可能为发挥作用的主要分子[19];CPC和其分化的心肌球细胞来源的外泌体中富含的miRNA-144、miRNA-451和miRNA-146a对血管生成和心肌细胞再生也有重要作用(如表1)[22-23]。

表1 不同干细胞来源的外泌体中富集的mi-RNA及其保护作用
4对治疗的启示及展望
越来越多的研究表明外泌体可在心肌梗死急性期减少细胞凋亡、减轻炎症反应、减少心肌梗死面积,后期促进血管生成,抑制纤维化,减轻心肌重构从而改善心肌梗死后的心脏功能。外泌体的这些特性使得其在治疗心肌梗死中存在良好的应用前景。体外分离干细胞来源的外泌体再注射到体内的治疗方式,在临床前期的鼠类在体试验中,得到良好的结果且并不逊于体内干细胞移植的治疗方式,相比可以降低移植手术和干细胞分化为其他组织甚至致瘤的风险。
此外,通过对干细胞进行不同的处理可以得到更高效的外泌体,例如缺血预适应处理或超表达某种想要的基因产物。得到富含心肌保护作用的蛋白和miRNA 的外泌体,可能成为以后新的研究热点。
目前,虽然有越来越多的研究证实干细胞来源的外泌体对心肌梗死后心肌的保护作用,但具体分子机制并不十分清楚。通过对外泌体中包含的主要有效成分及其作用机制的研究可以帮助找到新的治疗方法。例如最新的研究探讨联合应用有效成分miRNA和干细胞联合治疗心肌梗死[29]。
干细胞来源的外泌体治疗心肌梗死可能成为十分有前景的新的治疗方法,但目前研究仍处于临床前期,而且作用机制研究不足。增加外泌体治疗心肌梗死的效率和安全性可能是以后亟需解决的问题。
[ 参 考 文 献 ]
[1]Kanashiro-Takeuchi RM,Schulman IH,Hare JM.Pharmacologic and genetic strategies to enhance cell therapy for cardiac regeneration[J].J Mol Cell Cardiol,2011,51(4):619-625.
[2]Iglesias-Garcia O,Pelacho B,Prosper F.Induced pluripotent stem cells as a new strategy for cardiac regeneration and disease modeling[J].J Mol Cell Cardiol,2013,62:43-50.
[3]Makridakis M,Roubelakis MG,Vlahou A.Stem cells: insights into the secretome[J].Biochim Biophys Acta,2013,1834(11):2380-2384.
[4]Ailawadi S,Wang X,Gu H,et al.Pathologic function and therapeutic potential of exosomes in cardiovascular disease[J].Biochim Biophys Acta,2015,1852(1):1-11.
[5]Huang L,Ma W,Ma Y,et al.Exosomes in mesenchymal stem cells, a new therapeutic strategy for cardiovascular diseases?[J].Int J Biol Sci,2015,11(2):238-245.
[6]Kurpinski K,Lam H,Chu J,et al.Transforming growth factor-beta and notch signaling mediate stem cell differentiation into smooth muscle cells[J].Stem Cells,2010,28(4):734-742.
[7]Dufourcq P,Descamps B,Tojais NF,et al.Secreted frizzled-related protein-1 enhances mesenchymal stem cell function in angiogenesis and contributes to neovessel maturation[J].Stem Cells,2008,26(11):2991-3001.
[8]Tang YL,Zhao Q,Qin X,et al.Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].Ann Thorac Surg,2005,80(1):229-236, 236-237.
[9]Arslan F,Lai RC,Smeets MB,et al.Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[10]Feng Y,Huang W,Wani M,et al.Ischemic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J].PLoS One,2014,9(2):e88685.
[11]Yu B,Gong M,Wang Y,et al.Cardiomyocyte protection by GATA-4 gene engineered mesenchymal stem cells is partially mediated by translocation of miR-221 in microvesicles[J].PLoS One,2013,8(8):e73304.
[12]Kang K,Ma R,Cai W,et al.Exosomes secreted from CXCR4 overexpressing mesenchymal stem cells promote cardioprotection via Akt signaling pathway following myocardial infarction[J].Stem Cells Int,2015,2015:659890.
[13]Salomon C,Ryan J,Sobrevia L,et al.Exosomal signaling during hypoxia mediates microvascular endothelial cell migration and vasculogenesis[J].PLoS One,2013,8(7):e68451.
[14]Lopatina T,Bruno S,Tetta C,et al.Platelet-derived growth factor regulates the secretion of extracellular vesicles by adipose mesenchymal stem cells and enhances their angiogenic potential[J].Cell Commun Signal,2014,12:26.
[15]Zhao Y,Sun X,Cao W,et al.Exosomes derived from human umbilical cord mesenchymal stem cells relieve acute myocardial ischemic injury[J].Stem Cells Int,2015,2015:761643.
[16]Bian S,Zhang L,Duan L,et al.Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J].J Mol Med (Berl),2014,92(4):387-397.
[17]Sanada S,Komuro I,Kitakaze M.Pathophysiology of myocardial reperfusion injury:preconditioning, postconditioning, and translational aspects of protective measures[J].Am J Physiol Heart Circ Physiol,2011,301(5):H1723-H1741.
[18]Balmer GM,Riley PR.Harnessing the potential of adult cardiac stem cells: lessons from haematopoiesis, the embryo and the niche[J].J Cardiovasc Transl Res,2012,5(5):631-640.
[19]Sahoo S,Klychko E,Thorne T,et al.Exosomes from human CD34(+) stem cells mediate their proangiogenic paracrine activity[J].Circ Res,2011,109(7):724-728.
[20]Mackie AR,Klyachko E,Thorne T,et al.Sonic hedgehog-modified human CD34+ cells preserve cardiac function after acute myocardial infarction[J].Circ Res,2012,111(3):312-321.
[21]Vrijsen KR,Sluijter JP,Schuchardt MW,et al.Cardiomyocyte progenitor cell-derived exosomes stimulate migration of endothelial cells[J].J Cell Mol Med,2010,14(5):1064-1070.
[22]Barile L,Lionetti V,Cervio E,et al.Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction[J].Cardiovasc Res,2014,103(4):530-541.
[23]Chen L,Wang Y,Pan Y,et al.Cardiac progenitor-derived exosomes protect ischemic myocardium from acute ischemia/reperfusion injury[J].Biochem Biophys Res Commun,2013,431(3):566-571.
[24]Gray WD,French KM,Ghosh-Choudhary S,et al.Identification of therapeutic covariant microRNA clusters in hypoxia-treated cardiac progenitor cell exosomes using systems biology[J].Circ Res,2015,116(2):255-263.
[25]Smith RR,Barile L,Cho HC,et al.Regenerative potential of cardiosphere-derived cells expanded from percutaneous endomyocardial biopsy specimens[J].Circulation,2007,115(7):896-908.
[26]Cheng K,Malliaras K,Smith RR,et al.Human cardiosphere-derived cells from advanced heart failure patients exhibit augmented functional potency in myocardial repair[J].JACC Heart Fail,2014,2(1):49-61.
[27]Khan M,Nickoloff E,Abramova T,et al.Embryonic stem cell-derived exosomes promote endogenous repair mechanisms and enhance cardiac function following myocardial infarction[J].Circ Res,2015,117(1):52-64.
[28]Wang Y,Zhang L,Li Y,et al.Exosomes/microvesicles from induced pluripotent stem cells deliver cardioprotective miRNAs and prevent cardiomyocyte apoptosis in the ischemic myocardium[J].Int J Cardiol,2015,192:61-69.
[29]Emanueli C,Shearn AI,Angelini GD,et al.Exosomes and exosomal miRNAs in cardiovascular protection and repair[J].Vascul Pharmacol,2015,71:24-30.
Exosomes Derived from Stem Cells: Novel Approach in Treatment of Myocardial Infarction
SONG Fei1, YU Mengyue2
(1.PekingUnionMedicalCollege,ChineseAcademyofMedicalSciences&FuWaiHospital,Beijing100044,China;2.ChineseAcademyofMedicalSciences&FuWaiHospital,Beijing100044,China)
【Abstract】Exosomes are nanosized secreted vesicles with phospholipid bilayers, which play important roles in cell-to-cell communication.Exosomes can be released by various cells and transport protein and RNA effectively between cells.Recent studies discovered that exosomes derived from stem cells exerted anti-apoptosis,cardiac regeneration and neo-vascularization effect, which are considered as novel molecular mechanisms of therapeutic potential of myocardial infarction.This review mainly summarizes the recent advances in research and discussed exosomes as a novel approach in the treatment of myocardial infarction in the future.
【Key words】Exsomes; Stem cell; Myocardial infarction
收稿日期:2015-11-19修回日期:2015-12-23
【中图分类号】R542.2
【文献标志码】A【DOI】10.16806/j.cnki.issn.1004-3934.2016.02.000
作者简介:宋菲(1990—),在读硕士,主要从事冠心病研究。Email: songfeifeisong@163.com通信作者:俞梦越(1973—),主任医师,硕士生导师,博士,主要从事冠心病介入研究。Email: yumy73@163.com
