中国公民逝世后器官捐献供肾体外低温机械灌注保存专家共识(2016版)
2016-05-24中华医学会器官移植学分会中国医师协会器官移植医师分会
中华医学会器官移植学分会 中国医师协会器官移植医师分会
·专家共识·
中国公民逝世后器官捐献供肾体外低温机械灌注保存专家共识(2016版)
中华医学会器官移植学分会 中国医师协会器官移植医师分会
1 前 言
我国现阶段公民逝世后器官捐献分为三大类:中国一类(C-Ⅰ),国标标准化脑死亡器官捐献(donation after brain death,DBD);中国二类(C-Ⅱ),国际标准化心脏死亡器官捐献(donation after cardiac death,DCD),包括目前国际上的Maastrichit标准(马氏标准)的M-Ⅰ~Ⅴ类案例;中国三类(C-Ⅲ),中国过渡时期脑-心双死亡标准器官捐献(donation after brain death awaiting cardiac death,DBCD)。其中C-Ⅰ、C-Ⅲ均是在脑死亡状态基础上进行的,而C-Ⅱ中不可逆的脑损伤亦接近脑死亡状态。因此,公民逝世后捐献供器官功能评估和维护主要建立在脑死亡导致的病理生理变化基础上。
由于脑死亡判定在我国尚属新事物,有关脑死亡的病理生理变化及支持性治疗等方面的理论和研究在广大医务人员中尚未得到普及和开展。为使公民逝世后捐献供器官功能的评估和保护技术在我国器官移植领域的临床应用和操作更为规范,中华医学会器官移植学分会和中国医师协会器官移植医师分会组织专家制订了《公民逝世后捐献供器官功能评估和维护专家共识(2016版)》,以期为相关临床科室工作的规范化开展提供指引。
2 共识参照的推荐级别/证据水平标准
本共识按照“推荐分级的评估、制定与评价(GRADE)”系统对证据质量等级和推荐强度进行分级。
3 公民逝世后捐献供器官功能评估和维护的原则
脑死亡判定成立前后的医疗活动处理原则不相同。脑死亡之前称为“救治生命”,治疗的目的和重点在于逆转受损的脑功能,以维持血压保证脑组织血流供应为首要。但确诊脑死亡后,治疗的方向转为维持并优化器官功能以满足移植的需要,称之为“救治器官”,以保证供者中枢外器官的血流氧合灌注和功能为主。脑死亡后最终不可避免导致心脏停跳死亡,在此病程演变过程中,器官功能逐渐出现不同程度的受损甚至是衰竭。随着时间的推移,脑死亡机体的内环境紊乱状态及器官功能受损将显著增加。因此,对器官功能保护治疗的时间更紧迫,不能延误。
推荐意见:
1. 所有被诊断为脑死亡并维持机械通气的患者在医学上都是潜在的器官捐献供者(1A)。
2. 对脑干反射消失的重症患者引入脑死亡的诊断,并进行规律性、持续优化的器官功能保护性重症治疗和对拟移植器官功能进行针对性评估,对获取数量更多、质量更好的潜在移植器官非常重要(1B)。
3. 及时确诊脑死亡、熟悉器官捐献供者的病情并尽早开始器官保护的重症治疗是器官移植成功的开始。缩短从诊断脑死亡到开始进行供器官保护治疗的时间,可有效提高适于移植的器官产出率和移植后生存率(1B)。
4 捐献供器官功能评估与选择
一旦脑死亡判断成立(或出现严重的不可逆脑损伤),并且其直系亲属同意捐献器官,应进行综合评估以确定其是否适合进行器官捐献。必须注意供者是一个有机的整体,需要全面、系统地了解病情、查缺补漏。患者病情的评估可以根据情况选择急性生理和慢性健康状况Ⅱ评分、Glasgow昏迷评分、创伤评分、威斯康星大学评分系统、美国器官共享联合网络评估系统或其他评分系统,评估的过程是动态、连续的。
推荐意见:
4. 评估的内容包括(1B):
(1)是否为致命性疾病/损伤,及对器官功能的影响;
(2)是否为脑死亡或心脏死亡不可逆损伤,及脑死亡过程中对器官功能的影响;
(3)心脏、肺、肝、肾以及胰腺等捐献器官功能状态或受损严重程度;
(4)是否合并感染、弥散性血管内凝血(disseminated or diffuse intravascular coagulation,DIC)等全身疾病,全身状况对器官功能的影响程度;
(5)疾病、预后、救治过程影响器官功能的因素和环节。
5. 临床信息收集要点(1B):供者年龄、性别、体质量、身高;手术史和既往史(吸烟、吸毒、酗酒、性行为、过敏史);导致脑死亡的损伤或发病原因;ICU住院时间;目前的临床状况(包括生理参数,机械通气参数,合并感染及抗感染方案,心律失常、血流动力学不稳定的时间,心肺复苏次数及持续时间,低血氧饱和度的时间,血管活性药物的使用种类和剂量等)。注意创伤后的主要症状、体征及其发展变化情况,所采取的急救措施和用药情况也相当重要;尤其需要关注创伤后早期的肝、肾等器官功能的实验室检查以及腹部X线、B超、CT等检查结果,以判明创伤后实质性器官是否有损伤和损伤的程度,同时更需要重视这些检查结果的动态发展和变化速度。
6.实验室检查包括(1B):ABO血型、HLA配型、全血细胞计数、血电解质、血糖、动脉血气分析、尿液分析、凝血全套、病毒感染性疾病的检测(甲、乙、丙、丁、戊型肝炎病毒,EB病毒,CMV,HIV,人类嗜T细胞病毒等);病原微生物感染性疾病(细菌、真菌、分枝杆菌、寄生虫等)检查(血液、脑脊液、体腔渗出液、尿液和痰等分泌物的显微镜检测、培养及直接药敏试验等)。
7. 对于捐献不同器官的供者,还需要对具体的器官功能进行相应特殊检查(1B):
(1)心脏检查:心功能的临床评估、心肌酶谱和肌钙蛋白的检测、心电图分析、胸部X线检查、超声心动图,超过45岁者行心导管检查;
(2)肺脏检查:100%氧气吸入、呼气末正压通气(positive end expiratory pressure,PEEP)为5 cmH2O(1 cmH2O=0.098 kPa,下同),30 min后检测氧合指数,动态动脉血气分析,胸部X线检查,支气管镜检查;
(3)肝脏检查:肝功能、凝血酶原时间、活化部分凝血活酶时间;
(4)肾脏检查:电解质、血尿素氮、血清肌酐;
(5)胰腺检查:动态血糖、血淀粉酶和脂肪酶等监测。
4.1 器官捐献的禁忌证(表1)
排除存在对受者有致命威胁的系统性或感染性疾病的供者。

表1 器官捐献的禁忌证
4.2 脑死亡标准供者特征(表2)
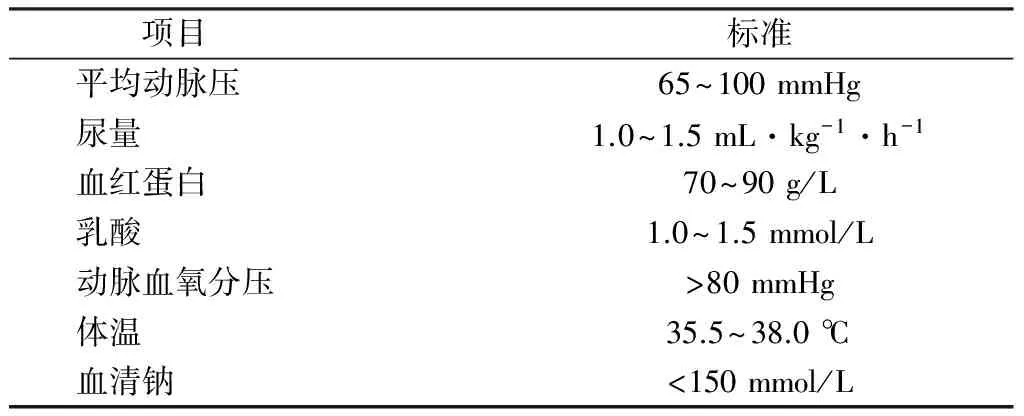
表2 脑死亡标准供者特征
注: 1 mmHg=0.133 kPa
4.3 不同器官移植的标准供者
4.3.1 肝脏
①年龄<50岁;②无肝胆疾病;③无严重的腹部损伤,无全身感染或肿瘤;④尿量>50 mL/h,血清肌酐<133 μmol/L;⑤血流动力学和呼吸功能稳定:收缩压>100 mmHg (1 mmHg=0.133 kPa,下同),中心静脉压>5 cmH2O,多巴胺用量<10 μg·kg-1·min-1,血气分析指标基本正常。
4.3.2 肾脏
①年龄10~39岁;②死亡原因为非脑血管疾病;③血清肌酐<133 μmol/L;④无高血压。
4.3.3 心脏
①年龄<50岁;②心脏超声没有室壁运动异常,左心室射血分数>50%,瓣膜结构功能良好;③多巴胺用量<15 μg·kg-1·min-1;④供、受者体质量比例为0.7~1.5;⑤冷缺血时间<4 h;⑥心电图正常或轻微ST-T改变,无心脏传导异常;⑦无细菌、真菌、分枝杆菌等的全身性感染;⑧血清学检查排除HBV、HCV、HIV等病毒感染。
4.3.4 肺脏
①年龄<55岁;②胸部X线正常;③动脉血气分析:在吸入氧浓度(FiO2)=1、PEEP=5 cmH2O时,动脉血氧分压(PaO2)>300 mmHg;④纤维支气管镜检查没有脓性分泌物或误吸;⑤无恶性肿瘤;⑥无细菌、真菌、分枝杆菌和病毒等病原体的全身性感染;⑦无肺部创伤、挫裂伤或损伤手术修复史;⑧无长期或大量吸烟史(超过5年的吸烟史或在过去1年每天吸烟超过20支)。
4.3.5 胰腺
①年龄<55岁;②无酗酒史;③个人或家族无糖尿病史;④血淀粉酶水平正常;⑤同时符合肾移植的选择标准。
4.4 扩大标准供者(expanded criteria donor,ECD)
除符合标准条件DBD以外的供者均被列为ECD:①在脑死亡期间切取器官前难以维持循环稳定等基本条件的供者;②心脏死亡供者;③DBD合并高龄、糖尿病、高血压、感染性疾病(HBV、HCV)、某些肿瘤、轻度结构功能异常(肝肾综合征、早期糖尿病肾病或IgA肾病、轻中度脂肪肝、轻度解剖学异常等);④移植物缺血时间过长。
5 捐献供器官功能维护的临床应用技术
5.1 捐献供器官功能维护新的治疗目标
捐献供器官功能维护的目的是防止甚至挽救器官功能和形态上的损伤,努力提高捐献器官的质量和数量。脑死亡后机体的最终血流动力学特征是有效循环血容量明显降低和器官组织低灌注,组织细胞缺氧是本质,其最终结果是多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。目前多数临床实践以血压恢复正常、心率下降、尿量恢复等作为复苏的目标。从病理生理角度来看,达到上述的复苏目标后,机体仍然存在器官组织缺氧,仍然有部分机体因全身炎症反应、缺血再灌注损伤以及肠道细菌和(或)毒素移位而最终发生MODS。因此,目前维持器官功能的“4个100原则”(收缩压>100 mmHg、尿量>100 mL/h、PaO2>100 mmHg、血红蛋白>100 g/L)显然是不够充分的。器官功能复苏的目标应是纠正组织细胞缺氧和氧债。实现脑死亡后器官功能的充分复苏,不仅仅要纠正血流动力学紊乱和氧代谢紊乱,还要采取积极有效措施,防止MODS的发生或进展。
推荐意见:
8. 捐献供器官功能维护新的治疗目标是改善器官的灌注和氧合(1B)。
9. 根据复苏治疗的阶段和目标,可将脑死亡后器官功能维护治疗分为血流动力学恢复稳定阶段(或称为捐献器官灌流恢复阶段)、氧代谢恢复阶段和MODS防治阶段。三个阶段同时进行,相互影响、相互作用(1C)。
5.2 完善监测系统
患者进展到脑死亡阶段,病情进入了终末期,实体器官功能或多或少会受损,机体内环境更为复杂和紊乱,因此器官功能维护过程中需要进行持续、严密监测。根据临床观察及时明确主要生理功能的各种变化,进行科学的调整管理,减少和避免过度治疗,使器官功能迅速复苏到最佳状态,满足器官移植的要求。既要检测机体整体的功能状况,持续监测供者的氧合、通气、循环和体温的变化,更要重视监测各个实体器官尤其是用于进行移植的器官功能。
推荐意见:

11.供者容量的变化常常需要有创技术连续监测机体的心血管功能(1B):①肺动脉压和肺毛细血管楔压及心排血量;②氧代动力学;③脉搏指数连续心输出量监测;④经食管超声心动图;⑤微循环功能等。
5.3 心血管功能支持和恢复氧供需平衡
脑死亡后早期出现交感神经活性增强引起“交感风暴”,此时可应用短效β-受体拮抗剂(如艾司洛尔)。短暂的“交感风暴”过后,儿茶酚胺分泌急剧减少,体、肺循环阻力下降,外周血管扩张甚至发生血管麻痹综合征。同时,脑死亡引起血管运动中枢功能严重受损等综合因素,导致以低血压为主要表现的血流动力学紊乱。血流动力学紊乱是脑死亡机体最持久的病理生理改变之一,导致全身有效循环血量明显减少,引起组织器官灌注量急剧减少和组织器官缺氧。因此,器官功能的维护首先应进行心血管功能支持治疗,目的是维持心脏有效做功,保证其他器官的有效灌注和氧供。
推荐意见:
12. 首先进行积极的输液复苏治疗以纠正由于限制液体、中枢性尿崩症或高血糖症引起的低血容量或低血压,维持充足的循环血量,保证有效的心输出量和器官灌注,但应重视液体负荷过重对呼吸功能的不良影响(1B)。
13. 心血管功能的有创监测对于指导治疗十分关键,推荐:维持CVP 6~10 mmHg,同时收缩压>100 mmHg,平均动脉压(mean artery pressure,MAP)>60 mmHg,左心室射血分数>45%,混合静脉血氧饱和度60%~80%;对于血流动力学不稳定的脑死亡患者,应当测定心输出量;在循环稳定的状态下维持红细胞压积在20%以上,循环状态不稳定的情况下则尽量维持在30%以上(1C)。
14. 如果不准备进行心脏移植,则可以维持更高的MAP以增加其他器官的灌注(1C)。
15. 如果在充分的液体复苏治疗后低血压仍然持续存在,则需要加用正性肌力药物(1A)。
16. 脑死亡后心血管功能支持治疗可选择多巴胺、肾上腺素或去甲肾上腺素;但应用外源性儿茶酚胺将引起心肌ATP的迅速耗竭,从而对移植后的心脏功能产生不利影响(1B)。
17. 临床应用小剂量血管加压素除能治疗尿崩症外,还能改善动脉血压,降低机体对外源性儿茶酚胺的需求,有利于肾脏、肝脏和心脏功能的保护(1B)。
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)既能提供持续有效的灌注,保证供者组织器官的充分供血供氧,又能减少大量血管活性药物的应用,并在此过程中纠正内环境紊乱。在器官切除前没有热缺血损伤,减少了不可预测的心脏骤停,同时提供了充分的时间切除器官,为获得最佳质量供器官提供良好的条件。
推荐意见:
18. 当出现下列循环功能不稳定的DBD供者,可考虑应用ECMO进行器官功能保护(1C):
① 心脏骤停、心肺复苏史(心脏按压20 min以上);
② MAP:成人<60~70 mmHg;儿童<50~60 mmHg;婴幼儿<40~50 mmHg;
③ 心脏指数<2 L·min-1·m-2(>3 h);
④ 在血容量正常情况下使用大量血管活性药物:多巴胺>20 μg·kg-1·min-1;(去甲)肾上腺素>1 μg·kg-1·min-1(>3 h);
⑤ 尿量<0.5 mL·kg-1·h-1;
⑥ 血生化指标:急性肝肾功中、重度损害;
⑦ 其他:心电图ST-T改变明显;难以纠正的代谢性酸中毒(>3 h)。
19. 实施中国二类(DCD)和中国三类(DBCD)的器官捐献,供者撤除生命支持治疗及判定供者心脏死亡后、器官切取之前,利用ECMO进行胸腹腔脏器原位氧合血灌注2~4 h,偿还机体氧债,纠正内环境紊乱,有效减轻热缺血损伤,改善器官移植的效果(1C)。
20. 脑死亡供者心律失常往往继发于电解质失衡、低体温、心肌缺血或医源性因素等,治疗时应当首先纠正上述因素。如纠正上述因素后仍无效,应及时应用抗心律失常药物,心动过缓首选异丙肾上腺素,其他类型的心律失常首选胺碘酮(1B)。
5.4 呼吸功能支持治疗
呼吸功能支持治疗的目的在于提高移植器官的氧输送。脑死亡后,多种因素都可以导致肺损伤,包括既往肺损伤、误吸、“交感风暴”、肺水肿、呼吸机相关性肺炎、院内肺部感染以及严重的全身炎症反应,目前临床上只有22%的供者捐献肺脏可用于肺移植手术。因此,呼吸治疗措施在维持氧合的同时,强调肺保护的重要性。
推荐意见:
21. 对于准备行肺移植的供者,在维持氧合的同时,强调肺保护策略:尽可能应用较低的FiO2,6~8 mL/kg 潮气量,避免呼吸损伤,同时将PEEP控制在5~10 cmH2O,维持PaO2在75 mmHg以上,谨慎进行输液治疗,并监测CVP、肺动脉楔压,合理使用血管活性药物,控制呼吸道感染等(1B)。
5.5 神经内分泌紊乱的处理——激素治疗
脑死亡后因下丘脑-垂体-肾上腺轴阻断,垂体后叶储存和释放的激素(抗利尿激素、催产素),以及垂体前叶形成的生长激素、促甲状腺素和促肾上腺皮质激素持续减少甚至缺如。皮质醇和甲状腺素分泌减少可引起心肌细胞的新陈代谢障碍以及心肌收缩力下降,加重血流动力学紊乱,同时增加炎症级联反应。
推荐意见:
22. 建议应用标准的激素治疗:甲泼尼龙(15 mg/kg静脉推注),三碘甲状腺原氨酸(4 μg静脉推注后、3 μg/h持续输注),以及精氨酸血管加压素(1 U静脉推注后、0.5~4.0 U/h持续输注)(1B)。
5.6 抗炎和免疫调节
严重的颅脑损伤和颅内出血是导致脑死亡的最常见病因,往往从一开始就对机体造成严重影响,引起各种炎症介质过量释放和炎症细胞过量激活,可导致一种难以控制的全身瀑布式炎症反应,即全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),造成组织器官严重损伤。因此,阻断SIRS的发展十分重要,可预防和减轻器官功能受损。
推荐意见:
23. 使用清除自由基和减轻炎症反应的措施,包括乌司他丁、血必净、前列腺素E1、还原型谷胱甘肽或连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)等,是供者脏器功能保护的有效手段(1B)。
24. 甲泼尼龙通过其免疫抑制作用减少器官移植术后发生的缺血再灌注损伤和急性排斥反应,一经诊断为脑死亡直接应用甲泼尼龙(1B)。
5.7 纠正水电解质和酸碱失衡
脑死亡后易出现代谢性酸中毒,加重循环系统的不稳定,如发生低血压、严重心律失常(室性心律失常、室颤等),心肌收缩力进一步下降,血管活性药物的作用降低。此外,脑死亡后抗利尿激素减少甚至缺如,导致尿崩症,引起高钠血症。同时为了降低颅压而大剂量使用甘露醇、利尿剂和限制液体输入,以及高血糖反应(大量输入含糖液体、应用糖皮质激素和正性肌力药可加剧血糖升高、体温降低和胰腺微循环障碍等)引起渗透性利尿,造成循环血量减少。脑死亡早期由于血浆渗透压增高、代谢性酸中毒以及失水多于失钠等原因,极易造成高钠血症、低钙血症、低镁血症、低钾血症和低磷酸血症等电解质紊乱。脑死亡晚期由于肾功能受损,可导致高钾血症等电解质紊乱。因此,及时监测和纠正内环境并保持稳定十分重要。
推荐意见:
25. 如不进行机体内环境的纠正治疗,约20%的脑死亡患者在6 h之内,或50%的脑死亡患者在24 h之内可出现心脏骤停。因此,必须保持水电解质、酸碱平衡,纠正低蛋白血症(1B)。
26. 尿崩症导致大量液体和电解质丢失,根据尿量给予低张晶体液,同时及时监测电解质变化,相应调整补液中电解质的量;如出现高钠血症,采用等量生理盐水加5%葡萄糖液补偿尿量丧失量及每日生理需要量(1C)。
27. 尿量大于5.0 mL·kg-1·h-1,尿比重低于1 005 g/L时,应给予小剂量精氨酸血管加压素(0.5~0.6 U/h)使尿量减少,极严重的病例可间断应用1-去氨基-8-D-精氨酸加压素(1C)。
28. 根据血糖水平调整胰岛素用量,以维持血糖在许可范围(<10 mmol/L)(1C)。
29. 当出现以下严重的或内科方法难以纠正的内环境紊乱,可使用CRRT技术(1C):①血清钠>160 mmol/h;②血清钾>6 mmol/h;③严重的代谢性酸中毒,血碳酸氢根<10 mmol/h,补碱难以纠正;④少尿或无尿(<0.5 mL·kg-1·h-1),液体负荷过重;⑤急性肾损伤2期、3期。
5.8 纠正凝血功能障碍
脑死亡过程中,缺血或坏死的脑组织能够释放组织凝血活酶,与被破坏的内皮细胞共同激活凝血途径。单核-巨噬细胞产生大量细胞因子,特别是TNF-α可引起组织因子的表达增加,后者与凝血因子Ⅶ结合成复合体,激活凝血因子X,导致微血栓形成。凝血系统活性增加反过来激活纤溶系统,凝血-纤溶动态平衡被打破,触发DIC的发生,多达28%的脑死亡患者发生DIC。器官微血栓形成主要见于合并DIC的供者,其危险因素包括:①严重的脑外伤,尤其是开放性颅脑损伤,损伤的脑组织释放脂肪、磷脂和凝血酶等物质,进入血液循环可以激活内源性和外源性的凝血级联反应,导致纤维蛋白的形成;②死亡前大量输血;③脑死亡前的心肺复苏病史;④合并急性坏死性胰腺炎的供者。
推荐意见:
30. 如果供者没有活动性出血和抗凝溶栓的禁忌证,可常规使用肝素,对防治脑死亡后DIC的发生发展有重要作用(1B)。如血栓形成,可使用尿激酶(1C)。
5.9 体温调节
脑死亡后下丘脑丧失体温调节功能,可出现生理节律性体温波动消失以及变温性紊乱(中枢性高热或低体温),体温调节功能丧失未经治疗可影响器官功能。
推荐意见:
31. 可静脉输注经过加温或冰冷的液体,应用加温毯或持续冰毯降温,或保证吸入气体的加温、加湿,以维持体温正常(直肠温度>35 ℃)(1B)。
5.10 预防感染和抗感染
多种因素易导致脑死亡供者的局部和全身感染:外伤或创伤、气管插管机械通气、留置深静脉导管和尿管等因素;脑死亡后小肠可能发生的炎症反应、细胞凋亡和结构破坏等;抗生素使用导致的菌群失调或细菌移位。因此,必须重视供者的病原体感染,尤其是多重耐药细菌、真菌等特殊病原体。
推荐意见:
32. 对供者的各项治疗措施,均应严格遵循无菌原则,每日应常规对血、尿、痰等进行病原体的检测和培养,行胸部X线检查;器官获取后,常规对灌注液或保存液进行病原体的检测和培养(1B)。
33. 只有当供者的感染被彻底控制,才考虑使用供器官,应避免使用对器官有较强毒性的抗生素等药物(1B)。
34. 应避免使用对器官有较强毒性的抗生素等药物。抗感染贯穿于供器官维护、保存、运输、修整、术后(1B)。
5.11 器官切取术中的器官功能保护和管理
在无麻醉状况下,脑死亡供者在器官切取期间血流动力学呈双向改变,即切开皮肤后动脉血压升高,持续一段时间后下降,外周交感和副交感神经受到刺激后,仍可释放残存的儿茶酚胺,造成一过性的血压升高,这将损害供器官功能。将供者转运至手术室后,应对供器官功能进行评估并继续对器官功能进行维护和适当的麻醉管理,保证器官有效的氧合和灌注。
推荐意见:
35. 脑死亡供者器官切取期间应给予适当麻醉管理。除加强监测、及时纠正内环境紊乱、保证重要器官足够的血流灌注等措施外,还必须给予供者适当的镇痛和肌松等麻醉措施,消除器官切取期间有害的应激反应,以避免对可移植器官功能的进一步损害(1B)。
36. 器官获取时在术前备血,术中要注意血容量的变化,必要时可以成分输血,尤其是多器官联合分组获取时(1C)。
37. 器官获取前,可使用甲泼尼龙(30 mg/kg)和甘露醇(1.5 g/kg)以减轻缺血再灌注损伤(1C)。
38. 使用前列腺素可以减轻肾门被牵拉时的血管痉挛,对肝、肺获取亦有器官保护作用(1C)。
39. 在器官获取前静脉注射利多卡因2 mg/kg,可以减少移植后急性肾小管坏死发生率(1C)。
40. 在器官获取前给予肝素375~625 U/kg(3~5 mg/kg)以防止血栓形成(1B)。
6 小 结
详细了解器官捐献供者的病情并正确评估器官功能,同时尽早开始进行器官功能维护的重症医学治疗是器官移植成功的开始。以改善捐献器官的氧合和灌注为主要治疗目标,开展综合有效的器官保护重症治疗,可以:①提高潜在捐献者的数量;②提高捐献者的器官产出率;③修复和改善捐献器官的质量;④保证受者器官移植的安全;⑤降低器官移植术后并发症和移植器官功能恢复延迟和/或无功能的发生率。
7 利益声明
本指南的发布不存在与任何公司、机构或个人之间的利益冲突。
执笔:孙煦勇(解放军第三〇三医院移植医学研究院);秦科(解放军第三〇三医院移植医学研究院)
审稿专家(按姓氏拼音排列):敖建华(解放军总医院);蔡明(解放军第三〇九医院);陈江华(浙江大学附属第一医院);陈正(广州医科大学附属第二医院);傅耀文(吉林大学第一医院);韩文科(北京大学第一医院);黄赤兵(第三军医大学新桥医院);林涛(四川大学华西医院);彭龙开(中南大学湘雅二医院);秦科(解放军第三〇三医院);石炳毅(解放军第三〇九医院);孙煦勇(解放军第三〇三医院);王长希(中山大学附属第一医院);薛武军(西安交通大学第一附属医院);张伟杰(华中科技大学同济医学院附属同济医院);张小东(首都医科大学附属北京朝阳医院);赵明(南方医科大学珠江医院);周江桥(武汉大学人民医院);朱同玉(复旦大学附属中山医院);朱有华(上海长征医院)
1 中华医学会器官移植分会. 中国心脏死亡器官捐献工作指南(第2版)[J]. 中华器官移植杂志, 2011, 32(12):756-758.
2 国家卫生和计划生育委员会脑损伤质控评价中心. 脑死亡判定标准与技术规范(成人质控版)[J/CD]. 中华移植杂志:电子版, 2015,9(1):13-17.
3 国家卫生和计划生育委员会脑损伤质控评价中心. 脑死亡判定标准与技术规范(儿童质控版)[J/CD]. 中华移植杂志:电子版, 2015, 9(2):54-57.
4 文宁, 张素斌, 秦科, 等. 早期目标液体复苏对脑死亡血流动力学及氧代谢的影响[J]. 广西医科大学学报, 2011, 28(5): 664-668.
5 秦科, 孙煦勇. 体外膜肺氧合在心死亡或脑死亡捐献器官保护中的应用的进展[J]. 中华器官移植杂志, 2012, 33(11):702-704.
6 孙煦勇, 秦科, 董建辉, 等. 体外膜肺氧合对循环功能不稳定中国一类捐献器官功能的保护三例[J]. 中华器官移植杂志, 2012, 33(11):657-660.
7 霍枫, 李鹏, 汪邵平. 体外膜肺氧合在心脏死亡器官捐献中的应用[J]. 中华消化外科杂志, 2013, 12(9):648-651.
8 蓝倩, 李壮江, 孙煦勇, 等. 体外膜肺氧合应用在捐献器官移植中的伦理学意义[J]. 中国医学伦理学, 2015, 28(5):741-744.
9 Mascia L, Mastromauro I, Viberti S, et al. Management to optimize organ procurement in brain dead donors[J]. Minerva Anestesia, 2009, 75(3):125-133.
10 Guidelines relating to solid organ transplants from non-heart beating donors[DB/OL]. British Transplantation Society, 2004(2012)[2013-7-1]. http//ukpmc.ac.uk/guidelines/HIR/142956.
11 Council of Europe, European Directorate for the Quality of Medicine and HealthCare. Council of Europe:Guide to the quality and safety of organs for transplantation(5th edition)[M]. Strasbourg, France, 2013.
12 Organ donation and transplantation activities 2011. Global Observatory on Donation and Transplantation[DB/OL]. 2011[2013-4-1]. http//www.transplant-observatory.org/Pages/DataRepOrts.
13 Matesanz R, Dominguez-Gil B, Coil E, et al. Spanish experience as a leading country: what kind of measures were taken?[J]. Transplant Int, 2011, 24(4):333-343.
14 Barber K, Falvey S, Hamilton C, et al. Potential for organ donation in the United Kingdom: audit of intensive care records[J]. Br Med J, 2006, 332(7550):1124-1127.
15 Sheehy E, O′Connor KJ, Luskina RS, et al. Investigating geographic variation in mortality in the context of organ donation[J]. Am J Transplant, 2012, 12(6):1598-1602.
16 Dominguez-Gil, Delmonico F, Shaheen FAM, et al. The critical pathway for deceased donation: reportable uniformity in the approach to deceased donation[J]. Transpl Int, 2011, 24(4):373-378.
17 De la Rosa G, Dominguez-Gil B, Matesanz R, et al. Continuous evaluating performance in deceased donation:The Spanish Quality Assurance Program[J]. Am J Transplant, 2012, 12(9):2507-2513.
18 Procaccio F, Rizzato L, Ricci A, et al. Indicators of efficiency in potential organ donation and identification: preliminary results from the national registry of deaths with acute cerebral lessions in Italian intensive care units[J]. Organ, Tissues and Cells, 2008, 2:125-129.
19 Sheehy E, Conrad SL, Brigham LE, et al. Estimating the number of potential organ donors in the United States[J]. N Engl J Med, 2003, 349(21):667-674.
20 Manara AR, Murphy PG, O′Callaghan G. Donation after circulatory death[J]. J Anaesth, 2012, 108(Suppl 1):i108-i121.
21 Reich DJ, Mulligan DC, Abt PL, et al. ASTS recommended practice guidelines for controlled donation after cardiac death organ procurement and transplantation[J]. Am J Transplant, 2009, 9(9):2004-2011.
22 Buell JF, Trofe J, Sethuraman G, et al. Donors with central nervous system malignancies: are they truly safe?[J]. Transplantation, 2003, 76(2):340-343.
23 Merion RM, Ashby VB, Wolfe RA, et al. Deceased-donor characteristics and the survival benefit of kidney transplantation[J]. JAMA, 2005, 294(21):2726-2733.
24 Olson L, Cravero L. Donor factors that affect the number of organs transplanted per donor[J]. Prog Transplant, 2009, 19(3):259-266.
25 Halpern SD, Shaked A, Hasz RD, et al. Informing candidates for solid-organ transplantation about donor risk factors[J]. N Engl J Med, 2008, 358(26):2832-2837.
26 Watson CJ, Johnson RJ, Birch R, et al. A simplified donor risk index for predicting outcome after deceased donor kidney transplantation[J]. Transplantation, 2012,93(3):314-318.
27 Singh RP, Farney AC, Rogers J, et al. Hypertension in standard criteria deceased donors is associated with inferior outcomes following kidney transplantation[J]. Clin Transplant, 2011, 25(4):E437- E446.
28 Holmes B, Diamond M. Amyotrophic lateral sclerosis and organ donation: is there risk of disease transmission[J]. Ann Neurology, 2012, 72(6):832-836.
29 Kauffman HM, McBride MA, Delmonico FL. First report of the United Network for Organ Sharing Transplant Tumor Registry: donors with a history of cancer[J]. Transplantation, 2000, 70(12):1747-1751.
30 Desai R, Collett D,Watson CJ, et al. Cancer transmission from organ donors: unavoidable but low risk[J]. Transplantation, 2012, 94(12):1200-1207.
31 Watson CJE, Roberts R, Wright KA, et al. How safe is it to transplant organs from deceased donors with primary intracranial malignancy? An analysis of UK Registry data[J]. Am J Transplant, 2010, 10(6):1437-1444.
32 Mukhopadhyay P, Kumar V, Rathi M, et al. Transmission of human immunodeficiency virus infection by renal transplantation[J]. Indian J Nephrol, 2012, 22(2):133-135.
33 Chiarelli AG. Donor and organ suitability: risk due to donor social behavior[J]. Transplant Proc, 2004, 36(3):426-427.
34 McKeown DW, Bonser RS, Kellum JA. Management of the heartbeating brain-dead organ donor[J]. Br J Anaesth, 2012, 108 (Suppl 1):i96-i107.
35 Casartelli M, Bombardini T, Simion D, et al. Wait, treat and see: echocardiographic monitoring of brain-dead potential donors with stunned heart[J]. Cardiovasc Ultrasound, 2012, 10(1):1-8.
36 Ballarin R, Cucchetti A, Spaggiari M, et al. Long-term follow-up and outcome of liver transplantation from anti-hepatitis C virus-positive donors: a European multicentric case-control study[J]. Transplantation, 2011, 91(11):1265-1272.
37 Seem DL, Lee I, Umscheid CA, et al. Excerpt from PHS guideline for reducing HIV, HBV and HCV transmission through organ transplantation[J]. Am J Transplant, 2013, 13(8):1953-1962.
38 Rabinstein AA, Yee AH, Mangrekar J, et al. Prediction of potential for organ donation after cardiac death in patients in neurocritical state: a prospective observational study[J]. Lancet Neurol, 2012, 11(5):414-419.
39 Power BM,Van Heerden PV. The physiological changes associated with brain death-current concepts and implications for treatment of the brain dead organ donor[J]. Anaesth Intensive Care, 1995, 23(1):26-36.
40 Valero R. Donor management: one step forward[J]. Am J Transplant, 2002, 2(8):693-694.
41 Mascia L, Mastromauro I, Viberti S, et al. Management to optimize organ procurement in brain dead donors[J]. Minerva Anestesia, 2009, 75(3):125-133.
42 Venkateswaran RV, Patchell VB, Wilson IC, et al. Early donor management increases the retrieval rate of lungs for transplantation[J]. Ann Thorac Surg, 2008, 85(1):278-286.
43 Cantin B, Kwok BW, Chan MC, et al. The impact of brain death on survival after heart transplantation: time is of the essence[J]. Transplantation, 2003, 76(9):1275-1279.
44 Odim J, Laks H, Banedi A, et al. Does duration of donor brain injury affect outcome after orthotopic pediatric heart transplantation?[J]. J Thorac Cardiovasc Surg, 2005, 130(1):187-193.
45 Abdelnour T, Rieke S. Relationship of hormonal resuscitation therapy and central venous pressure on increasing organs for transplant[J]. J Heart Lung Transplant, 2009, 28(5): 480-485.
46 Avlonitis VS, Wigfield CH, Golledge HD, et al. Early hemodynamic injury during donor brain death determines the severity of primary graft dysfunction after lung transplantation[J]. Am J Transplant, 2007, 7(1):83-90.
47 Wheeldon DR, Potter CD, Oduro A, et al. Transforming the “unacceptable” donor:Outcomes from the adoption of a standardized donor management technique[J]. J Heart Lung Transplant, 1995, 14(4):734-742.
48 Salim A, Martin M, Brown C, et al. The effect of a protocol of aggressive donor management: Implications for the national organ donor shortage[J]. J Trauma, 2006, 61(2):429-433.
49 Shemie SD, Doig C, Dickens B, et al. Severe brain injury to neurological determination of death: Canadian forum recommendations[J]. CMAJ, 2006, 174(6):S1-S13.
50 Rosendale JD, Chabalewski FL, McBride MA, et al. Increased transplanted organs from the use of a standardized donor management protocol[J]. Am J Transplant, 2002, 2(8):761-768.
51 Jenkins DH, Reilly PM, Schwab CW. Improving the approach to organ donation: a review[J]. World J Surg, 1999, 23(7):644-649.
52 Lopez-Navidad A, Domingo P, Caballero F. Organ shortage: viability of potential organ donors and possible loss depend on health care workers who are responsible for the organ procurement program[J]. Transplant Proc, 1997, 29(8):3614-3616.
53 Singbartl K, Murugan R, Kaynar AM, et al. Intensivist-led management of brain-dead donors is associated with an increase in organ recovery for transplantation[J]. Am J Transplant, 2011, 11(7):1517-1521.
54 Wood RE. Donor management, multi organ procurement and renal preservation[J]. J R Soc Med, 1996, 89(Suppl 29):23-24.
55 Avlonitis VS, Wigfield CH, Kirby JA, et al. The hemodynamic mechanisms of lung injury and systemic inflammatory response following brain death in the transplant donor[J]. Am J Transplant, 2005, 5(4 Pt 1):684-693.
56 Wood KE, Becker BN, McCartney JG, et al. Care of the potential organ donor[J]. N Engl J Med, 2004, 351(26):2730-2739.
57 Salim A, Martin M, Brown C, et al. Complications of brain death: frequency and impact on organ retrieval[J]. Am Surg, 2006, 72(5):377-381.
58 Boom H, Mallat MJ, de Fijter JW, et al. Calcium levels as a risk factor for delayed graft function[J]. Transplantation, 2004, 77(6):868-873.
59 Cywinski JB, Mascha E, Miller C, et al. Association between donor-recipient serum sodium differences and orthotopic liver transplant graft function[J]. Liver Transpl, 2008, 14(1):59-65.
60 Zaroff JG, Rosengard BR, Armstrong WF, et al. Consensus conference report: maximizing use of organs recovered from the cadaver donor: cardiac recommendations: March 28-29, 2001, Crystal City, Va[J]. Circulation, 2002, 106(7):836-841.
61 Schnuelle P, Lorenz D, Mueller A, et al. Donor catecholamine use reduces acute allograft rejection and improves graft survival after cadaveric renal transplantation[J]. Kidney Int, 1999, 56(2):738-746.
62 Schnuelle P, Berger S, de BJ, et al. Effects of catecholamine application to brain-dead donors on graft survival in solid organ transplantation[J]. Transplantation, 2001, 72(3):455-463.
63 Schnuelle P, Berger S, de BJ, et al. Donor employment of vasopressors and its impact on allograft survival after transplantation[J]. Transplant Proc, 2001, 33(1-2):1282-1283.
64 Schnuelle P, Yard BA, Braun C, et al. Impact of donor dopamine on immediate graft function after kidney transplantation[J]. Am J Transplant, 2004, 4(3):419-426.
65 Schnuelle P, Gottmann U, Hoeger S, et al. Effects of donor pretreatment with dopamine on graft function after kidney transplantation: a randomized controlled trial[J]. JAMA, 2009, 302(10):1067-1075.
66 Stoica SC, Satchithananda DK, White PA, et al. Noradrenalin use in the human donor and relationship with load-independent right ventricular contractility[J]. Transplantation, 2004, 78(8):1193-1197.
67 Kutsogiannis DJ, Pagliarello G, Doig C, et al. Medical management to optimize donor organ potential: review of the literature[J]. Can J Anaesth, 2006, 53(8):820-830.
68 Pennefather SH, Bullock RE, Mantle D, et al. Use of low dose arginine vasopressin to support brain-dead organ donors[J]. Transplantation, 1995, 59(1):58-62.
69 de PM, Weder W, Patterson GA, et al. Strategies to increase limited donor resources[J]. Eur Respir J, 2004, 23(3):477-482.
70 Venkateswaran RV, Steeds RP, Quinn DW, et al. The haemodynamic effects of adjunctive hormone therapy in potential heart donors: a prospective randomized double-blind factorially designed controlled trial[J]. Eur Heart J, 2009, 30(14):1771-1780.
71 McLean KM, Pandalai PK, Pearl JM, et al. Beta-adrenergic receptor antagonism preserves myocardiaI function after brain death in a porcine model[J]. J Heart Lung Transplant, 2007, 26(5):522-528.
72 Audibert G, Charpentier C, Seguin-Devaux C, et al. Improvement of donor myocardial function after treatment of autonomic storm during brain death[J]. Transplantation, 2006, 82(8):1031-1036.
73 Powner DJ, Crommett JW. Advanced assessment of hemodynamic parameters during donor care[J]. Prog Transplant, 2003, 13(4):249-257.
74 Gu J, Tao G, Yi B, et al. Hemodynamic monitoring in pigs undergoing orthotopic abdominaI multivisceral transplantation[J]. Transplant Proc, 2009, 41(10):4376-4381.
75 Dominguez-Roldan JM, Jimenez-Gonzalez PI, Garcia-Alfaro C, et al. Electrolytic disorders, hyperosmolar states, and lactic acidosis in braindead patients[J]. Transplant Proc, 2005, 37(5):1987-1989.
76 Powner DJ, Allison TA. Cardiac dysrhythmias during donor care[J]. Prog Transplant, 2006, 16(1):74-80.
77 Garcia-Fages LC, Cabrer C, Valero R, et al. Hemodynamic and metabolic effects of substitutive triiodothyronine therapy in organ donors[J]. Transplant Proc, 1993, 25(6):3038-3039.
78 Novitzky D, Cooper DK, Human PA, et al. Triiodothyronine therapy for heart donor and recipient[J]. J Heart Transplant, 1988, 7(5):370-376.
79 Novitzky D, Cooper DK, Chaffin JS, et al. Improved cardiac allograft function following triiodothyronine therapy to both donor and recipient[J]. Transplantation, 1990, 49(2):311-316.
80 Novitzky D, Matthews N, Shawley D, et al. Triiodothyronine in the recovery of stunned myocardium in dogs[J]. Ann Thorac Surg, 1991, 51(1):10-16.
81 Rosendale JD, Kauffman HM, McBride MA, et al. Aggressive pharmacologic donor management results in more transplanted organs[J]. Transplantaton, 2003, 75(4):482-487.
82 Salim A, Martin M, Brown C, et al. Using thyroid hormone in brain-dead donors to maximize the number of organs available for transplantation[J]. Clin Transplant, 2007, 21(3):405-409.
83 Mckeown WD, Bonser SR, Kellum AJ. Management of the heartbeating brain-dead organ donor[J]. BJA, 2012, 108 (S1):i96-i107.
84 Dimopoulou I, Tsagarakis S, Anthi A, et al. High prevalence of decreased cortisol reserve in brain-dead potential organ donors[J]. Crit Care Med, 2003, 31(4):1113-1117.
85 Blasi-Ibanez A, Hirose R, Feiner J, et al. Predictors associated with terminal renal function in deceased organ donors in the intensive care unit[J]. Anesthesiology, 2009, 110(2):333-341.
86 Obermaier R, von DE, Keck T, et al. Brain death impairs pancreatic microcirculation[J]. Am J Transplant, 2004, 4(2):210-215.
87 Mascia L, Bosma K, Pasero D, et al. Ventilatory and hemodynamic management of potential organ donors: an observational survey[J]. Crit Care Med, 2006, 34(2):321-327.
88 Avlonitis VS, Fisher AJ, Kirby JA, et al. Pulmonary transplantation: the role of brain death in donor lung injury[J]. Transplantation, 2003, 75(12):1928-1933.
89 Powner DJ, Darby JM, Stuart SA. Recommendations for mechanical ventilation during donor care[J]. Prog Transplant, 2000, 10(1):33-38.
90 Follette DM, Rudich SM, Babcock WD. Improved oxygenation and increased lung donor recovery with high-dose steroid administration after brain death[J]. J Heart Lung Transplant, 1998, 17(4):423-429.
91 Gabbay E, Williams TJ, Griffiths AP, et al. Maximizing the utilization of donor organs offered for lung transplantation[J]. Am J Respir Crit Care Med, 1999, 160(1):265-271.
92 Riou B, Guesde R, Jacquens Y, et al. Fiberoptic bronchoscopy in brain-dead organ donors[J]. Am J Respir Crit Care Med, 1994, 150(2):558-560.
93 Mascia L, Pasero D, Slutsky AS, et al. Effect of a lung protective strategy for organ donors on eligibility and availability of lungs for transplantation: a randomized controlled trial[J]. JAMA, 2010, 304(23):2620-2627.
94 Levesque S, Lessard MR, Nicole PC, et al. Efficacy of a T-piece system and a continuous positive airway pressure system for apnea testing in the diagnosis of brain death[J]. Crit Care Med, 2006, 34(8):2213-2216.
95 Powner DJ, Reich HS. Regulation of coagulation abnormalities and temperature in organ donors[J]. Prog Transplant, 2000, 10(3):146-151; quiz 152-153.
96 Kutsogiannis DJ, Pagliarello G, Doig C, et al. Medical management to optimize donor organ potential: review of the literature[J]. Can J Anesth, 2006, 53(8):820-830.
97 Grino JM, Miravitlles R, Castelao AM, et al. Flush solution with mannitol in the prevention of post-transplant renal failure[J]. Transplant Proc, 1987, 19(5):4140-4142.
98 Haririan A, Metireddy M, Cangro C, et al. Association of serum uric acid with graft survival after kidney transplantation: a time-varying analysis[J]. Am J Transplant, 2011, 11(9):1943-1950.
99 Khan TA, Schnickel G, Ross D, et al. A prospective,randomized,crossover pilot study of inhaled nitric oxide versus inhaled prostacyclin in heart transplant and lung transplant recipients[J]. J Thorac Cardiovasc Surg, 2009, 138(6):1417-1424.
100 Singer P, Cohen J, Cynober L. Effect of nutritional state of brain-dead organ donor on transplantation[J]. Nutrition, 2001, 17(11-12):948-952.
101 Barklin A. Systemic inflammation in the brain-dead organ donor[J]. Acta Anaesthesiol Scand, 2009, 53(4):425-435.
102 Nijboer WN, Schuurs TA, van der Hoeven JA, et al. Effects of brain death on stress and inflammatory response in the human donor kidney[J]. Transplant Proc, 2005, 37(1):367-369.
103 Lopau K, Mark J, Schramm L, et al. Hormonal changes in brain death and immune activation in the donor[J]. Transp Int, 2000, 13(Suppl 1):S282-S285.
104 Kuecuek O, Mantouvalou L, Klemz R, et al. Significant reduction of proinflammatory cytokines by treatment of the brain-dead donor[J]. Transplant Proc, 2005, 37(1):387-388.
105 Kotsch K, Ulrich F, Reutzel-Selke A, et al. Methylprednisolone therapy in deceased donors reduces inflammation in the donor liver and improves outcome after liver transplantation: a prospective randomized controlled trial[J]. Ann Surg, 2008, 248(6):1042-1050.
106 Venkateswaran RV, Dronavalli V, Lambert PA, et al. The proinflammatory environment in potential heart and lung donors: prevalence and impact of donor management and hormonal therapy[J]. Transplantation, 2009, 88(4):582-588.
107 Gelb AW, Robertson KM. Anaesthetic management of the brain dead for organ donation[J]. Can J Anaesth, 1990, 37(7):806-812.
108 Walaszewski J, Rowinski W, Chmura A, et al. Decreased incidence of acute tubular necrosis after cadaveric donor transplantation due to lidocaine donor pretreatment and low-dose dopamine infusion in the recipient[J]. Transplant Proc, 1988, 20(5):913.
109 Zych B, Popov AF, Stavri G, et al. Early outcomes of bilateral sequential single lung transplantation afterex-vivolung evaluation and reconditioning[J]. J Heart Lung Transplant, 2012, 31(3):274-281.
110 Vekemans K, van Pelt J, Komuta M, et al. Attempt to rescue discarded human liver grafts by end ischemic hypothermic oxygenated machine perfusion[J]. Transplant Proc, 2011, 43(9):3455-3459.
111 Youn TS, Greer DM. Brain death and management of a potential organ donor in the intensive care unit[J]. Critical care clinics, 2014, 30(4):813-831.
112 Lansdale M, Gropper MA. Management of the potential organ donor in the ICU[J]. ICU Director, 2012, 3(4):185-188.
(本文编辑:杨扬 鲍夏茜)
中华医学会器官移植学分会, 中国医师协会器官移植医师分会. `供肾体外低温机械灌注保存专家共识(2016版)[J/CD]. 中华移植杂志:电子版, 2016,10(4):154-158.
10.3877/cma.j.issn.1674-3903.2016.04.001
孙煦勇,530021 南宁,解放军第三〇三医院移植医学研究院(Email: sxywn@sohu.com);石炳毅,100091 北京,解放军第三〇九医院器官移植研究所(Email: shibingyi@medmail.com.cn)
2016-06-17)
