樟芝菌液态发酵合成安卓奎诺尔的条件优化
2016-05-23胡永丹路瑞秋张薄博许赣荣廖祥儒江南大学工业与生物技术教育部重点实验室江苏无锡214122江南大学生物工程学院江苏无锡214122
胡永丹, 路瑞秋, 张薄博, 许赣荣, 廖祥儒*(1.江南大学工业与生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
樟芝菌液态发酵合成安卓奎诺尔的条件优化
胡永丹1,2,路瑞秋1,2,张薄博1,2,许赣荣1,2,廖祥儒*1,2
(1.江南大学工业与生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
摘要:安卓奎诺尔(Antroquinonol)是药食两用真菌樟芝子实体中的特征代谢产物之一,具有显著的生理活性。然而,在普通液态发酵条件下,樟芝菌丝体无法合成Antroquinonol,作者在添加前体物质和效应物促进樟芝液态发酵合成Antroquinonol的基础上,对其培养基以及发酵条件进行研究。结果表明,在复合添加大豆油和辅酶Q0的基础上,利用单因素实验分别对樟芝菌液态发酵培养基的碳氮源的种类和发酵条件进行了优化,最终确定发酵培养基的最佳碳源为米粉50 g/L,氮源为大豆粉6 g/L和玉米浆粉8 g/L。最适的发酵条件为初始pH 6,接种量为体积分数10%,发酵温度25℃,摇床转速150 r/min,在此条件下Antroquinonol的产量可以达到170.34 mg/L。
关键词:樟芝;安卓奎诺尔(Antroquinonol);培养基;发酵条件
樟芝(Antrodia camphorata,Antrodia cinnamomea)俗称牛樟芝、牛樟菇等,是台湾特有的一类十分稀有的药食两用真菌[1-3]。樟芝在很久以前就被台湾土著居民用作治疗疾病的良药,素有“森林红宝石”之称[4-6]。近年来,许多研究表明樟芝具有抗氧化、抗炎症、抗肿瘤、保护肝脏、免疫调节和降血糖等多种功效[7-12]。
樟芝对生长环境要求苛刻,仅能寄生于台湾特有树种-牛樟树(Cinnamomum kanehirai)的腐朽内壁上,且生长极其缓慢,因此利用现代生物技术进行樟芝人工培养已经成为解决樟芝供需矛盾的有效方式。目前樟芝常用的3种人工培养方式为:椴木栽培法、固态发酵法和液态发酵法,其中液态发酵法可以在短时间内获得大量的菌丝体,生产效率高,产量稳定,是一种经济环保的生产方式[13]。然而樟芝液态发酵存在的主要问题是得到的菌丝体活性成分较少,因此如何通过对樟芝液态发酵过程进行优化和代谢调控,缩小其在成分和功效上与野生樟芝子实体之间的差异具有重要的研究意义。
安卓奎诺尔(Antroquinonol)是2007年Lee等从樟芝固态发酵菌丝体中萃取并鉴定的一个新的化合物,也是樟芝子实体的特征代谢产物之一[14]。实验表明,Antroquinonol具有抗癌、抗氧化应激和抗炎等活性[15-17]。目前与樟芝Antroquinonol相关的研究基本上集中在其药理活性及其药理机制方面,对于其生物合成方面的研究较少。固态发酵方面,喻学淳等对樟芝合成Antroquinonol的条件进行了优化[18]。而液态发酵方面,实验表明,在普通的液态发酵条件下,樟芝菌丝体无法合成Antroquinonol。作者分别通过添加前体物质和效应物,促进樟芝液态发酵合成Antroquinonol[19-20],然而其产量还较低。在复合添加前体物质和效应物的基础上对樟芝液态发酵合成Antroquinonol的培养基和发酵条件进行研究,以进一步提高液态发酵合成Antroquinonol的产量。
1 材料与方法
1.1材料
1.1.1菌种樟芝菌(Antrodia camphorata):上海福茂食用菌有限公司提供。
1.1.2试剂葡萄糖、蔗糖、麦芽糖、马铃薯淀粉、玉米淀粉、可溶性淀粉、酵母膏、牛肉膏、蛋白胨、尿素、(NH4)2SO4、MgSO4、K2HPO4、柠檬酸、辅酶Q0、对羟基苯甲酸均为国产分析纯试剂;乙腈(色谱纯)、甲醇(色谱纯):德国Meker公司产品;黄豆、玉米浆粉、米粉、大豆油市售;樟树萃取物实验室制备[20]。
1.1.3仪器与设备HYG-A全温摇瓶柜:太仓市强乐实验设备有限公司产品;SHZ-D循环水式真空泵:巩义市予华仪器有限责任公司产品;高效液相色谱仪:Waters公司产品;Agilent ZORBAX Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm):美国赛分科技有限公司产品。
1.2实验方法
1.2.1培养基与培养条件樟芝(A. camphorata)接种于PDA斜面,28℃避光培养9 d,4℃保藏。
孢子悬浮液制备:取PDA斜面,利用无菌水洗下斜面表层的孢子,并用玻璃珠打散后镜检,使孢子数达到1×106个/mL。
种子培养基:葡萄糖20 g/L、黄豆粉2 g/L、玉米浆粉16 g/L、MgSO40.5 g/L、K2HPO40.5 g/L、柠檬酸0.5 g/L,pH自然。28℃、130 rpm培养4 d。
液态发酵基础培养基:葡萄糖70 g/L、黄豆粉6 g/L、玉米浆粉8 g/L、MgSO40.5 g/L、K2HPO40.5 g/L,pH自然。接种量为体积分数15%,28℃、130 r/min培养15 d。
所有培养基均在121℃灭菌20 min。
1.2.2 Antroquinonol和生物量的测定
1)Antroquinonol含量的测定采用HPLC法测定。对于单一相液态发酵,取樟芝发酵液100 mL,抽滤得到菌体,加入少量体积分数95%的乙醇研磨5 min后定容至100 mL,50℃震荡萃取1 h,静置后0.22 μm滤膜过滤,进行HPLC分析[19]。对于双液相液态发酵,先将油相与水相完全分离后进行处理。水相处理方式与单一相液态发酵相同。对于油相,取1 mL的油相与10倍体积的体积分数95%乙醇混合均匀后静置萃取,待两相完全分离后取上层乙醇相微滤进行HPLC分析[20]。
Antroquinonol的参标经提取纯化之后制备得到[20],经过UV、HPLC-MS、NMR分析,其纯度≥92%。
2)Antroquinonol参标的制作精确称取Antroquinonol 25 mg,乙腈溶解配制成1 mg/mL母液,再分别稀释定容至5、10、20、40、60、80、100 mg/ L。微滤后进行HPLC分析,Antroquinonol的参考标准曲线如图1所示。

图1 Antroquinonol标准曲线Fig. 1 Standard curve of Antroquinonol
3)菌体生物量的测定将发酵液抽滤后,收集菌体,50℃烘干至恒重后称重。
1.3实验设计
1.3.1复合添加对樟芝菌液态发酵合成Antroquinonol的影响在单独添加前体物质和效应物的基础上[19-20],考虑选择效果较好的前体物质和效应物进行复合添加效果的研究。分别选择辅酶Q0、对羟基苯甲酸、豆油和樟树萃取液在樟芝液态发酵过程中进行复合添加,考察不同的添加组合与单独添加对Antroquinonol合成的影响。
1.3.2樟芝菌液态发酵合成Antroquinonol的培养基的优化
1)碳源的优化在樟芝液态发酵基础培养基的前提下,考虑不同碳源对樟芝液态发酵合成Antroquinonol的影响。分别在培养基中加入70 g/L的葡萄糖、蔗糖、麦芽糖、马铃薯淀粉、玉米淀粉、可溶性淀粉和米粉作为碳源,进行樟芝液态发酵合成Antroquinonol的最佳碳源种类的筛选,并在此基础上进一步优化碳源的添加量。其中对于马铃薯淀粉、玉米淀粉、可溶性淀粉和米粉,需要糊化和水解后,再进行培养基的配制。
2)氮源的优化同样的在樟芝基础发酵培养基和碳源优化的前提下,对于氮源对樟芝液态发酵合成Antroquinonol的影响进行探究。分别在培养基中加入14 g/L的大豆粉、玉米浆粉、酵母膏、牛肉膏、蛋白胨、硫酸铵和尿素作为氮源,考察樟芝液态发酵合成Antroquinonol最佳氮源。
1.3.3发酵条件的优化在对培养基的碳氮源进行优化的基础上,进一步对樟芝液态发酵的条件进行优化。分别选择合适的初始pH(pH 2~8)、接种量(5%~25%)、发酵温度(22~31℃)和摇床转速(100~250 rpm)进行实验,确定出樟芝液态发酵合成Antroquinonol的最佳条件。
2 结果与讨论
2.1复合添加对樟芝菌液态发酵合成Antroquinonol的影响
实验室前期的研究表明,在基础液态发酵体系中,樟芝菌丝体无法合成Antroquinonol。但在液态发酵体系中分别加入相应的前体物质或者效应物后,可以促使Antroquinonol的合成[19-20]。为了进一步的提高樟芝液态发酵菌丝体合成Antroquinonol的能力,本实验考虑复合添加前体物和效应物,通过两种物质的协同作用,达到进一步提高Antroquinonol产量的目的。
如表1所示,分别对前期研究中效果较好的前体物质辅酶Q0、对羟基苯甲酸和效应物大豆油、樟树萃取液进行单独添加以及两两复合添加的效果进行考察。结果表明,辅酶Q0和豆油进行复合添加时效果最好。这可能与辅酶Q0与豆油对樟芝菌丝体合成Antroquinonol的促进机制不同有关,辅酶Q0作为樟芝液态发酵过程中Antroquinonol合成的前体物质在代谢过程中促进Antroquinonol的合成,而豆油在樟芝菌丝体的生长,细胞的通透性,氧气的供给以及Antroquinonol的萃取等方面均有一定的促进作用,两者的复合添加能够对于Antroquinonol的合成起到协同促进的作用。
2.2樟芝菌液态发酵合成Antroquinonol的培养基优化
2.2.1碳源种类对樟芝菌液态发酵合成Antroquinonol的影响碳源是微生物生长过程中重要的碳水化合物,提供菌体细胞核产物的碳架和菌体生命活动所需要的能量。许多真菌菌丝体能够利用多种碳源进行生长,因此选择了7种常用的碳源,考察不同碳源对樟芝液态发酵合成Antroquinonol的影响,如图2所示。
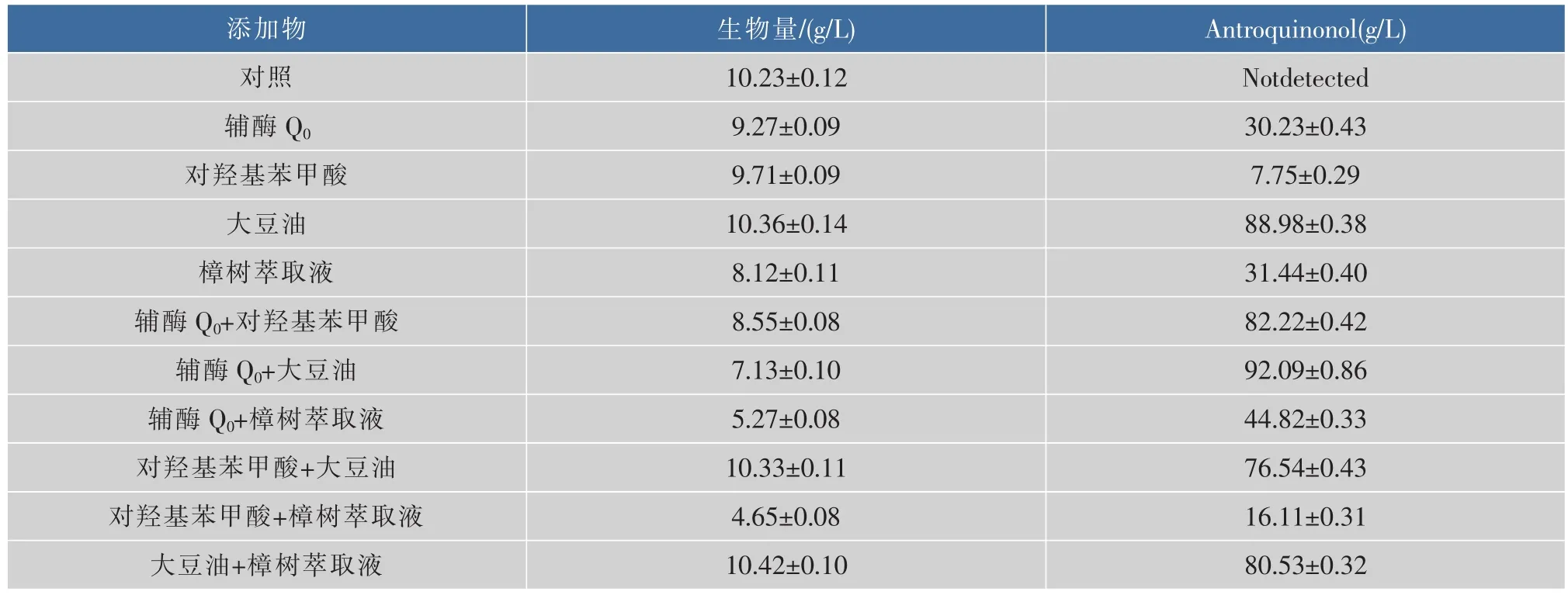
表1 复合添加对樟芝菌液态发酵生物量和Antroquinonol产量的影响Table 1 Effect of multiple addtitives on the biomass and production of Antroquinonol in submerged fermentation of Antrodia camphorata

图2 不同碳源对樟芝液态发酵生物量和Antroquinonol产量的影响Fig. 2 Effect of various carbon sources on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
碳源的种类对樟芝液态发酵Antroquinonol的产量和菌体量有明显的影响。当以米粉为碳源时,Antroquinonol的产量最高,其次为葡萄糖,玉米淀粉。其中淀粉和米粉的水解液的对樟芝的菌丝体的生长均有一定的促进作用,比葡萄糖等单糖为碳源更有利于菌丝体的生长,且Antroquinonol的产量也普遍偏高。这可能是由于淀粉和米粉在配制培养基时已经被水解成各种寡糖的混合物,碳源种类更丰富。而与淀粉相比较,米粉除了碳水化合物外还含有多种蛋白质、脂质、无机盐、氨基酸以及一些微量元素等,更能促进樟芝液态发酵Antroquinonol的合成和菌丝体的生长,是樟芝液态发酵的最佳碳源。
2.2.2米粉添加量对樟芝菌液态发酵合成Antroquinonol的影响在确定米粉为最佳碳源的基础上,进一步的对培养基中米粉的含量进行优化,分别选择30、40、50、60、70和80 g/L 6个水平进行实验。结果如图3所示。
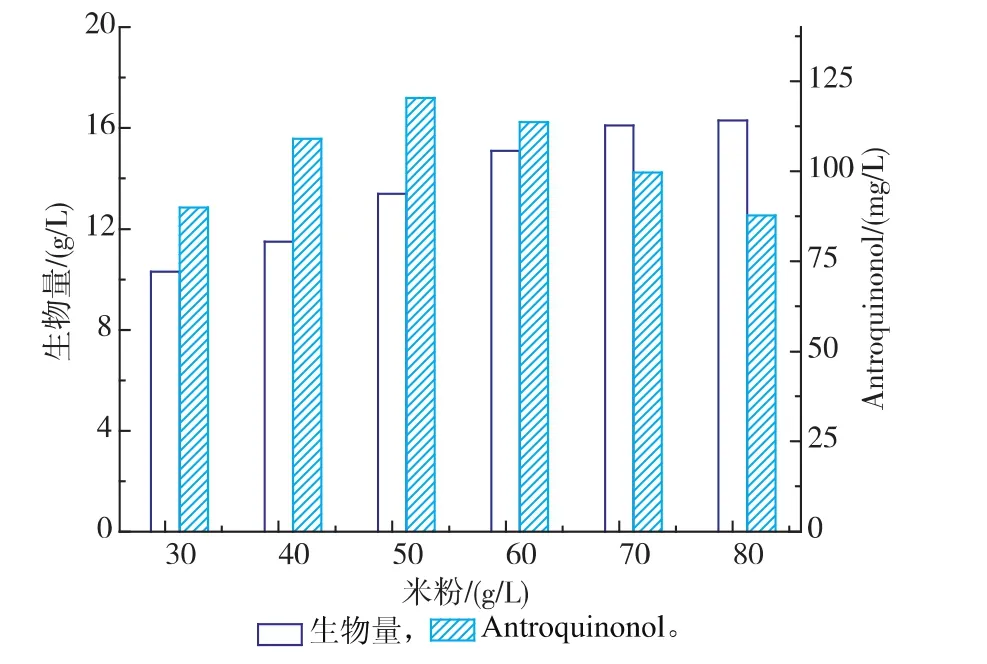
图3 不同质量浓度的米粉对樟芝液态发酵生物量和Antroquinonol产量的影响Fig. 3 Effect of different concentrations of rice flour on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
可以看出当米粉的质量浓度为50 g/L时,Antroquinonol的产量最高,随着米粉质量浓度的增加,菌体量逐渐增大,但是Antroquinonol的产量却有所降低,这可能是由于当米粉质量浓度太高时,大部分的营养都被消耗用来合成菌丝体,而没有用于合成具有生理活性的次级代谢产物Antroquinonol。由实验结果确定米粉的最佳质量浓度为50 g/L。
2.2.3氮源种类对樟芝菌液态发酵合成Antroquinonol的影响在确定樟芝液态发酵培养基最佳碳源种类和含量的基础上,考察不同氮源对合成Antroquinonol的影响,如图4所示。
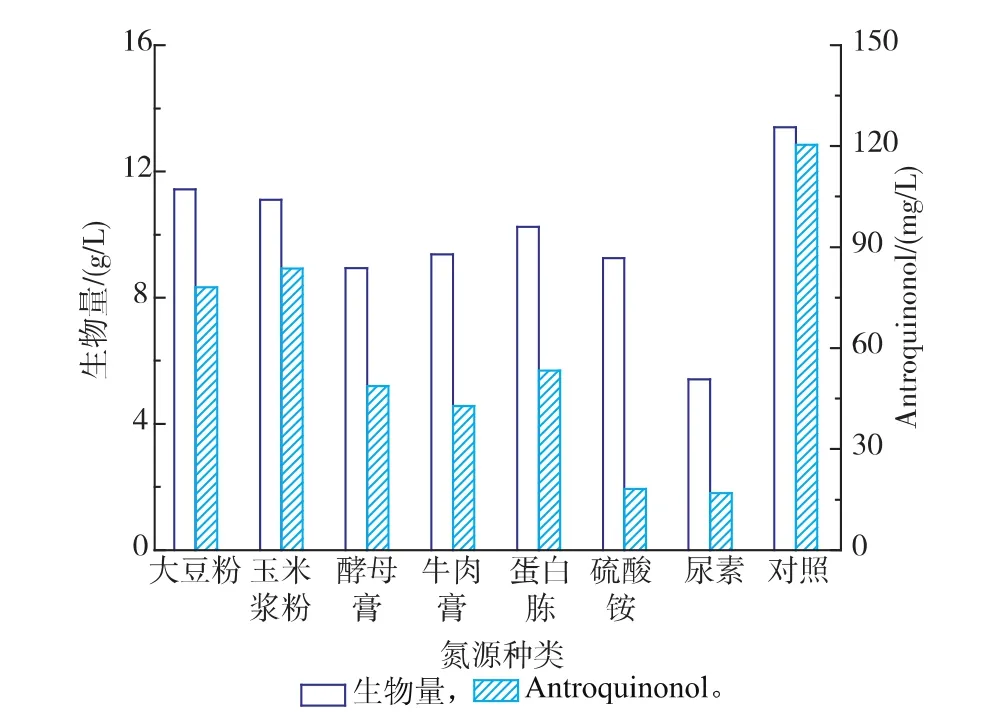
图4 不同氮源对樟芝液态发酵生物量和Antroquinonol产量的影响Fig. 4 Effect of various nitrogen sources on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
分别选择了7种不同的有机和无机氮源进行樟芝液态发酵培养,由图可以看出有机氮源的效果要明显高于无机氮源,这与有机氮源含有较多的氨基酸和生长促进因子有关。其中大豆粉和玉米浆粉的效果最好,但是比对照组中以大豆粉和玉米浆粉为复合氮源的效果稍差,说明不同种类的有机氮源对于合成Antroquinonol具有协同促进作用,因此仍然以大豆粉和玉米浆粉作为樟芝液态发酵培养基的氮源。
2.3樟芝菌液态发酵合成Antroquinonol的发酵条件的优化
2.3.1初始pH对樟芝菌液态发酵合成Antroquinonol的影响在对樟芝液态发酵的培养基进行优化的前提下,进一步的对其发酵条件进行了探究。首先对于樟芝液态发酵培养基的初始pH进行了优化,分别调整发酵培养基的初始pH为2、3、4、5、6、7、8,实验结果如图所示。
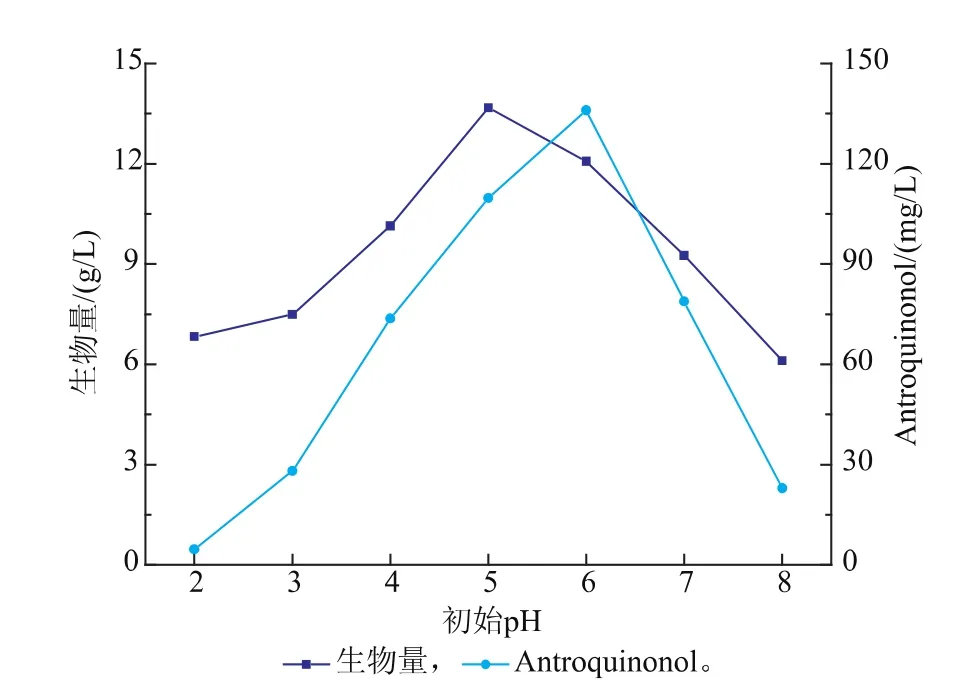
图5 初始pH对樟芝液态发酵生物量和Antroquinonol产量的影响Fig. 5 Effect of different initial pH values on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
如图所示,随着发酵培养基初始pH的增加,菌体量和Antroquinonol的产量呈现先上升后下降的趋势,初始pH为5时最利于菌丝体的生长,而当初始pH为6时,Antroquinonol的产量达到最高。综合考虑樟芝液态发酵过程中的菌体量和Antroquinonol的产量,确定樟芝液态发酵合成Antroquinonol的最佳初始pH值为6。
2.3.2接种量对樟芝菌液态发酵合成Antroquinonol的影响合适的接种量有利于缩短菌体的延滞期,提高活性产物的产量,因此在对樟芝液态发酵培养基组成和初始pH优化的前提下,进一步的对其接种量进行优化,分别选择接种量为体积分数5%、10%、15%、20%和25%进行实验,结果如图6所示。

图6 接种量对樟芝菌液态发酵生物量和Antroquinonol产量的影响Fig. 6 Effect of different inoculum concentrations on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
接种量对于樟芝液态发酵菌丝体的生长和Antroquinonol的合成具有重要影响。随着接种量的逐渐增大,菌体量呈逐渐上升的趋势,当接种量为体积分数15%时趋于稳定。对于Antroquinonol的合成,当接种量为体积分数10%时,Antroquinonol的产量最高,达到148.27 mg/L。由于樟芝菌生长缓慢,当接种量较小时不利于菌丝体的生长和活性产物的合成,而接种量过大则会导致发酵培养基的营养消耗过快,不利于活性产物的合成,因此选择合适的接种量较为重要。结合实验结果,确定最佳的接种量为体积分数10%。
2.3.3发酵温度对樟芝菌液态发酵合成Antroquinonol的影响综合考虑野生樟芝子实体的生长环境和一般丝状真菌的培养温度,选择22、25、
28℃和31℃4个温度水平来进行樟芝菌液态发酵最佳培养温度的筛选。

图7 温度对樟芝菌液态发酵生物量和Antroquinonol产量的影响Fig. 7 Effect of different temperatures on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
如图7所示,温度对樟芝液态发酵合成Antroquinonol和菌丝体的生长有较大的影响,当发酵温度为25℃时有利于Antroquinonol的合成,而在28℃时较有利于樟芝菌丝体的生长。综合考虑,确定樟芝液态发酵合成Antroquinonol的最佳培养温度为25℃。
2.3.4摇床转速对樟芝菌液态发酵合成Antroquinonol的影响在樟芝液态发酵培养基的初始pH为6、接种量为体积分数10%、发酵温度为25℃的条件下,对于樟芝液态发酵的摇床转速进行了优化,分别选择100、150、200,250 r/min 4个水平进行实验,结果如图8所示。
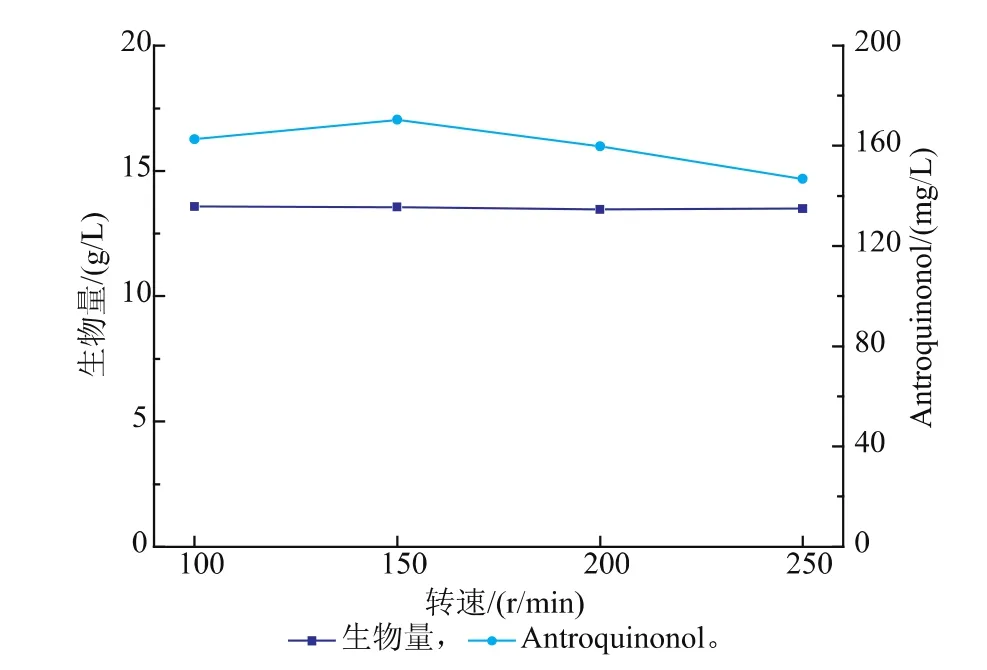
图8 转速对樟芝菌液态发酵生物量和Antroquinonol产量的影响Fig. 8 Effect of rotational speed on the biomass and production of Antroquinonol in submerged fermentation of A. camphorata
由图可以看出,在发酵过程中改变摇床转速对于樟芝液态发酵的菌体生长影响不大,但是对于Antroquinonol的产量却有重要的影响。不同的摇床转速会影响发酵过程中的供氧量以及菌体形态,从而影响活性物质的合成。当摇床的转速过高时不利于发酵过程中氧气的供给,因此樟芝液态发酵合成Antroquinonol的最佳摇床转速为150 r/min。
3 结语
对樟芝液态发酵过程中前体物质和效应物的复合添加进行研究,并在此基础上,进一步对培养基及发酵条件进行优化。结果表明,在复合添加豆油和辅酶Q0的前提下,发酵培养基的最佳碳源为米粉50 g/L、氮源为大豆粉6 g/L和玉米浆粉8 g/L,最适的发酵条件为初始pH 6、接种量为体积分数10%、发酵温度25℃、摇床转速150 r/min,在此条件下Antroquinonol的产量最高可以达到170 mg/L。
参考文献:
[1]Chang T T,Chou W N. Antrodia cinnamomea sp. nov. on Cinnamomum kanehirai in Taiwan[J]. Mycological Research,1995,99 (6):756-758.
[2]Wu S H,Leif R,Chang T T. Antrodia camphorata(“niu-chang-chih”),new combination on medicinal fungus in Taiwan[J]. Botanical Bulletin of Academia Sinica,1997,38:273-275.
[3]Wu S H,Yu Z H,Dai Y C,et al. Taiwanofungus,a polypore new genus[J]. Fung Sci,2004,19(3-4):109-116.
[4]Ao Z H,Xu Z H,Lu Z M,et al. Niuchangchih(Antrodia camphorata)and its potential in treating liver diseases[J]. Journal of Ethnopharmacology,2009,121:194-212.
[5]Geethangili M,Tzang Y M. Review of pharmacological effects of Antrodia camphorata and its bioactive compounds[J]. Evidence-Based Complementary and Alternative Medicine,2009,2011:1-17.
[6]Lu M C,EI-Shazly M,Wu T Y,et al. Recent research and development of Antrodia cinnamomea[J]. Pharmacology & Therapeutics,2013,139:124-156.
[7]George H,Shen M Y,Lin K H,et al. Antioxidative and hepatoprotective effects of Antrodia cinnamomea[J]. Journal of Agricultural and Food Chemistry,2003,51:3302-3308.
[8]Shen Y C,Chou C J,Wang Y H,et al. Anti-inflammatory activity of the extracts from mycelia of Antrodia camphorata cultured with water-soluble fractions from five different Cinnamomum species[J]. FEMS Microbiology Letters,2004,231:137-143.
[9]Yang H L,Kumar K J,Kuo Y T,et al. Antrodia camphorata induces G1 cell-cycle arrest in human premyelocytic leukemia (HL-60)cells and suppresses tumor growth in athymic nude mice[J]. Food & Function,2014,5(9):2278-2288.
[10]Chen Y R,Chang K T,Tsai M J,et al. Antrodia cinnamomea profoundly exalted the reversion of activated hepatic stellate cells by the alteration of cellular proteins[J]. Food and Chemical Toxicology,2014,69:150-162.
[11]Kuo M C,Chang C Y,Cheng T L,et al. Immunomodulatory effect of Antrodia camphorata mycelia and culture filtrate[J]. Journal of Ethnopharmacology,2008,120:196-203.
[12]Ker Y B,Peng C C,Chang W L,et al. Hepatoprotective bioactivity of the glycoprotein,Antrodan,isolated from Antrodia cinnamomea mycelia[J]. PLOS one,2014,9(4):1-11.
[13]张薄博,夏永军,许赣荣.樟芝发酵产品的研究进展[J].食品科技,2012,37(10):89-91. ZHANG Bobo,XIA Yongjun,XU Ganrong. Advance on the fermented products of Antrodia camphorata[J]. Food Science and Technology,2012,37(10):89-91.(in Chinese)
[14]Lee T H,Lee C K,Tsou W L,et al. A new cytotoxic agent from solid-state fermented mycelium of Antrodia camphorata[J]. Planta Letter,2007,73:1412-1415.
[15]Yu C C,Chiang P C,Lu P H,et al. Antroquinonol,a natural ubiquinone derivative,induces a cross talk between apoptosis,autophagy and senescence in human pancreatic carcinoma cells[J]. Journal of Nutritional Biochemistry,2012,23:900-907.
[16]Yang S M,Ka S M,Hua K F,et al. Antroquinonol mitigates an accelerated and progressive IgA nephropathy model in mice by activating the Nrf2 pathway and inhibiting T cells and NLRP3 inflammasome[J]. Free Radical Biology and Medicine,2013,61:285-297.
[17]Lin T J,Lee Y Y,Tzeng B H,et al. Antroquinonol,an active pure compound from Antrodia camphorata mycelium,modulates the development of atherosclerosis in a mouse carotid artery ligation model[J]. Journal of Medical Science,2014,34(2):56-61.
[18]喻学淳,夏永军,张欢,等.樟芝固态发酵生产Antroquinonol及萃取Antroquinonol的研究[J].食品工业科技,2013,34(5):164-168. YU Xuechun,XIA Yongjun,ZHANG Huan,et al. Research of A. camphorata solid-state fermentation production Antroquinonol and extraction Antroquinonol[J]. Science and Technology of Food Industry,2013,34(5):164-168.(in Chinese)
[19]Hu Y D,Zhang H,Lu R Q,et al. Enabling the biosynthesis of Antroquinonol in submerged fermentation of Antrodia camphorata[J]. Biochemical Engineering Journal,2014,91:157-162.
[20]Hu Y D,Lu R Q,Liao X R,et al. Stimulating the biosynthesis of Antroquinonol by addition of effectors and soybean oil in submerged fermentation of Antrodia camphorata[J]. Biotechnology and Applied Biochemistry,2015,dio:10.1002/bab.1387.
Optimization of Submerged Fermentation for the Biosynthesis of Antroquinonol from Antrodia camphorata
HU Yongdan1,2,LU Ruiqiu1,2,ZHANG Bobo1,2,XU Ganrong1,2,LIAO Xiangru*1,2
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2. School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Abstract:Antroquinonol,one of the metabolites in the edible and medicinal mushroom Antrodia camphorate,is considered as an effective bioactive component. However,Antroquinonol could not be biosynthesized via conventional submerged fermentation of A. camphorata. In this study,the culture medium and submerged fermentation conditions for the biosynthesis of Antroquinonol from A. camphorata was optimized based on the addition of precursors and effectors. The carbon/nitrogen source and the culture conditions of A. camphorata in submerged fermentation were optimized by single factor experiment with soybean oil and coenzyme Q0 added. The optimal carbon source was rice flour of 50 g/L,while the nitrogen source was soybean flour of 6 g/L and corn steep powder of 8 g/L. The initial pH is pH 6 with the inoculums concentration of 10%(v/v),and the fermentation temperature is 25℃at 150 rpm,under which the production of Antroquinonol can reach 170.34book=29,ebook=34mg/L.
Keywords:Antrodia camphorata,antroquinonol,medium,fermentation conditions
*通信作者:廖祥儒(1964—),男,江西赣州人,理学博士,教授,博士研究生导师,主要从事发酵工程研究。E-mail:13771104596@163.com
作者简介:胡永丹(1990—),女,河南驻马店人,发酵工程博士研究生,主要从事真菌发酵合成活性产物研究。E-mail:kunlan881221@126.com
基金项目:国家自然科学基金项目(21306065);江苏省自然科学基金(BK20130134);江苏高校优势学科建设工程资助项目;111引智计划(111-2-06);江苏省现代发酵工业协同创新中心资助项目。
收稿日期:2015-08-13
中图分类号:Q 815
文献标志码:A
文章编号:1673—1689(2016)01—0028—07
