锌α2糖蛋白对实验性大鼠肝癌的抑制作用
2016-05-23廖红雨于景霞刘婷陆伦根徐铭益
廖红雨 于景霞 刘婷 陆伦根 徐铭益
856000 西藏 西藏山南扎囊县吉汝乡卫生院(廖红雨);上海交通大学附属第一人民医院消化科(于景霞,刘婷,陆伦根,徐铭益)
·论著·
锌α2糖蛋白对实验性大鼠肝癌的抑制作用
廖红雨于景霞刘婷陆伦根徐铭益
856000西藏西藏山南扎囊县吉汝乡卫生院(廖红雨);上海交通大学附属第一人民医院消化科(于景霞,刘婷,陆伦根,徐铭益)
【摘要】目的探讨锌α2糖蛋白(AZGP1)与肝细胞癌(HCC)发生、发展和转移的关系。方法二乙基亚硝胺(DEN)构建肝硬化和HCC大鼠模型,以过表达AZGP1基因干扰的HepG2细胞液构建裸鼠皮下成瘤和肝原位移植模型。免疫组织化学、蛋白免疫和PCR检测AZGP1和TGFβ1的表达。结果AZGP1 mRNA在正常肝组织、肝硬化和肝癌中的表达分别为(0.98±0.02)、(0.52±0.03)、(0.20±0.02);而TGFβ1的基因和蛋白表达在肝硬化和肝癌组织中呈现显著上调。AZGP1过表达的HepG2细胞接种裸鼠构建皮下肿瘤(HepG2-AZGP1组)。与对照组(HepG2-GFP组)比较,肿瘤大小无差异。裸鼠肝内移植术6周后,HepG2-GFP组57%和HepG2-AZGP1组14%发生肺转移(P=0.0157)。与HepG2-GFP组比较,HepG2-AZGP1组肝脏原发灶和肺转移灶结节数目明显减少,癌细胞异型性明显较轻。结论肝硬化进展至肝癌过程中抑癌基因AZGP1发生缺失,伴随着失去阻抑TGFβ1作用。恢复AZGP1功能可能是一种新的有前途的治疗肝癌方法。
【关键词】肝细胞肝癌;肝硬化;锌α2糖蛋白;转化生长因子β1
锌α2糖蛋白(Zinc-α2-glycoprotein 1,AZGP1)的相对分子质量为40×103,主要在上皮细胞表达,可抑制肿瘤生长,抑制酶介导的肿瘤浸润,激活细胞凋亡[1,2]。已发现AZGP1可抑制转化生长因子-β1(transforming growth factor,TGF-β1)介导的上皮间质转化(EMT)而抑制胰腺肿瘤的侵袭 ,而AZGP1在肝癌中的作用机制尚未明确。本研究拟阐明实验性大鼠HCC模型中,AZGP1的表达和对HCC的影响作用。
资料和方法
一、实验动物
60只健康雄性SD大鼠,SPF 级,体质量180~220 g,由中国科学院上海实验动物中心提供,饲养于上海交通大学医学院实验动物中心,所有动物自由进食饮水,温度湿度符合标准。每日饮水中加入0.05 g/L的二乙基亚硝胺(DEN,美国Sigma公司)诱导肝硬化及肝癌大鼠模型。造模后分别在0、8、12、16周处死大鼠,设立对照组、肝硬化组、晚期肝硬化组和肝癌组,每组15只。
二、细胞株及试剂来源
HepG2细胞株,HEK293T细胞株,购自中科院上海细胞库。30只雄性BALB/c裸鼠(4~6周龄),购自上海中科院实验动物中心。胎牛血清、0.25%胰酶、RPMI1640培养液(美国Gibco公司),双抗和PBS(美国Hyclone公司),Opti-MEM 和Lipofectamine 2000(美国Life Technologies公司),Polybrene(美国Sigma公司),pLenti-AZGP1载体(含有mGFP标记)及对照空载体(美国Origene公司),慢病毒包装试剂盒(美国Origene公司)。
三、皮下成瘤试验
应用Lipofectamine 2000转染试剂将慢病毒表达质粒pLenti-AZGP1与慢病毒包装试剂盒共转染293T细胞进行重组慢病毒包装及阴性对照载体病毒液。取对数生长期的HepG2细胞接种在培养皿中,加入病毒液感染细胞,加入终浓度8 μg/mL的Polybrene,摇匀后37 ℃、体积分数为0.05的CO2培养,24 h后根据细胞状态适时更换新鲜完全培养基,待细胞长至80%~90%汇合时,传代扩增培养,流式细胞仪分选荧光强度高的稳定细胞。随机选取4~6周龄雄性 BALB/c 裸鼠16只,分为两组(每组8只),分别注射AZGP1过表达或对照空载体转染的HepG2细胞液。细胞液摇匀后,在裸鼠双侧下肢髋关节上方皮下分别接种5×106/0.2 mL细胞悬液。观察皮下肿瘤生长,4周时,断颈处死裸鼠称重。
四、肝原位移植
14只6周龄裸鼠分别以AZGP1过表达的HepG2细胞接种的皮下肿瘤(HepG2-AZGP1组,n=7)和空载体转染HepG2细胞接种的皮下肿瘤(HepG2-GFP组,n=7)行肝内移植术,取长至约1 cm皮下瘤,去除坏死组织剪成1~2 mm3小块。HepG2-AZGP1组7只小鼠,用戊巴比妥钠腹腔麻醉,皮肤消毒后行左上腹横开口,暴露肝脏,取上述2块瘤组织,在离体30 min内用针头植入裸鼠肝叶深部实质内,压迫止血后全层关腹。完成肝内移植后,裸鼠放回笼中SPF条件饲养,自由饮食,并观察裸鼠生活状况。手术6周后,处死裸鼠,取肝脏、肺组织行HE染色。
五、免疫组化
采用即用型免疫组织化学超敏Ultra SensitiveTM SP 试剂盒(美国ZYMED公司),参考说明书进行。切片依次经下述处理:组织脱蜡;水化;PBS浸泡;滴加阻断剂;抗原修复;使用非免疫血清封闭;滴加AZGP1和TGFβ1一抗(美国Abcam公司),4 ℃过夜;滴加辣根过氧化物酶(HRP)标记二抗(稀释度1∶200),37 ℃ 10 min;DAB显色,苏木素复染(美国Sigma公司)。
六、荧光定量PCR
采用反转录试剂盒(美国Promega公司),RNA抽提采用TRI REAGENT○RRNA提取试剂盒(美国Molecular Research Center),按说明书进行,DEPC(焦碳酸乙二酯,美国Sigma公司),氯仿、无水乙醇、异丙醇(上海国药集团),RNA定量及电泳,电泳后见28S及18S两条条带,且28S:18S比值大于2。总RNA反转录,根据M-MLV操作说明书进行。应用Primer 5.0,设计检测基因引物,内参基因为β-Actin。引物(上海生工),各引物序列见表1。SYBR Green掺入法荧光定量PCR反应体系。荧光定量PCR:95 ℃,10 min;95 ℃,15 s;55 ℃,1 min;循环40次。样品目的基因的相对表达率 (Relative Expression,RQ)采用△△CT方法计算,RQ=2-△△CT。RNA荧光定量PCR拷贝数,根据标准曲线获得。每个样品的目的基因与内参照基因各设3个重复试验。
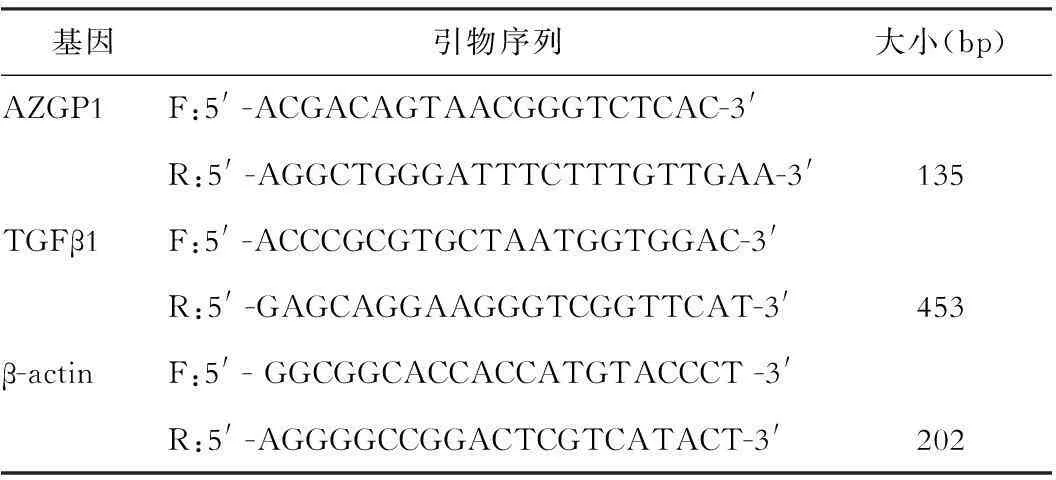
表1 PCR引物序列
七、Western印迹
WB采用RIPA细胞裂解液(美国Santa Cruz公司),BCA蛋白质定量试剂盒(上海生工),硝酸纤维素膜(美国Millipore公司),丙烯酰胺、SDS(美国Sigma公司),TEMDE(美国Sigma公司),甘氨酸、滤纸(美国Promega公司),抗体(美国Abcam公司)。
八、统计学方法
采用SPSS 19.0统计软件。各组数据以均数±标准差表示,两组数据间比较采用独立样本t检验,三组以上数据间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
结果
一、肝硬化、肝癌大鼠组织中AZGP1 mRNA和TGFβ1 mRNA表达
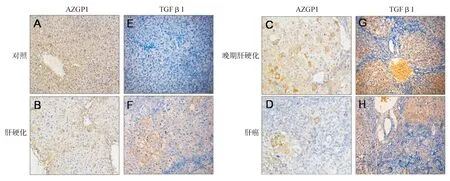
图2 各组大鼠肝组织免疫组化结果(×200)
AZGP1mRNA表达水平,在肝硬化组(0.52±0.03,P=0.0467)和晚期肝硬化组(0.38±0.01,P=0.0204)中较正常肝组织明显下调,在肝癌组(0.20±0.02,P=0.003)中的表达较其他组均显著下调。TGFβ1mRNA表达在肝硬化组(2.24±0.09,P=0.0370)和晚期肝硬化组(3.14±0.21,P=0.0251)中较正常肝组织明显上调,在肝癌组(1.98±0.02,P=0.0412)中比正常肝组织也呈显著上调,但低于肝硬化组。
二、肝硬化、肝癌大鼠肝组织中AZGP1和TGFβ1蛋白表达
AZGP1的蛋白表达在肝硬化组织中较正常肝组织明显减低,在肝癌组织中的表达较其他组均明显降低。而TGFβ1蛋白表达在肝硬化组中较正常肝组织明显升高,在肝癌组织中表达接近或低于正常组织(图1)。
AZGP1在正常肝组织中呈强阳性表达,在肝硬化和晚期肝硬化组织中表达逐渐变弱,在肝癌组织中呈弱表达或几乎阴性表达。TGFβ1在肝癌组织的表达强于正常肝组织,但比肝硬化组织显著减弱;而肝硬化组织中TGFβ1蛋白的表达较正常肝组织强,晚期肝硬化组织中表达最强(图2)。
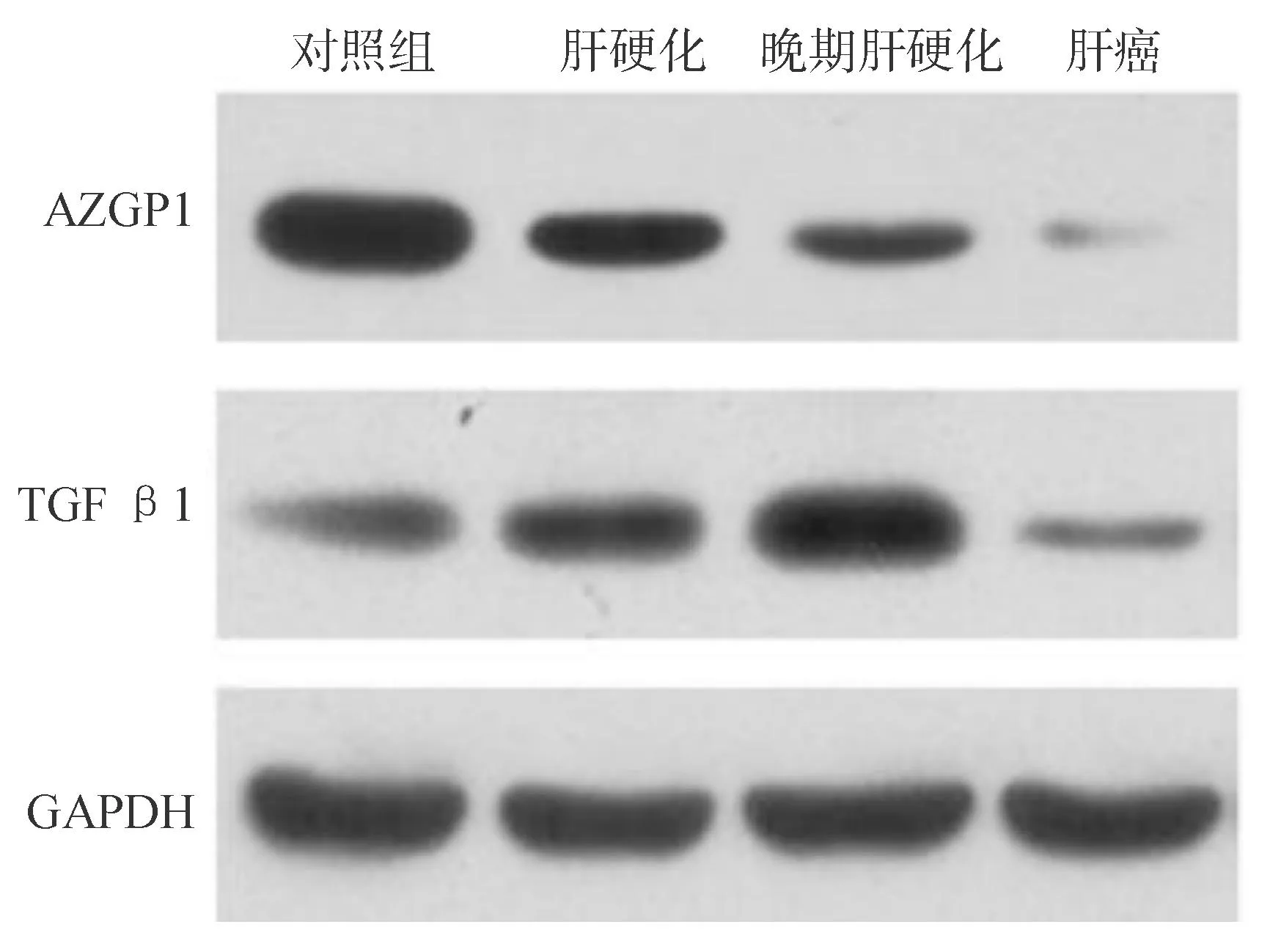
图1 Western印迹法检测AZGP1蛋白的表达
三、裸鼠体内成瘤试验
AZGP1过表达的HepG2细胞液注射形成的皮下肿瘤,HepG2-AZGP1组为(1.77±0.42) g,与HepG2-GFP组的(2.05±0.35) g比较,肿瘤大小差异无统计学意义(P=0.075),表明AZGP1对肿瘤生长没有显著影响。
四、裸鼠体内转移试验
每组7只裸鼠中,对照HepG2-GFP组有4只发生肺转移,HepG2-AZGP1组有1只发生肺转移(P=0.0157)。肝脏病理大体观察可见,两组小鼠肝脏均可见灰白色粟粒状结节,大小不等,分散分布,HepG2-AZGP1组结节数目明显比对照组少。光镜检查可见,两组肝癌细胞均呈胞核大而不规则,分裂相多,细胞排列不规则,HepG2-AZGP1组肝癌细胞异型性明显较对照组轻。肺转移灶病理大体形态观察HepG2-AZGP1组结节数目大小明显比对照组少;HE染色光镜观察也可见与对照组相比,肺内转移灶HepG2-AZGP1组瘤细胞形态小,异形性轻(图3)。

图3 裸鼠肝原位移植6周后肝脏和肺脏镜下表现(HE,×100~200)
讨论
AZGP1与多种肿瘤的发生发展相关,在肿瘤性疾病中呈异常低表达,可以定义为抑癌基因,在人肝癌组织中也可见AZGP1基因表达缺失,其与HCC预后密切相关[3-6]。本研究观察大鼠肝癌、肝硬化和正常肝组织中AZGP1 mRNA和蛋白的表达差异,证实AZGP1在正常肝脏呈高表达,肝硬化时AZGP1表达显著降低,肝癌时AZGP1表达缺失呈最低。AZGP1的表达异常伴随TGFβ1在大鼠肝硬化或肝癌中极度活化表达上调。TGFβ1是纤维化促发因素,参与了肝硬化发生发展的全过程;在HCC时TGFβ1也能诱导EMT发生,所以TGFβ1在肝炎、肝硬化至肝癌的过程中都发挥了重要调节作用。
肿瘤侵袭和转移是影响肿瘤生存的主要因素。 在肿瘤侵袭和转移的过程中,血管形成和EMT扮演着重要的作用。肝癌是富血管性肿瘤,且微血管生长增加,肿瘤细胞得以不断增殖和转移;在EMT 过程中,上皮细胞极性的丧失和间质特征的获得为主要特点。体外研究证实,AZGP1可上调上皮细胞标志物 E-cadherin 的表达,使得细胞之间的连接加强;而间质细胞标志物 Vimentin 的表达降低,导致肿瘤细胞发生转移减少。在本研究中制备了过表达AZGP1的病毒包装载体,可干扰受体的AZGP1过表达,结果也验证了其可以显著抑制HCC的远处肺转移。虽然体内裸鼠试验在过表达AZGP1组和对照组的移植瘤和肝原发肿瘤无明显差异,但也观察到了肝原发肿瘤的癌结节大小和范围比对照组小。
总之,肝硬化进展至肝癌过程中抑癌基因AZGP1发生缺失,伴随着失去阻抑TGFβ1作用,恢复AZGP1功能可能是一种新的治疗肝癌方法。
参考文献
1Zorin NA, Zorina VN, Zorina RM. Role of proteins of the macroglobulin family in regulation of tumor growth. Ontogenez, 2006, 37: 12-19.
2Zorin NA, Zorina VN, Zorina RM. The role of macroglobulin family proteins in the regulation of inflammation. Biomed Khim, 2006, 52: 229-238.
3Hassan MI, Waheed A, Yadav S, et al. Zinc alpha 2-glycoprotein: a multidisciplinary protein. Mol Cancer Res, 2008, 6: 892-906.
4Irmak S, Tilki D, Heukeshoven J, et al. Stage-dependent increase of orosomucoid and zinc-alpha2-glycoprotein in urinary bladder cancer. Proteomics, 2005, 5: 4296-4304.
5Abdul-Rahman PS, Lim BK, Hashim OH. Expression of high-abundance proteins in sera of patients with endometrial and cervical cancers: analysis using 2-DE with silver staining and lectin detection methods. Electrophoresis, 2007, 28: 1989-1996.
6Huang Y, Li LZ, Zhang CZ, et al. Decreased expression of zinc-alpha2-glycoprotein in hepatocellular carcinoma associates with poor prognosis. J Transl Med, 2012, 10:106.
(本文编辑:钱燕)
Inhibition of zinc-2 glycoprotein in a rat model of hepatocellular carcinoma
LIAOHong-yu,YUJing-xia,LIUTing,LULun-gen,XUMing-yi.Jirutownshiphospital,Zhanangcountry,ShannanprefectureofTibetautonomousregion856000,China;DepartmentofGastroenterology,ShanghaiFirstPeople’sHospital,ShanghaiJiaotongUniversity,Shanghai200080,China
【Abstract】ObjectiveTo investigate the expression of zinc-α2-glycoprotein (AZGP1) in a rat model of hepatocellular carcinoma (HCC), and its relationship with HCC progression. MethodsCirrhosis and HCC in rat models were established by diethylnitrosamine (DEN) water feeding, and subcutaneous tumor and orthotopic liver transplantation models in nude mice were constructed by injection of HepG2 cells with AZGP1 gene over-expressed interferenced vector. The expressions of AZGP1 and transforming growth factor β1 (TGFβ1) were detected by immunohistochemistry staining, westernblot (WB) and polymerase chain reaction (PCR), respectively, then the relationship among AZGP1, tumor size and metastasis rate was evaluated. ResultsThe level of AZGP1 mRNA (0.20±0.02, p=0.003) was lower in HCC tissues than that in normal or cirrhosis tissues. Hepatic expression of AZGP1 proteins was absent or low-expressed, which was confirmed by quantitative immunohistochemical and WB analysis. Hepatic TGFβ1 gene and protein in cirrhotic and HCC tissues were significantly increased. The size of subcutaneous tumors had no difference between AZGP1 over-expressed HepG2 cells treated group (HepG2-AZGP1 group) and the control group (HepG2-GFP group). The incidence of lung metastasis was 57% in HepG2-AZGP1 group and 14% in HepG2-GFP group at week 6 after transplantation of subcutaneous tumors in nude mice. Compared with those in HepG2-GFP group, the numbers and sizes of tumor nodules in liver and lung were significantly decreased and the distinct atypia degrees of cancer cells were significantly lower in HepG2-AZGP1 group. ConclusionDuring the progression from cirrhosis to HCC, AZGP1 loss occurred accompanied with derepression of TGFβ1, which was proposed that function recovery of AZGP1 might be a new promising approach to reversing HCC.
【Key words】Hepatocellular carcinoma (HCC); Zinc-α2-glycoprotein 1 (AZGP1); Transforming growth factor-β1 (TGF-β1); Cirrhosis
(收稿日期:2015-12-25)
Corresponding author:XU Ming-yi,Email: xumingyi2014@163.com
通信作者:徐铭益,Email:xumingyi2014@163.com
基金项目:国家科技部“十二五”重大专项(2013ZX10002004-002-003),国家自然基金面上项目(81570547),院优秀青年培养计划(061405)
