eIF5A活化因子DHPS在非酒精性脂肪性肝病中的表达及意义
2016-05-23苗琪卞兆连王昭月彭延申马雄
苗琪 卞兆连 王昭月 彭延申 马雄
200001 上海交通大学医学院附属仁济医院消化内科,上海市消化疾病研究所
·论著·
eIF5A活化因子DHPS在非酒精性脂肪性肝病中的表达及意义
苗琪卞兆连王昭月彭延申马雄
200001上海交通大学医学院附属仁济医院消化内科,上海市消化疾病研究所
【摘要】目的初步探讨真核细胞翻译起始因子5A (eIF5A)活化因子脱氧辅蛋白合成酶(DHPS)在脂肪肝小鼠模型和非酒精性脂肪性肝病(NAFLD)患者中的表达及其意义。方法采用免疫组化、Western 印迹、实时 PCR观察脂肪肝造模小鼠及正常饮食小鼠DHPS的表达情况;HE及油红染色比较DHPS过表达小鼠与绿色荧光蛋白(GFP)对照组间脂肪造模后肝脏脂肪变性及炎症程度,PCR-arrays检测引起差异的相关基因;免疫组化、荧光观察NAFLD患者肝穿标本及人肝细胞系HL-7702脂肪造模后DHPS的表达。结果脂肪肝模型小鼠较对照组DHPS表达量明显升高(1.80 比 0.69, P<0.05),以肝脏(13.21 比 1.00, P<0.01)、脂肪为主(7.97 比 1.00, P<0.01);DHPS过表达小鼠较GFP对照组在脂肪造模后肝内脂肪变性更明显(2.78 比 2.20, P<0.05),其可能与胰岛素抵抗(Irs1)、脂肪酸合成增加(Ascbg2)及(iNos、 IL-6)相关;NAFLD患者较健康人群DHPS表达增多(1.29 比 0.50, P<0.05),且与肝细胞脂肪变性呈正相关(r=0.5927,P=0.018);人肝细胞系HL-7702脂肪造模后(OP 2:1)DHPS表达显著升高。结论DHPS在脂肪肝小鼠模型、NAFLD患者及脂肪造模HL-7702中均有高表达,DHPS过表达能加速肝内脂肪沉积,提示其在NAFLD发病中发挥重要作用。
【关键词】真核细胞翻译起始因子5A;脱氧辅蛋白合成酶;非酒精性脂肪性肝病
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD) 是一种无过量饮酒史,以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征,部分患者会进展至终末期肝病[1-2]。欧美国家成年人患病率可达30%[3],而我国上海、广州等发达地区在15%左右[4]。NAFLD 的发病目前尚不能以单一的机制解释,一般认为是一种遗传、环境、代谢应激相关性疾病,最为接受的理论是Day和James[5]提出的“二次打击假说”。真核细胞翻译起始因子5A (Eukaryotic translation initiation factor 5A,eIF5A)是一个高度保守的小分子蛋白(17 kDa),其活化依赖于脱氧辅蛋白合成酶 (deoxyhypusine synthase,DHPS)和脱氧辅蛋白羟化酶(deoxyhypusine hydroxylase,DOHH)的先后作用[6]。活化后的eIF5A具有翻译起始、延长等作用。近年来eIF5A及其活化在炎性反应中的作用日益显现,尤其在糖尿病模型小鼠中敲除eIF5A或抑制DHPS可减轻胰岛细胞炎性反应,保护其功能,提高糖耐量水平,这一过程与iNOS的转录密切相关[7]。由于NAFLD和糖尿病都是以胰岛素抵抗为基础而引发代谢紊乱综合征,iNOS在两种疾病中都高表达[8-9],推测DHPS在NAFLD发病过程中发挥一定的作用。本研究通过观察:①脂肪肝造模小鼠DHPS的表达情况;②腺病毒过表达DHPS小鼠与对照组肝脏脂肪变性及炎症程度;③NAFLD患者肝脏组织学DHPS表达;④人肝细胞系HL-7702脂肪造模后DHPS表达,旨在明确DHPS在NAFLD发病中的作用,为临床治疗提供新的思路。
资料和方法
一、研究对象
6~8周龄雄性 C57BL/6小鼠购于上海实验动物中心,饲养于上海交通大学医学院附属仁济医院动物实验中心SPF级笼舍。饮食分为高脂饮食(59%脂肪、25%碳水化合物和16%蛋白质)和正常饮食(12%脂肪、59%碳水化合物和29%蛋白质)。8周后高脂小鼠分别予尾静脉注射PBS溶解的DHPS腺病毒过表达质粒(100 μg/只) 和GFP对照质粒,继续饲养两周后处死。腺病毒过表达质粒和对照质粒购于上海和元生物技术公司。所有动物实验均符合上海交通大学医学院实验动物伦理学。
收集2011至2014年期间上海交通大学医学院附属仁济医院消化内科27例NAFLD患者肝组织标本,同时选取8例肝血管瘤切除时瘤旁正常肝组织作为健康对照。 NAFLD诊断参照2012年美国肝脏病学会《非酒精性脂肪性肝病诊疗指南》[1]。纳入标准:①无饮酒史或乙醇摄入量男性<210 g/周,女性<140 g/周;②肝组织病理学改变符合脂肪性肝病。除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等。肝细胞脂肪变性、小叶内炎症及肝细胞气球样变的评分参照Kleiner DE分级[10]。研究方案经上海交通大学医学院附属仁济医院伦理委员会批准,所有纳入对象均由本人签署书面知情同意书。
NAFLD组男15例,女12例,年龄(50.3±12.6)岁,其中单纯性脂肪肝9例,NASH 18例;健康对照组男4例,女4例,年龄(48.2±9.8)岁。两组之间性别构成及年龄差异均无统计学意义。
二、免疫组化染色
石蜡切片70 ℃ 1 h经脱蜡、水化,PBS洗涤3次,3% H2O2作用15 min消除内源性过氧化物酶活性。柠檬酸盐缓冲液微波修复15 min,自然冷却至室温。非免疫羊血清室温封闭30 min滴加一抗 (抗DHPS抗体,Abcam,1∶100)稀释。4℃湿盒过夜,次日复温30 min,PBS 3次,滴加即用型辣根过氧化物酶(HRP)结合二抗,DAB显色,苏木精复染,晾干后中性树胶封片。显微镜下观察细胞核呈棕褐色者为阳性细胞,在40×10倍镜下随机选取5个视野,计数DHPS阳性细胞个数,根据阳性细胞数量分为3级,0级:0个;1级:1~5个;2级:6~10个;3级:>15个。
三、细胞培养及细胞荧光
人肝细胞系HL-7702购于中国科学院上海细胞库。培养基为 DMEM (美国Invitrogen公司)、10% 胎牛血清(美国Hyclone公司)、100 U/mL 青霉素、100 μg/mL 链霉素(美国Invitrogen)。 脂肪造模的试剂为OP 2∶1(油酸和软脂酸 2∶1混合) 。造模24 h后细胞予以4%多聚甲醛固定15 min,0.1% Triton X-100穿透,2% BSA封闭30 min。37 ℃ DHPS一抗孵育60 min,室温避光二抗(Alexa 488 驴抗兔)孵育30 min。DAPI染核封片,Carl Zeiss LSM 710 共聚焦显微镜观察脂肪造模肝细胞DHPS表达情况。
四、实时PCR及PCR array
总RNA采用 TRIzol试剂抽提并且反转录为cDNA,于ABI PRISM 7900HT 检测。β-actin基因作为内参。PCR-array采用384板,BioTNT QPCR染料法premix,ViiATM7实时荧光定量检测。
五、Western印迹
提取小鼠肝脏组织蛋白,经过电泳、转膜后一抗DHPS(Abcam,1∶500)孵育过夜,次日孵育二抗后显色。
六、油红染色
切片干燥后入50%乙醇稍洗;油红O乙醇染液作用8 min;50%乙醇分化,自来水终止分化;苏木素复染核,自来水返蓝,甘油明胶封片。
七、统计学方法
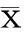
结果
一、小鼠高脂饮食诱导肝脏高表达DHPS
高脂饮食组小鼠肝脏内可见大小不一的脂肪空泡。与正常饮食组对比,脂肪肝小鼠肝脏DHPS的表达量明显升高,主要表达在脂肪变性的肝细胞核,呈棕褐色(图1A)。Western印迹进一步证实两组间DHPS的表达差异存在统计学意义(P<0.05,图1B)。为了明确DHPS的表达是否和胰岛素抵抗相关,采用实时PCR分别检测正常饮食组(n=3)和高脂饮食组(n=3)小鼠肝脏、脂肪和骨骼肌的DHPS RNA表达。结果显示,正常组和高脂组小鼠肝脏(P<0.01)和脂肪组织(P<0.01)DHPS表达差异均存在统计学意义,而骨骼肌则无统计学意义(P>0.05),提示该基因可能与胰岛素抵抗相关(图1C)。
二、过表达DHPS可加重高脂饮食小鼠肝脏脂肪变性
C57BL/6小鼠给予高脂饮食8周后分别尾静脉注射DHPS过表达质粒(n=9)和GFP对照质粒(n=5),再予以高脂饮食2周后分别取肝脏行HE和油红染色。结果显示DHPS过表达小鼠肝脏脂肪变性程度显著高于GFP对照组,DHPS过表达组肝脏小叶内炎症及气球样变程度均高于GFP对照组(图2A,2B)。
三、过表达DHPS影响的相关基因
选取DHPS过表达小鼠(n=3)和GFP对照小鼠(n=3)行PCR-arrays检测脂肪肝代谢相关的基因表达。每个基因均比较两组间表达的倍数(DHPS过表达/GFP对照组),当比值≥3时考虑为变化明显。图3显示的是变化明显的基因,通过实时PCR 进一步证实有显著变化的基因包括iNos,IL-6,Irs1,Ascbg2。
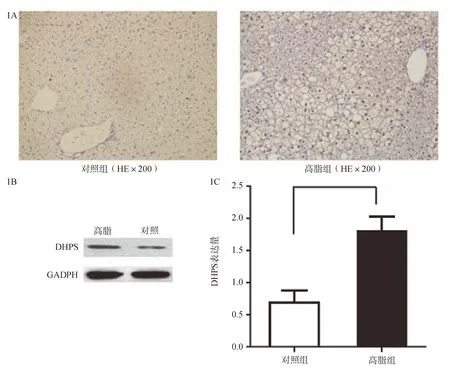
图1 高脂饮食和对照小鼠DHPS表达情况
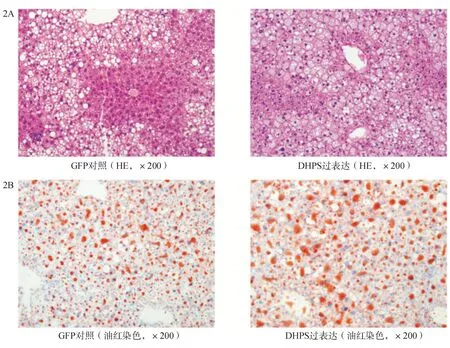
图2 DHPS过表达和GFP对照组高脂饮食肝脏变化
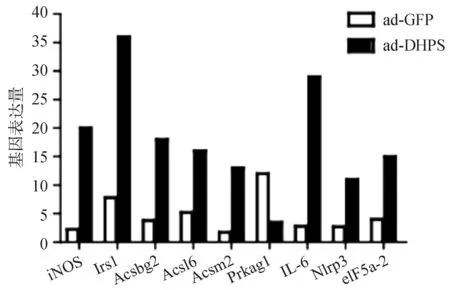
图3 DHPS过表达和GFP对照组脂肪肝相关基因表达
四、NAFLD患者肝脏DHPS表达情况
结果显示,与健康对照组相比,NAFLD组肝脏DHPS表达量更多,以脂肪变性的肝细胞为主,细胞核呈棕褐色(图4A)。组织学上,DHPS阳性的肝细胞与脂肪变性程度呈正相关 (r=0.5927,P=0.018),与小叶内炎症及气球样变无相关性(图4B)。这一结果与小鼠体内相似。
五、人肝细胞系HL-7702脂肪造模DHPS表达情况
体外人肝细胞系HL-7702予以OP 2∶1 (油酸和软脂酸2∶1混合)脂肪造模后可见DHPS在肝细胞核内高表达 (图4C)。由此可见, 无论体内还是体外DHPS在人脂肪变性的肝脏中均高表达。
讨论
DHPS是eIF5A活化过程中的关键酶。研究发现,高脂饮食可促进小鼠肝脏DHPS的表达。与GFP对照组相比,过表达DHPS可加重高脂饮食小鼠肝内脂肪沉积,其可能与增加脂肪酸合成、胰岛素抵抗和炎性因子的表达相关。此外NAFLD患者和脂肪造模的人肝细胞系HL-7702均可出现DHPS高表达,提示DHPS参与NAFLD的发生。
eIF5A是一个高度保守的小分子蛋白,DHPS和DOHH对于eIF5A均是高度特异的,且DHPS是反应过程中的限速酶[11-14]。最初认为eIF5A和翻译起始有关[15],后来又被证实具有翻译延长功能[16]。此外活化的eIF5A能与某些特定的mRNA结合进而调控其翻译过程,如: HIV感染的T淋巴细胞mRNA的转运[17]、树突状细胞表面成熟标记CD83mRNA的翻译[18]、糖尿病小鼠模型Th1细胞表面CD25的表达[19]等 。近年来eIF5A及其活化在炎症发生过程的作用也日益显现。抑制eIF5A可减轻脂多糖造模小鼠脓毒素血症的死亡率,其血清促炎细胞因子和趋化物明显减少[20]。敲除DHPS杂合子小鼠胚胎成纤维细胞在应激情况下iNOS生成量减少导致炎性反应减弱[21]。Maier等[7]的研究发现,糖尿病小鼠模型敲除eIF5A基因或抑制其活化(DHPS抑制剂)能有效减轻炎症程度,保护胰岛细胞功能,提高糖耐量水平。研究发现,脂肪肝模型小鼠中DHPS过表达组与对照组相比,iNos、IL-6表达明显升高,肝内炎症程度亦增加(炎症评分1.8/1.4),但差异无统计学意义,其原因在于采用高脂饮食造模,与人NAFLD的发病相似,主要为胰岛素抵抗引起肝内脂肪的沉积,而炎症程度本身就较轻,因此两组间的差异不够明显。
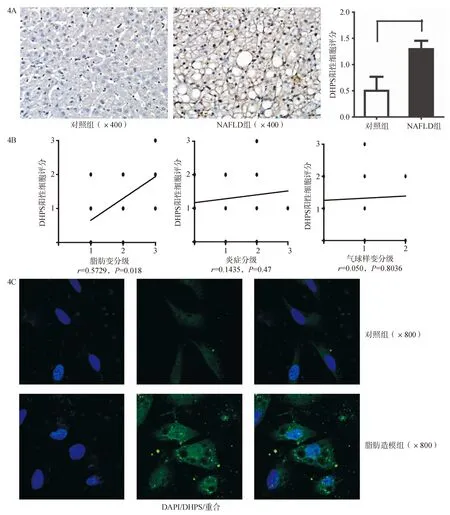
图4 NAFLD患者及HL-7702脂肪造模后DHPS表达
体内 NO 主要由NOS催化L - 精氨酸生成。肝内NOS有两种存在形式: 肝细胞、巨噬细胞和白细胞中的诱导型NOS (iNOS);内皮细胞和血小板中的组成型NOS (eNOS)。在正常情况下,肝组织中主要表达 eNOS,而iNOS无或仅有少量,在各种致病因子诱导下可高表达。iNOS通过增加胰岛素抵抗及氧化应激在NAFLD中发病过程中发挥重要作用[8-9]。在糖尿病的发病过程中,各种炎性因子通过NF-κB途径介导iNOS的转录,但iNOS-mRNA出核需要与相关转运蛋白结合。经DHPS活化的eIF5A与exportin1/CRM1组成的结合体发挥了将iNOS-RNA从核内转运至核外的作用[7,22]。因此使用DHPS抑制剂能阻碍iNOS蛋白表达进而起到减轻胰岛细胞炎症作用[23]。由于NAFLD和糖尿病发病机制有一定的相似性,推测可能存在相同的机制。
除了炎性因子,脂肪代谢异常沉积、胰岛素抵抗也是NAFLD 的重要病因[5]。研究发现,脂肪肝模型小鼠DHPS过表达,其肝内脂肪变性细胞较对照组明显增多;NAFLD患者中DHPS的表达量与肝细胞脂肪变性的程度成正相关。此外DHPS过表达可上调脂肪酸合成因子Ascbg2、胰岛素受体IRS-1的表达,提示DHPS可能通过增加肝内脂肪沉积及胰岛素抵抗促进NAFLD的发生。
综上所述,本研究从细胞、动物和人体组织学水平证实,DHPS与NAFLD发病存在一定的相关性,并对其可能的机制做了初步探索,为治疗NAFLD提供新的理论依据。
参考文献
1 Chalasani N, Younossi Z, Lavine JE,et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology, 2012,55:2005-2023.
2 Masuoka HC, Chalasani N. Nonalcoholic fatty liver disease: an emerging threat to obese and diabetic individuals. Ann N Y Acad Sci,2013,1281:106-122.
3 Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology,2004,40:1387-1395.
4 Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol,2009,50:204-210.
5 Day CP, James OF. Steatohepatitis: a tale of two "hits" Gastroenterology, 1998,114:842-845.
6 Cooper HL, Park MH, Folk JE, et al. Identification of the hypusine- containing protein hy+ as translation initiation factor eIF-4D. Proc Natl Acad Sci U S A,1983,80:1854-1857.
7 Maier B, Ogihara T, Trace AP, et al. The unique hypusine modification of eIF5A promotes islet beta cell inflammation and dysfunction in mice. J Clin Invest,2010,120:2156-2170.
8 Pasarin M, Abraldes JG, Rodriguez-Vilarrupla A,et al. Insulin resistance and liver microcirculation in a rat model of early NAFLD. J Hepatol, 2011,55:1095-1102.
9 Shinozaki S, Choi CS, Shimizu N, et al. Liver-specific inducible nitric-oxide synthase expression is sufficient to cause hepatic insulin resistance and mild hyperglycemia in mice. J Biol Chem,2011,286:34959-34975.
10Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology, 2005,41:1313-1321.
11Ma X, Hua J, Mohamood AR, et al. A high-fat diet and regulatory T cells influence susceptibility to endotoxin-induced liver injury. Hepatology, 2007,46:1519-1529.
12Park MH, Nishimura K, Zanelli CF, et al. Functional significance of eIF5A and its hypusine modification in eukaryotes.Amino Acids,2010,38:491-500.
13Wolff EC, Kang KR, Kim YS, et al. Posttranslational synthesis of hypusine: evolutionary progression and specificity of the hypusine modification. Amino Acids, 2007,33:341-350.
14Pallmann N, Braig M,Sievert H,et al. Biological Relevance and Therapeutic Potential of the Hypusine Modification System. J Biol Chem,2015,290:18343-18360.
15Kemper WM, Berry KW, Merrick WC. Purification and properties of rabbit reticulocyte protein synthesis initiation factors M2Balpha and M2Bbeta. J Biol Chem, 1976,251:5551-5557.
16Saini P, Eyler DE, Green R, et al. Hypusine-containing protein eIF5A promotes translation elongation. Nature, 2009,459:118-121.
17Hauber I, Bevec D, Heukeshoven J, et al. Identification of cellular deoxyhypusine synthase as a novel target for antiretroviral therapy. J Clin Invest,2005,115:76-85.
18Kruse M, Rosorius O, Kratzer F, et al. Inhibition of CD83 cell surface expression during dendritic cell maturation by interference with nuclear export of CD83 mRNA. J Exp Med, 2000,191:1581-1590.
19Colvin SC, Maier B, Morris DL, et al. Deoxyhypusine synthase promotes differentiation and proliferation of T helper type 1 (Th1) cells in autoimmune diabetes. J Biol Chem, 2013,288:36226-36235.
20Moore CC, Martin EN, Lee G, et al. Eukaryotic translation initiation factor 5A small interference RNA-liposome complexes reduce inflammation and increase survival in murine models of severe sepsis and acute lung injury. J Infect Dis,2008,198:1407-1414.
21Templin AT, Maier B, Nishiki Y, et al. Deoxyhypusine synthase haploinsufficiency attenuates acute cytokine signaling. Cell Cycle,2011,10:1043-1049.
22Hauber J. Revisiting an old acquaintance: role for eIF5A in diabetes. J Clin Invest,2010,120:1806-1808.
23Maier B, Tersey SA, Mirmira RG. Hypusine: a new target for therapeutic intervention in diabetic inflammation. Discov Med,2010,10:18-23.
(本文编辑:钱燕)
Expression and significance of DHPS,an activating factor of eIF5A,in nonalcoholic fatty liver disease
MIAOQi,BIANZhao-lian,WANGZhao-yue,PENGYan-shen,MAXiong.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai200001,China
【Abstract】ObjectiveTo investigate the expression and mechanism of deoxyhypusine synthase (DHPS), an activating factor of eIF5A, in high-fat (HF) diet-fed mice and nonalcoholic fatty liver disease (NAFLD) patients. MethodsImmunohistochemistry, western blot and real-time polymerase chain reaction (PCR) were performed to identify the DHPS expression in both HF mice and normal diet-fed (ND) mice. Hematoxylin-eosin (H&E) and oil red staining were conducted between DHPS overexpression group and green fluorescent protein (GFP) control group to compare the degree of liver steatosis and inflammation. In addition, PCR arrays were made to find potential genes related to DHPS. Immunohistochemistry and immunofluorescence were conducted to identify the expression of DHPS in NAFLD patients and HL-7702 cell line modeled with OP 2:1. ResultsHF mice highly expressed DHPS (1.80 vs 0.69, P<0.05), especially in liver (13.21 vs 1.00, P<0.01) and adipose (7.97 vs 1.00, P<0.01) tissue. Mice with overexpression DHPS endured more severe hepatic steatosis compared with mice treated with GFP (2.78 vs 2.20, P<0.05), which might be correlated with Ascbg2, Irs1, iNos and IL-6. Expression of DHPS was more common in NAFLD patients than that in normal controls (1.29 vs 0.50, P<0.05). In histology, the number of DHPS-positive cells was correlated with the degree of steatosis (r=0.5927,P=0.018). HL-7702 treated with OP 2:1 showed higher expression of DHPS. ConclusionExpression of DHPS is significantly increased in HF mice, liver tissue in patients with NAFLD and HL-7702 cell line treated with OP, which suggests an important role of DHPS in the pathogenesis of NAFLD.
【Key words】Eukaryotic translation initiation factor 5A; Deoxyhypusine synthase; Nonalcoholic fatty liver disease
(收稿日期:2015-11-25)
Corresponding author:MA Xiong,Email:maxiongmd@hotmail.com
通信作者:马雄,Email: maxiongmd@ hotmail.com
基金项目:国家自然科学基金(81200293)
