八聚体结合蛋白-4对胃癌细胞增殖和侵袭能力的影响
2016-05-23赵娟,田怡,李凡
赵 娟,田 怡,李 凡
·基础医学·
八聚体结合蛋白-4对胃癌细胞增殖和侵袭能力的影响
赵娟,田怡,李凡
[摘要]目的探讨八聚体结合蛋白-4(octamer-bindingprotein-4,Oct 4)在胃癌(gastriccarcinoma)组织及其4株细胞系(MKN-28、SGC-7901、BGC-823和GES-1)中的表达,并分析其对细胞增殖、迁移和侵袭能力的影响。方法收集20例胃癌手术患者的癌变组织和20例正常组织,通过Real time PCR(RT-PCR)和Western blot法检测Oct 4在胃癌组织及其4株细胞系中的表达水平。在干扰掉Oct 4后,采用MTT的方法检测BGC-823细胞的增殖活性,通过Transwell小室法检测BGC-832细胞的侵袭活性,利用Western blot法检测MMP-2及MMP-9的表达。结果RT-PCR检测发现Oct 4 mRNA在胃癌组织中高表达,而在正常组织中低表达,Western blot法检测发现Oct 4在BGC-832表达水平最高。下调Oct 4的表达导致BGC-823细胞增殖和侵袭活性被抑制,MMP-2及MMP-9的表达水平均降低。结论Oct 4在胃癌组织和胃癌细胞系中高表达,并且敲除Oct 4会导致胃癌细胞的增殖和侵袭活性明显减弱,降低MMP-2及MMP-9的表达水平。Oct 4在胃癌组织中的过量表达有助于胃癌的临床诊断,同时Oct 4在胃癌的恶性肿瘤生物活性中发挥着重要作用。
[关键词]八聚体结合-4;胃癌;BGC-823细胞;增殖;侵袭
胃癌是威胁人类健康常见的恶性肿瘤之一。尽管胃癌的手术、放疗、化疗和分子靶向等临床治疗方法较多,但疗效均不满意,患者5年生存率均较低,特别是在化疗方面,目前仍无标准的一线化疗方案。因此,随着研究胃癌侵袭及转移的相关分子机制的深入,寻找抗肿瘤侵袭转移的关键治疗靶点目标,从而开发出新一代抑制肿瘤侵袭转移的抑制剂,对胃癌的防治具有非常重要的临床意义。八聚体结合蛋白-4(octamer-bindingprotein-4,Oct4)主要表达于胚胎干细胞、生殖干细胞。对维持胚胎干细胞的多潜能性和自我更新能力具有极其重要的作用[1-2]。近年来有研究发现,Oct4基因表达于膀胱癌[3]、乳腺癌[4]、胰腺癌[5]、骨和软骨瘤[6]中,但在正常组织中不表达。也有研究报道,通过慢病毒载体转染并沉默特定基因在胃癌细胞的表达,可以抑制胃癌细胞的生长[7]。因此,笔者推测Oct4可能在胃癌的发生、进展、转移和预后中起着重要作用。本研究检测Oct4基因在胃癌组织和不同分化程度胃癌细胞株中的表达情况,并采用RNA干扰技术沉默Oct4基因的表达,以研究其表达水平对胃癌细胞增殖和侵袭力的影响。现报道如下。
1材料与方法
1.1标本收集
收集上海市闵行区中心医院2014年10月至2015年10月20例胃癌患者手术切除的癌组织及其对应的癌旁正常组织标本。所有患者在手术前均未接受过局部或全身治疗。所有标本取下后立刻用液氮-80 ℃冻存。本研究经上海市闵行区中心医院伦理委员会批准通过,并获得所有患者的知情同意书。
1.2细胞和主要试剂
MKN-28、SGC-7901、BGC-823分别为高、中、低分化人胃癌细胞系,GES-1为胃黏膜正常细胞。上述细胞均由本实验室保存。TRIzol试剂盒购自天根生化科技(北京)有限公司,RT-PCR试剂盒购自Fermentas,细胞蛋白RIPA裂解液及BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司,Oct siRNA(human)序列及干扰转染(siRNA)购自Qiagen公司,ECM胶、Oct3/4及GAPDH兔抗人抗体购自Sigma公司,MMP-2和MMP-9多克隆抗体购自武汉博士德生物工程有限公司,侵袭性小室购自Corning公司,荧光定量PCR的引物均由Invitrogen公司提供。
1.3方法
1.3.1细胞培养及转染上述细胞用RPMI-1640或DMEM(GIBCO-BRL)培养基培养,补充10%胎牛血清、100 U/ml青霉素以及100 mg/ml链霉素,置于37 ℃、含5% CO2的饱和湿度恒温培养箱中常规培养。每1~2 d更换新鲜培养基,当细胞融合度达到80%~90%时进行传代培养。当胃癌BGC-823细胞生长密度至70%~80%时,按照转染说明书进行转染。依据转染类型,将BGC-823细胞分为3组:Oct4 siRNA(干扰作用的siRNA转染BGC-823细胞)组、阴性siRNA组(不具有任何干扰作用的siRNA转染BGC-823细胞)、对照组(未转染任何siRNA的BGC-823细胞)。
1.3.2RT-PCR检测从标本中取100 mg肿瘤组织,剪碎后加入一定量TRIzol(Invitrogen),按常规方法提取总RNA,采用逆转录系统试剂盒(Fermentas)获取cDNA,以GAPDH为内参照进行Oct4基因的RT-PCR。根据GenBank中Oct4 cDNA序列设计引物,上游引物为5′-CGTGAAGCTGGAGAAGGAGAA ̄GCTG-3′,下游引物为5′-CCACATCGGCCTGTGTATATccCAG-3′,产物大小为140 bp。上游引物为5′-GCACCGTCAAGGCTGAGAA-3′,下游引物为5′-TGGTGAAGACGCCAGTGGA-3′,产物大小为138 bp。PCR反应条件为:预变性95 ℃ 15 s,变性95 ℃ 5 s,退火60 ℃ 30 s,45个循环。PCR结束后,95 ℃变性1 min,冷却至55 ℃,使DNA双链充分结合。从55 ℃开始到95 ℃,每次增加0.5 ℃,保持4 s,同时读取吸光度,制作溶解曲线,以目的基因与GAPDH的比值进行定量分析。每个样本重复3次。
1.3.3Western blot检测当细胞生长至接近80%汇合时,用胰酶将细胞消化成单个细胞后再收获细胞,加入蛋白裂解液RIPA(含终浓度为1 mmol的PMSF及1%的蛋白酶抑制剂),冰上裂解30 min,收集细胞,4 ℃ 12 000 r/min离心20 min(r=3.5 cm),取上清BCA测蛋白浓度,取40 μg蛋白样品,进行12% SDS-PAGE电泳,然后用15 V转印1 h至硝酸纤维素薄膜,转印结束后将膜放入封闭液中37 ℃封闭2 h;加入一抗4 ℃过夜,PBST洗膜3次后,加入二抗孵育,室温轻摇1 h,洗膜后用ECL化学发光。图像经扫描后,用图像分析软件Band Scan 5.0进行吸收度积分值分析,计算相对表达率(实验灰度值/内参灰度值)。实验重复3次。
1.3.4MTT检测细胞增殖将对数生长期的细胞接种到%孔板中,每种细胞每天设3个副孔,每孔2 000个细胞,每孔中加0.1 ml含10%胎牛血清的RPMI-1640培养液,37 ℃,5% CO2培养箱中培养6 h。向第1天检测孔中每孔加20 μl MTT,继续培养4~5 h,将细胞培养液上清弃去,每孔加入100 μl DMSO,摇床混匀约5 min。酶标仪490 nm比色(PBS缓冲液调零),连续检测5 d,绘制肿瘤细胞生长曲线。本实验独立重复3次。
1.3.5细胞迁移和侵袭实验上述细胞在转染后48 h进行Transwell实验。迁移实验中,将5×104个细胞加入上层的无血清培养基中;侵袭实验中,将1×105个细胞加入上层的无血清培养基中;下层小室为含有10%胎牛血清的培养基。孵育24 h后,用甲醇固定迁移或侵袭至下层的细胞并用0.1%的结晶紫染色,并用IX71倒置显微镜计数。实验独立重复3次。
1.4统计学处理RT-PCR、Western-blot均采用不同实验批次的标本重复3次,RT-PCR产物的量及Western-blot表达量均用内参β-actin校正,相对恢复以均数±标准差(x±s)表示;根据3次实验结果进行ANOVA统计分析。P<0.05为差异有统计学意义。
2结果
2.1Oct4在胃癌组织及不同胃癌细胞株中的表达
RT-PCR检测20例胃癌组织标本结果显示,癌组织中Oct4的表达水平高于癌旁组织(图1A);4株细胞系检测结果发现,Oct4在正常胃黏膜细胞膜细胞株GES-1不表达,胃癌细胞株MKN-28、SGC-7901、BGC-823中均表达,但是各细胞株的表达程度有所不同,分化程度越低的细胞系表达水平越高(图1B);通过Westernblot检测上述4株细胞中Oct4的表达,胃癌细胞株均表达,但是在GES-1中未发现Oct4蛋白的存在(图1C、D)。
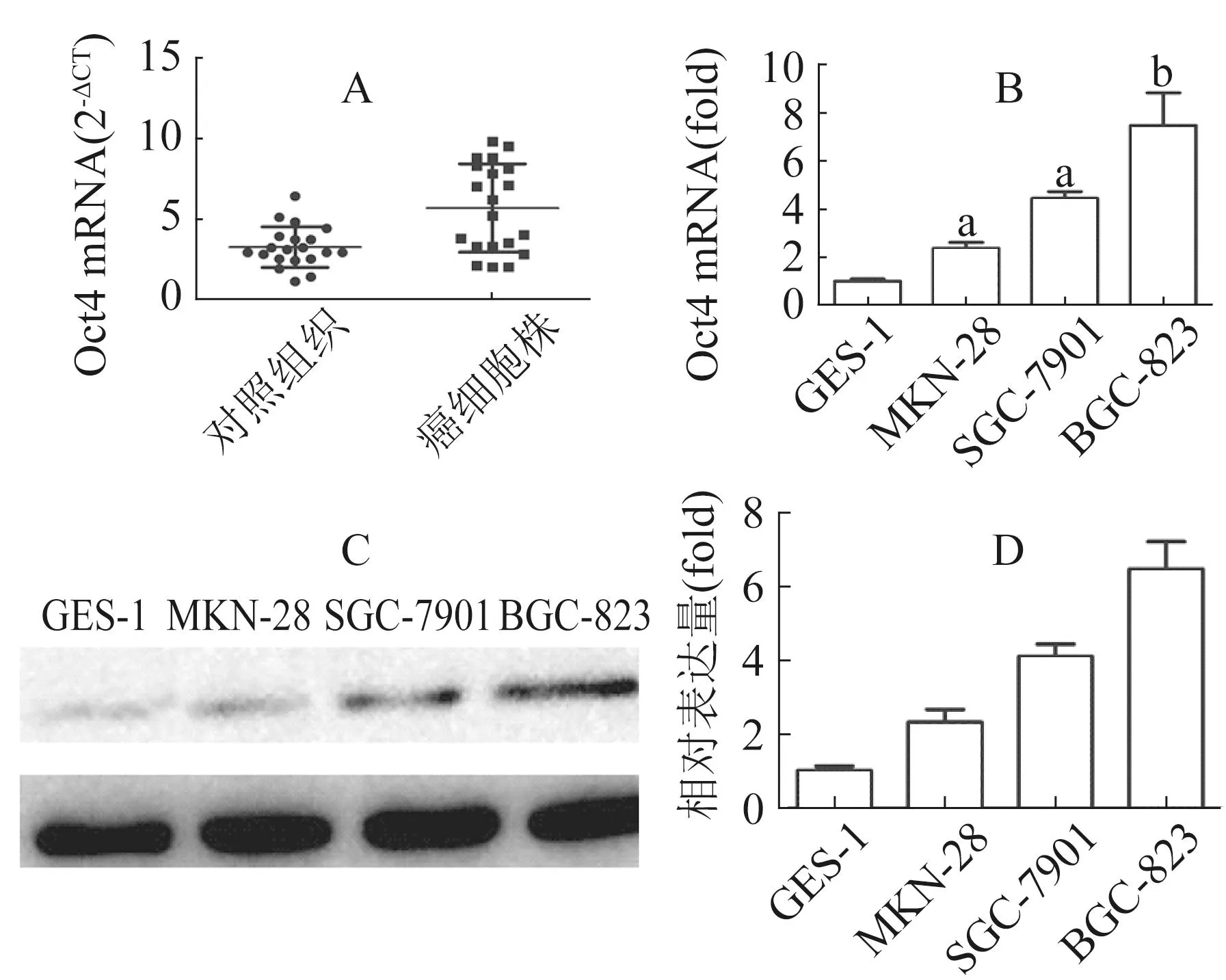
注:GSE-1、MKN-28、SGC-7901、BGC-823为胃癌细胞株。A为RT-PCR检测Oct4在肿瘤组织中的表达;B为RT-PCR检测Oct4在肿瘤细胞系中的表达;C、D为Western blot检测Oct4在肿瘤细胞系中的表达及灰度分析。与GES-1组比较aP<0.05,bP<0.01图1 Oct4在胃癌组织及不同胃癌细胞株中的表达
2.2干扰Oct4表达对胃癌细胞增殖的影响
实验结果显示, Oct4在BCG-823胃癌细胞中表达水平最高,同时,在预实验中发现50 mmol/L siRNA转染效率最佳,因此在此浓度下利用该细胞作为模型进行功能缺失性研究,RT-PCR结果显示细胞转染48 h后Oct4表达水平较对照组下降,尤其以si-Oct4-2干扰效果最为明显,差异有统计学意义(P<0.05)。见图2A。在此基础上,采用MTT增殖实验观察Oct4对细胞增殖的影响。与对照组相比,在不同观察时间点24、48、72 h Oct4表达受抑制后其细胞增殖能力显著降低,差异有统计学意义(P<0.05)。见图2B。以上结果表明,Oct4的表达对胃癌细胞的增殖具有明显的促进作用。

注:A为RT-PCR检测BGC-823 siRNA的干扰效率;B为MTT法检测BGC-823细胞增殖图2 Oct4表达下调对胃癌细胞增殖的影响
2.3干扰Oct4表达对胃癌细胞侵袭和迁移能力的影响
与GES-1比较,BGC-823胃癌细胞转移至小室下层的细胞数降低,差异有统计学意义(P<0.05),表明抑制Oct4表达引起肿瘤侵袭能力降低。见图3。
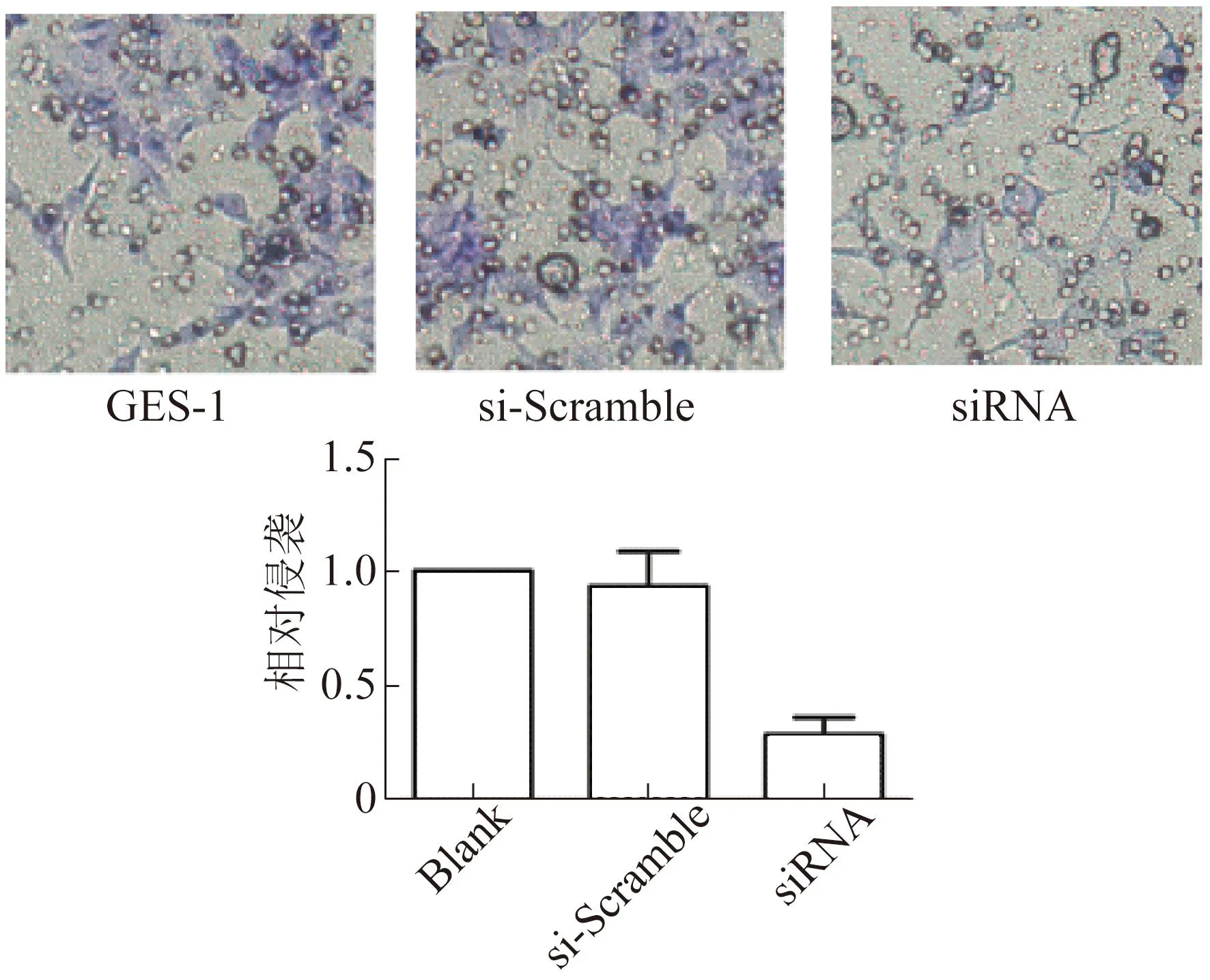
图3 Oct4表达下调对胃癌细胞手术BGC-823侵袭及迁移能力的影响电镜图
2.4干扰Oct4表达对MMP-2和MMP-9蛋白表达的影响
从图4可以看出,Western blot结果显示干扰后,MMP-2及MMP-9的表达水平均降低,差异有统计学意义(P<0.05),推测Oct4可能通过影响MMP-2和MMP-9的表达,调控胃癌细胞的迁移和侵袭。

图4 干扰Oct4表达对胃癌细胞MMP-2及MMP-9表达影响的电泳图
3讨论
肿瘤的生长、转移、复发是靠少数肿瘤干细胞不断自我更新以及繁衍来维持和促成的。而Oct4又是自我更新的关键调节因子,因此,检测Oct4在胃癌中的表达有助于理解其与胃癌的发生、发展的关系。近年来,有研究结果显示,Oct4基因在一些肿瘤细胞内高表达,如非生殖系统肿瘤细胞如胰腺癌pan-1细胞系、肝癌Mahlava细胞系、宫颈癌Hela细胞株、人乳腺癌MCF-7细胞系表达[2,8]。同样在肿瘤组织中Oct4也有表达,如人乳腺痛及骨肉瘤组织[9]等。这说明Oct4基因在肿瘤的发生中有着重要促进作用。
从本实验RT-PCR及Western blot结果显示,20例胃癌组织标本结果显示癌组织中Oct4的表达水平高于癌旁组织;4株细胞系检测结果发现,Oct4在正常胃黏膜细胞膜细胞株GES-1不表达,胃癌细胞株MKN-28、SGC-7901、BGC-823中均表达Oct4,但是各细胞株的表达程度有所不同,分化程度越低的细胞系表达水平越高。进一步对Oct4基因表达量高的低分化胃癌细胞BGC-823行siRNA转染,转染Oct4 siRNA的BCG-823细胞内Oct4 siRNA相对表达量及Oct4蛋白表达量明显下降。在细胞增殖和侵袭性实验中发现,转染Oct4 siRNA后BGC-823细胞增殖能力显著降低和细胞穿膜数量下降,表明Oct4基因表达下降导致胃癌细胞的增殖和侵袭能力下降,降低了胃癌细胞的恶性度。
同时,本研究通过Western blot技术检测到MMP-2及MMP-9的表达均明显下降。不难看出,抑制Oct4的表达对MMP-2及MMP-9的表达有显著的抑制作用。而MMP-2和MMP-9在肿瘤侵袭和转移中的作用己经被深入研究,尤其在结肠癌、直肠癌、乳腺癌和肾癌等多种肿瘤中的作用己进行了大批量的临床验证[10]。Oct4以直接或间接的方式同时下调MMP-2和MMP-9,从多个层面抑制了结肠肿瘤的进展,体现出了极高的效率。尽管这些调控过程仍需进一步探索,但Oct4无疑成了胃癌形成及发展过程中基因网状结构中非常重要的枢纽部分。
综上所述,Oct4在胃癌组织和胃癌细胞系中能高表达,敲除Oct4基因后会导致胃癌细胞的增殖和侵袭活性明显减弱,同时降低MMP-2及MMP-9的表达水平。Oct4在胃癌组织中的过量表达有助于胃癌的临床诊断,有望成为早期检测胃癌及评估患者预后的一个分子生物学指标,乃至成为药物治疗的新靶点。
[参考文献]
[1]Burdon T, Smith A, Savatier P. Signalling, cell cycle and pluripotency in embryonic stem cells[J]. Trends Cell Biol, 2002, 12(9): 432-438.
[2]Looijenga LH, Stoop H, de Leeuw HP, et al. POU5F1 (OCT3/4) identifies cells with pluripotent potential in human germ cell tumors[J]. Cancer Res, 2003, 63(9): 2244-2250.
[3]Atlasi Y, Mowla SJ, Ziaee SA, et al. OCT-4, an embryonic stem cell marker, is highly expressed in bladder cancer[J]. Int J Cancer, 2007, 120(7): 1598-1602. DOI:10.1002/ijc.22508.
[4]Ezeh UI, Turek PJ, Reijo RA, et al. Human embryonic stem cell genes OCT4, NANOG, STELLAR, and GDF3 are expressed in both seminoma and breast carcinoma[J]. Cancer, 2005, 104(10): 2255-2265. DOI:10.1002/cncr.21432.
[5]Iki K, Pour PM. Expression of Oct4, a stem cell marker, in the hamster pancreatic cancer model[J]. Pancreatology, 2006, 6(4): 406-413. DOI:10.1159/000094317.
[6]Gibbs CP, Kukekov VG, Reith JD, et al. Stem-like cells in bone sarcomas: implications for tumorigenesis[J]. Neoplasia, 2005, 7(11): 967-976.
[7]蔡世荣,王昭,陈创奇,等. 沉默PRL-3基因表达抑制胃癌生长研究[J]. 中华外科杂志, 2008, 46(8):618-621.
[8]Abate-Shen C. Homeobox genes and cancer: new OCTaves for an old tune[J]. Cancer Cell, 2003, 4(5): 329-330.
[9]Gibbs CP, Kukekov VG, Reith JD, et al. Stem-like cells in bone sarcomas: implications for tumorigenesis[J]. Neoplasia, 2005, 7(11): 967-976.
[10] Park KS, Kim SJ, Kim KH, et al. Clinical characteristics of TIMP2, MMP-2, and MMP-9 gene polymorphisms in colorectal cancer[J]. J Gastroenterol Hepatol, 2011, 26(2): 391-397. DOI:10.1111/j.1440-1746.2010.06504.
(本文编辑:王映红)
Effects of Octamer-bindingprotein-4 on the proliferation and invasion of gastric carcinoma cells
Zhao Juan, Tian Yi, Li Fan
(Department of Gastroenterology, Minhang District Central Hospital, Shanghai 201199, China)
[Abstract]ObjectiveTo investigate the expression of octamer-binding protein-4 (Oct 4) in the tissue of gastric carcinoma and 4 strains of cell line (MKN-28, SGC-7901, BGC-823 and GES-1), and to analyze the effects of the substance on the proliferation, migration and invasion of cells.Methods The canceration tissues of gastric carcinoma in 20 surgical patients and the normal tissues of 20 non-carcinoma patients were collected for the study. The expression levels of Oct 4 in the tissues of gastric carcinoma and 4 strains of cell line were detected by real time PCR and Western Blot. Following depletion of Oct 4, the proliferation activity of BGC-823 cells was detected by MTT assay, and the invasion of BGC-832 cells was detected by Transwell assay. Western Blot was further used to determine the expression levels of MMP-2 and MMP-9.ResultsReal time PCR revealed that there was a high expression level of Oct 4 mRNA in the tissue of gastric carcinoma, while low expression level was detected in the normal tissue. Western Blotting indicated that its expression level was the highest in BGC-832 cells. However, the down-regulation of Oct 4 would result in the reduction of proliferation and invasion activity, and the expression levels of MMP-2 and MMP-9 would be decreased.ConclusionThe elevated Oct 4 expression in the gastric carcinoma tissue and cells and Oct 4 gene knock-out would induce significant decrease in the proliferation of gastric carcinoma cells and cell invasion activity, and decrease the expression levels of MMP-2 and MMP-9. The over-expression of Oct 4 in the gastric carcinoma tissue would facilitate clinical diagnosis of the disorder, and it seemed that Oct 4 played an important role in the regulation of gastric carcinoma biological activity.
[Key words]Oct 4; Gastric carcinoma; BGC-823 cell; Proliferation; Invasion
(收稿日期:2015-10-19)
[中图分类号]R735.2
[文献标识码]A[DOI]10.3969/j.issn.1009-0754.2016.02.006
[通信作者]李凡,电子信箱:syrile@126.com
·论著·
[作者单位]201199上海,上海市闵行区中心医院消化内科
