色彩成因分类浅析
2016-05-23杨红英杨志晖姜鹏飞丁世印张三亮
杨红英, 杨志晖, 张 戈,3, 姜鹏飞, 丁世印, 张三亮, 潘 宁
(1.中原工学院; 2.河南省纺织服装产业协同创新中心, 郑州 450007;3.江南大学 纺织服装学院, 江苏 无锡 214122; 4.美国加州大学戴维斯分校, CA 95616, 美国)
色彩成因分类浅析
杨红英1,2, 杨志晖1, 张戈1,3, 姜鹏飞1, 丁世印1, 张三亮4, 潘宁4
(1.中原工学院; 2.河南省纺织服装产业协同创新中心, 郑州 450007;3.江南大学 纺织服装学院, 江苏 无锡 214122; 4.美国加州大学戴维斯分校, CA 95616, 美国)
摘要:基于色彩成因的本质和机理,尝试对色彩成因进行重新分类和命名,按照逐层划分归总出的4大类(其他能转化成光能生色、几何和物理光学效应生色、振动和转动吸光生色、电子跃迁吸光生色)对色彩成因分别进行了阐述,对机理进行了通俗化描述,以便初学者和非专业人士理解、掌握和借鉴。
关键词:色彩;成因;机理;分类
人们生活在五颜六色、七彩缤纷的世界中,时刻感受到色彩带来的美感和喜悦。大自然是人类研究的对象,科学家不断探索自然界中各种色彩的形成原因和机理,并“仿造”出许多色彩。Nassau K和Shevell S K等根据前人的研究成果,系统地总结了颜色的15种起源,将其分成5大类,并进行了详细的介绍[1-2]。但是,想要全面了解色彩成因并非易事,因为它涉及到物理、化学方面的诸多原理和理论。对于初学者和非专业人士而言,Nassau K总结的色彩成因系统稍显庞大,对色彩成因的分类和命名不易理解。本文根据色彩形成的本质和机理,尝试对色彩成因进行重新归纳分类。本着易于理解的原则,尝试给色彩成因一个更易理解的名称,并简化对深奥机理的描述。
1色彩成因的分类
色彩是光源或物体反射或物体透射的可见光进入眼睛通过视觉和神经系统在大脑中形成的色知觉。不同可见光光谱组成给人以不同的色彩感受,不同的人、不同的生物体对可见光光谱的色彩感知也存在差异。为简化描述,本文只讨论进入人眼视觉系统的可见光,而不考虑视觉系统的影响,即仅依据380~780 nm可见光的光谱组成来解释色彩的成因和变化。Nassau K归纳的5大类色彩成因是:振动和简单激发、配位场效应、分子轨道效应、能带效应及几何和物理光学效应。本文尝试从色彩成因的本质和机理出发,对其进行逐层划分重新分类。
人类能感知的色彩可分为两大类,即光源色和物体色。光源色是由其他形式的能量转化成的光能,物体色源自于物体与光相互作用的结果。物体与光相互作用的方式很多,这里依据物体对光有无吸收分为有光吸收的物体吸光生色和无光吸收的几何和物理光学效应生色。光吸收生色机理又可分为两类:一类是振动和转动吸光生色,一类是电子跃迁吸光生色。众所周知,一般物质中原子基团的热振动和转动吸光通常发生在低能量的红外线(IR)区域,而电子跃迁通常需要吸收高能量的紫外线(UV)。但是,如果某些物质的振动和转动蓝移(向短波方向移动)到可见光(VIS)区域,或者电子跃迁吸光红移(向长波方向移动)到VIS区域,则可因吸收VIS而使物质呈现色彩。根据以上分析,色彩成因可以逐层划分归总为4大类,即:其他能转化成光能生色、几何和物理光学效应生色、振动和转动吸光生色、电子跃迁吸光生色。如图1所示。
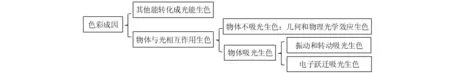
图1 色彩成因分类
关于“几何和物理光学效应生色”这一分类,本文与Nassau K总结的色彩成因分类的观点相同;本文的“电子跃迁吸光生色”这一类包含了Nassau K的“配位场效应”“分子轨道效应”和“能带效应”;将Nassau K的“振动和简单激发”分成两大类,因为振动是物体吸光生色,而简单激发是能量转化生色,二者存在本质的区别;另外,本文对各大类色彩成因中小类的划分和排序也与Nassau K的略有不同。
需要说明的是,随着科技的发展,色彩成因早已超过Nassau K总结的5大类(共15种),如发光二极管LED灯的色彩成因不在Nassau K总结的15种之列。限于篇幅,本文不能介绍所有种类的色彩成因和机理,仅先尝试按4大类对色彩成因进行描述。
2色彩成因的分类描述
2.1其他能转化成光能生色
很多种类的能可以转化成光能而发出色光。例如,耐热物体加热后因伴随热振动的热辐射释放一定量的光子而使物体呈色,气态物体因电子受激到高能态后以光子形式释放多余能量而发出色光,等等。这两种机理有时同时发生,如蜡烛的火焰既包含白炽生色,又包含气体激发生色。此外, LED灯是将电能转化成光能而发光的,半导体通电后,电子和空穴复合的能量以光子形式释放,从而发出色光。
2.1.1白炽生色(白炽物体热振动发射光子生色)
耐热物体被连续加热至高温,会出现从黑、红、橙、黄白到蓝白的连续的颜色变化,人们平时所说的红热、白热就是对物体持续加热呈现出的一部分颜色。无论温度多高,蓝白光是可以看到的“最热”的光。图2给出了对黑体加热后其颜色色度的连续变化轨迹。物体加热生色的原因是,当物体被加热时,其电子、原子和分子的一部分热振动能量以辐射形式发射,释放出一定量的光子。白炽热物体温度不同,释放出来的光子频率也不同,因而呈现出不同的颜色。热能的补充形式可以是电能(如白炽灯),也可以是化学能(如蜡烛、烟花和燃气炉)。工业中应用的辐射高温计也是利用这一原理。
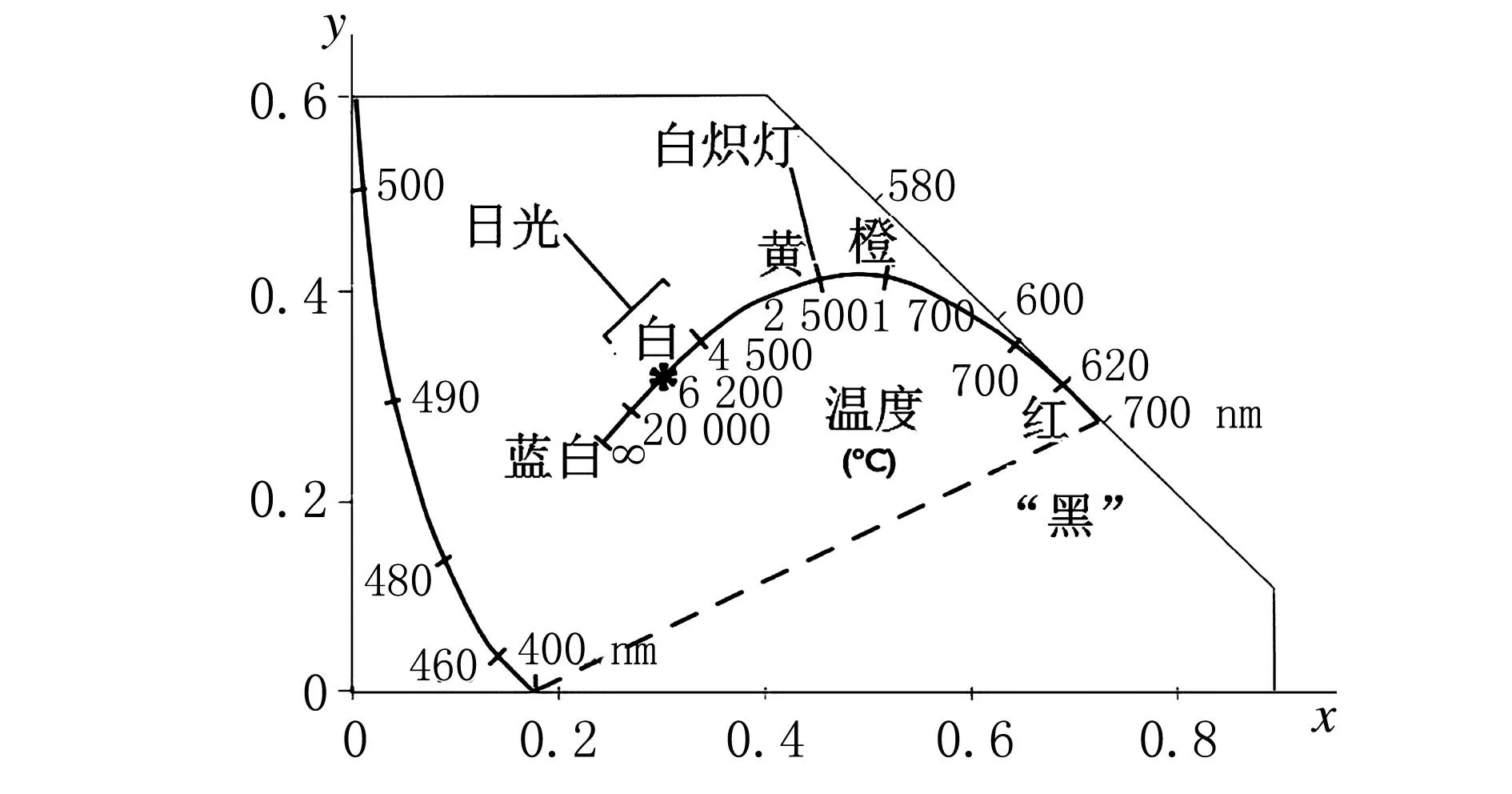
图2 黑体加热后的色度变化轨迹
2.1.2气体电子激发生色
当特定的化学元素以蒸气或气体的形式存在时,气体受激发会使电子激发到一个高能态,当多余能量被以光子的形式释放出来时,便形成色光,呈现一定的色彩。气体激发可以用电激发、化学激发和高能粒子激发等。电激发生色有电弧、火花、闪电、黄色的钠蒸气灯、蓝色的汞蒸气灯和多彩的霓虹灯等;化学激发生色有钠、钾、铜以及其他的一些化学元素的焰色实验;高能粒子激发生色有北极光和南极光等。
2.2几何和物理光学效应生色
基于几何和物理光学效应生色的基本机理有4种:色散生色、散射生色、干涉生色和衍射生色。这4种生色机理有时可能协同作用,如衍射干涉生色、双折射材料的色散干涉生色等。
2.2.1色散生色
1666年,牛顿利用三棱镜将一束日光分散成许多不同颜色的色光,呈现出红、橙、黄、绿、青、蓝、紫的连续彩色光谱,此即典型的色散生色现象。由于介质的折射率随波长不同而变化,在非光吸收波段,一般波长越小,折射率越大,波长越大,折射率越小。因此,当白光通过棱镜时,不同颜色的光因折射角不同而被色散分开,从而呈现连续的色光。
雨后的彩虹,是太阳光沿着一定角度射入空气中的水滴所引起的一种比较复杂的由折射和反射形成的色散现象,一般包括两次折射和不同次数的反射。当太阳光在水珠中只发生一次反射时,形成的彩带叫虹,是最常被看到的;当太阳光在水珠中发生两次反射时,形成的彩带叫霓,比虹暗,不太容易被看到;太阳光在水珠中经过3次、4次反射,也可以形成第三虹、第四虹,但它们的色彩更暗淡,一般很难看到。
2.2.2散射生色
散射是由传播介质的不均匀性引起的光线向四周射去的现象。太阳辐射通过大气遇到空气分子、尘粒、云滴等质点时,都要发生散射。散射质点越小,其对波长越敏感,分子对短波长的光散射得最多。因此,雨后天晴,天空呈现蓝色,就是因为太阳辐射中蓝光波长较短,更容易被大气分子散射的缘故。如果空气中存在较多的尘埃或雾粒,一定范围的长、短波都被同样地散射,则天空呈灰白色。
一些壮观的大气景象均源于散射生色,如蔚蓝的天空、橙红的落日、白色的云朵、罕见的蓝色月亮,等等。很多鸟类的羽毛呈现蓝、绿色也牵涉到散射,一些植物的蓝色也是如此。同样的散射现象还出现在蓝色的眼睛中。浅肤色的人的粉红肤色同样来源于表皮下方与红血管相关的皮肤的散射。
2.2.3干涉生色
同样波长的两束光在适当的环境下以两种不同的方式相互影响,即叠加增强或者相互减弱,此即干涉生色的原因。例如,当一束光照射在薄膜上,由于折射率不同,光波会被薄膜的上界面和下界面分别反射,这两束光因相互干涉而形成新的光波,呈现彩色的干涉条纹。薄膜通常由厚度很小的透明介质组成,如肥皂泡膜、水面上的油膜、两片玻璃间所夹的空气膜、照相机镜头上所镀的介质膜等。
一些生物拥有类似于这种薄膜的多层结构,不含任何色素,却能呈现亮丽的色彩。如著名的南美洲尖翅蓝闪蝶(Morpho rhetenor),其雄蝶具有闪亮的金属般的蓝色光泽、绿白色光泽和橙褐色光泽,这是一种典型的结构生色,且其金属般的光泽是一般色料所无法呈现的[3]。珍珠的彩光也是源于其多层结构对光的干涉。
2.2.4衍射生色
光在传播路径中,遇到不透明或透明的障碍物或者小孔(窄缝),绕过障碍物产生偏离直线传播的现象称为光的衍射。衍射时产生明暗条纹或光环,即衍射图样。光的衍射效应最早是由意大利科学家弗朗西斯科·格里马第(Francesco Grimaldi)于1665年发现并给予描述的。他用小口百叶窗研究小物体的影子,就像牛顿几年后获得光谱那样。他观察到影子无法依靠几何光学解释,同时显现出颜色条纹,不仅在外面,甚至一定条件下在影子的内部。当阳光通过一个大开口的百叶窗时,光透射后落在一个屏幕上,随着开口变小,屏幕上光的斑点也变小,边缘变得清晰,然而,超过一定点后,边缘开始变得模糊,同时出现颜色条纹。
地球的大气层是由微小粒子组成的,它也能够使空间光源(例如太阳或者月亮)的光在大气层发生衍射,从而形成光环。此外,当激光照射到粗糙的光学界面上时,也能够发生衍射现象,产生散斑。现代分光光度仪上的衍射光栅则是利用衍射原理将白光分成单色光的最典型的应用。
2.3振动和转动吸光生色
原子之间振动通常吸收能量较低的IR,不涉及可见光,与色彩无关。但若其振动频率提高、吸收更高能量的VIS时,便会伴随色彩的呈现。如同乐器中增加弦的张力可提高音频一样,当原子质量很小、原子间键能很强时,原子的振动频率则很高,吸收的能量也相应很高。当其光吸收对应VIS时,便产生振动生色。水在冰川及大海、湖泊中呈现蓝色便源于此。
水和冰中的共价键、氢键都是很强的键,氢又是最轻的元素,因此当存在大量水分子时,分子之间相邻原子间的大量氢键结合可显著增加振动所需能量,从而导致对光的吸收蓝移到VIS末端,即对长波长的红光产生微弱吸收,从而使大量的水和冰呈现出它们的补色,即蓝色。这种现象在热带白沙滩和冰川洞穴中比较容易看到。水和冰的量越大,蓝色就越明显,如游泳池、湖泊、大海等。而在一些湖泊中看到的绿色,则通常源于水中藻类的颜色。
当分子吸光引起振动能级改变时, 不可避免地要伴随转动的发生。两个原子之间化学键的振动也是卤素呈现颜色的根源。对于成键情况类似的物体,键长与键能成反比。键能较大的氯分子吸收高能量的蓝紫色光,呈现黄绿色;键能稍小的溴分子吸收蓝绿色光,分子状的溴蒸气表现为淡红棕色。碘的原子量大,碘分子的键能比氯、溴分子低,化学键的振动相对更弱些,对光谱中能量低些的红外、红色、橙色一直到绿色都有很强的吸收,产生碘分子特征的紫色。当碘升华为碘蒸气时,紫色非常明显[4]。
2.4电子跃迁吸光生色
电子跃迁通常需要吸收能量稍高的UV,但是特
殊的物质结构可减弱原子对电子的束缚,使电子跃迁吸光红移到VIS,从而使物质呈现一定的色彩。
2.4.1能带中的电子跃迁生色
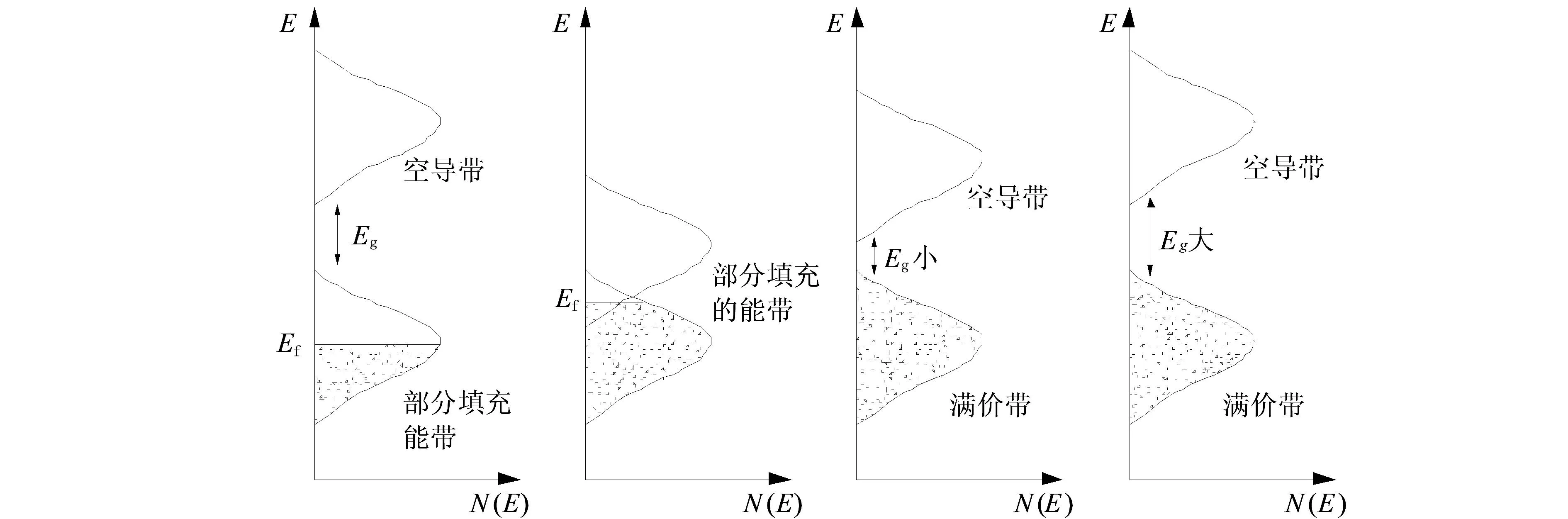
金属和合金、半导体和绝缘体、含杂半导体和绝缘体的色彩都可以用能带中的电子跃迁给予解释。能带理论是讨论金属、绝缘体和半导体中电子的状态及其运动的一种重要的近似理论,能够比较全面地解释这些材料的主要特性,包括它们的颜色。这些材料中众多原子相邻的轨道发生一定程度的重叠,因而形成能带。能带有充满电子的满带、部分填充电子的导带和完全没有电子的空带,能带间不能填充电子的区域叫禁带或带隙,能级最高的有电子填充的能带叫价带。金属、半导体和绝缘体具有不同的能带结构,因而呈现不同的性能和色彩。图3给出了这3类材料的能带结构,其中空白区域无电子填充;灰色区域代表电子填充;Ef为费米能级(电子占据的最高能级)。金属最小带隙为0,半导体和绝缘体都有能隙,且后者大于前者。
(a)金属 (b)金属 (c)半导体 (d)绝缘体图3 金属、半导体、绝缘体材料的能带结构示意图
2.4.1.1金属中的电子跃迁生色
在金属能带结构中,价带中的电子不再属于某个原子,而是属于整块金属,因此它们具有更高的自由度,对金属的性质具有重要影响。当光线照射到金属上,费米能级Ef以下的价电子吸收光子能量激发到能带中更高能量水平的空位,形成电子-空穴对。金属对光的吸收非常强,致使光子只能渗透到金属表面几百个电子的深度,典型的渗透深度不到一个波长。由于金属导电,它吸收的光(电磁波)会在其表面诱导出交变电流,根据电磁理论,这些电流又会立刻从金属表面再发射出光,从而在金属表面呈现很亮的强反射。在此过程中,如果金属对所有波长的可见光具有相同的吸收和发射效率,即白光中的不同波长能被平均反射,则呈现银白色光泽,就像表面光滑的银、铬等呈现的银白色光泽一样。如果在某波段的发射小于吸收,金属则会呈现一定的颜色,比如黄金由于对高能量的蓝光的再发射效率较低,因而呈现出黄色。
2.4.1.2半导体的电子跃迁生色
半导体和绝缘体都有一个完全充满的价带和完全空虚的导带,两者之间存在带隙,带隙宽度决定了材料的导电、导热等性能,同时也决定了其颜色。一般半导体的带隙为0.1~3 eV,绝缘体的带隙为3~6 eV。
图4所示为半导体和绝缘体材料的态密度图。由于在价带与导带之间的带隙中没有电子能级,因而所能吸收的最低能量的光对应于箭号A,即对应从价带的顶部能级向上跃迁到导带底部的能级,其光能量相当于带隙Eg。较高能量的光也能被吸收,如箭号B和C所示。

图4 半导体和绝缘体材料的态密度图和光吸收与颜色随能隙大小变化的情况
中等能隙的半导体材料,如颜料铬黄,其带隙为2.6 eV,这使它能吸收紫色和一些蓝色而不能吸收别的色光,因此显示为黄色。半导体的颜色可根据其能隙宽度从颜色尺度(图4右方)中导出来。能隙再小一些的材料可以吸收紫、蓝及绿色,从而呈现橙色;更小能隙的材料(如颜料朱砂为2.0 eV),除红色以外,吸收了所有的光,因而呈现红色。当带隙小于1.77 eV(700 nm)时,所有的可见光均可被吸收,因此窄能隙的半导体呈黑色,如表1中最后3种材料。

表1 一些半导体材料的带隙能和颜色
绝缘体的能隙大于3 eV,如金刚石的能隙为5.4 eV,在可见光中没有光能被吸收,因此其纯物质没有色彩。这种绝缘体材料往往被看作是共价键材料,它们的束缚电子只在极高的温度下做自由运动。
2.4.1.3含杂半导体/绝缘体的电子跃迁生色
绝缘体和部分半导体材料由于带隙较宽而无法吸收VIS呈现色彩,但是若在其中掺杂百万分之几的杂质,则可呈现一定的色彩。例如,能隙为5.4 eV的金刚石无色,掺杂百万分之几的氮或者硼元素后,其形状和能带结构不发生明显变化,但在带隙中能形成一个杂质能级。由于这个杂质能级的存在,使得VIS可以被吸收而激发电子跃迁。
金刚石掺杂氮,其多余的电子可在带隙中形成氮施主杂质能级,如图5所示,氮施主的电子从杂质能级跃迁到导带,只需2.2 eV的光能。因此,纯金刚石是无色的,掺杂百万分之几的氮后,能量大于2.2 eV的任何光量子都能把多余的电子激发到导带中去,即产生对蓝光与紫光的吸收现象,从而使含氮的金刚石呈现黄色。当氮在金刚石中的含量达到千分之一时,还可使金刚石呈现稀有的绿色。掺杂硼的金刚石在其带隙中形成受主杂质能级,如图6所示,该硼受主(空穴)
与导带间的能级仅为0.4 eV,很低能量的长波长的VIS都能使电子从价带中跃迁入空穴。当进入空穴的电子形成的增宽能带与导带间的能级差小于2.5 eV时,产生美丽的蓝色透射光。每百万个碳原子中含有1个或几个硼原子,由此发生的跃迁产生诱人的蓝色,这种天然蓝色的金刚石是很稀有的。

图5 金刚石掺杂氮的态密度图 图6 金刚石掺杂硼的态密度图
2.4.2配位场中的电子跃迁生色
对于大多数无机物,要激发配对电子,需要较高的能量,因此电子的光吸收通常发生在UV区域,如离子化合物食盐由于不能吸收VIS而无色。配位健则不同,它们由一方提供孤对电子、一方提供空轨道,其键能比由键联双方均提供电子的普通共价键和由一方提供电子一方提供轨道的离子键都要弱,因此配位场中电子跃迁的光吸收可红移到VIS,此即配位场中电子跃迁使物质呈现色彩的机理。
2.4.2.1过渡金属配位化合物的电子跃迁生色
过渡金属比较容易形成配位化合物,如d轨道过渡元素铬、铁、钴、镍和铜的盐,4f轨道的镧系元素铈、钕的盐,5f轨道的锕系元素铀的盐等,这些配位化合物的电子跃迁吸收VIS,使它们呈现一定的色彩。很多矿物质和颜料的颜色即源于此,如绿色染料Cr2O(OH)4、孔雀绿Cu2(CO3)(OH)2、蓝色玻璃K2CoSi3O8、粉红色菱锰矿MnCO3、褐色水锰矿MnO(OH)、红色铁矿Fe2O3、黄色针铁矿FeO(OH)、绿镍矿NiO和斜硅铜矿Cu5(SiO3)4(OH)2,等等。
2.4.2.2无色材料掺杂过渡金属的电子跃迁生色
一些无色材料,添加少量过渡金属杂质(大约1%含量),即可呈现一定的色彩。一些矿物、宝石、陶瓷、玻璃、釉料和搪瓷的色彩即源于此,即材料中的过渡金属杂质所形成的配位体中的电子跃迁,使材料呈现一定色彩。例如,由纯氧化铝(Al2O3)所组成的刚玉是一种外表不吸引人的材料(无色宝石),当它含1%或稍多一点儿的Cr2O3时,便可呈现美丽的红色,被称为红宝石。
对配位化合物施加温度、压力,相当于改变了配位键的强度,因此其颜色会发生相应的变化。此外,由无色材料掺杂过渡金属形成的化合物的颜色要弱于相应的过渡金属化合物的颜色,这从配位场中电子跃迁生色机理的角度考虑就非常容易理解。
2.4.3分子轨道中的电子跃迁生色
人类发现很多源于分子轨道理论的染料和颜料,基于其呈色机理研发出很多人工着色剂。涉及分子轨道中电子跃迁的着色剂的色彩起因主要有两种:一种涉及有机分子中多个原子中的电子,另一种涉及多原子系统之间的电荷转移。
2.4.3.1有机化合物中的电子跃迁生色
虽然用能带理论能解释金属、半导体和绝缘体的颜色,用配位场能够解释过渡金属配位化合物的颜色,但仍需要分子轨道理论来说明有机分子的色彩成因。
有机化合物中电子对光的吸收通常发生在UV区域,如设法使其红移到VIS,则可藉由吸收VIS而使其呈现一定的色彩。共轭双键结构(单键、双键交替排列)分子轨道中的π电子属于整个链或环系统所共有,因而原子对π电子的束缚减弱。当这种共轭系统足够大时,π电子的受激状态就像过渡金属化合物的配位电子一样,可以吸收和发射VIS。例如苯环和线性的六碳烯的光吸收发生在UV区,当增长碳链到十碳烯,则可以吸收VIS的紫端而呈现黄色。
非环多烯、苯环系统和非苯环系统这3类有机着色剂都是共轭双键结构,足以使光吸收红移到VIS。对于非环多烯CH3(-CH=CH)n-CH,红移随着n的增加而增加,在7~8之间,光吸收红移到VIS区域,其结果是,n=8的2,4,6,8癸四烯的光吸收发生在VIS的紫端,故而呈现黄色。类胡萝卜素是典型的非环形的共轭多烯着色剂,其中β胡萝卜素是胡萝卜及其他植物的主要橙色成分。植物中的叶绿素和血液中的血红素均为环状的非苯环系统的多烯的卟啉类。而水晶紫则是一种多苯环着色剂。
前述振动和转动生色机理是通过提高振动频率使光吸收从IR蓝移到VIS,这里则相反,需要降低振动频率以使光吸收从UV红移到VIS,使能量低于UV的VIS激发其电子跃迁,从而呈现一定的色彩。
降低振动频率使有机物光吸收发生红移的方法有多种,除了上述增加多烯的链长之外,还有增加电子施主原子团,向共轭系统中推动电子,如-NH2;增加电子受主原子团,从共轭系统中向外拉电子,如-NO2;共振结构,可使化合物的光吸收发生更大的红移。
图7是两种典型染料的结构图.图7(a)为苯环上同时增加了电子施主和电子受主原子团的硝基苯二胺染料,其光吸收红移到VIS。若以-NHR和(或)-NR原子团来取代-NH2原子团,则可出现一系列附加的红移。这些化合物分子很小,很容易渗透到头发里,可为染发剂提供多种颜色。图7(b) 为共振结构的紫色还原染料蒽酮紫(紫极)。
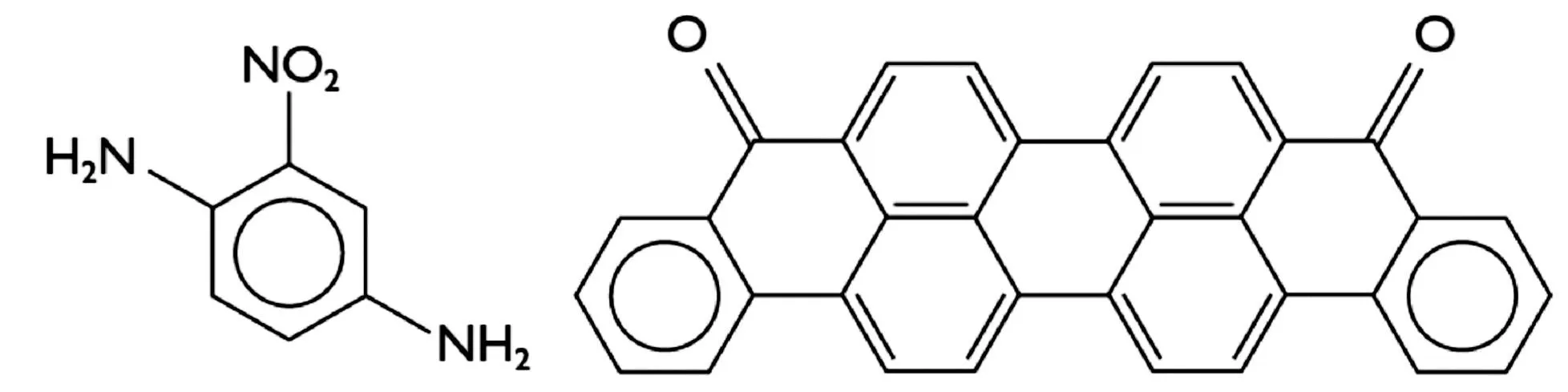
(a) 硝基苯二胺 (b) 蒽酮紫 图7 两种典型染料的结构
有机物分子轨道中的电子跃迁生色广泛存在于动物和植物中,如萤火虫、叶绿素等,同时也广泛应用于合成染料和颜料。同配位场效应一样,分子轨道电子跃迁吸收的一些能量也可以以荧光的形式再次被发射,因此可用于染料激光器中。
有机色素分子的共轭系统若被破坏,则发生褪色,例如太阳和其他光源中的紫外线、漂白剂和消毒剂中的氧化剂等都可能将共轭系统中的双键变成单键,导致褪色,这也是博物馆采用的照明中屏蔽紫外线的原因。
2.4.3.2电荷转移生色
纯Al2O3刚玉晶体是无色的,包含万分之几的钛的刚玉也是无色的,但如果包含同样含量的铁,则呈现浅黄色,当钛和铁这两种杂质同时存在,又可呈现华丽的深蓝色。此呈色机理是价间电荷转移(也叫协同电荷转移或电子跳跃),即通过吸收光能,电子从一种过渡金属离子转移到另一种离子中,导致两种离子价态的暂时变化。刚玉中相邻的两个Al3+被Fe2+和Ti4+所占据,电子从Fe转移到Ti,两个离子的价态都发生了改变,即(Fe2+)A +(Ti4+)B→(Fe3+)A+(Ti3+)B。此电荷转移的过程需要2.1 eV能量,此能量对应光谱中黄色区域一个中等波长的光子,结果呈现其互补色蓝色,此即蓝宝石的呈色机理。许多深蓝色、棕色或黑色宝石与矿物着色剂也来自于Fe2+-Ti4+组合的电荷转移[5]。
许多过渡金属氧化物的矿石,如氧化铁磁铁矿Fe3O4呈现黑色或暗色,也源于价间电荷转移,其反应式为(Fe2+)A+(Fe3+)B→(Fe3+)A+(Fe2+)B。许多颜料(如普鲁士蓝)也是原子价之间电荷转移的例子,它们大多数是棕色与黑色的含铁的岩石与矿物。起源于这种原子价之间的电荷转移的颜色通常是棕色、深蓝色或黑色,它包括两种可变价的过渡金属离子之间的一个电子的转移。
其他类型的电荷转移,如金属-配位体(阳离子-阴离子)、阴离子-阴离子、施主-受主之间的电荷转移也可使物质显色,铬酸盐、高锰酸盐、天青石以及石墨等的颜色便源于此。配位体到金属的电荷转移生色使铬酸钾(K2CrO4)呈黄色,重铬酸钾(K2Cr2O7)呈橙色,高锰酸钾呈深紫红色。天青石是阴离子-阴离子电荷转移的例子,它是深紫蓝色矿物金青石的宝石形式。施主-受主染料具有施主和受主原子团,它们联结在相同的共轭系统上,也可看作电荷转移的例子,电子从施主团经由共轭系统传递到受主团。
电荷转移产生很强的吸收,因此,电荷转移呈色机理成就了很多着色剂。
2.4.4色心呈色
一些造成晶体缺陷的电子、空穴和杂质受辐射后,可使晶体呈现颜色,被称为色心(又叫F心,来自于德语表示颜色的词Farbe)。色心是蓝紫宝石和茶、黄、橙、棕、蓝色水晶颜色形成的原因。许多天然和人工的玻璃材料,都可以被照射形成色心,呈现不同的色彩。大部分色心产生的颜色都是比较稳定的,但受热后可能会失去颜色。部分色心是不稳定的,日晒即会褪色,一部分甚至避光存放也会褪色。有一种可以室外变暗室内褪色的自动变色墨镜即是利用色心的这种性能制作的,该太阳镜在室外时受阳光中UV照射变暗起保护眼睛的作用,到室内不再有紫外线照射时,室温即可使色心褪色,因此镜片又变回到原来的无色透亮状态。
色心形成的机理非常复杂,有多种不同的解释,有用能带理论解释的,也有用配位场效应解释的,Nassau K将其列入能带效应一类。由于在已知的许多色心中,只有少数得到充分细致研究而确定出它们的确切结构,在某些情况中,意见也并不一致。还有一些色心,多年来经历了几次不同的解释。鉴于此,本文暂且将色心呈色机理在电子跃迁大类中单独列出。
3结语
色彩的成因及其机理非常复杂,人类一直在探索。在有限的空间中,用严谨的科学来学习和解释几乎是不可能的。分类和命名是人类认识事物的一种方法,好的分类和命名可以提高初学者认识事物的效率和效果。本文对色彩成因的15种方法进行了重新分类、排序和命名,以帮助初学者、非专业人士和色彩爱好者快速认识色彩成因,欣赏色彩的奥妙和美丽。
当然,色彩成因的分类可以有多种不同的方法。本文的尝试可较好地帮助人们认识色彩的成因,帮助人们进行教学和研究,也希望能对色彩爱好者有所帮助。
4致谢
本研究受到国家自然科学基金(61440064)、河南省功能性纺织面料重点学科开放实验室和河南省外专局的资助。本文引用了Nassau K等专家对色彩成因的很多示例和解释,限于篇幅不能全部列出,在此一并致谢!
参考文献:
[1]Nassau K. The Physics and Chemistry of Color[M]. Canada: John Wiley & Sons, 2001.
[2]Shevell S K. The science of color[M]. Washington: Optical Society of America, 2003.
[3]宋心远. 结构生色和染整加工(一)[J]. 印染, 2005(17): 46-48.
[4]金增瑗. 色彩与物质的微观结构[J]. 大学化学, 2006(1): 63-69.
[5]吴瑞华 刘琼林. Fe3+在蓝宝石中作用的研究[J].长春科技大学学报, 2000 (1): 38-41.
(责任编辑:姜海芹)
Introduction of Color Causes Based on a New Classification
YANG Hong-ying1,2, YANG Zhi-hui1, ZHANG Ge1,3,JIANG Peng-fei1, DING Shi-yin1, ZHANG San-liang4, PAN Ning4
(1.Zhongyuan University of Technology;2. Collaborative Innovation Center of Textile and Garment Industry, Zhengzhou 450007;3. Jiangnan University, Wuxi 214122, China;4. University of California, Davis, CA 95616, USA)
Abstract:This paper proposes a new classification of color causes based on their essence and mechanism, and then simplifies the description of color causes according to the new classification for the understanding and utilization of the beginners and non-professionals of color.
Key words:color; cause; mechanism; classification
中图分类号:O436;TS190
文献标志码:A
DOI:10.3969/j.issn.1671-6906.2016.01.001
文章编号:1671-6906(2016)01-0001-08
作者简介:杨红英(1970-),女,河南安阳人,教授,博士,主要研究方向为纤维材料光学性能、纺织色彩学。
基金项目:国家自然科学基金项目(61440064)
收稿日期:2015-12-15
杨红英:博士,教授,中原工学院青年拔尖人才,中原工学院纺织学院副院长,河南省青年骨干教师,河南省教育厅学术技术带头人。研究方向主要有纺织材料光学性能与模型、纺织色彩学与计算机配色、现代纺织技术与经纱可织性、新型纺织材料等。2014年荣获“纺织之光”教师奖。目前主持国家自然科学基金项目1项、教育部留学回国人员科研启动基金项目1项、河南省外专局高层次人才培养国际合作项目1项、河南省重点学科开放实验室研究基金项目1项。发表论文30余篇,被SCI、EI收录10余篇,其中“Studying the Mechanism of Titanium Dioxide as Ultraviolet-blocking Additives for Films and Fabrics by an Improved Scheme”被引用187次。参编出版教材专著10余部,其中5部为国家级规划教材,1部获国家精品教材奖。
