舒洛地特与粘多糖类物质的关系
2016-05-21炜中国医学科学院北京协和医学院北京协和医院血管外科北京100730
蒋 超 叶 炜中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
舒洛地特与粘多糖类物质的关系
蒋 超 叶 炜*
中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
前言:舒洛地特(SDX)是葡糖胺葡聚糖(GAG)类物质。这类物质具有粘性,因此也被称为粘多糖。GAG是一大类发现于哺乳动物组织中的带负电荷的多聚碳水化合物,在很多生命活动中都具有重要的作用。其能够调控一系列蛋白在生理和病理情况下的活动,包括趋化因子、细胞因子、生长因子、酶、构型素和粘附分子等[1]。GAGs还能够通过介导细胞-细胞或细胞-间质的相互作用,在多细胞器官的发育和维持正常功能方面发挥着不可或缺的作用[2]。
GAG是很长的线性分子,经常被硫酸化,形成带负电荷的多糖,分子量为1000~2000 kDa。其由糖醛酸(D-葡糖醛酸、GlcA或L-艾杜糖醛酸、IdoA)和乙酰氨基糖(N-乙酰半乳糖胺或N-乙酰氨基葡糖)的二聚重复单元组成,硫酸化或非硫酸化的分子都可见到。GAG糖基骨架的硫酸化位点,根据其在细胞和组织中位置的不同而有很大的差异。此外,其还具有2种形态的糖蛋白游离糖链(图1)[1,3]。根据多糖的组成种类、位置、硫酸化以及几何结构的诸多不同,GAG可以被分为非硫酸化GAG〔包括透明质酸(HA)〕和硫酸化GAG〔包括硫酸软骨素(CS)、硫酸皮肤素( DS)、硫酸角质素(KS)、肝素(HP)和硫酸肝素(HS)(图1)〕。
虽然在人体组织中存在上述各种GAGs,但是本综述主要阐述2种天然药物SDX中含有的GAG化合物,即硫酸皮肤素(DS)和肝素(HP)。
1 硫酸皮肤素(DS)
在硫酸化GAG中,CS家族有着至关重要的作用,包括CS(CS-A和CS-C)和DS(也被称为硫酸软骨素B,CS-B),其具有相同的双糖单位的重复结构。
所有CS(CS-A,-B和-C)都是聚合的带负电的线性碳水化合物,由交替的双糖单位GlcA和D-N-乙酰半乳糖胺组成,经过多个硫酸化修饰于一个或多个位于C-4(形成CS-A)和/或C-6(形成CS-C)的N-乙酰半乳糖胺和/或C-2葡萄糖醛酸,使这些化合物高度地带负电。这些修饰的变化可以生成16种双糖异构体。所有3种CS化合物都是通过含有1个木糖、2个半乳糖分子和1个葡糖醛酸的四糖复合体,与核心蛋白的丝氨酸残基相连(图1)。其主链大小各不相同,可包含100个或更多的二糖重复单元。人们可以通过合成CS链的核心蛋白来生成特定的CS蛋白聚糖,诸如聚集蛋白聚糖、多能聚糖、核心蛋白聚糖和二聚糖,从而在细胞生物学、信号转导、胚胎形成、干细胞调节和分化、癌细胞增殖等方面起到至关重要的作用[4]。
DS(或CS-B)起源于5-表异构酶在CS链上的活动,这使葡萄糖醛酸表异构化生成艾杜糖醛酸。DS(CSB)和CS-A、CS-C不同,可以被2-O-硫酸化。DS和CS实质上的差异在于糖醛酸的差异(艾杜糖醛酸和葡萄糖醛酸)及分子链被硫酸化的程度不同。
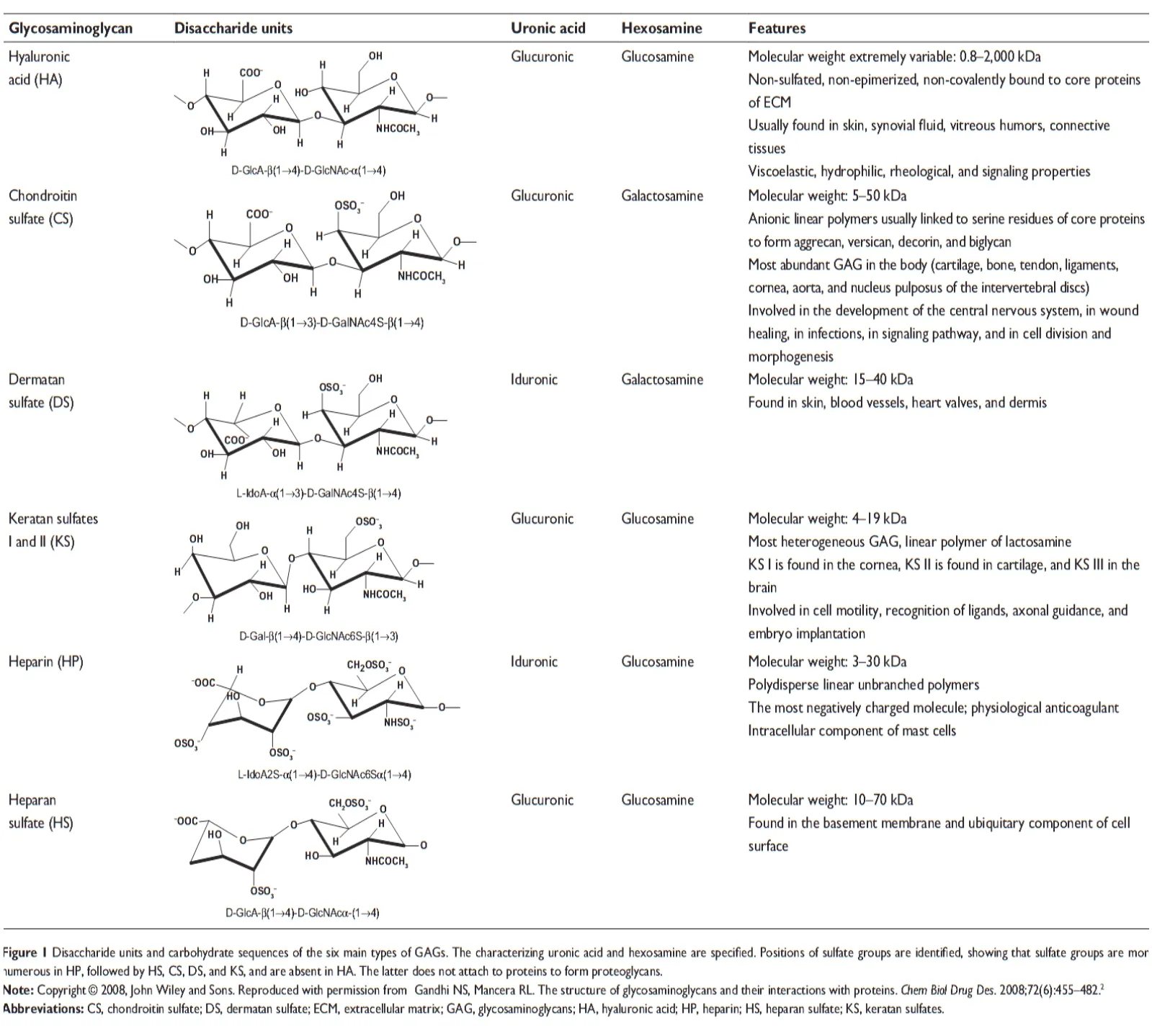
图1 主要的葡糖胺葡聚糖(GAG)类物质的结构
考虑到组织位置的表达和生物学功能,CS-A异构体在软骨、骨和角膜中都有显著的表达,而CS-C表达在软骨、肌腱、心脏瓣膜和椎间盘的髓核中。除了骨关节和结缔组织结构上的功能外,CS还参与中枢神经系统发育、伤口愈合、感染、细胞分化和器官发生的信号通路功能。而DS主要在皮肤、真皮、心脏瓣膜和血管壁中发现。其与原胶原蛋白纤维的结合能力很强,使得DS可能在指导胶原蛋白的构成方面发挥着重要的作用,尤其是真皮层的表达浓度较高。所有这些功能似乎都来自于特定的多糖区域和多种分子(如生长因子、细胞因子、趋化因子、粘附分子和脂蛋白)的相互作用[4,5]。此外,DS还通过天然抑制剂HP辅助因子Ⅱ(HC Ⅱ)抑制X因子和凝血酶功能,发挥抗凝作用。这一通路是抗凝途径的次要通路,但却是连接基于抗凝血酶的主要通路。因此,DS的活性可能在一定条件下具有一定的临床意义。
2 硫酸肝素(HS)和肝素(HP)
HSs是一组包括HP的GAG,是由包含α-D-葡萄糖胺和糖醛酸的重复双糖单位构成的多元分散系聚合物,即90% GlcA和10% 的IdoA。硫酸肝素的特点是平均每个双糖上只有少于一个的硫酸化位点,并且主要由连接葡萄糖胺的GlcA构成(图1)。HS硫酸化的位点和HP非常类似,因此和蛋白的结合能力也类似。HS链通常比HP链要长,平均29 kDa,范围是5~50 kDa。
HP链的长度有很大的差异,平均是13 kDa,范围是3~30 kDa。HP的多元分散性和微观不均一性使得这一化合物的结构非常复杂[6]。HP在糖醛酸和葡萄糖胺中展现出了极大程度的硫酸化和异性,并成为已知的具有最多负电荷的物质。其中最常见的结构是三硫酸化二糖,包括一个位于C-2的单硫酸化的艾杜糖醛酸和双硫酸化的葡萄糖胺。约12个硫酸化二糖的结构变异,使得HP称为一个高度异质性的物质。
许多哺乳动物的HP是由结缔组织中的肥大细胞合成的,其通过增强体内丝氨酸蛋白酶抑制剂和抗凝血酶(AT)的活性,因而产生重要的抗凝/抗血栓作用。HP能催化内源性凝血通路中的丝氨酸蛋白酶的抑制作用,抑制包括Ⅸa因子、Ⅺa因子、Ⅻa因子和一些共同通路的因子,例如凝血酶和Xa因子。除了已知的抗凝血方面的活性外,HP和HS还与生长因子、细胞因子、构型素以及其他细胞生长、分化、血管形成通路中的酶和分子结合[7]。目前治疗用的HP是从猪肠粘膜中提取的,是与人内源性HP类似的提取物。
努力改良HP,在增加其抗血栓效果的同时减少其抗凝及后出血效果后,就得到了低分子肝素(LMWH)。这是一种通过化学方法或者酶解聚得到的片段化的HP,其具有更短的分子链、更小的分子量(3000~6500 Da),且硫酸化程度也更低[8]。LMWH与普通肝素(UFH)相比,具有更可控的剂量反应,作用于Ⅹ因子的作用比Ⅱ因子更强,并且减少了后出血与抗血栓效果的比率。第1代LMWH包含25%~50%的18糖或更大的分子(分子量≥6000 Da),而新一代的LMWH(第2代LMWH或ultra-LMWH)则包含更大比例的短链分子(分子量<3000 Da)和更多的五糖结构,以便更好地结合X因子。磺达肝癸就是一种人工合成的物质,能够模拟HP的五糖核心结构。
3 SDX及其粘多糖的组成部分
作为一种高纯度的GAG,SDX使用一种专利保护的方法从猪肠粘膜中提取出来[9]。与HP不同的是,其具有2个独立的组分。这一天然混合物包含了80%硫酸艾杜糖原氨基聚糖〔IGS,是有名的快速移动HP(FMH),由于其在钡丙电泳系统中的移动速度而得名〕和20%的DS(或CS-B)。SDX主要的特点之一是其完整的化合物和片段均可以通过肠粘膜吸收[10]。由于存在2种GAG组分,SDX能够同时使AT和HP辅助因子Ⅱ(HCⅡ)的抗蛋白酶活性成为可能[11]。SDX诱导的凝血酶抑制作用是由其2种组分共同甚至可能是协同作用而产生的。
4 SDX中的快速移动肝素组分
SDX中IGS或者称为FMH部分的平均分子量约为7 kDa。SDX的这一组分性质和LMWH更接近,对凝血检测的影响更小,后出血的程度也更轻,这与UFH相比差异较大。SDX的FMH组分与UFH相比,其不同点还包括更长的半衰期和能够口服给药[10]。
5 SDX中的硫酸皮肤素组分
DS由许多不同的双糖单位组成,平均分子量为25 kDa,已经在不同的静脉血栓模型实验中被证明能抑制血栓的形成和生长。与HP不同的是,DS在动脉血栓形成的作用方面并没有很多有效的数据[12]。然而,在一个大鼠动脉血栓形成实验中,SDX中低分子量和高分子量的DS与HS的比较结果表示,DS同样可以抑制大鼠动脉血栓形成而不增加出血并发症[12];DS还被证实可以用于预防患者术后下肢深静脉血栓形成(DVT)[13]。同时,最新证据强调了DS的一个全新的生物学功能,其可以抑制基质金属蛋白酶(MMP)。MMP是细胞外基质(ECM)重构的重要角色,这就意味着SDX有着能够保护血管因慢性静脉疾病(CVD)所致的血管壁损伤和炎症反应[14,15]。最近,人们还发现DS可能还是促进伤口愈合的辅助因子[16]。
综上,SDX中2种GAG共同存在,共同作用甚至可能有协同作用,具有抗血栓形成、内皮保护和伤口治疗的作用。
参考文献
[1] Afratis N, Gialeli C, Nikitovic D, et al. Glycosaminoglycans: key players in cancer cell biology and treatment. FEBS J,2012,279:1177-1197.
[2] Gandhi NS, Mancera RL. The structure of glycosaminoglycans and their interactions with proteins. Chem Biol Drug Des,2008,72(6):455-482.
[3] Rudd TR, Skidmore MA, Guimond SE, et al. Glycosaminoglycan origin and structure revealed by multivariate analysis of NMR and CD spectra. Glycobiology,2009,19(1):52-67.
[4] Lauder RM. Chondroitin sulphate: a complex molecule with potential impacts on a wide range of biological systems. Complement Ther Med, 2009,17:56-62.
[5] Asimakopoulou AP, Theocharis AD, Tzanakakis GN, et al. The biological role of chondroitin sulfate in cancer and chondroitin-based anticancer agents. In Vivo,2008,22(3):385-389.
[6] Mulloy B. Structure and physicochemical characterisation of heparin. Handb Exp Pharmacol,2012,(207):77-98.
[7] Dreyfuss JL, Regatieri CV, Jarrouge TR, et al. Heparan sulfate proteoglycans: structure, protein interactions and cell signaling. An Acad Bras Cienc,2009,81(3):409-429.
[8] Bick RL, Frenkel EP, Walenga J, et al. Unfractionated heparin, low molecular weight heparins, and pentasaccharide: basic mechanism of actions, pharmacology and clinical use. Hematol Oncol Clin North Am, 2005,19(1):1-51.
[9] Bianchini P, Opocrin SRL. Method for preparing glucoronylglucosamino- glycan sulphates exhibiting antilipasaemic activity. United States patent US,1976.
[10]Silvestro L, Lanzarotti E, Marchi E, et al. Human pharmacokinetics of glycosaminoglycans using deuteriumlabeled and unlabeled substances: evidence for oral absorption. Semin Thromb Hemost,1994,20:281-292.
[11]Tollefsen DM. Vascular dermatan sulphate and heparin cofactor Ⅱ. Prog Mol Biol Transl Sci,2010,93:351-372.
[12]Iacoviello L, D’Adamo MC, Pawlak K, et al. Antithrombotic activity of dermatan sulphates, heparins and their combination in an animal model of arterial thrombosis. Thromb Haemost,1996,76(6):1102-1107.
[13] Di Carlo V, Agnelli G, Prandoni P, etal. Dermatan sulphate for the prevention of postoperative venous thromboembolism in patients with cancer. DOS (Dermatan sulphate Oncolologic Surgery) Study Group. Thromb Haemost,1999,82(1):30-34.
[14]Mannello F, Raffetto JD. Matrix metalloproteinase activity and glycosaminoglycans in chronic venous disease: the linkage among cell biology, pathology and translational research. Am J Transl Res, 2011,3(2):149-158.
[15]Mattana P, Mannello F, Ferrari P, Agus GB. Vascular pathologies and inflammation: the anti-inflammatory properties of sulodexide. J Vasc Endovasc Surg,2012,19:1-7.
[16]Plichta JK, Radek KA. Sugar coating wound repair: a review of FGF10 and DS in wound healing and their potential application in burn wounds. J Burn Care Res,2012,33:299-310.
*通信作者:叶炜,E-mail:yewill18@126.com
文章编号:2096-0646.2016.02.01.19
