C/EBPs和内质网应激相关分子在高三酰甘油血症性急性胰腺炎大鼠胰腺中的表达
2016-05-19郑俊媛吴江红陈静刘杰胡国勇王兴鹏曾悦
郑俊媛 吴江红 陈静 刘杰 胡国勇 王兴鹏 曾悦
200080 上海,上海交通大学附属第一人民医院消化科
·论著·
C/EBPs和内质网应激相关分子在高三酰甘油血症性急性胰腺炎大鼠胰腺中的表达
郑俊媛吴江红陈静刘杰胡国勇王兴鹏曾悦
200080上海,上海交通大学附属第一人民医院消化科
【摘要】目的探讨C/EBPα、C/EBPβ和内质网应激相关分子(IRE1α和sXBP1)在高三酰甘油血症(HTG)相关性急性胰腺炎(AP)大鼠胰腺中的表达变化。方法96只SD大鼠按数字表法随机分为对照组、HTG组(高脂饮食2周)、AP组、HTG+AP组,每组24只。采用腹腔注射雨蛙肽方法制备AP模型,造模后3、6、9、24 h分批处死大鼠。观察胰腺病理变化并予评分,检测血清TG、总胆固醇(TC)及血浆IL-1β、IL-6、TNF-α水平,实时PCR法检测胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达,蛋白质印迹法检测胰腺组织IRE1α、sXBP1、NF-κB、C/EBPα和C/EBPβ蛋白表达,免疫组化法检测胰腺组织C/EBPα和C/EBPβ蛋白表达。结果高脂饮食2周后,HTG组、HTG+AP组大鼠血清TG和TC均较对照组明显升高,差异有统计学意义(P值均<0.05)。HTG+AP组胰腺病理变化较AP组更严重,以9 h点表现最为显著(P<0.05)。与AP组比较,HTG+AP组血浆IL-1β、IL-6和TNF-α水平明显升高,9 h点差异有统计学意义(P值分别为0.011、0.034、0.027)。AP组和HTG+AP组胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达均于3 h点开始升高,分别于24、9、6、6 h点达峰值。与AP组比较,HTG+AP组IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达明显更高,其中IRE1α、sXBP1 mRNA 3、6、9、24 h点,C/EBPα mRNA 6、9、24 h点,C/EBPβ mRNA 6、9 h点差异均有统计学意义(P值均<0.05)。AP组和HTG+AP组胰腺组织IRE1α、sXBP1、NF-κB蛋白表达均于3 h点开始上调,9 h点达最高水平,HTG+AP组较AP组上调更显著;HTG+AP组6 、9 h点C/EBPα、C/EBPβ蛋白高表达,AP组则无表达。结论C/EBPα、C/EBPβ、IRE1α、sXBP1基因参与HTG相关性AP的发病,内质网应激通路IRE1α/sXBP1和C/EBPα、C/EBPβ可能共同介导HTG性AP的胰腺病理损伤和炎症过程。
【关键词】胰腺炎;C/EBPα;C/EBPβ;内质网应激;高酯血症;大鼠
高三酰甘油血症(hypertriglyceridemia,HTG)是急性胰腺炎(AP)发病的一个仅次于胆源性和酒精性、明确而独立的危险因素。HTG性AP占所有AP病例的10%,在妊娠期AP中的比例则高达50%[1]。HTG性AP的病情重症化和炎性反应扩大化[2]早有定论,但具体机制尚不明确。内质网应激(endoplasmic reticulum stress,ERS)是近年来在细胞生物学层面上提出的一个较新颖的AP发病机制,而高脂饮食本身也能够诱发肝脏、脂肪、骨骼肌等组织发生ERS[3],尤其是与脂代谢和炎症都有关联的IRE1α-sXBP1通路[4]。C/EBPs(CCAAT enhancer binding proteins)是一个包括C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε、C/EBPξ 6个成员的转录因子家族,其C端都具有高度保守的、碱性亮氨酸拉链结构的DNA结合域和二聚化功能域,N端则为转录激活域。该家族具有调控细胞增殖和分化、能量代谢、炎症、学习和记忆等多种功能。本研究检测ERS相关分子(IRE1α、sXBP1)和C/EBPα、C/EBPβ在HTG性AP胰腺组织的表达,分析它们间的关系。
材料和方法
一、动物模型制备和实验分组
96只雄性SD大鼠,SPF级,体重150~ 160 g,购自上海斯莱克实验动物有限公司。按数字表法随机分为对照组、AP组、HTG组、HTG+AP组,每组24只大鼠。对照组给予正常饮食喂养;AP组给予正常饮食喂养2周后采用腹腔注射雨蛙肽50 μg/kg体重2次、间隔1 h的方法制备AP模型;HTG组给予高脂饲料(正常饲料77%+猪油20%+胆固醇3%)喂养2周; HTG+AP组给予高脂饲料喂养2周后同上述方法制备AP模型。对照组和HTG组腹腔注射等容积生理盐水。AP诱发后3、6、9、24 h处死大鼠,腹主动脉采血,分离血浆,置-20℃保存;取胰腺组织,部分立即置液氮保存,部分用10%甲醛固定备用。
二、血三酰甘油(TG)、总胆固醇(TC)、IL-1β、IL-6、TNF-α检测
正常饮食或高脂饮食喂养2周后大鼠尾静脉采血,分离血清送上海市第一人民医院生物化学实验室检测血TG、TC水平,分离的血浆应用ELISA试剂盒(eBioscience)检测IL-1β、IL-6、TNF-α水平,按说明书操作。
三、胰腺组织病理检查
取固定的胰腺组织,常规脱水、石蜡包埋、切片及HE染色,光镜下读片,并参照Schmidt等[5]的胰腺组织病理评分标准进行评分。
四、胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA检测
应用Trizol(Invitrogen)抽提胰腺组织总RNA,应用RT试剂盒和SYBGreen荧光定量PCR试剂盒(Takara公司)进行逆转录及实时PCR反应,按说明书操作。 IRE1α、sXBP1、C/EBPα、C/EBPβ、β-actin引物由上海生工生物技术有限公司设计并合成,引物序列和退火温度见表1。 通过PCR仪自带软件获取Ct值,根据公式2-ΔΔCt计算mRNA表达量。

表1 各基因引物序列及退火温度
五、胰腺组织IRE1α、sXBP1、NF-κB、C/EBPα、C/EBPβ蛋白检测
应用RIPA裂解液提取胰腺组织总蛋白,用核蛋白抽提试剂盒(碧云天生物技术有限公司)提取核蛋白,应用BCA试剂盒(碧云天生物技术有限公司)测定蛋白浓度。采用蛋白质印迹法检测IRE1α、sXBP1、NF-κB、C/EBPα、C/EBPβ蛋白表达量,以Tubulin为内参,最后ECL(Millipore公司)化学发光。 兔抗大鼠 IRE1α、sXBP1、NF-κB、C/EBPα、C/EBPβ抗体购自Santa Cruz公司,工作浓度分别为1∶250、1∶400、1∶400、1∶250、1∶250;羊抗兔IgG-HRP购自Jackson公司,工作浓度1∶5 000。应用天能Tanon 5200全自动化学发光成像分析系统扫描,以目的条带与内参条带的灰度值比表示蛋白表达量。
取固定的胰腺组织,石蜡包埋、切片,采用免疫组化方法检测C/EBPα、C/EBPβ蛋白表达,最后DAB显色,苏木精复染,封片,光镜下读片。以胞质和(或)胞核出现棕黄色颗粒为阳性表达。蛋白表达强度结果判定标准:无染色为阴性,阳性细胞占全片1/3以下为弱阳性,占全片1/3 ~2/3为阳性,占全片2/3以上为强阳性。
六、统计学分析
结果
一、血清TG、TC水平及胰腺组织病理变化
对照组、AP组、HTG组、HTG+AP组血清TG分别为(0.67±0.25)、(0.64±0.18)、(4.41±0.94)、(4.45±0.84)mmol/L;TC分别为(2.17±0.20)、(2.19±0.30)、(2.87±0.45)、(2.96±0.55)mmol/L。两高脂饲料喂养组大鼠的TG、TC水平均显著高于两正常饲料喂养组,差异均有统计学意义(TG:t值分别为9.378、10.784,P值均<0.001;TC:t值分别为3.184、2.765,P值均<0.05)。
对照组和HTG组的胰腺组织病理无明显变化,病理评分基本为0分。AP组和HTG+AP组胰腺组织均出现不同程度的水肿、出血、坏死和炎性浸润,尤以9 h点病变最为严重。AP组胰腺组织病理评分显著高于对照组,HTG+AP组则显著高于HTG组,差异均有统计学意义(P值均<0.05)。HTG+AP组的胰腺病理改变较AP组更严重,尤以水肿和腺泡坏死为甚(t=3.464,P=0.026;t=5.292,P=0.006)。HTG+AP组胰腺病理总评分、水肿和坏死评分较AP组同时点显著增加,差异均有统计学意义(P值均<0.05),而出血和炎性浸润评分差异仅在9 h点有统计学意义(P<0.05;图1,表2)。

图1 对照组(1A )、 AP 9 h组(1B)、HTG组(1C)、HTG+AP 9 h组(1D)大鼠胰腺组织病理改变(HE ×400)
二、血浆IL-1β、IL-6、TNF-α水平的变化
HTG组大鼠血浆IL-1β、IL-6、TNF-α水平与对照组差异无统计学意义。AP组、HTG+AP组大鼠血浆IL-1β、IL-6、TNF-α水平均较对照组、HTG组显著升高,HTG+AP组又较AP组显著升高。两组9 h时的IL-1β分别为(115.31±3.09)、(62.58±1.32)ng/L;IL-6为(43.20±3.81)、(22.41±2.40)ng/L;TNF-α为(38.75±1.02)、(22.11±1.10)ng/L,差异均有统计学意义(t值分别为4.495、2.709、3.328,P值分别为0.011、0.034、0.027;图2)。
三、胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达变化
与对照组比较,HTG组大鼠胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达呈现不同程度上调,但仅6、9、24 h点C/EBPα mRNA的表达差异有统计学意义(P值均<0.05)。AP组IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA表达均较对照组升高,其中IRE1α mRNA在9、24 h点,sXBP1 mRNA在6、9、24 h点,C/EBPα mRNA在3、6、9、24 h点,C/EBPβ mRNA在3、6 h的差异有统计学意义(P值均<0.05)。 HTG+AP组IRE1α、sXBP1、C/EBPα、C/EBPβ mRNA也均较HTG组表达升高,其中IRE1α、sXBP1、C/EBPα mRNA在3、6、9、24 h点,C/EBPβ mRNA在3、6 h点的差异有统计学意义(P值均<0.05,表3)。
四、胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ、NF-κB蛋白表达的变化
HTG组和对照组大鼠胰腺组织IRE1α、sXBP1、C/EBPα、C/EBPβ、NF-κB蛋白均低表达或未检测到表达。AP组IRE1α、sXBP1、NF-κB蛋白表达均较对照组增加; HTG+AP组IRE1α、sXBP1、NF-κB蛋白表达均较HTG组、AP组增加。HTG+AP组C/EBPα和C/EBPβ蛋白高表达,其中C/EBPα蛋白6、9、24 h点,C/EBPβ蛋白3、6 h点表达均较AP组显著增加,差异有统计学意义(P值均<0.05,图3)。
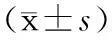
表2 AP组和HTG+AP组大鼠胰腺组织病理评分
注:与AP组同时点比较,aP<0.05

注:与AP组比较,aP<0.05

组别只数IRE1αmRNA3h6h9h24h对照组241.00±0.021.09±0.151.07±0.071.04±0.03HTG组241.26±0.131.20±0.011.24±0.101.24±0.14AP组241.04±0.011.29±0.022.67±0.08a4.93±0.19aHTG+AP组242.88±0.07bc3.55±0.04bc4.99±0.12bc5.86±0.04bc组别只数sXBP1mRNA3h6h9h24h对照组241.00±0.021.30±0.201.29±0.110.89±0.08HTG组241.46±0.171.67±0.091.59±0.141.49±0.22AP组242.25±0.357.89±0.89a16.08±1.48a14.12±1.06aHTG+AP组247.29±2.08bc20.55±1.21bc25.56±1.38bc21.66±0.23bc组别只数C/EBPαmRNA3h6h9h24h对照组241.00±0.011.01±0.130.84±0.081.06±0.05HTG组241.31±0.124.03±1.00a4.89±0.97a4.44±0.86aAP组2411.16±2.17a16.68±3.11a15.67±2.65a11.08±1.77aHTG+AP组247.58±2.58c29.94±3.40bc21.90±1.93bc16.68±0.33bc组别只数C/EBPβmRNA3h6h9h24h对照组241.00±0.101.82±0.051.66±0.021.00±0.01HTG组242.89±0.233.61±0.313.27±0.111.66±0.44AP组248.17±1.50a10.56±1.61a2.57±0.691.00±0.07HTG+AP组248.64±1.25c18.13±2.09bc3.63±0.22b3.12±0.58
注:与对照组比较,aP<0.05;与AP组比较,bP<0.05;与HTG组比较,cP<0.05
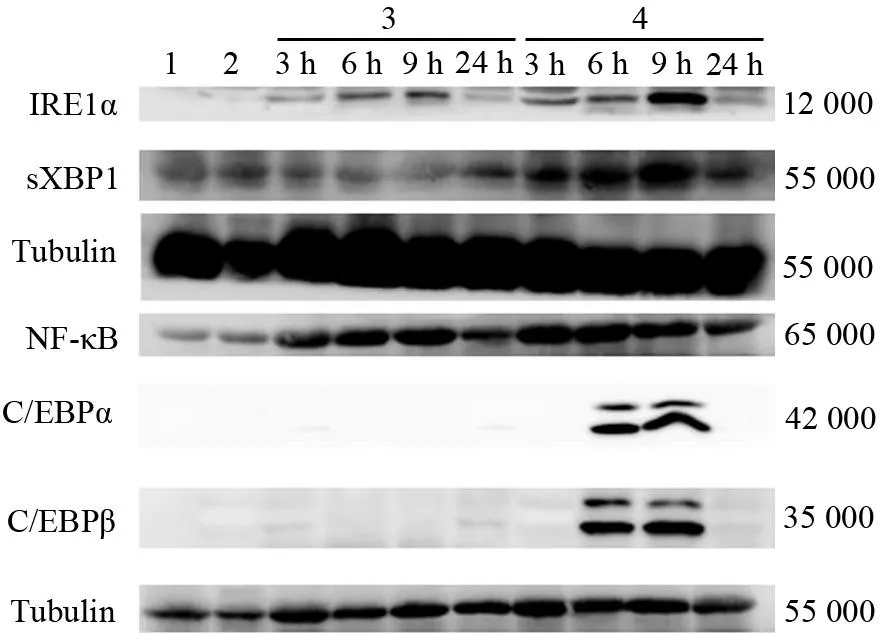
图3 对照组(1)、HTG组(2)及AP组(3)、HTG+AP组(4)3、6、9、24 h点胰腺组织IRE1α、sXBP1、NF-κB、C/EBPα、C/EBPβ蛋白表达
免疫组化染色显示,HTG+AP组6、9 h点C/EBPα和C/EBPβ呈强阳性表达,而AP组则无表达(图4),与蛋白质印迹法检测的结果一致。
讨论
目前已有不少研究[6]发现,在多种AP模型中均存在ERS,包括ERS标志分子的mRNA和蛋白表达上调以及内质网扩张、液化和腔内出现大量空泡等形态结构的改变。ERS信号通路主要包括IRE1α-sXBP1、PERK-eIF2α和ATF6,其中IRE1α-sXBP1是ERS最经典最保守的一条信号通路,且与炎症、糖脂代谢紊乱和脂肪细胞分化等都有密切关系[4,7]。Zhang等[8]采用蛋白质组学技术发现,与正常血脂的大鼠AP比较,HTG相关性AP大鼠胰腺的ERS相关蛋白,如GRP78等的表达显著升高。本课题组前期研究结果也显示[9],HTG性AP的GRP78、sXBP1mRNA和蛋白表达显著上调,腺泡细胞内的内质网极度扩张、空泡化,推测ERS可能是HTG性AP重症化的一个重要机制。
近年来,肥胖、糖尿病、HTG等多种脂肪代谢性疾病在全球范围内的流行使人们越来越关注脂肪沉积调控的机制研究,其中就包括调控脂肪细胞分化、葡萄糖和胰岛素代谢以及高密度脂蛋白(HDL)生成的C/EBPα和C/EBPβ[10]。研究表明, 生脂基因调控因子C/EBPα和C/EBPβ还可调控炎性通路[11-12]。C/EBPα可通过激活巨噬细胞加重炎性反应[13],但也是对抗炎性疾病的一个保护因子[14]。C/EBPβ可以上调炎性因子的表达加重神经炎性疾病和急性肺损伤[15-16]。高脂饮食能诱导脂肪细胞和巨噬细胞C/EBPβ的高表达进而上调IL-6、TNF-α、MCP1等炎性因子表达,而敲除C/EBPβ基因则可减轻高脂饮食诱发的炎症和胰岛素抵抗[17]。Ji等[18]
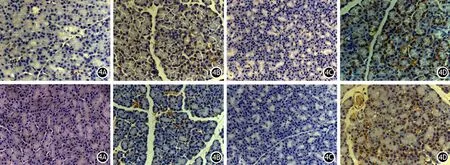
图4 对照组(4A)、AP 9 h组(4B)、HTG组(4C)、HTG+AP 9 h组(4D)大鼠胰腺组织C/EBPα(上)、C/EBPβ(下)的表达(免疫组化 ×400)
应用基因芯片技术检测AP大鼠胰腺组织,发现1 h后C/EBPβ基因表达上调,是正常大鼠的8倍,2 h高达正常的16倍,4 h则是正常的9倍;而注射牛黄胆酸1 h后胰腺组织C/EBPβ基因上调至正常的17倍,3 h高达正常的20倍。
文献报道C/EBPβ与ERS、炎症和代谢障碍都有密切的联系[10],ERS可诱导C/EBPβ高表达,C/EBPβ可诱导NF-κB和炎性因子表达上调[17]。但尚无有关ERS和C/EBPα关系的文献报道,且有关C/EBPα和C/EBPβ关系的报道也只限于在脂肪细胞分化过程中C/EBPβ诱导C/EBPα的表达。
本研究结果显示,HTG+AP组的胰腺病理损伤更严重,血浆中炎性因子IL-1β、IL-6和TNF-α水平更高,胰腺组织NF-κB的蛋白表达增强,证明HTG加重了AP的全身炎症反应和胰腺病理损伤。HTG+AP组胰腺IRE1α、sXBP1、C/EBPα、C/EBPβ、NF-κB表达上调,血中炎性因子(IL-1β、IL-6、TNF-α)水平升高,进一步验证ERS参与了HTG加重AP的过程。至于HTG性AP中IRE1α-sXBP1是否诱导C/EBPα和C/EBPβ的高表达,进而激活NF-κB,加重炎症反应还有待进一步研究证实。
参考文献
[1]Valdivielso P, Ramírez-Bueno A, Ewald N, et al. Current knowledge of hypertriglyceridemic pancreatitis[J]. Eur J Intern Med, 2014, 25(8): 689-694.DOI: 10.1016/j.ejim.2014.08.008.
[2]Bosques-Padilla FJ, Vázquez-Elizondo G, González-Santiago O, et al. Hypertriglyceridemia-ind-uced pancreatitis and risk of persistent systemic inflammatory response syndrome[J]. Am J Med Sci, 2015, 349(3): 206-211.DOI: 10.1097/MAJ.0000000000000392.
[3]Pierre N, Deldicque L, Barbé C, et al. Toll-like receptor 4 knockout mice are protected against endoplasmic reticulum stress induced by a high-fat diet[J]. PLoS One, 2013, 8(5): e65061.DOI: 10.1371/journal.pone.0065061.
[4]Sha H, He Y, Yang L, et al. Stressed out about obesity: IRE1α-XBP1 in metabolic disorders[J]. Trends Endocrinol Metab, 2011, 22(9): 374-381.DOI: 10.1016/j.tem.2011.05.002.
[5]Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy[J]. Ann Surg, 1992, 215(1): 44-56.
[6]Sah RP, Garg P, Saluja AK. Pathogenic mechanisms of acute pancreatitis[J]. Curr Opin Gastroenterol, 2012, 28(5): 507-515.DOI: 10.1097/MOG.0b013e3283567f52.
[7]Sha H, He Y, Chen H, et al. The IRE1alpha-XBP1 pathway of the unfolded protein response is required for adipogenesis[J]. Cell Metab, 2009, 9(6): 556-564.
[8]Zhang W, Zhao Y, Zeng Y, et al. Hyperlipidemic versus normal-lipid acute necrotic pancreatitis: proteomic analysis using an animal model[J]. Pancreas, 2012, 41(2): 317-322.DOI: 10.1097/MPA.0b013e31822981fb.
[9]Zeng Y, Wang X, Zhang W, et al. Hypertriglyceridemia aggravates ER stress and pathogenesis of acute pancreatitis[J]. Hepatogastroenterology, 2012, 59(119): 2318-2326.DOI:10.5754/hge12042.
[10]van der Krieken SE, Popeijus HE, Mensink RP, et al. CCAAT/enhancer binding protein β in relation to ER stress, inflammation, and metabolic disturbances[J]. Biomed Res Int, 2015, 2015: 324815.DOI: 10.1155/2015/324815.
[11]Tsukada J, Yoshida Y, Kominato Y, et al. The CCAAT/enhancer(C/EBP) family of basic-leucine zipper (bZIP) transcription factors is a multifaceted highly-regulated system for gene regulation[J]. Cytokine, 2011, 54(1): 6-19.DOI: 10.1016/j.cyto.2010.12.019.
[12]Wang K, Brems JJ, Gamelli RL, et al. C/EBPα and C/EBPβ binding proteins modulate hepatocyte apoptosis through iNOS signaling pathway[J]. Biochim Biophys Acta, 2011, 1813(8): 1395-1403.DOI: 10.1016/j.bbamcr.2011.04.004.
[13]Lee B, Qiao L, Lu M, et al. C/EBPα regulates macrophage activation and systemic metabolism[J]. Am J Physiol Endocrinol Metab, 2014, 306(10): E1144-E1154.DOI: 10.1152/ajpendo.00002.2014.
[14]Didon L, Roos AB, Elmberger GP, et al. Lung-specific inactivation of CCAAT/enhancer binding protein α causes a pathological pattern characteristic of COPD[J]. Eur Respir J, 2010, 35(1): 186-197.DOI: 10.1183/09031936.00185008.
[15]Straccia M, Gresa-Arribas N, Dentesano G, et al. Pro-inflammatory gene expression and neuro- toxic effects of activated microglia are attenuated by absence of CCAAT/enhancer binding protein β[J]. J Neuroinflammation, 2011, 8: 156.DOI: 10.1186/1742-2094-8-156.
[16]Yan C, Wu M, Cao J, et al. Critical role for CCAAT/enhancer-binding protein β in immune complex-induced acute lung injury[J]. J Immunol, 2012, 189(3): 1480-1490.DOI: 10.4049/jimmunol.1200877.
[17]Rahman SM, Janssen RC, Choudhury M, et al. CCAAT/enhancer-binding protein β (C/EBPβ) expression regulates dietary-induced inflammation in macrophages and adipose tissue in mice[J]. J Biol Chem, 2012, 287(41): 34349-34360.DOI: 10.1074/jbc.M112.410613.
[18]Ji B, Chen XQ, Misek DE, et al. Pancreatic gene expression during the initiation of acute pancreatitis: identification of EGR-1 as a key regulator[J]. Physiol Genomics, 2003, 14(1): 59-72.DOI:10.1152/physiolgenomics.00174.2002.
(本文编辑:吕芳萍)
Alteration of C/EBPs and endoplasmic reticulum stress related molecules expression in pancreatic tissues in rats with hypertriglyceridemia related acute pancreatitis
ZhengJunyuan,WuJianghong,ChenJing,LiuJie,HuGuoyong,WangXingpeng,ZengYue.DepartmentofGastroenterology,ShanghaiFirstPeople′sHospital,ShanghaiJiaotongUniversity,Shanghai200080,China
【Abstract】Objective To investigate the alteration of C/EBP α, C/EBP β and endoplasmic reticulum stress (ERS) related molecules (IRE1 α and sXBP1) expression in pancreatic tissues in rats with hypertriglyceridemia related acute pancreatitis. MethodsNinety six Sprague Dawley (SD) rats were divided into 4 groups: control group, hypertriglyceridemia (HTG) group (n=24, fed with high fat diet for 2 weeks), AP group (n=24), HTG+AP group (n=24), and AP was induced by peritoneal injection of cerulein. The rats were sacrificed at 3, 6, 9, 24 h after AP induction, respectively. The pathological changes of the pancreatic tissues were observed and scored by HE staining. Plasma levels of IL-1β, IL-6 and TNF-α weremeasured by ELISA. The expression of IRE1α, sXBP1, C/EBPα, C/EBPβ mRNA were analyzed by real time PCR. The expressions of IRE1α, sXBP1, NF-kB, C/EBPα and C/EBPβ protein were determined by Western Blot. The expressions of C/EBPα and C/EBPβ proteins were also determined by immunohitochemistry. ResultsAfter two weeks of high fat diet, serum levels of triglyceride(TG) and total cholesterol (TC) in HTG group, HTG+AP group were much higher than those of the control group, and the difference was statistically significant (P<0.05). The pancreatic tissue injury was more severe in HTG +AP group, particularly at 9 h (P<0.05). And plasma IL-1β, IL-6 and TNF-α levels were also much higher in HTG+AP group when compared with that of AP group, the differences were all significant at 9 h (P=0.011; P=0.034; P=0.027). After AP induction, IRE1, sXBP1, C/EBP and C/EBPβ mRNA began to be up-regulated at 3 h, and IRE1 mRNA reached the highest level at 24 h, sXBP1 mRNA at 9 h, while C/EBP and C/EBPβ mRNA reached the highest level at 6 h. Compared with AP group, IRE1, sXBP1, C/EBP and C/EBPβ mRNA levels were much higher in HTG+AP group. In addition, as to IRE1 and sXBP1 mRNA, the difference was significant at 3, 6, 9, 24 h, and C/EBP mRNA at 6, 9, 24 h, C/EBPβ mRNA at 6 and 9 h (P<0.05). After AP induction, IRE1α, sXBP1 and NF-kB proteins in the pancreatic tissue began to be up-regulated at 3 h, and all reached the highest level at 9 h. IRE1α, sXBP1 and NF-kB proteins were up-regulated more obviously in HTG+AP group, and the up-regulation in HTG+AP group was higher than that in AP group, and the high expressions of C/EBPα and C/EBPβ proteins could only be detected at 6 and 9 h in the HTG+AP group, while there was no expression detected in AP group. ConclusionsC/EBPα, C/EBPβ, IRE1α and sXBP1 may be involved in the pathogenesis of HTG related AP, and IRE1α/sXBP1 pathway and C/EBPα, C/EBPβ may mediate the pathologic injury and inflammation process of HTG related AP.
【Key words】Pancreatitis;C/EBPα;C/EBPβ;Endoplasmic reticulum stress;Hyperlipidemias;Rats
(收稿日期:2015-06-29)
Corresponding author:Zeng Yue, Email: carrie@medmail.com.cn
基金项目:国家自然科学基金青年项目(81200322);上海市自然科学基金面上项目(12ZR1424000);上海市胰腺疾病重点实验室开放课题资助项目(SPDF2013004)
通信作者:曾悦,Email:carrie@medmail.com.cn
DOI:10.3760/cma.j.issn.1674-1935.2016.02.007
Fund program:Natural Science Foundation for Young Scholars of China (81200322); Shanghai Natural Science Foundation(12ZR1424000);Open Project of Shanghai Key Laboratory of Pancreatic Diseases (SPDF2013004)
