p38抑制剂对低剪切应力诱导的人脐静脉内皮细胞株Fractalkine蛋白表达的影响
2016-05-18阿曼古丽如则赵一蔚古力热巴夏依买旦聂永梅新疆医科大学基础医学院生理学教研室乌鲁木齐8300第二附属医院心电图室乌鲁木齐830063
阿曼古丽·如则,赵一蔚,古力热巴·夏依买旦,吴 江,聂永梅(新疆医科大学基础医学院生理学教研室,乌鲁木齐 8300;第二附属医院心电图室,乌鲁木齐 830063)
p38抑制剂对低剪切应力诱导的人脐静脉内皮细胞株Fractalkine蛋白表达的影响
阿曼古丽·如则1,赵一蔚1,古力热巴·夏依买旦2,吴江1,聂永梅1
(新疆医科大学1基础医学院生理学教研室,乌鲁木齐830011;2第二附属医院心电图室,乌鲁木齐830063)
摘要:目的探讨p38 MAPK信号通路特异性抑制剂SB203580对血流低剪切应力诱导的人脐静脉内皮细胞株Fractalkine蛋白表达的影响。方法用M199生长液(含1%的青链霉素合剂和10%的胎牛血清)培养EA.hy926细胞至第2~5代,待细胞长满汇合后加载强度为4.58 dyne/cm2的剪切应力,分别处理0、5、10、30、60 min。收集细胞提总蛋白,通过Western-blot技术检测剪切应力处理不同时间对EA.hy926细胞p38 MAPK磷酸化的影响,并分析p38 MAPK特异性抑制剂SB203580对p38磷酸化水平的抑制程度,观察SB203580对低剪切应力诱导的人脐静脉内皮细胞株Fractalkine蛋白表达的影响。结果低剪切应力处理可引起EA.hy926细胞p38蛋白磷酸化水平的上调,此过程与剪切应力作用时间有关,30 min时磷酸化水平最高。用SB203580处理可明显抑制低剪切应力诱导的EA.hy926细胞Fractalkine蛋白表达上调过程。结论低剪切应力可激活p38信号转导途径,激活的p38信号分子可能参与调节低剪切应力诱导的内皮细胞Fractalkine表达上调过程,p38抑制剂能够下调低剪切应力诱导的Fractalkine的表达。
关键词:EA.hy926细胞;流体剪切应;Fractalkine;p38 MAPK;p38抑制剂
Fractalkine(又名CX3CL1)是兼具趋化和黏附双重功能的独特的趋化因子,大量研究表明在模型小鼠动脉粥样硬化部位Fractalkine与其受体CX3CR1表达增强[1],通过抑制其表达可以改善动脉粥样硬化病变[2-3],表明Fractalkine在动脉粥样硬化性疾病的发生、发展中起重要的作用。有研究表明,低剪切应力和震荡剪切应力会促进模型动物中的动脉粥样硬化病变[4],低剪切应力诱导的动脉粥样硬化病变部位Fractalkine的表达量增加[5],在低剪切应力诱导的动脉粥样硬化模型大鼠中抑制Fractalkine表达会减小大鼠体内动脉粥样硬化斑块区域,提示低剪切应力与Fractalkine表达之间有一定的联系。本课题组前期研究已证实,用不同强度的流体剪切应力(2.62、4.58、6.54、10.47、15.71、19.64 dyne/cm2)处理培养的EA.hy926人脐静脉内皮细胞株,在4.58 dyne/cm2强度的剪切应力作用下EA.hy926人脐静脉内皮细胞株Fractalkine mRNA和蛋白表达量最高。
p38 MAPK是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族中的一员,目前研究表明,P38 MAPK存在6种异构形式,即p38α1/α2、p38β1/β2、p38γ和p38δ,可以被多种物理、化学因素、应激刺激(紫外线照射、脂多糖、热休克、蛋白合成的抑制剂、高渗性损伤、缺血-再灌注)所激活[6]。众多研究结果表明,p38 MAPK信号途径在低剪切应力诱导的各种生理活动或病理损伤中起着至关重要的作用[7-8]。SB203580是第一个被报道的p38 MAPK特异性阻滞剂,主要阻断p38α和p38β。本研究探讨低剪切应力诱导内皮细胞Fractalkine表达上调过程中是否也存在p38信号转导途径的激活及其作用。
1 材料与方法
1.1主要试剂M199培养基(Hyclone,美国),PBS 液(Hyclone,美国),胰酶(Hyclone,美国),双抗/青链霉素合剂(Hyclone,美国),胎牛血清(Gibco,美国),人纤维黏连蛋白(CORNING,美国),SB203580 (Sigma,美国),RIPA裂解液(Pierce,美国),苯甲基磺酰氟(PMSF),磷酸酶抑制剂混合物Ⅱ型,BCA法蛋白定量试剂盒(Pierce,美国),SDS-PAGE凝胶制备试剂盒(索莱宝,北京),2×蛋白质电泳loading buffer(天根,北京),预染蛋白分子量marker (Thermo,美国),Trisbase(SIGMA,美国),甘氨酸(BIOSHARP,美国),SDS(BIOSHARP,美国),甲醇(天津市福晨化学试剂厂),脱脂奶粉(天根,北京),牛血清白蛋白(博士德,武汉),氯化钠、氯化钾(BIOSHARP,美国),Tween 20(Biotpped,北京),βactin多克隆兔抗(USCN,美国),兔源p38 MAPK抗体(Cell Signalling Technology,美国),兔源Phosphop38 MAPK抗体(Cell Signalling Technology,美国),辣根酶标记山羊抗兔(中彬金桥,北京),Super Signal West Femto最高灵敏度化学发光底物(Thermo,美国)。
1.2细胞培养EA.hy926细胞株购自上海细胞库,培养于全M199培养基(10%小牛血清、1%青链霉素合剂),37℃、5%CO2条件下静置培养。倒置显微镜下观察EA.hy926细胞,待细胞的生长面积达到90%以上时,用吸管吸出培养皿内培养液,用3 mL PBS洗2次。向培养皿内加1 mL 0.25%胰蛋白酶消化液,将培养皿立即转移到37℃恒温箱消化1 min后,在倒置显微镜下观察细胞形态变化,如发现胞质回缩、细胞间隙增大并开始脱离皿底,立即加入4 mL生长液终止消化。用吸管吸取皿内培养液,反复吹打皿底的细胞。将细胞悬液移入15mL的离心管,1 000 r/min离心5 min。除去上清液,加2 mL生长液细胞计数后种植在2个100 mm的培养皿中,水平十字混匀后移入37℃、5%CO2培养箱静置培养。每3天换1次液。
1.3 EA.hy926细胞的剪切应力加载
1.3.1载玻片上EA.hy926人脐静脉内皮细胞株的种植100 mm培养皿中放入已经过消毒处理的载玻片(1个载玻片/培养皿)。每个载玻片上铺满1 mL的纤维黏连蛋白(FN),将培养皿移入37℃恒温箱,放置30 min,以使FN充分发挥作用,回收FN。将经胰蛋白酶消化收集后的悬浮细胞1 mL (106个/mL)种植在载玻片上,之后将培养皿移至37℃、5%CO2培养箱孵育。待细胞长满汇合后加8 mL无血清M199培养基继续孵育细胞12 h,使其饥饿同步化,用于后续实验。
1.3.2剪切应力的加载流室是依据文献[9]模型设计并由西木子公司(中国成都)制造,整个实验装置由流室系统和灌流系统组成,包括恒流泵、储液瓶、管道及流室(图1)。恒流泵(精科实业有限公司,上海)为实验系统提供稳定的定常流(steady flow),用无血清M199培养液作为灌流液体(黏度为0.72 mPa/s)。实验时储液瓶置水浴中保持37℃。
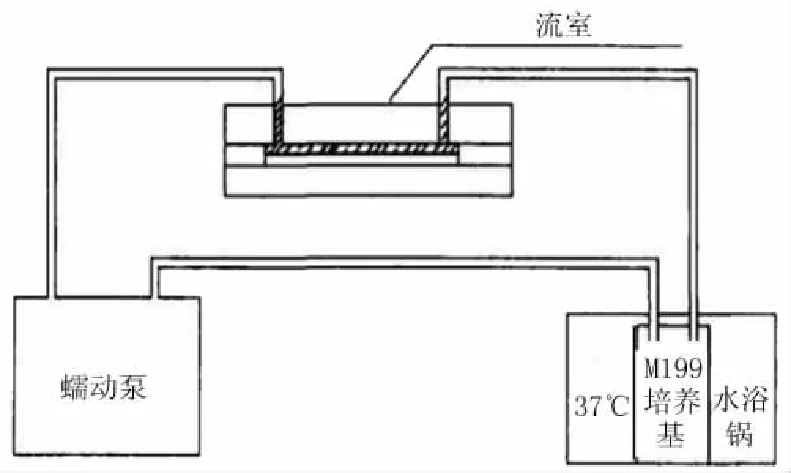
图1 剪切应力加载装置
1.4实验设计及蛋白质印迹(W estern blot)实验
1.4.1实验设计
1.4.1.1低剪切应力对p38 MAPK的激活选取P38磷酸化水平最高的时间点,按低剪切应力作用时间的不同分为0、5、10、30、60 min处理组。
1.4.1.2 SB203580对低剪切应力激活的p38 MAPK的影响实验分组:(1)无处理组:不施加剪切应力; (2)剪切应力作用组:以4.58 dyne/cm2强度的剪切应力作用30 min;(3)SB203580+剪切应力作用组:预先用10μmol/L SB203580预处理EA.hy926人脐静脉内皮细胞株30 min后行剪切应力处理,剪切应力强度、作用时间同剪切应力作用组。
1.4.1.3 SB203580对低剪切应力诱导的Fractalkine蛋白表达的影响分组:(1)正常对照组:以4.58 dyne/cm2强度的剪切应力处理1 h;(2)DMSO+剪切应力作用组:预先用0.1%DMSO预处理EA.hy926人脐静脉内皮细胞株30 min后行剪切应力处理,剪切应力强度4.58 dyne/cm2,作用时间1 h;(3) SB203580+剪切应力作用组:预先用10μmol/L SB203580预处理EA.hy926人脐静脉内皮细胞株30 min后行剪切应力处理,剪切应力强度、作用时间同正常对照组。
1.4.2蛋白质印迹(Western blot)实验将经剪切应力处理的细胞用预冷的PBS洗2遍并用含有PMSF的RIPA裂解液冰上裂解30 min,用细胞刮刀将载玻片上的细胞刮下来收集到1.5 mL离心管中,4℃、12 000 r/min离心10 min,取上清于新的离心管。用BCA蛋白定量试剂盒测定蛋白含量后用SDS-PAGE蛋白质电泳法分离蛋白质并用湿转的方法将蛋白转移到PVDF膜上并在4℃条件下一抗孵育过夜。用TBST清洗膜3次,辣根过氧化物酶标记的二抗孵育2 h后再次用TBST清洗膜3次,每次10 min,实验中所用抗体分别为β-actin多克隆兔抗、兔源p38 MAPK抗体、兔源Phospho-p38 MAPK抗体,按1∶1 000稀释,二抗按1∶5 000稀释,相关蛋白分子量:p38 MAPK:43 ku;Phospho p38 MAPK:43 ku。加入显色液,将显色后的PVDF膜置于Bio-Rad凝胶成像系统成像,用Image J图像分析系统测定灰度,对EA.hy926细胞p-p38和β-actin蛋白表达进行灰度分析,实验结果要用归一化值表示,归一化值=目的蛋白灰度值/内参蛋白灰度值,根据公式算出每个样本的归一化值,然后统计所有样本归一化值的算术平均数及标准差。所有实验均重复3次。
1.5统计学处理所有参数均采用SPSS17.0统计软件包进行one-way ANOVA分析,P<0.05为差异有统计学意义。
2 结果
2.1低剪切应力刺激之后的细胞形态变化正常状态下生长的EA.hy926细胞呈长梭形并伸展至平行状态(图2a)。低剪切应力(4.58 dyne/cm2)处理60 min后细胞形态变化不规则,局部区域可见细胞间隙增大、细胞皱缩,少量细胞有脱落现象(图2b)。

图2 剪切应力诱导的EA.hy926细胞株形态学改变(×50)
2.2剪切应力对p38 MAPK的磷酸化作用低剪切应力(4.58 dyne/cm2)作用于EA.hy926细胞后在观察时间内可促进p38的激活,即引起其蛋白磷酸化水平上调,出现明显的蛋白条带。剪切应力刺激5min后p38磷酸化水平开始增强,30min时达到高峰(图3a),之后随刺激时间的延长其磷酸化程度也减弱,60 min时降至0 min时的水平以下;而相应的总p38在各时间段的表达差异无统计学意义。βactin表达量差异无统计学意义,见图3。
2.3 SB203580对p38磷酸化的抑制低剪切应力(4.58 dyne/cm2)刺激30 min后的p38磷酸化水平较单纯给予低剪切应力刺激时的p38磷酸化水平明显降低。而总p38和内参β-actin的表达无明显差异(图4)。
2.4 p38抑制剂对低剪切应力诱导的EA.hy926细胞Fractalkine蛋白表达的影响Western blot结果显示,加抑制剂后SB203580+剪切应力组Fractalkine表达量较正常对照组低(图5)。

图3 剪切应力对p38 MAPK的磷酸化作用

图4 p38特异性抑制剂对低剪切应力诱导的EA.hy926细胞p38磷酸化水平的影响

图5 p38特异性抑制剂对低剪切应力诱导的EA.hy926细胞Fractalkine表达的影响
3 讨论
动脉粥样硬化斑块主要发生在动脉分支开口处外侧壁及动脉弯曲处[10]。已有研究表明剪切应力因素是动脉粥样硬化性疾病的内在的独立的物理因素[11]。动脉粥样硬化的好发部位,如动脉分叉处和血管弯曲处等为4 dyne/cm2左右。Fractalkine是1997年被发现的兼具有趋化和黏附的双重特殊性、并与多种炎症性疾病相关的趋化因子。它一直是趋化因子中研究比较活跃的领域。Cheng等[4]发现低剪切应力诱导鼠形成的AS斑块处有Fractalkine的表达。有研究表明,通过免疫组化的方法定位在造模不同时间的兔主动脉弓升部AS斑块处的Fractalkine及其受体CX3CR1蛋白表达,发现表达量明显增高[12]。这些研究结果均表明Fractalkine与AS病变的形成关系密切。在此过程中存在某种机械-生物化学信号转导机制来发挥作用,因此剪切应力对内皮细胞影响的信号转导过程成为研究热点。
研究表明,p38参与白细胞的趋化、炎症相关细胞与白细胞的黏附、细胞凋亡等生理或病理过程,其正常的生物活性对免疫和炎症反应至关重要。p38属应激激活的蛋白激酶。很多研究都证实,剪切应力可激活内皮细胞p38,从而启动相关基因的表达[13-14]。机械环境的变化以一种特殊的动力学方式诱导p38的活性[15]。还有研究证实,剪切应力可激活p38信号途径从而启动有关基因的表达[13]。本研究的核心问题是探讨p38信号转导途径是否参与了剪切应力刺激Fractalkine表达的过程。本实验已证实,低剪切应力(4.58 dyne/cm2)刺激EA.hy926细胞5 min后,p38蛋白磷酸化水平开始增强,作用时间延长到30 min时p38磷酸化水平达到峰值,继续延长刺激时间其磷酸化水平便开始降低,但刺激60 min时仍有明显的蛋白条带,而相应的总p38蛋白含量在各时间段的表达无明显差异。提示剪切应力调节p38的方式主要是通过刺激其磷酸化来实现的。SB203580是p38特异性抑制剂,其主要作用于p38的ATP结合活性位点,从而失去其与ATP结合的能力。本实验结果表明,SB203580可抑制p38MAPK的激活进而下调低剪切应力诱导的EA.hy926细胞Fractalkine蛋白表达。目前已有许多研究用p38 MAPK的抑制剂干预治疗相关疾病,取得了可喜的成果。随着研究的深入,本研究结果可能对动脉粥样硬化等心脑血管疾病的治疗提供理论依据。p38MAPK信号转导途径及其抑制剂的生物效应将更加清楚、明了,会取得更加广泛的临床应用前景。
参考文献:
[1]Liu H,Jiang D.Fractalkine/CX3CR1 and atherosclerosis[J].Clin Chem Acta,2011,412(13):1180-1186.
[2]D'Haese JG,Demir IE,Friess H,et al.Fractalkine/CX3CR1:why a single chemokine-receptor duo bears a major and unique therapeutic potential[J].Expert Opin Ther Targets,2010,14(2): 207-219.
[3]Liu H,Jiang D,Zhang S,et al.Aspirin inhibits fractalkine expression in atherosclerotic plaques and reduces atherosclerosis in ApoE gene knockoutmice[J].Cardiovasc Drugs Ther,2010,24 (1):17-24.
[4]Chatzizisis YS,Jonas M,Coskun AU,et al.Prediction of the localization of high-risk coronary atherosclerotic plaques on the basis of low endothelial shear stress an intravascular ultrasound and histopathology natural history study[J].Circulation,2008,117(8): 993-1002.
[5]Damås JK,Boullier A,Wæhre T,et al.Expression of fractalkine (CX3CL1)and its receptor,CX3CR1,is elevated in coronary artery disease and is reduced during statin therapy[J].Arterioscler Thromb Vasc Biol,2005,25(12):2567-2572.
[6]张奇,白晓东,付小兵.p38MAPK信号通路研究进展[J].感染、炎症、修复,2005,6(2):121-123.
[7]Shaik SS,Soltau TD,Chaturvedi G,et al.Low intensity shear stress increases endothelial ELR+CXC chemokine production via a focal adhesion kinase-p38MAPK-NF-κB pathway[J].J Biol Chem,2009,284(9):5945-5955.
[8]Wang Z,Zhang J,Li B,et al.MAPK signaling mediates low shear stress-induced oxidative damage in human umbilical vein endothelial cells in vitro[J].J South Med Univ,2014,34(5): 603-608.
[9]Cunningham KS,Gotlieb AI.The role of shear stress in the pathogenesis of atherosclerosis[J].Lab Invest,2005,85(1):9-23.
[10]Cheng M,Wu J,Liu X,etal.Low shear stress-induced interleukin-8mRNA expression in endothelial cells ismechanotransduced by integrinsand the cytoskeleton[J].Endothelium,2007,14 (6):265-273.
[11]Chatzizisis YS,Coskun AU,Jonas M,et al.Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling:molecular,cellular,and vascular behavior [J].JAm Coll Cardiol,2007,49(25):2379-2393.
[12]Ikejima H,Imanishi T,Tsujioka H,etal.Upregulation of fractalkine and its receptor,CX3CR1,is associated with coronary plaque rupture in patients with unstable angina pectoris[J].Circulation,2010,74(2):337-345.
[13]Riquelme MA,Burra S,Kar R,et al.Mitogen-activated Protein Kinase(MAPK)activated by prostaglandin E2 phosphorylates connexin 43 and closes osteocytic hemichannels in response to continuous flow shear stress[J].JBiol Chem,2015,290(47): 28321-28328.
[14]Yamawaki H,Pan S,Lee RT,et al.Fluid shear stress inhibits vascular inflammation by decreasing thioredoxin-interacting protein in endothelial cells[J].JClin Invest,2005,115(3): 733-738.
[15]聂永梅,陈槐卿.Fractalkine及其受体CX3CR1在兔动脉粥样硬化斑块处的蛋白表达增加[J].基础医学与临床,2010,30(2):200-202.
(本文编辑杨晨晨)
Effects of p38 inhibitor on protein expression of fractalkine induced by low shear stress in human umbilical vein endothelial cell line
Amanguli Ruze1,ZHAO Yiwei1,Gulireba Xiayimaidan2,WU Jiang1,NIE Yongmei1
(1Department of Physiology,Prellinial Medicine College,Xinjiang Medical University,Urumqi830011,China;2Electrocardiogram Room,the Second Affiliated Hospital,Xinjiang Medical University,Urumqi830063,China)
Abstract:Objective Fluid shear stress is a frictional force exerted parallel to the vessel wall,to investigate the impacts of SB203580,a specific inhibitor of p38,on the expression of Fractalkine in endothelial cells(ECs)induced by low shear stress.M ethods M199 growth medium(containing 1%penicillin-streptomycin combination and 10%fetal bovine serum)was used to culture the EA.HY926 cell line,after being cultured for two to five passages,were exposed to shear stress of 4.58 dyne/cm2 for different time(0,5,10,30 and 60 min).Cells were collected to extract total protein forwestern blotting analysis of p38 phosphorylation in different time.The inhibition level of p38 inhibitor on the phosphorylation of p38 was analyzed and then Fractalkine expression induced by low shear stress was detected.Results p38 phosphorylation was upregulated from the 5 min exposure of low shear stress(4.58 dyne/cm2)and reach to themaximum level at30min.And the p38 phosphorylation regulated protein expression of p38 by corresponding signal transduction pathway.Additionally,p38 activation and the Fractalkinebook=294,ebook=44expression induced by low shear stress was inhibited by SB203580.Conclusionp38 MAPK signaling pathways could be activated by low shear stress.The activated p38 involved in low shear stress-induced Fractalkine expression.Inhibitor of p38 downregulated the expression of Fractalkine under low shear stress.
Key words:EA.HY926 cell line;fluid shear stress;Fractalkine;p38 MAPK;p38 inhibitor
[收稿日期:2015-10-13]
通信作者:聂永梅,女,博士,教授,研究方向:心血管生理,E-mail:nieyongmei@163.com。
作者简介:阿曼古丽·如则(1989-),女(维吾尔族),硕士,研究方向:心血管生理。
基金项目:国家自然科学基金(11462022)
doi:10.3969/j.issn.1009-5551.2016.03.008
中图分类号:Q233
文献标识码:A
文章编号:1009-5551(2016)03-0293-05
