运动预干预通过增强杏仁核抗氧化能力及BDNF表达改善睡眠剥夺大鼠焦虑行为
2016-05-18崔建梅郭燕兰赵行瑞李鸿涛药红慧苏晓云
崔建梅,郭燕兰,赵行瑞,于 芳,李鸿涛,药红慧,苏晓云
运动预干预通过增强杏仁核抗氧化能力及BDNF表达改善睡眠剥夺大鼠焦虑行为
崔建梅1,郭燕兰1,赵行瑞1,于 芳1,李鸿涛2,药红慧3,苏晓云4
(1.中北大学体育学院,山西太原030051;2.山西省体科所,山西太原030012;3.太原学院体育系,山西太原030051;4.山西医科大学汾阳学院,山西汾阳032200)
目的:研究表明体育锻炼可以预防睡眠不足引起的焦虑行为,然而机制尚不清楚。因此,通过探讨4周跑台运动预干预对睡眠剥夺大鼠焦虑样行为的影响,并通过检测杏仁核氧化应激水平及BDNF的表达,探讨跑台运动影响睡眠剥夺大鼠焦虑样行为的可能机制。方法:实验前将大鼠随机分为安静组(S,n=10)、运动组(E,n=10)、安静睡眠剥夺组(SSD,n=10)和睡眠剥夺运动组(ESD,n=10)。除S及SSD组大鼠外,E及ESD组大鼠进行中等强度跑台运动预干预4周,随后采用小平台水环境法建立大鼠72h睡眠剥夺模型,然后运用高架十字迷宫实验评估大鼠焦虑样行为。焦虑样行为学测试结束后,检测大鼠杏仁核超氧化物歧化酶(SOD)及过氧化氢酶(CAT)的活性,计算杏仁核BDNF的表达。结果:与安静组比较,高架迷宫实验中,72 h睡眠剥夺导致大鼠闭合臂时间百分比CT%(P<0.01)及粪便颗粒(P<0.05)增多、(OE+CE)次数(P<0.01)及开放臂时间百分比OT%(P<0.01)均显著减少,杏仁核SOD、CAT活性(P<0.01,P<0.01)及BDNF表达均显著下降(P<0.01)。而适度的跑台运动预干预可削弱睡眠剥夺引起的焦虑行为,杏仁核BDNF表达显著提升(P<0.05),抗氧化酶SOD及CAT的活性增强(P<0.05,P<0.05)。结论:规律跑台运动预干预可以通过提高睡眠剥夺大鼠杏仁核BDNF表达及抗氧化能力,对杏仁核相关功能产生保护作用,削弱睡眠剥夺大鼠的焦虑样行为。
跑台运动;焦虑行为;脑源性神经营养因子;氧化应激;睡眠剥夺
Key w ords:treadm ill exercise;anxiety behavior;BDNF;oxidative damage;sleep deprivation
人类及动物的研究表明,睡眠可以增强神经毒物的清除,促进与学习记忆相关的突触的形成和维护,因此对大脑功能至关重要,尤其是认知能力,然而睡眠的确切功能尚不清楚[1]。统计表明成年人中绝大多数没有足够的睡眠,仅在美国,至少有1亿人受到与睡眠不足相关疾病的影响[2]。临床研究证实,睡眠不足会引起焦虑,甚至加重焦虑,导致警惕性下降、注意力不集中等认知功能损害。事实上,70%的睡眠不足患者患有焦虑症[3]。在动物模型中,通过行为学实验,证实睡眠不足会引起大鼠焦虑样行为[4],然而睡眠剥夺引起焦虑样行为的确切机制目前还不清楚。
最近研究表明,睡眠不足可能增加大脑多个区域,包括海马、前额叶皮质及杏仁核氧化应激的风险,导致活性氧(ROS)生成与内源性抗氧化防御系统的不平衡,最终引起神经和细胞损伤[5]。杏仁复合体(amygdaloid body)位于皮层下边缘结构,不仅参与记忆、注意力及感知的情感表达等复杂功能,并且在调节情绪刺激的行为反应及调节睡眠机制方面起重要作用[6]。证据表明,杏仁核在焦虑行为的整合与协调方面起关键作用,直接参与焦虑样行为的调节[7]。因此可以假设睡眠剥夺后杏仁核自由基的增加或许与睡眠剥夺引起的焦虑样行为变化有关。
脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是一种与神经发生、突触可塑性和细胞生存密切相关的神经营养因子,在神经保护和认知功能方面起关键作用。一些研究表明,脑源性神经营养因子BDNF可能是睡眠的调控物质。而且Zielinski等通过高架迷宫实验证实睡眠剥夺引起的焦虑样行为与海马BDNF表达下降有关[8],但是目前尚不清楚睡眠剥夺对杏仁核BDNF变化是否出现类似的变化。
各种流行病学和动物研究表明,运动锻炼对很多慢性疾病均有有益影响,如阿尔茨海默病和痴呆以及促进脑损伤功能恢复[9]。一些学者认为,运动锻炼具有抗焦虑作用。有些研究认为运动锻炼可以加剧睡眠不足大鼠的心理及认知功能损害[10]。最近证据表明,规律的跑台运动预干预可以通过诱导海马BDNF表达改善睡眠剥夺对大鼠焦虑样行为的负面影响[11],但是运动预干预对睡眠剥夺大鼠焦虑行为的影响是否与杏仁核氧化应激损害及BDNF表达变化有关,目前文献较少涉及。因此,本研究主要解决睡眠不足引起的焦虑行为是否与杏仁核氧化应激水平及BDNF蛋白的表达有关,以及确定跑台运动预干预是否通过调节杏仁核氧化应激及上调BDNF的表达改善大鼠焦虑行为。
1 研究材料与方法
1.1 动物及分组
SD雄性大鼠40只,2月龄,体质量200~230 g。实验前将大鼠随机分为安静组(sedentary,S;n=10)、运动组(exercise,E;n=10)、安静睡眠剥夺组(sedentary sleep deprived,SSD;n=10)和睡眠剥夺运动组(exercise sleep-deprived,ESD;n=10)。将大鼠放在标准树脂鼠笼中,3只大鼠同处一笼;大鼠可自由获取食物及水。
1.2 跑台训练安排
根据Zagaar等[12]描述的方法,E及ESD组大鼠递增负荷跑台运动4w(0坡度),时间及速度具体安排如图1。
1.3 睡眠剥夺SD(sleep deprivation)模型建立
跑台运动结束后SSD组及ESD组大鼠制备SD模型。按照前期学者的操作方法略作修改[11],具体方法如下:大鼠放在睡眠剥夺箱(30×30×30 cm)内的平台(高8.0 cm,直径7.0 cm)顶部。当大鼠进入REM(快速眼动睡眠阶段)时,由于肌肉张力下降大鼠不能维持站立状态时导致触水惊醒。为了使大鼠学会在平台上平衡自己及避免SD时掉入水中,正式实验前大鼠适应水环境平台3 d(1 h/d)。
1.4 焦虑样行为检测
本研究中根据以前学者描述的高架迷宫实验[12](elevated-plusmaze)评估大鼠焦虑行为。高架迷宫(包括两个开放臂和两个闭合臂)置于距离地面50 cm,大鼠被放置在迷宫的中心区探索迷宫5 min。记录指标:开放臂时间OT%(OT,open arm time)及闭合臂时间CT%(CT,close arm time)百分比;粪便颗粒(fecalparticles,number);开放臂及闭合臂总次数(OE+CE)评价大鼠运动能力。
1.5 杏仁核自由基SOD、CAT活性检测
高架迷宫实验结束后,将每组6只大鼠称重后断头处死,冰上快速分离杏仁核后制成10%的组织匀浆,离心后取上清液测定杏仁核超氧化物歧化酶(SOD)及过氧化氢酶(CAT)活性。
1.6 杏仁核BDNF免疫组化染色
高架迷宫实验结束后,每组4只大鼠经常规灌注取脑,石蜡包埋脑组织行大鼠杏仁核冠状位切片(5μm),切片脱蜡、水化,PBS磷酸盐缓冲液将切片漂洗5min×3次,加3%双氧水室温放置5min以灭活内源性酶,滴加BDNF一抗(兔抗鼠多克隆抗体1:00)、4℃过夜,PBS液漂洗后滴加BDNF二抗(山羊抗兔IgG生物素),恒温箱37℃孵育30 min,随后显色(10 min)、脱水(5 min)、透明(10 min),封片,自然晾干。
每组每张切片取5个视野采集图像,测量大鼠杏仁核BDNF表达阳性细胞数(number)及面积(μm2)。
1.7 统计分析
使用SPSS 18.0统计软件进行统计分析,组间比较采用单因素方差分析,以P<0.05表示差异具有显著性。所有数据结果均采用平均数±标准差表示。
2 研究结果
2.1 跑台运动预干预对SSD大鼠焦虑样行为的影响
由图2结果可知:高架迷宫实验中,与S组比较,SSD组大鼠开放臂停留时间百分比OT%(15.26 ±3.17)%,显著下降(P<0.01),闭合臂停留时间百分比CT%(65.36±13.65)%,显著增加(P<0.01),(闭合臂+开放臂)次数(5.86±0.79)次,显著下降(P<0.01),粪便颗粒(3.67±0.39)颗,增多(P<0.05);而跑台运动使睡眠剥夺大鼠CT%(52.79±14.86)%,及粪便颗粒(2.46±0.16)颗,均显著降低(P<0.05),(闭合臂+开放臂)次数(8.88±1.67)次,显著增加(P<0.05),而跑台运动对睡眠剥夺大鼠开放臂停留时间百分比OT%(16.46±4.78)%,无显著影响(P>0.05);但是运动对正常大鼠所有指标均无显著影响(P>0.05)。
2.2 跑台运动预干预对SSD大鼠杏仁核氧化应激的影响
图3结果显示,与S组比较,SSD组大鼠杏仁核SOD活性及CAT活性均显著下降(P<0.01,P<0.01),下降幅度分别为36.95%及39.88%;而跑台运动可显著减弱睡眠剥夺大鼠的氧化应激;与SSD组大鼠比较,ESD组大鼠杏仁核SOD活性及CAT活性均显著增加(P<0.05,P<0.05),增强幅度分别为30.41%及51.13%;E组与S组比较,SOD活性及CAT活性均无显著差异(P>0.05,P>0.05)。
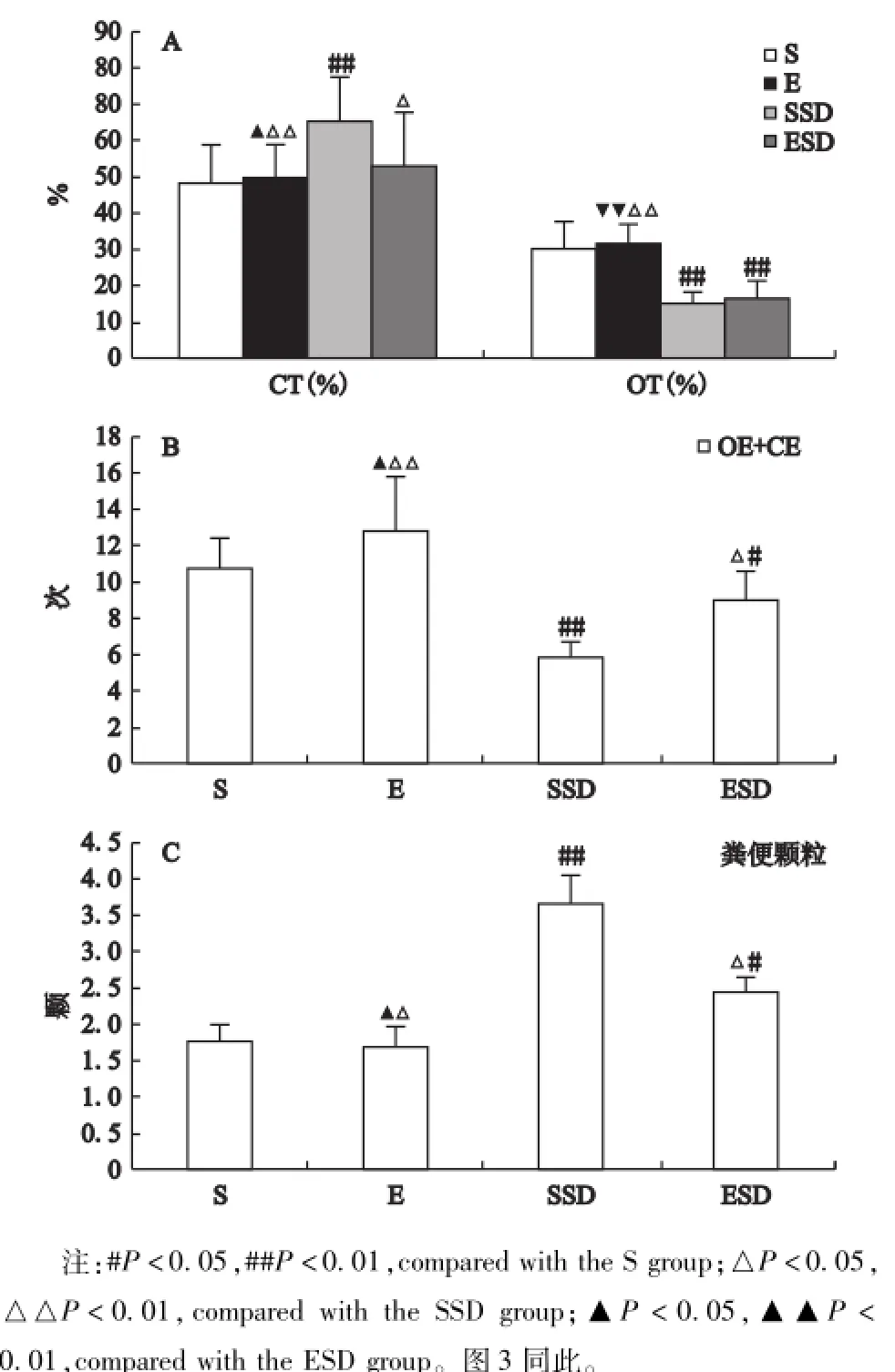
图2 大鼠高架十字迷宫中CT%、OT%、CE+OE及粪便颗粒实验结果

图3 大鼠杏仁核SOD及CAT结果
2.3 跑台运动预干预对SSD大鼠杏仁核BDNF表达的影响
与S组比较,72 h睡眠剥夺使杏仁核BDNF面积(2239.37±400.98)μm2,及数目(18.92±3.48)个,均显著减少(P<0.01,P<0.01),下降幅度分别为45.74%及47.28%;而跑台运动预干预明显纠正了睡眠剥夺引起的杏仁核BDNF的下降,ESD组大鼠与SSD大鼠比较杏仁核BDNF表达显著上调(P<0.05),BDNF面积及数目增加幅度分别为40.16%及39.22%。E组与S组比较杏仁核BDNF表达无显著差异(P>0.05)。

表1 跑台运动预干预对SSD大鼠杏仁核BDNF表达的影响(¯X±S,n=4)
图4 A 杏仁核冠状位图,箭头所示
图4 B 杏仁核BDNF表达(10×4,10×40)
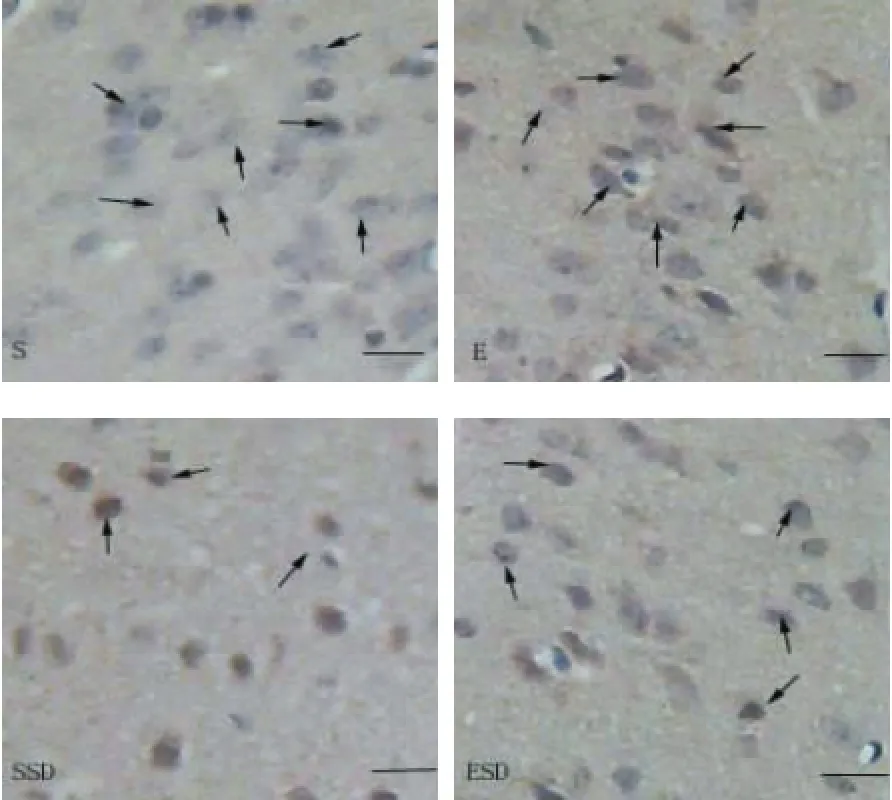
图5 睡眠剥夺可以减少杏仁核BDNF的水平,而跑台运动预干预可增加睡眠剥夺大鼠杏仁核BDNF的水平
3 讨论
临床研究表明,睡眠剥夺与消极情绪状态密切相关,长期睡眠不足会导致人类病理性焦虑,事实上睡眠剥夺患者70%患焦虑症[14]。Franzen等研究发现24 h睡眠剥夺的人比睡眠正常的人积极情绪减少而消极情绪增加[15],而健康自愿者连续睡眠剥夺56 h会增加焦虑、抑郁及偏执症状[16]。并且通过睡眠剥夺的各种动物模型表明缺乏睡眠会导致高焦虑行为。高架迷宫实验是评价动物焦虑行为的可靠指标,通过高架迷宫实验证实72h睡眠剥夺显著增加了大鼠的焦虑样行为,具体表现为高架迷宫实验中SSD大鼠开放臂时间百分比及(开放臂+闭合臂)次数显著下降、闭合臂时间百分比及粪便颗粒显著增加,与上述学者研究结果一致。研究表明,体育锻炼对改善焦虑和抑郁症状及对抗应激均有有益的影响。临床研究认为焦虑症状改善或许是运动影响睡眠的可能机制[18]。动物实验证实,跑台运动及自愿转轮运动训练可以改善大鼠的焦虑行为,增加高架迷宫实验中睡眠剥夺大鼠开放臂的时间及次数[19]。本研究得到相同结果,4周跑台运动预干预可显著改善睡眠剥夺大鼠的焦虑行为,表现为高架迷宫实验中睡眠剥夺大鼠闭合臂时间百分比及粪便颗粒显著减少,(开放臂+闭合臂)次数增加,结果提示跑步机锻炼对睡眠剥夺大鼠具有保护作用。
据报道,氧化应激与抑郁、焦虑样行为及其他精神疾病的病理生理学发展有关,可以调节学习记忆、焦虑、抑郁等行为变化[20-21]。而研究普遍认为,清醒时ROS(活性氧)产生,睡眠时被清除,因此睡眠在消除睡眠/唤醒周期抗氧化作用方面扮演重要作用。杏仁核被认为是焦虑性和情感性行为至关重要的神经调节中枢,因此本研究聚焦杏仁核,证实急性72 h睡眠剥夺通过下调杏仁核SOD(超氧化物歧化酶)及CAT(过氧化氢酶)的活性显著增强了杏仁核的氧化应激,导致氧自由基过度积累损害杏仁核功能,而杏仁核结构和功能的改变可能与睡眠剥夺大鼠焦虑样行为有关。研究认为,氧化应激会引起认知功能下降及焦虑行为,而适度跑台运动已经被证明可以降低氧化应激引起的焦虑样行为,表明体育锻炼是治疗焦虑和情绪障碍疾病有效及成本最低的方法之一[22]。Cechetti等研究认为,体育锻炼可以通过增强睡眠不足大鼠抗氧化酶包括超氧化物歧化酶SOD1、SOD-2及谷胱甘肽过氧化物酶(GPx)的活性减少氧化应激和焦虑行为,提示运动锻炼可提高睡眠不足大鼠的抗氧化能力[23]。本研究发现4周中等强度跑台运动预干预可显著逆转睡眠剥夺导致的杏仁核氧化损伤,杏仁核抗氧化酶SOD及CAT活性均显著增强,表明此运动具有抗氧化作用,因此杏仁核抗氧化能力增强至少在一定程度上可能与跑台运动改善睡眠剥夺大鼠焦虑样行为有关。
BDNF是调节中枢神经系统功能以及突触传递及可塑性的重要神经营养因子,在神经细胞生存、维护和神经元的生长方面发挥重要作用,并且对各种神经性损伤及神经退行性疾病均有神经保护作用,与焦虑障碍的病理生理学发展有关[24]。前期研究认为,脑源性神经营养因子的变化与睡眠不足导致的神经可塑性变化密切相关,但是有关睡眠剥夺对大脑BDNF表达的变化是有争议的。有学者研究认为,睡眠剥夺6 h对海马BDNF水平无显著变化,但可抑制小脑和脑干BDNF的表达[25],而睡眠剥夺8至48 h海马脑源性神经营养因子mRNA水平及蛋白含量均显著下降[26]。Lee等研究认为,短期睡眠不足可以上调大脑不同区域BDNF的表达,而异相睡眠剥夺对大鼠BDNF表达的没有改变[27]。本研究对大鼠的剥夺时间为72 h,结果发现72 h睡眠剥夺显著削弱了大鼠杏仁核BDNF表达,与Alhaider等学者研究结果一致[28]。临床研究证实,BDNF基因变异导致脑源性神经营养因子的分泌减少与焦虑障碍等神经精神疾病密切相关,因此,本实验中72 h睡眠剥夺大鼠焦虑样行为可能与杏仁核BDNF表达下降有关。
研究表明,运动锻炼可以改变某些神经递质及神经蛋白的表达。脑源性神经营养因子BDNF众所周知在成人大脑突触可塑性及神经发生中发挥重要作用,被认为是运动干预最重要的调节因子之一[29]。Saadati等研究认为,规律的跑台运动预干预可以通过上调海马BDNF表达对睡眠不足诱导的海马相关功能损害起到保护作用[11]。本研究也证实了4周跑台运动预干预可显著上调睡眠剥夺大鼠杏仁核BDNF的表达,并且睡眠剥夺大鼠焦虑行为显著改善。最近研究报道,BDNF可以通过增强氧化物歧化酶SOD活性从而提高大脑抗氧化能力[30],WU等报道高脂肪饮食导致的氧化应激损伤与BDNF表达减弱有关,而抗氧化剂维生素E可以通过提高抗氧化能力使BDNF水平恢复到正常水平[31],以上研究表明,氧化应激与BDNF相互影响在精神障碍疾病的病理发展中发挥重要作用。因此,可以推测本实验中跑台运动通过降低杏仁核氧化应激调节BDNF通路增强杏仁核BDNF表达从而增强杏仁核神经元的营养,改善睡眠剥夺大鼠的焦虑样行为,具体机制需进一步研究。
4 结论
4周跑台运动预干预可以通过降低杏仁核氧化应激调节BDNF信号通路增强杏仁核脑源性神经营养因子BDNF表达,增强杏仁核神经元的营养起到脑保护作用,从而减少睡眠剥夺大鼠的焦虑样行为。因此,本研究结果提供了体育锻炼改善睡眠不足焦虑样行为的分子机制,证实了体育锻炼是治疗焦虑和情绪障碍疾病的有效方法之一。
[1]Wei Zhao,Jun Wang,Weina Bi,et al.Novel application of braintargeting polyphenol compounds in sleep deprivation-induced cognitive dysfunction[J].Neurochemistry International,2015,89:191-197.
[2]Centers for Disease Control and Prevention(CDC).Effect of short sleep duration on daily activities-United States,2005-2008[J]. MMWRMorb MortalWkly Rep,2011,60(8):239-242.
[3]McCoy JG,Strecker RE.The cognitive costof sleep lost[J].Neurobiology of Learning and Memory,2011,96:564-582.
[4]MR.Zielinski,JM Davis,JR Fadel,et al.Influence of chronic moderate sleep restriction and exercise training on anxiety,spatialmemory,and associated neurobiologicalmeasures in mice[J].Behavioural Brain Research,2013,250:74-80.
[5]Takuya Kanamaru,Naomi Kamimura,Takashi Yokota,et al.Oxidative stress accelerates amyloid deposition and memory impairment in a double-transgenic mousemodel of Alzheimer’s disease[J].Neuroscience Letters,2015,587:126-131.
[6]Kumar A,Singh A,Kumar P.Possible involvement of GABAergic mechanism in protective effect ofmelatonin against sleep deprivation-induced behavior modi?cation and oxidative damage in mice[J].Indian JExp Biol,2011,49(3):211-218.
[7]M Davis,DLWalker,L Miles,et al.Phasic vs sustained fear in rats and humans:role of the extended amygdala in fear vs anxiety[J]. Neuropsychopharmacology,2010,35:105-135.
[8]ZielinskiMR,Davis JM,Fadel JR,etal.Influence of chronicmoderate sleep restriction and exercise training on anxiety,spatialmemory,and associated neurobiological measures in mice[J].Behav Brain Res,2013,250:74-80.
[9]Lalanza JF,Sanchez-Roige S,Gagliano H,et al.Physiological and behavioural consequences of long-term moderate treadmill exercise[J].Psychoneuroendocrinology,2012,37:1745-1754.
[10]Vollert C,Zagaar M,Hovatta I,et al.Exercise prevents sleep deprivation-associated anxiety-like behavior in rats:potential role of oxidative stress mechanisms[J].Behavioural Brain Research,2011,224:233-240.
[11]Saadati H,Sheibani V,Esmaeili-Mahani S,etal.Prior regular exercise reverses the decreased effects of sleep deprivation on brain-derived neurotrophic factor levels in the hippocampus of ovariectomized female rats[J].Regulatory Peptides,2014(194-195):11-15.
[12]Zagaar M,Alhaider I,Dao A,et al.The beneficial effects of regular exercise on cognition in REM sleep deprivation:behavioral,electrophysiological and molecular evidence[J].Neurobiol Dis,2012,45(3):1153-1162.
[13]Suchecki D,Tiba PA,Tu?k S.Hormonal and behavioral responses of paradoxical sleep-deprived rats to the elevated plus maze[J].J Neuroendocrinol,2002,14:549-554.
[14]P Sagaspe,M Sanchez-Ortuno,A Charles,et al.Effects of sleep deprivation on Color-Word,Emotional,and Specific Stroop interference and on self-reported anxiety[J].Brain Cogn,2005,60:76-87.
[15]PL Franzen,GJSiegle,DJBuysse.Relationships between affect,vigilance,and sleepiness following sleep deprivation[J].Journal of Sleep Research,2008,17:34-41.
[16]ET Kahn-Greene,DB Killgore,GH Kamimori,et al.The effects of sleep deprivation on symptoms of psychopathology in healthy adults[J].Sleep Medicine,2007,8:215-221.
[17]PY Yang,KH Ho,HCChen,et al.Exercise training improves sleep quality in middle-aged and older adults with sleep problems:a systematic review[J].Journal of Physiotherapy,2012,58(3):157-163.
[18]SD Youngstedt,CE Kline.Epidemiology of exercise and sleep[J]. Sleep and Biological Rhythms,2006(3):215-221.
[19]Fulk LJ,Stock HS,Marshall JD,et al.Chronic treadmill training reduces acute anxiety-related behaviors in rats[J].Int JSports Med,2003,24:1-5.
[20]JK Kiecolt-Glaser,ESEpel,MA Belury,et al.Omega-3 fatty acids,oxidative stress,and leukocyte telomere length:a randomized controlled trial[J].Brain,Behavior,and Immunity,2013,28:16-24.
[21]Singh R,Kiloung J,Singh S,et al.Effect of paradoxical sleep deprivation on oxidative stress parameters in brain regions of adult and old rats[J].Biogerontology,2008,9(3):153-162.
[22]SSalim,N Sarraj,M Taneja,et al.Moderate treadmill exercise prevents oxidative stress-induced anxiety-like behavior in rats[J].Behav Brain Res,2010,208:545-552.
[23]F Cechetti,PV Woem,VR Elsner,et al.Forced treadmill exercise prevents oxidative stress andmemory deficits following chronic cerebral hypoperfusion in the rat[J].Neurobiology of Learning and Memory,2012,97:90-96.
[24]AH Nagahara,DA Merrill.Neuroprotective effects of brain-derived neurotrophic factor in rodent and primate models of Alzheimer’s disease[J].Nature Medicine,2009,15(3):331-337.
[25]H Sei,D Saitoh,K Yamamoto,et al.Differential effect of short-term REM sleep deprivation on NGF and BDNF protein levels in the rat brain[J].Brain Research,2000,877:387-390.
[26]R Guzman-Marin,Z Ying,N Suntsova,et al.Suppression of hippocampal plasticity-related gene expression by sleep deprivation in rats[J].Journal of Physiology,2006,575:807-819.
[27]KSLee,TA Alvarenga,C Guindalini,et al.Validation of commonly used reference genes for sleep-related gene expression studies[J]. BMCMol Biol,2009,10:45-53.
[28]IA Alhaider,AM Aleisa,TTTran,et al.Caffeine prevents sleep lossinduced deficits in long-term potentiation and related signalingmolecules in the dentate gyrus[J].European Journal of Neuroscience,2010,31:1368-1376.
[29]CW Cotman,NC Berchtold,LA Christie.Exercise builds brain health:key roles of growth factor cascades and inflammation[J]. Trends Neurosci,2007,30:464-472.
[30]F Kapczinski,BN Frey,AC Andreazza,et al.Increased oxidative stress as amechanism for decreased BDNF levels in acutemanic episodes[J].Rev Bras Psiquiatr,2008,30(3):243-245.
[31]A Wu,Z Ying,F Gomez-Pinilla.The interplay between oxidative stress and brain-derived neurotrophic factor modulates the outcome of a saturated fat diet on synaptic plasticity and cognition[J].Eur J Neurosci,2004,19(7):1699-1707.
责任编辑:郭长寿
Prior Exercise Im pairm ents Anxiety-Like Behavior and Increase in Amygdala Antioxidant Capacity and BDNF Exp ression in Sleep Dep rived Rats
CUIJianmei1,GUO Yanlan1,ZHAO Xingrui1,YU Fang1,LIHongtao2,YAO Honghui3,SU Xiaoyun4
(1.School of P.E.,North University of China,Taiyuan 030051,Shanxi,China;2.Shanxi Research Institute of Sports Science,Taiyuan 030012,Shanxi,China;3.P.E.Department,Taiyuan University,Taiyuan 030051,Shanxi,China;4.Fenyang College,ShanxiMedical University,Fenyang 032200,Shanxi,China)
Objetive:Evidence suggests that treadm ill exercise can protect sleep deprivation induced anxiety-like behavior. However themechanism isunclear.So we examined the impactof 4 weeks of prior regular treadm ill exercise on sleep deprivation induced anxiety-like behavior and possiblemechanism by detecting oxidative stress level and calculating BDNF expression of the rat amygdala.Methods:The rats were random ly divided into the following subgroups:the sedentary group(S),the exercise group(E),sedentary sleep deprived group(SSD)and exercise sleep-deprived group(ESD).E and ESD rats were exposed to 4 weeks of regular treadm ill exercise,and then subsequently were deprived of sleep for 72 h using small platform method.Then elevated plus-maze test(EPM)were used to evaluate the anxiety-like behavior of rats;antioxidant enzymes SOD and CAT activities in amygdala were exam ined and amygdala BDNF expression was calculated. Results:Compared with S group,CT%and fecal particles increased(P<0.01,P<0.05),(OE+CE)numbers(P<0.01)and OT%(P<0.01)significantly decreased in EPM test of SSD group rats;SOD and CAT activities and BDNF expression significantly reduced after72 h sleep deprivation in SSD rats compared with the S groups.Results showed that sleep-deprived rats undermoderate treadm ill significantly attenuated sleep deprivation induced anxiety-like behavior,BDNF expression had a signi?cantup-regulation(P<0.05)and SOD,CAT activities in amygdala significantly enhanced(P<0.05,P<0.05).Conclusion:prior regular exercise can exert a protective effect on amygdala-related functions and impairments anxiety-like behavior induced by sleep deprivation probably by inducing BDNF expression and decreasing oxidative damage in amygdala.
G804.55
A
1004-0560(2016)03-0079-06
2016-04-27;
2016-05-21
国家自然科学基金项目(30671019);山西省自然科学基金项目(2014011041-6)。作者简介:崔建梅(1972—),女,讲师,硕士,主要研究方向为运动与中医康复。
于 芳(1968—),女,教授,硕士,主要研究方向为运动与中医康复。
