一种准确测定热轧钢板酸洗模拟液中盐酸浓度的方法
2016-05-16沈少波毛尚伟
罗 坤,沈少波,毛尚伟
(1.北京科技大学冶金与生态工程学院,北京100083; 2.重庆赛迪冶炼装备系统集成工程技术研究中心有限公司,重庆401122)
一种准确测定热轧钢板酸洗模拟液中盐酸浓度的方法
罗 坤1,沈少波1,毛尚伟2
(1.北京科技大学冶金与生态工程学院,北京100083; 2.重庆赛迪冶炼装备系统集成工程技术研究中心有限公司,重庆401122)
摘 要:用EDTA-Ca、KSCN以及NH4SCN作为有Fe(2+)存在的热轧钢板酸洗模拟溶液中Fe(2+)掩蔽剂,用NaOH滴定法测定溶液中盐酸的浓度,并记录溶液p H值随NaOH溶液消耗的体积变化,选择相应的曲线段的数学拐点作为滴定终点。结果发现这些掩蔽剂的加入都可使测定误差降低,测量误差从18.75%(没有掩蔽剂)分别降低为-7.9%,3.1%和0.2%,很显然,NH4SCN掩蔽效果很好。NH4SCN作为亚铁离子掩蔽剂,用在Fe(2+)存在的酸性溶液中盐酸浓度测定,这之前未见报导。该方法具有操作简单、准确的特点。
关键词:盐酸浓度测定;热轧钢板酸洗液;亚铁离子掩蔽剂;硫氰酸铵
1 引言
钢厂通常采用盐酸酸洗去除热轧钢板表面的氧化铁皮[1],酸液浓度对酸洗效果起着至关重要的影响。目前,钢厂普遍采用在线测量的方法检测酸液浓度,该方法根据实验测定酸液密度、电导率和温度三者与实际盐酸浓度建立关系,从而得出酸液浓度的计算经验公式[2]。由于经验公式只能在实验室或钢铁厂通过实验获得,而准确测定酸洗液中盐酸浓度对建立经验公式十分重要[2,3,4],因此必须找到合适的方法准确测定室温下酸洗液中HCl浓度[4]。虽然已经有一些测定锅炉酸洗过程等相关酸浓度的方法[3,5-13],但文献中鲜有提出准确测定热轧带钢酸洗溶液中HCl浓度的记录。因此,下面提出一种准确测定热轧钢板酸洗模拟液中盐酸浓度的方法。
酸洗时,酸液中HCl浓度随着酸洗进行不断下降,而Fe2+和Fe3+浓度不断升高,随着温度的升高Fe2+也会被氧化成Fe3+[3],但检测发现酸洗槽中主要还是Fe2+,因此用HCl+ FeCl2溶液来模拟实际酸洗液。实验室一般采用NaOH滴定法来测定盐酸浓度,然而盐酸酸洗时盐酸与氧化铁皮反应生成的Fe2+和Fe3+会与NaOH形成沉淀,消耗额外的OH-,从而导致滴定结果偏高[3,4,6,7]。因此在酸洗液的盐酸浓度测定时,需要使用掩蔽剂来掩蔽Fe2+和Fe3+[6,7]。前人研究结果表明,采用柠檬酸铵和氟化钾作掩蔽剂[6,7]时,虽然能掩蔽Fe2+和Fe3+,但是柠檬酸铵和氟化钾溶解时会因水解而显碱性,从而导致滴定终点结果比实际偏低;用碳酸钠、硫代硫酸钠作为掩蔽剂[3,4],会使滴定终点结果偏大;在搪瓷酸液洗盐酸浓度测定时,EDTACa是一个很好的铁离子掩蔽剂[3]。然而,在热轧带钢酸洗液测定中并没有用EDTA-Ca用作铁离子的掩蔽剂。同时我们发现在测定热轧带钢酸洗液中盐酸浓度时,硫氰酸盐是一个更好的铁离子掩蔽剂,然而这项研究从来没有报道过。因此,在本文中,研究EDTA-Ca、KSCN和NH4SCN几种比较新颖的热轧带钢酸洗溶液中亚铁离子掩蔽剂对铁离子的掩蔽效果。当用NaOH滴定盐酸,通常用酚酞作终点滴定指示剂。在滴定终点p H值为8.3左右时,酚酞的颜色会由无色变为红色。由于铁离子与硫氰酸根离子的络合物也是红色,会干扰酚酞滴定终点颜色变化。因此实验中不能用酚酞作为指示剂,可通过p H值计测定酸洗溶液随NaOH滴定体积变化的p H值,然后绘制p H随NaOH滴定体积变化的曲线,选择相应的曲线段的数学拐点作为滴定终点。
2 仪器与试剂
PHS-CW数显台式酸度计;
NaOH标准溶液(CNaOH=1.01mol/L) 1。准确称量4.055 6g NaOH于50m L烧杯中以适量的蒸馏水溶解,转移至100ml容量瓶,定容。然后用基准邻苯二甲酸氢钾标定(CC8H5O4K=0.20mol/L)。
NaOH标准溶液(CNaOH=2.52mol/L) 2。准确称量10.083 6g NaOH于50m L烧杯中以适量的蒸馏水溶解,转移至100ml容量瓶,定容。然后用基准邻苯二甲酸氢钾标定(CC8H5O4K=0.20mol/L)。
NaOH标准溶液(CNaOH=0.98mol/L) 3。准确称量20.004 5g NaOH于50m L烧杯中以适量的蒸馏水溶解,转移至500ml容量瓶,定容,然后用基准邻苯二甲酸氢钾标定(CC8H5O4K=0.20mol/L)。
HCl(CHCl=1.07mol/L)溶液A。用移液枪准确量取10ml浓盐酸(AR)于50m L烧杯中以适量蒸馏水稀释,转移烧杯中溶液至100ml容量瓶,定容,用标准NaOH溶液1标定。
HCl(CHCl = 1.07mol/L)+ FeCl2(CFeCl2=0.56mol/L)溶液B。用移液枪准确量取10ml浓盐酸(AR)于50m L烧杯中以适量蒸馏水稀释;准确称量11.102 1g FeCl2·4H2O,然后加入烧杯,溶解,转移烧杯中溶液至100ml容量瓶中,定容。
HCl(CHCl=3.16mol/L)溶液C。用移液枪准确量取27.1ml浓盐酸(AR)于50m L烧杯中以适量蒸馏水稀释,转移烧杯中溶液至100ml容量瓶中,定容,用标准NaOH溶液1标定。
HCl(CHCl= 3.16mol/L)+ FeCl2(CFeCl2=0.56mol/L)溶液D。用移液枪准确量取27.1ml浓盐酸(AR)于50m L烧杯中以适量蒸馏水稀释;准确称量11.103 2g FeCl2·4H2O,然后加入烧杯,溶解,转移烧杯中溶液至100ml容量瓶中,定容。
EDTA-Ca(CEDTA-Ca=0.1mol/L)溶液E。将50m L的0.2 mol/L CaCO3(用HCl溶解)溶液与50m L的0.2mol/L EDTA标准溶液混匀,然后加入甲基橙指示剂,用10%NaOH溶液中和至橙黄色为止。
3mol/L KSCN溶液F。准确称量72.750 2g KSCN于烧杯中以适量的蒸馏水溶解,转移至250ml容量瓶,定容。
3mol/L NH4SCN溶液G。准确称量57.324 2g NH4SCN于烧杯中以适量的蒸馏水溶解,转移至250ml容量瓶,定容。
3 实验方法
3.1 实验1(无掩蔽剂时钢板酸洗液中盐酸浓度测定)
取8ml A容量瓶(CHCl=1.07mol/L)中酸液于250ml锥形瓶1中,加水稀释至100ml;取8mlB容量瓶(CHCl=1.07mol/L; CFeCl2=0.56mol/L)中酸液于250ml锥形瓶2中,加水稀释至100ml;然后用碱式滴定管中标准NaOH溶液1(CNaOH=1.01mol/L)分别滴定锥形瓶1和2溶液,记录溶液p H值随NaOH标准溶液1消耗量的变化。
3.2 实验2(掩蔽剂EDTA-Ca存在时钢板酸洗液中盐酸浓度测定)
分别取8ml C容量瓶(CHCl=3.16mol/ L)中酸液于250ml锥形瓶3、4中,分别加水稀释至100ml;取8ml D容量瓶中(CHCl= 3.16mol/L;CFeCl2=0.56mol/L)酸液于250ml锥形瓶杯5中,加水稀释至100ml。往锥形瓶3中加入50ml蒸馏水,往烧杯4和5中分别加入50ml 0.1mol/L EDTA-Ca溶液。然后用碱式滴定管中标准NaOH溶液2 (CNaOH=2.52mol/L)分别滴定锥形瓶3、4 和5溶液,分别记录溶液p H随NaOH标准溶液2消耗量的变化。
3.3 实验3(掩蔽剂KSCN存在时钢板酸洗液中盐酸浓度测定)
分别取8ml C容量瓶(CHCl=3.16mol/ L)中酸液于250ml锥形瓶6和7中,分别加水稀释至100ml;取8mlD容量瓶(CHCl= 3.16mol/L;CFeCl2=0.56mol/L)中酸液于250ml锥形瓶8中,加水稀释至100ml。往烧杯6中加20ml蒸馏水,往烧杯7和8中加入20ml 3mol/L KSCN溶液。然后用碱式滴定管中标准NaOH溶液3(CNaOH=0.98mol/ L)分别滴定锥形瓶6、7、8中溶液,记录溶液p H随NaOH标准溶液3消耗量的变化。
3.4 实验4(掩蔽剂NH4SCN存在时钢板酸洗液中盐酸浓度测定)
取8ml C容量瓶(CHCl=3.16mol/L)中酸液于250ml锥形瓶9中,加水稀释至100ml;取8mlD容量瓶(CHCl=3.16mol/L; CFeCl2=0.56mol/L)中酸液于250ml锥形瓶10中,加水稀释至100ml。往烧杯9和10中分别加入20ml 3mol/L NH4SCN。然后用碱式滴定管中标准NaOH溶液3(CNaOH= 0.98mol/L)分别滴定锥形瓶9和10溶液,记录溶液p H随NaOH标准溶液3消耗量的变化。
然后利用公式1,计算实验1至实验4酸洗液中盐酸浓度:

式中:CHCl—酸洗液中盐酸的浓度, mol/L;VNaOH—滴定消耗的Na OH标准溶液体积,m L;CNaOH—Na OH标准溶液浓度, mol/L;V酸—酸洗液体积,m L。
4 结果与讨论
4.1 无掩蔽剂时钢板酸洗液中盐酸浓测度定实验1的结果见图1。当没有屏蔽剂时,用NaOH标准溶液1(CNaOH=1.01mol/L)分别滴定溶液A(CHCl=1.07mol/L)和溶液B(CHCl=1.07mol/L;CFeCl2=0.56mol/ L),滴定终点的p H值分别为3.34和9.97,此时分别消耗8.48 m L和10.07m LNaOH标准溶液1。当存在氯化亚铁时,盐酸浓度的测定结果偏大,相对误差高达18.75%(见表1)。
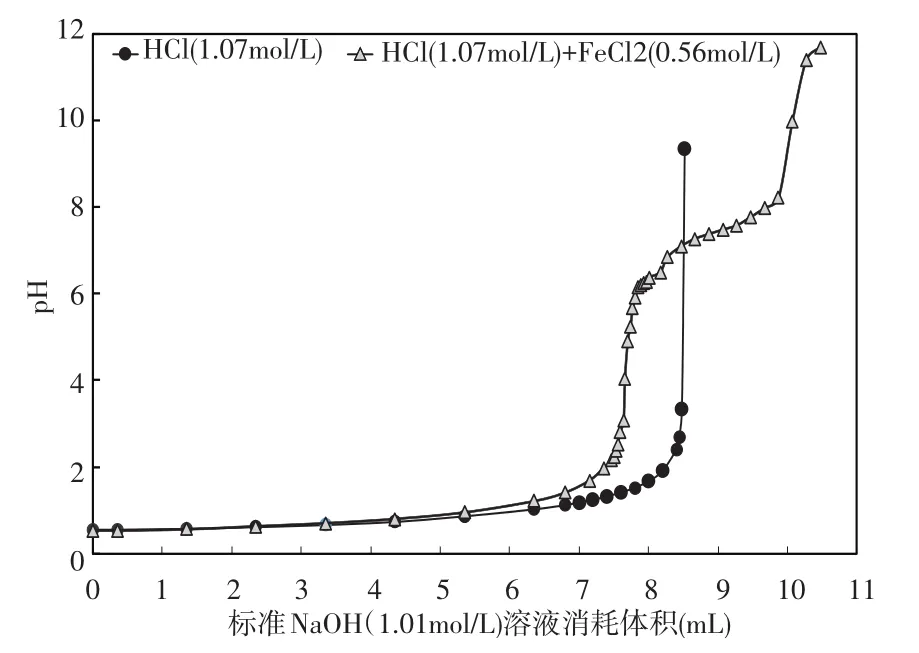
图1 实验1中溶液p H值与消耗的NaOH(1.01mol/L)的体积变化图

表1 实验1的结果
4.2 掩蔽剂EDTA-Ca存在时钢板酸洗液中盐酸浓度测定
实验2的结果见图2。当无掩蔽剂时,用NaOH标准溶液2(CNaOH=2.52mol/L)滴定溶液C(CHCl=3.16 mol/L),消耗NaOH标准溶液2的体积为10.04 m L(见表2)。当使用掩蔽剂EDTA-Ca时,用NaOH标准溶液2(CNaOH=2.52 mol/L)分别滴定溶液C (CHCl=3.16 mol/L)和溶液D(CHCl=3.16 mol/L;CFeCl2=0.56mol/L),滴定终点的p H值分别是6.34和3.62(见表2),消耗NaOH标准溶液2的体积分别为10.20m L 和9.30 m L,HCl浓度测定的相对误差分别为1.0%和-7.9%,(见表2)。实验结果可以看出,当存在EDTA-Ca时,含有FeCl2的酸液HCl浓度测定值低于实际值;同时,EDTA-Ca的加入虽然降低了盐酸浓度测定的相对误差(从18.75%到-7.9%),但EDTACa不能有效地掩蔽FeCl2的干扰。

表2 实验2中溶液p H值与消耗的NaOH(2.52mol/L)的体积变化图
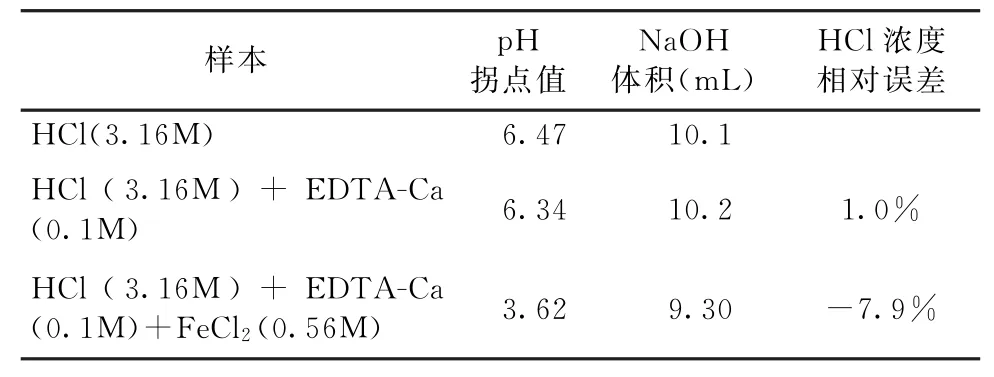
表2 实验2的结果
4.3 掩蔽剂KSCN存在时钢板酸洗液中盐酸浓度测定
实验3的结果见图3。在没有掩蔽剂时, 用NaOH标准溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L),滴定终点的p H值为6.64,溶液3消耗的体积为25.7m L(见表3)。当存在掩蔽剂KSCN时, 用NaOH标准溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16mol/L)和溶液D (CHCl=3.16mol/L;CFeCl2=0.56mol/L),滴定终点的p H值分别为6.34和4.58,溶液3的消耗量分别为25.70m L和26.50m L,此时HCl浓度测定的相对误差分别为0和3.1%(见表3)。实验结果可以看出,当盐酸溶液中加入KSCN后,此时HCl浓度测定的相对误差为0,说明KSCN的加入不会对盐酸溶液的测定产生影响;当含有FeCl2的酸洗溶液中加入KSCN时,HCl浓度测定值与实际值误差减小(从18.75%到3.1%),说明KSCN溶液能有效地掩蔽FeCl2的干扰。
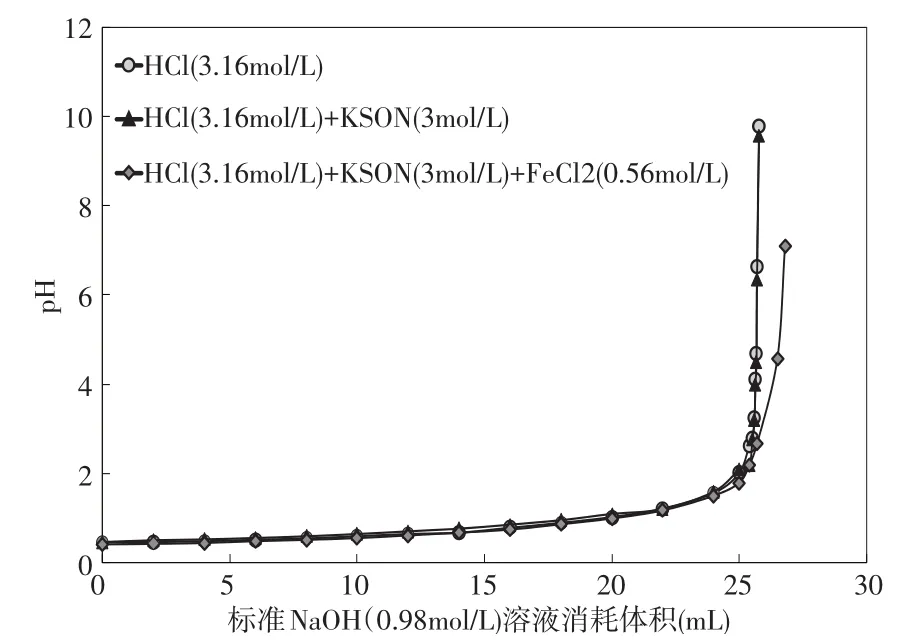
图3 实验3中溶液p H值与消耗的NaOH(0.98mol/L)的体积变化图
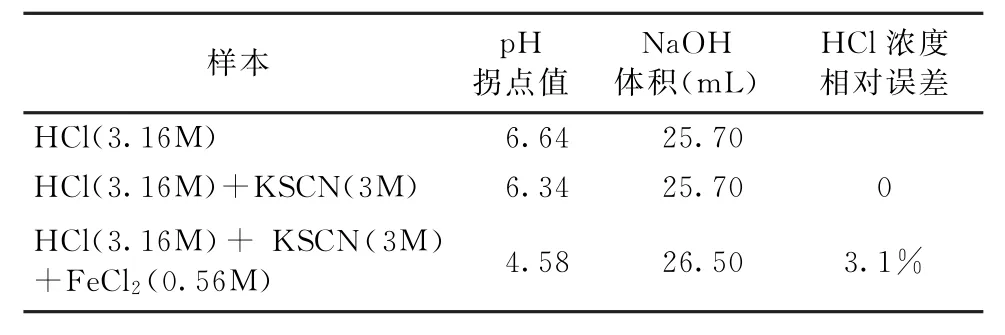
表3 实验3的结果
4.4 掩蔽剂NH4SCN存在时钢板酸洗液中盐酸浓度测定
实验4的结果见图4。当无掩蔽剂,用NaOH标准溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L),滴定终点的p H值为6.64,消耗溶液3的体积为25.7m L(见表4)。当使用NH4SCN作为掩蔽剂时, 用NaOH标准溶液3(CNaOH=0.98mol/L)滴定溶液C(CHCl=3.16 mol/L)和溶液D (CHCl=3.16mol/L;CFeCl2=0.56mol/L),滴定终点的p H值分别为6.44和4.49(见表4),溶液3的消耗体积分别为25.76m L和25.76m L,HCl浓度测定的相对误差分别为0.2%和0.2%(见表4)。实验结果可以看出,当NH4SCN加入到盐酸溶液中时,HCl浓度测定的相对误差为0.2%,说明NH4SCN不会对HCl浓度测定产生影响;当含有FeCl2的酸洗溶液采用NH4SCN作为掩蔽剂时,HCl浓度测定值最接近实际值,说明NH4SCN对FeCl2的掩蔽效果最佳。
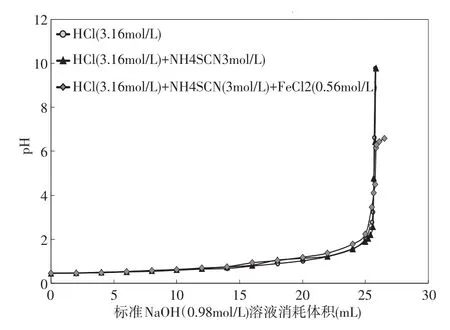
图4 实验4中溶液p H值与消耗的NaOH(0.98mol/L)的体积变化图
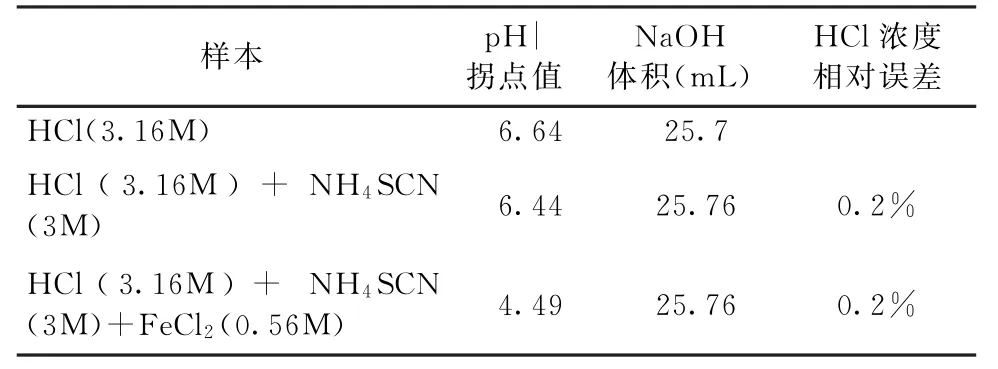
表4 实验4的结果
以上实验可以看出,在测量模拟含有Fe2+的酸洗溶液盐酸浓度中,NH4SCN是最好的掩蔽剂。同时,在国内某钢厂酸洗线的现场测试表明,用NH4SCN作掩蔽剂测定的HCl浓度和现场在线检测计算HCl浓度平均相对误差<1%。
4.5 NH4SCN滴定酸洗液盐酸浓度的方法原理
用标准NaOH溶液滴定含有亚铁离子的酸洗液中的盐酸时,溶液的p H值不断升高,一部分亚铁离子可能会被氧化成三价铁离子,形成氢氧化物沉淀,使得测得的盐酸浓度高于实际值。当NH4SCN作Fe2+和Fe3+的掩蔽剂时,由于SCN与Fe2+和Fe3+形成复杂稳定络合物,避免了三价铁沉淀的形成, Fe2+和Fe3+与SCN-形成络合物的主要反应式:
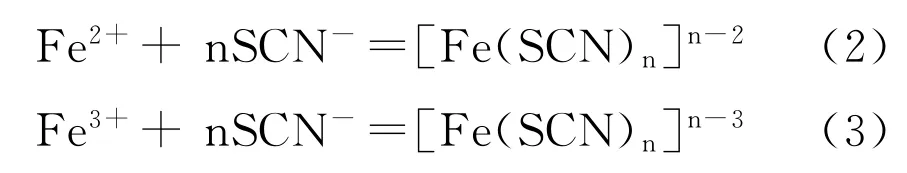
βn(2)、βn(3)为累积稳定常数,表达式分别如下:
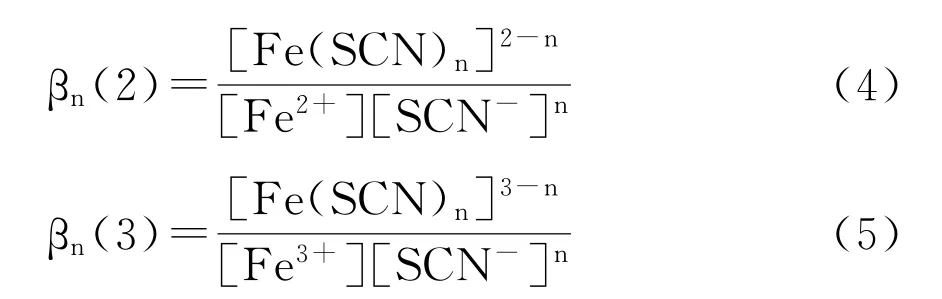
其中 lgβ(n=2,5)分别为5.6和6.4, lgβ(n=3,6)分别为6.3和6.1[14,15]。β是累积稳定常数,例如对Fe2+,β
这表明SCN-能同时和热轧钢板酸洗液中Fe2+和Fe3+络合,形成稳定的水溶性络合物,从而阻碍Fe2+和Fe3+在滴定过程中形成氢氧化物沉淀,对Fe2+和Fe3+起到掩蔽作用。
5 结论
用EDTA-Ca、KSCN及NH4SCN作掩蔽剂时,用酸碱中和滴定法测定含有亚铁离子的热轧板酸洗模拟液中的盐酸浓度。研究结果如下。
(1)Fe2+存在会使酸洗液中的盐酸浓度测定结果严重偏高,相对误差可达18.75%。
(2)采用EDTA-Ca、KSCN及NH4SCN作为Fe2+掩蔽剂时,都可降低HCl浓度的测定误差,并分别降低到-7.9%,3.1% 和0.2%。
(3)采用NH4SCN作为掩蔽剂时,HCl浓度测定值最接近实际值,说明NH4SCN对FeCl2的掩蔽效果最佳。
参考文献:
[1] M.Tourabi,K.Nohair and M.Traisnel.Electrochemical and XPS studies of the corrosion inhibition of carbon steel in hydrochloric acid pickling solutions by 3,5-bis(2-thienylmethyl)-4-amino-1,2,4-triazole[J].Corro.Sci. 2013,(75):123-133.
[2] 王元槐.基于电导率和比重的酸浓度控制[J].酒钢科技专刊,2011,(1):82-85.
[3] 彭大龙.酸洗溶液中酸度的准确测定[J].中国搪瓷,1994,15(6):16-17.
[4] 王献科,李玉萍.钢材酸洗液中酸、亚铁的简易测定法[J].化学清洗,1993,9(03):24-27.
[5] H.du.Plessis and J.F.van Staden.Determination of sulphuric acid in process effluent streams using sequential injection titration [J].Talanta,2002,(52):83-90.
[6] 齐贤成.锅炉酸洗过程中总酸度的测定[J].化肥工业,2006,33(6):47.
[7] 余鸿恩.盐酸冼炉时酸液浓度的测定法[J].电力技术,1980,(12):85.
[8] A.R.T?rresa et al.A digital image-based method for determining of total acidity in red wines using acid-base titration without indicator[J].Talanta,2011,(84):601-606.
[9] J.F.van Staden,M G Mashamba and R I Stefan.Determination of the total acidity in soft drinks using potentiometric sequential injection titration[J].Talanta,2002,(58): 1109-1114.
[10]M.Weiss,M Manneberg,J FJuranville,H W Lahm and M Fountoulakis.Effect of the hydrolysis method on the determination of the amino acid composition of proteins[J].J. Chromatogr.A,1998,(795):263 275.
[11]D.M.Albin,J E Wubben and V MGabert. The influence of hydrochloric acid concentration and measurement method on the determination of amino acid levels in soya bean products[J].Anim.Feed Sci.Tech,2000, (87):173-186.
[12]D.L.Jones,A G Owen and J F Farrar. Simple method to enable the high resolution determination of total free amino acids in soil solutions and soil extracts[J].Soil Biol.Biochem,2002,(34):1893-1902.
[13]J.Kozak,M Wójtowicz and P Ko'scielniak. An automatic system for acidity determination based on sequential injection titration and the monosegmented flow approach[J].Talanta,2011,(84):1379-1383.
[14]陈永雷,陈兴国,何疆,陈宏丽.分析化学[M].北京:高等教育出版社,2012:446.
[15]温金莲,郭兴杰.分析化学[M].北京:中国医药科技出版社,2012:457.
A Method for Accurate Determination of the Concentration of Hydrochloric Acid from Simulated Picking Solutions of Hot Rolled Steel Strip
LUO Kun1,SHEN Shao-bo1,MAO Shang-wei2
(1.School of Metallurgical and Ecological Engineering,University of Science and Technology Beijing,Beijing 100083,China; 2.CISDI Engineering Co.LTD,Chongqing 401122,China)
Abstract:EDTA-Ca,KSCN and NH4SCN were tested as the masking agents of the Fe(2+)of the simulated pickling solutions in the presence of Fe(2+),A volumetric method using NaOH as titration agent was studied for the determination of HCl concentration from the pickling solutions in this work.The variation of solution p H with the volume of NaOH solution consumed was recorded.The mathematical inflection point of the curve section corresponding to a p H jump was selected as the endpoint of titration.It was found that the relative measurement errors were reduced from 18.75%(No masking agent)to-7.9 %,3.1 % and 0.2 %for EDTA-Ca,KSCN and NH4SCN,respectively.Thus NH4SCN was the best masking agent of the ferrous ions.It hasbook=70,ebook=74never reported before that NH4SCN is used as a masking agent of ferrous ions for determination of concentration of hydrochloric acid from acidic solutions in the presence of Fe(2+).This method is simple and accurate.
Key words:determination of hydrochloric acid;pickling solution of hot rolled steel strip;masking agents of ferrous ions;ammonium thiocyanate
作者简介:罗 坤,硕士生,主要从事湿法冶金和冶金物理化学研究。
文章编号:1001-5108(2016)01-0069-07
中图分类号:O655.22
文献标识码:A
