三种检测方法联合使用对结核性胸膜炎的诊断价值
2016-05-12程丽平肖和平
程丽平 肖和平
·论著·
三种检测方法联合使用对结核性胸膜炎的诊断价值
程丽平 肖和平
目的 探讨结核性胸膜炎患者外周血结核感染T细胞斑点试验(T-SPOT.TB)、胸腔积液腺苷脱氨酶(ADA)及胸腔积液结核分枝杆菌DNA荧光定量聚合酶链反应(TB-DNA-PCR)联合检测对结核性胸膜炎的诊断价值。方法 收集2012年1月至2014年5月在上海市肺科医院住院的胸腔积液患者399例,其中确诊为结核性胸膜炎296例,非结核性胸膜炎103例。分别采集患者外周血和胸腔积液,进行外周血T-SPOT.TB、胸腔积液ADA和胸腔积液TB-DNA-PCR的检测,分别计算3项检测的敏感度和特异度,以及串联联合检测(ADA、TB-DNA-PCR和T-SPOT.TB检测结果均为阳性视为阳性结果)和并联联合检测(ADA、TB-DNA-PCR和T-SPOT.TB任意一项检测结果为阳性视为阳性结果)的敏感度和特异度。样本“率”的比较采用χ2检验,以P<0.05为差异有统计学意义。 结果 分别采用ADA检测、TB-DNA-PCR和T-SPOT.TB的方法对296例结核性胸膜炎和103例非结核性胸膜炎患者进行检测,敏感度分别为90.88%(269/296)、31.42%(93/296)和81.76%(242/296);胸腔积液ADA检测的敏感度高于外周血T-SPOT.TB,差异有统计学意义(χ2=11.23,P=0.000);外周血T-SPOT.TB的敏感度高于胸腔积液TB-DNA-PCR,差异有统计学意义(χ2=152.66,P=0.000)。ADA检测、TB-DNA-PCR和T-SPOT.TB方法的特异度分别为78.64%(81/103)、97.09%(100/103)和73.79%(76/103);胸腔积液TB-DNA-PCR的特异度高于外周血T-SPOT.TB,差异有统计学意义(χ2=22.47,P=0.000);胸腔积液TB-DNA-PCR的特异度高于胸腔积液ADA检测,差异有统计学意义(χ2=16.43,P=0.000);而胸腔积液ADA检测与外周血T-SPOT.TB的特异度差异无统计学意义(χ2=0.67,P=0.513)。对3项诊断方法进行联合检测,行串联试验时,特异度高达99.03%(102/103),敏感度为28.38%(84/296);行并联试验时,敏感度高达99.32%(294/296),特异度为69.90%(72/103)。结论 胸腔积液ADA检测、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB进行串联联合检测特异度较高,能够更好地降低误诊率;并联联合检测敏感度较高,能够更好地降低漏诊率。
结核,胸膜; 诊断技术和方法; 胸腔积液; 腺苷脱氨酶; 聚合酶链反应; 酶联免疫斑点检测
结核性胸膜炎(tuberculous pleurisy,TBP)在我国胸腔积液住院患者中占49.5%~54.5%[1],在临床诊断上,通常以胸膜活检发现肉芽肿或活检组织、胸腔积液检测到结核分枝杆菌为标准。胸膜活检的病理组织阳性率较高,可达50%~80%,胸腔镜诊断阳性率可高达86%~97%[2]。但上述两种检查方法均为有创性,而结核性胸膜炎胸腔积液中抗酸杆菌涂片阳性率仅为0%~25%,胸腔积液培养阳性率也仅为11.7%~56.8%[3]。因此寻找方便、可靠的检测指标迫在眉睫。
本研究主要通过结核性胸膜炎及非结核性胸膜炎患者外周血结核感染T细胞斑点试验(T-SPOT.TB)、胸腔积液腺苷脱氨酶(ADA)检测、胸腔积液结核分枝杆菌脱氧核糖核酸聚合酶链反应(TB-DNA-PCR)水平,评价各项检测指标的敏感度及特异度,并探讨联合检测对结核性胸膜炎的诊断价值。
资料和方法
一、研究对象及诊断标准
1. 一般资料:本研究对2012年1月至2014年5月在上海市肺科医院住院的胸腔积液患者进行回顾性分析。共收集胸腔积液患者478例,根据纳入和排除标准,最终进入本研究399例。入选患者中结核性胸膜炎组296例,其中男210例,女86例,平均年龄(42.08±17.91)岁;非结核性胸膜炎组103例,男79例,女24例,平均年龄(53.36±14.20)岁。
2.最终诊断情况:(1)结核性胸膜炎组,共296例。16例胸腔积液涂片抗酸染色阳性(其中13例结核分枝杆菌培养阳性,3例培养阴性);75例胸腔积液或胸膜组织改良罗氏培养结果为阳性,经菌型鉴定为结核分枝杆菌;92例胸膜病理检查可见干酪性肉芽肿伴(或不伴)抗酸杆菌阳性。其中,170例有细菌学和(或)病理学诊断依据(其中13例涂片和培养结果均为阳性),其余126例通过临床诊断性抗结核药物治疗有效而确诊。(2)非结核性胸膜炎组,共103例。包括肺癌胸膜转移65例(63.11%),原发性胸膜恶性病变3例(2.91%),肺炎旁胸腔积液9例(8.74%),漏出性胸腔积液13例(12.62%),乳糜胸3例(2.91%),肺部真菌感染3例(2.91%),其他风湿性疾病2例(1.94%),肺栓塞5例(4.85%)。
3.结核性胸膜炎诊断标准:参照中华医学会结核病学分会《肺结核诊断和治疗指南》[4]中的诊断标准,并符合以下3条或3条以上:(1)胸腔积液找到结核分枝杆菌;(2)胸膜活检发现结核性肉芽肿;(3)临床有发热、盗汗、咳嗽、消瘦等结核中毒症状;(4)胸部影像学检查提示有结核病灶;(5)抗结核治疗后临床症状改善,胸腔积液吸收;(6)治疗后直至停药后6个月随访,病情稳定,胸腔积液未见复发。
4.非结核性胸腔积液纳入标准:(1)胸腔积液为漏出液,排除结核病病因;(2)胸腔积液病理细胞学检查或胸膜组织病理学检查明确恶性肿瘤;(3)其他疾病:胸腔积液为渗出液,涂片及结核分枝杆菌培养阴性,根据临床症状、体征、常规化验检查、细菌学检测、影像学表现及疗效等证实病因。
5.排除标准:上述患者诊断均依据相关诊断标准[5],同时需要排除:(1)人类免疫缺陷病毒感染;(2)妊娠;(3)并发自身免疫系统疾病;(4)有移植或免疫抑制剂用药史;(5)其他脏器疾病终末期;(6)并发活动性肺结核;(7)血性胸腔积液。
二、检查方法
1.ADA的检测:根据患者胸腔彩色超声结果,行常规胸腔穿刺。抽取胸腔积液2~3 ml置于无菌试管中,1500×g离心5 min后,取其上清液,吸入样本杯,上机进行检测。检测仪器采用日立7150全自动生化仪和北京利德曼生化股份有限公司试剂盒,按试剂盒说明书要求将参考值设定为≥25 U/L为阳性,<25 U/L为阴性。
2.TB-DNA-PCR:抽取患者胸腔积液置于无菌试管中,加入2~3倍体积4%的NaOH溶液,37 ℃恒温处理30 min使之液化。取标本900 μl及试剂盒中的阴性对照、阳性对照各500 μl置于1.5 ml无菌离心管中,6000×g离心10 min。弃上清,沉淀中加入1 ml灭菌生理盐水,振荡悬浮,6000×g离心10 min。弃上清,向沉淀中加入DNA提取液30 μl,振荡混匀,1000×g离心5 s,置于37 ℃温浴30 min,放入100 ℃水浴或干浴10 min,6000×g离心10 min。取出PCR反应液、Taq酶及尿嘧啶糖苷酶(UNG),室温融化并振荡混匀,1000×g离心10 s。设所需要的PCR反应管管数为n(n=样本数+1管阴性对照+1管阳性对照),向设定的n个PCR反应管中分别加入38 μl经上述步骤处理过的样本、阴性对照、阳性对照上清液各2 μl,置于PCR仪上检测。37 ℃:5 min;94 ℃:1 min;95 ℃:5 s,60 ℃:40 s,40个循环。反应体系设为40 μl。根据检测结果绘制标准曲线,取6~10或6~15个循环的荧光信号确定基线。Ct值等于40或0的样本判为阴性;循环阈值(Ct值)≤37.0者判为阳性;Ct值>37.0的样本重做。重做结果Ct值<40者为阳性,否则为阴性。本试验采用的是深圳凯杰生物工程有限公司试剂盒,以及瑞士罗氏实时荧光定量PCR扩增仪(Light Cycler 480)。
3.T-SPOT.TB:本试验是利用结核分枝杆菌感染者外周血单个核细胞(PBMC)中存在致敏的T淋巴细胞,在受到结核分枝杆菌特异抗原A(ESAT-6:早期分泌抗原靶分子)和抗原B(CFP-10:培养滤液蛋白)刺激后释放相应γ-干扰素的特异性T细胞,分别记为T-SPOT.TB评分的A抗原值、B抗原值。无菌注射器抽取足量的外周静脉血,加至含肝素或柠檬酸钠抗凝剂的真空采血管直接进行采集;或使用BD公司的单个核细胞准备管(CPT),根据厂家说明书要求分离PBMC,吸取PBMC层并转移至15 ml尖底离心管中。加入细胞培养液至10 ml,600×g离心7 min。弃上清,用1 ml培养液重悬沉淀,加培养液至10 ml,350×g离心7 min。弃上清,加0.7 ml培养液重悬沉淀。以细胞培养液作为阴性对照,植物血凝素(PHA)作为阳性对照,ESAT-6和CFP-10作为刺激抗原,每个检测孔加入100 μl细胞终溶液(含有25万个活细胞),在37 ℃湿润的含有5%的CO2培养箱中孵育16~20 h。洗板后加入含有碱性磷酸酶标记的小鼠抗人γ-干扰素单抗的抗体工作液,2~8 ℃孵育1 h。洗板后加入含5-溴-4-氯-3-吲哚磷酸(BCIP)和氯化硝基四氮唑蓝(NBT)的显色底物,室温孵育7 min。在通风处或37 ℃温箱干燥培养板,记录每个反应孔内深蓝色清晰的斑点数,每个斑点代表每个活化的结核特异性效应T细胞。应用结核感染T细胞检测试剂盒(免疫斑点法)进行检测。
根据抗原A和(或)抗原B孔的反应判断结果:空白对照孔斑点数为0~5个时,且抗原A或抗原B孔的斑点数-空白对照孔斑点数≥6;空白对照孔斑点数为6~10个时,且抗原A或抗原B孔的斑点数≥2倍空白对照孔斑点数,检测结果为“有反应性”;如果上述标准不符合,且阳性质控对照孔正常时,检测结果为“无反应性”。
根据周晴等[6]的经验,对特异性抗原孔数值进行分层。分层1:阴性对照斑点数为0~5个,任何一个检测孔计数减去阴性孔计数≥6,或者阴性对照斑点数≥6,检测孔斑点数≥2倍阴性对照孔斑点数;分层2:抗原A或抗原B孔计数减去阴性孔计数>10;分层3:抗原A或抗原B孔计数减去阴性孔计数>20;分层4:抗原A和抗原B孔计数减去阴性孔计数均>20。分别统计两组患者于不同T-SPOT.TB分层组别的反应情况。
4.联合检测:(1)串联试验:分别检测两组患者胸腔积液ADA、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB,行串联试验(2项或3项分别进行比较时,检测结果均为阳性视为阳性;2项或3项分别进行比较时,其中任意一项检测结果为阴性视为阴性),分组如下:ADA和TB-DNA-PCR、ADA和T-SPOT.TB、TB-DNA-PCR和T-SPOT.TB、ADA和TB-DNA-PCR和T-SPOT.TB,比较各组敏感度和特异度的差异。(2)并联试验:分别检测两组患者胸腔积液ADA、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB,行并联试验(2项或3项分别进行比较时,其中任意一项检测结果为阳性即视为阳性;检测结果均为阴性视为阴性),分组如下:ADA或TB-DNA-PCR、ADA或T-SPOT.TB、TB-DNA-PCR或T-SPOT.TB、ADA或TB-DNA-PCR或T-SPOT.TB,比较各组的敏感度和特异度的差异。
三、统计学分析
采用SPSS 17.0软件进行统计学分析。计数资料采用χ2检验;在符合正态分布,且方差齐性的条件下,计量资料采用t检验。均以P<0.05为差异有统计学意义。
结 果
一、3项指标的单项诊断价值
1.ADA检测结果:结核性胸膜炎组胸腔积液ADA平均值为(56.18±17.84) U/L,非结核性胸膜炎组胸腔积液ADA平均值为(19.38±5.59) U/L。两组比较,结核性胸膜炎组胸腔积液ADA平均值明显高于非结核性胸膜炎组(t=9.59,P=0.000)。胸腔积液ADA诊断的敏感度为90.88%(269/296),特异度为78.64%(81/103)。
2.TB-DNA-PCR检测结果:结核性胸膜炎组胸腔积液TB-DNA-PCR阳性93例,非结核性胸膜炎组胸腔积液TB-DNA-PCR阳性3例,胸腔积液TB-DNA-PCR诊断的敏感度为31.42%(93/296),特异度为97.09%(100/103)。
3.外周血T-SPOT.TB检测结果:外周血T-SPOT.TB敏感度为81.76%(242/296),特异度为73.79%(76/103)。其中,结核性胸膜炎组抗原A孔平均计数为(15.81±4.29)个,明显高于非结核性胸膜炎组抗原A孔平均计数[(2.73±0.89)个],差异有统计学意义(t=-5.50,P=0.000)。结核性胸膜炎组抗原B孔平均计数为(18.93±5.67)个,明显高于非结核性胸膜炎组抗原B孔平均计数[(2.21±0.70)个],差异有统计学意义(t=4.61,P=0.000)。
根据分层分析,当抗原A或B孔计数的数值≥6(分层1),外周血T-SPOT.TB敏感度最高,达到81.76%,特异度为73.79%;当抗原A和B两孔计数均>20(分层4),外周血T-SPOT.TB特异度最高,达到100.00%,敏感度为17.23%。如表1所示:分层1敏感度高于分层2,差异有统计学意义(χ2=12.50,P=0.001);分层2敏感度高于分层3,差异有统计学意义(χ2=31.12,P=0.000);分层3敏感度高于分层4,差异有统计学意义(χ2=58.83,P=0.000);分层4特异度高于分层3,差异有统计学意义(χ2=8.10,P=0.005);分层3特异度与分层2差异无统计学意义(χ2=3.23,P=0.105);分层2特异度与分层1差异无统计学意义(χ2=0.24,P=0.747)。
二、3项指标诊断价值的比较
对3种诊断方法进行比较,胸腔积液ADA检测的敏感度高于外周血T-SPOT.TB,差异有统计学意义(χ2=11.23,P=0.000);外周血T-SPOT.TB的敏感度高于胸腔积液TB-DNA-PCR,差异有统计学意义(χ2=152.66,P=0.000)。胸腔积液TB-DNA-PCR的特异度高于外周血T-SPOT.TB,差异有统计学意义(χ2=22.47,P=0.000);胸腔积液TB-DNA-PCR的特异度高于胸腔积液ADA检测,差异有统计学意义(χ2=16.43,P=0.000);胸腔积液ADA检测与外周血T-SPOT.TB的特异度差异无统计学意义(χ2=0.67,P=0.513)。具体见表2。
三、3项指标联合检测的价值
两组患者分别检测胸腔积液ADA、胸腔积液TB-DNA-PCR和外周血T-SPOT.TB,行串联试验。如表3所示,当胸腔积液ADA、胸腔积液TB-DNA-PCR和外周血T-SPOT.TB 3项检测结果均为阳性时,相比于2项联合检测,特异度更高,达到99.03%(102/103),敏感度为28.38%(84/296)。
两组患者分别检测胸腔积液ADA、胸腔积液TB-DNA-PCR和外周血T-SPOT.TB,行并联试验。如表4所示,当胸腔积液ADA或胸腔积液TB-DNA-PCR或外周血T-SPOT.TB任意一项检测结果为阳性时,相比于2项联合检测,其敏感度更高,达到99.32%(294/296),特异度为69.90%(72/103)。
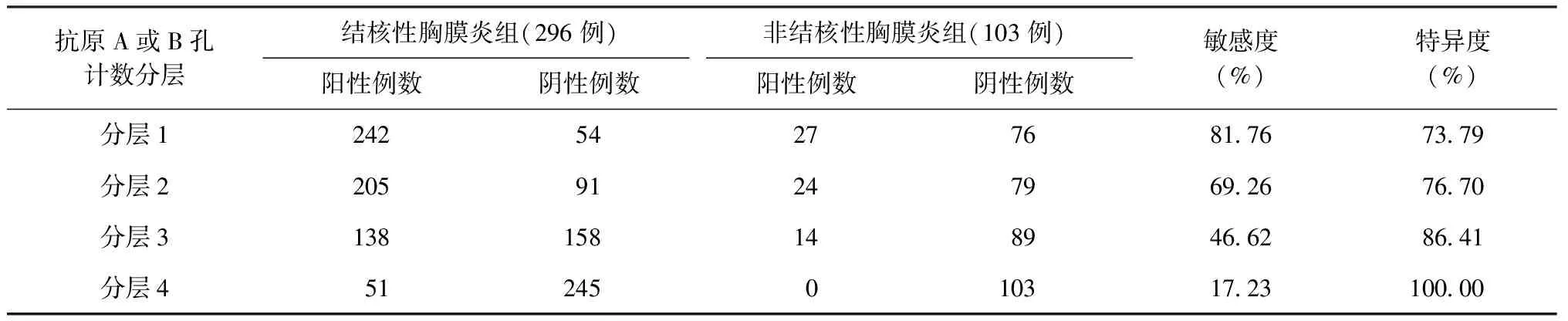
表1 T-SPOT.TB检测不同分层标准对两组患者的诊断价值
注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%

表2 不同检测方法对结核性胸膜炎的诊断价值
注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%

表3 3种检测方法串联试验的诊断价值
注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%
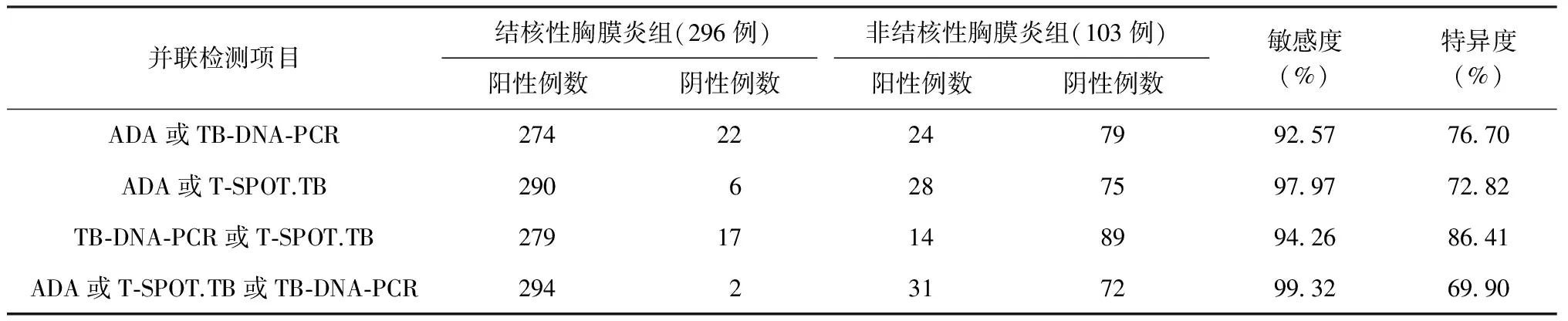
表4 3种检测方法并联试验的诊断价值
注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%
讨 论
ADA目前在很多国家已经成为诊断结核性胸膜炎的常规检测项目。梁秋丽等[7]将61项独立研究进行Meta分析,结果显示:ADA诊断结核性胸膜炎的总体敏感度为0.92(95%CI:0.91~0.93),特异度为0.90(95%CI:0.89~0.91)。Meta分析结果表明胸腔积液ADA测定有助于诊断结核性胸膜炎。研究阳性似然比为8.82,提示结核性胸膜炎患者ADA检测结果为阳性的机会约为非结核性胸膜炎患者的9倍。然而,在一些细菌感染和风湿性疾病引起的胸腔积液中ADA活性也有所升高,诊断的特异度降低[8]。
应用PCR检测结核分枝杆菌DNA对病因学诊断的阳性率明显高于常规涂片和培养,因而特别适用于难于培养和生长缓慢的结核分枝杆菌的诊断。Kalantri等[9]研究显示结核性胸膜炎患者胸腔积液实时荧光TB-DNA-PCR与γ-干扰素及ADA检测比较,敏感度较低,但阳性似然比更高。TB-DNA-PCR的假阴性结果目前考虑为胸腔积液样本中所含结核分枝杆菌菌量较少的缘故。
近年来,γ-干扰素释放试验(IGRA)被认为是结核病诊断方面的一个重大突破。外周血IGRA对结核感染的诊断有较高的敏感度和特异度,但在不同部位,结核病诊断的敏感度不一致,不能区分活动性结核病和潜伏性结核感染[10]。本研究选取的T-SPOT.TB是目前临床常用的IGRA检测方法。范俊等[11]对156例骨关节疾病患者的研究发现:外周血T-SPOT.TB试验作为一种非侵入性且便利的辅助诊断方法,在我国这种结核病高流行国家的骨关节结核病中仍有较高的诊断价值。本研究选用外周血T-SPOT.TB试验进行相关检测,结果显示:在结核性胸膜炎的诊断中,T-SPOT.TB敏感度为81.76%(242/296),特异度为73.79%(76/103)。其中,非结核性胸膜炎组T-SPOT.TB阳性27例,分析资料后发现18例为恶性胸腔积液(其中1例为肺结核并发肺癌),3例为肺炎旁胸腔积液,2例为漏出性胸腔积液,2例为肺栓塞,1例为乳糜胸,1例为风湿病。分析出现假阳性的原因可能是:(1)中国属于结核病高流行地区,结核潜伏感染(LTBI)者占总人口的44.5%[12],T-SPOT.TB检测技术不能区分LTBI和活动性结核病;(2)患者可能存在目前常规方法尚不能检出的肺外结核病;(3)肺癌患者的某些肿瘤抗原与2种结核抗原存在交叉表位,导致肿瘤患者的T细胞对ESAT-6或CFP-10产生细胞免疫反应;(4)存在感染,Diel等[13]研究发现,如果炎症同时并发短暂的一过性感染,也可出现T-SPOT.TB阳性结果;(5)存在特殊非结核分枝杆菌感染,当感染堪萨斯分枝杆菌、海分枝杆菌等时,T-SPOT.TB检测可能出现“有反应性”的结果。Lee等[14]对结核与非结核性胸腔积液患者的胸腔积液和外周血进行T-SPOT.TB检测,结果显示胸腔积液中的敏感度和特异度分别为94.7%、85.7%,外周血的敏感度和特异度分别为77.8%、90.5%。付洪义等[15]应用T-SPOT.TB方法检测,结果显示:在老年结核性胸膜炎患者中,胸腔积液IGRA的敏感度为90.79%,特异度为98.25%,明显高于外周血的67.11%和84.21%,差异有统计学意义。今后可进一步研究胸腔积液的T-SPOT.TB检测,了解其对结核性胸膜炎的诊断价值。
Janssens等[16]研究显示,T-SPOT.TB斑点计数与结核病病情活动程度密切相关。结核活动度越高,T-SPOT.TB斑点数呈现越多的趋势。本研究将外周血T-SPOT.TB的检测价值提高并进行分层,探讨对疾病的诊断价值。研究结果显示:当抗原A孔和B孔斑点数均>20时,结核性胸膜炎诊断特异度明显提高,而敏感度相对较低;当发生胸膜炎时,尤其抗原A孔和B孔斑点数均>20时,强烈提示结核性胸膜炎的可能。
Gao等[17]将QFT-GIT 和巢氏PCR法联合检查,发现两者联合检测可显著提高结核性胸膜炎诊断的敏感度,达到100.0%,特异度可增至90.0%,认为免疫及分子生物学方法联合检测可显著提高结核性胸膜炎的临床诊断。Villegas等[18]应用胸腔积液ADA、TB-DNA-PCR(结核分枝杆菌IS6110序列)及IFN-γ联合检测,探讨对结核性胸膜炎患者的诊断意义。结果显示,当进行串联试验时,ADA和IFN-γ组合的特异度为98.5%,TB-DNA-PCR和ADA组合的特异度为98.6%,而TB-DNA-PCR和IFN-γ组合的特异度最高,可达100.0%,但组间差异无统计学意义;当进行并联试验时,ADA或IFN-γ组合的敏感度为90.5%,TB-DNA-PCR或IFN-γ组合的敏感度为90.5%,TB-DNA-PCR或ADA组合的敏感度为90.5%,三组间差异无统计学意义。此外,Kalantri等[9]做了同类联合检测试验,结果发现TB-DNA-PCR或IFN-γ组合在确诊的结核性胸膜炎组的敏感度高达100.0%,在疑似结核性胸膜炎组诊断的敏感度高达96.2%;ADA和IFN-γ组合在确诊的结核性胸膜炎组中,特异度达到100.0%,在疑似结核性胸膜炎组,特异度达到100.0%。
本研究显示,在结核性胸膜炎组中,胸腔积液ADA、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB诊断的敏感度分别为90.88%(269/296)、31.42%(93/296)、81.76%(242/296)。胸腔积液ADA诊断的敏感度高于外周血T-SPOT.TB,差异有统计学意义;外周血T-SPOT.TB的敏感度高于胸腔积液TB-DNA-PCR,差异有统计学意义。胸腔积液ADA、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB特异度分别为78.64%(81/103)、97.09%(100/103)、73.79%(76/103)。胸腔积液TB-DNA-PCR的特异度高于外周血T-SPOT.TB,差异有统计学意义;胸腔积液TB-DNA-PCR的特异度高于胸腔积液ADA检测,差异有统计学意义;而胸腔积液ADA检测与外周血T-SPOT.TB的特异度差异无统计学意义。联合检测上述3项指标,结果显示:在串联试验中,ADA和TB-DNA-PCR组合、T-SPOT.TB和TB-DNA-PCR组合的特异度较高,均达到98.06%(101/103);而三者联合检测时,ADA和TB-DNA-PCR及T-SPOT.TB组合的特异度高达99.03%(102/103),能够更好地降低误诊率;在并联试验中,ADA或TB-DNA-PCR组合、ADA或T-SPOT.TB组合、TB-DNA-PCR或T-SPOT.TB组合的敏感度分别为92.57%(274/296)、97.97%(290/296)、94.26%(279/296)。但三者联合检测,ADA或T-SPOT.TB或TB-DNA-PCR组合的敏感度更高,达到99.32%(294/296),能够更好地降低漏诊率。
根据本次研究结果,提示联合检测胸腔积液ADA、胸腔积液TB-DNA-PCR及外周血T-SPOT.TB是一种快速、敏感度和特异度很高的诊断结核性胸膜炎的方法。3种检测方法进行串联联合检测时,特异度较高,能够更好地降低误诊率;并联联合检测时,敏感度较高,能够更好地降低漏诊率。
[1] 中华医学会结核病学分会. 中国结核病分类法. 中华结核和呼吸杂志,1998,21(12):716-717.
[2] 卜建玲,马玙. 结核性胸膜炎的诊断现状与研究进展.中国防痨杂志,2009,31(1):70-74.
[3] Mehta AA, Gupta AS, Ahmed S, et al. Diagnostic utility of adenosine deaminase in exudative pleural effusions.Lung India,2014, 31(2):142-144.
[4] 中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[5] 中华医学会.临床诊疗指南·呼吸病学分册.北京:人民卫生出版社,2009.
[6] 周晴,胡必杰,黄声雷,等.结核感染T细胞斑点试验在结核诊断中的价值.中华医院感染学杂志,2013,23(7):1726-1728.
[7] 梁秋丽,施焕中,王可,等. 腺苷脱氨酶对结核性胸膜炎诊断价值的荟萃分析.中华结核和呼吸杂志,2008,31(9):707.
[8] Villena V, López-Encuentra A, Pozo F, et al. Interferon gamma levels in pleural fluid for the diagnosis of tuberculosis. Am J Med, 2003, 115(5): 365-370.
[9] Kalantri Y, Hemvani N, Chitnis DS. Evaluation of real-time polymerase chain reaction, interferon-gamma, adenosine deaminase, and immunoglobulin A for the efficient diagnosis of pleural tuberculosis. Int J Infect Dis,2011, 15(4):e226-231.
[10] 中华医学会结核病学分会,《中华结核和呼吸杂志》编辑委员会. γ-干扰素释放试验在中国应用的建议.中华结核和呼吸杂志,2014,37(10):744-747.
[11] 范俊,秦世炳,贾红彦,等. 结核感染T细胞酶联免疫斑点试验与结核抗体检测在骨关节结核辅助诊断中的价值.中国防痨杂志,2014,36(10):884-887.
[12] 全国结核病流行病学抽样调查技术指导组, 全国结核病流行病学抽样调查办公室. 2000年全国结核病流行病学抽样调查报告.中国防痨杂志,2002,24(2):65-108.
[13] Diel R, Loddenkemper R, Nienhaus A. Evidence-based comparison of commercial interferon-gamma release assays for detecting active TB: a metaanalysis. Chest, 2010, 137(4):952-968.
[14] Lee LN,Chou CH,Wang JY,et al. Enzyme-linked immunospot assay for interferon-gamma in the diagnosis of tuberculous pleurisy. Clin Microbiol Infect,2009,15(2):173-179.
[15] 付洪义,章志华,刘宁,等. 胸腔积液γ-干扰素释放试验对老年结核性胸膜炎的诊断价值.中国防痨杂志,2016,38(8):630-633.
[16] Janssens JP, Roux-Lombard P, Perneger T, et al. Quantitative scoring of an interferon-gamma assay for differentiating active from latent tuberculosis. Eur Respir J,2007, 30(4):722-728.
[17] Gao Y,Ou Q,Huang F,et al. Improved diagnostic power by combined interferon-gamma release assay and nested-PCR in tuberculous pleurisy in high tuberculosis prevalence area. FEMS Immunol Med Microbiol,2012, 66(3): 393-398.
[18] Villegas MV,Labrada LA,Saravia NG. Evaluation of polymerase chain reaction, adenosine deaminase, and interferon-gamma in pleural fluid for the differential diagnosis of pleural tuberculosis.Chest,2000, 118(5):1355-1364.
(本文编辑:郭萌)
Evaluation on the combination of three methods for the diagnosis of tuberculous pleurisy
CHENGLi-ping,XIAOHe-ping.
ClinicandResearchCenterofTuberculosis,ShanghaiKeyLabofTuberculosis,ShanghaiPulmonaryHospital,TongjiUniversitySchoolofMedicine,Shanghai200433,China
XIAOHe-ping,Email:xiaoheping_sars@163.com
Objective To study the clinical value of combined detection using peripheral blood T-SPOT.TB, pleural effusion adenosine deaminase (ADA) and pleural effusionMycobacteriumtuberculosisDNA fluorescence quantitative polymerase chain reaction (TB-DNA-PCR) for the diagnosis of tuberculous pleurisy. Methods Three hundred and ninty-nine cases in Shanghai Pulmonary Hospital from January 2012 to May 2014 were retrospectively analyzed, including 296 cases of tuberculous pleurisy and 103 cases of non-tuberculous pleurisy. Every patient was tested with pleural effusion ADA, pleural effusion TB-DNA-PCR and peripheral blood T-SPOT.TB. The sensitivities and specificities of three detections, serial joint detection and parallel joint detection are calculated, respectively. ADA, TB-DNA-PCR and T-SPOT.TB test results were all positive as a positive result in serial joint detection, any one of ADA or TB-DNA-PCR or T-SPOT.TB test results was positive as a positive result in parallel joint detection. Data were compared withχ2test,P<0.05 was considered statistically significant. Results The sensitivities of pleural effusion ADA, pleural effusion TB-DNA-PCR and peripheral blood T-SPOT.TB were 90.88% (269/296), 31.42% (93/296), and 81.76% (242/296), respectively. The sensitivity of T-SPOT.TB was significantly higher than that of TB-DNA-PCR (χ2=152.66,P=0.000),but significantly lower than that of ADA (χ2=11.23,P=0.000). Their specificities were 78.64% (81/103), 97.09% (100/103), and 73.79% (76/103), respectively. The specifi-city of TB-DNA-PCR was significantly higher than those of T-SPOT.TB (χ2=22.47,P=0.000) and ADA (χ2=16.43,P=0.000), but there was no statistical difference between the specificities of T-SPOT.TB and ADA (χ2=0.67,P=0.513). The sensitivity and specificity of serial joint detection was 28.38% (84/296) and 99.03% (102/103) respectively. The sensitivity and specificity of parallel joint detection was 99.32% (294/296) and 69.90% (72/103), respectively. Conclusion The specificity of the serial joint detection of pleural effusion ADA, pleural effusion TB-DNA-PCR and peripheral blood T-SPOT.TB was higher, better to reduce the misdiagnosis; the sensitivity of the parallel joint detection was higher, better to decrease the missed diagnosis.
Tuberculosis, pleural; Diagnostic techniques and procedures; Pleural effusion; Adenosine deaminase; Polymerase chain reaction; Enzyme-linked immunospot assay
10.3969/j.issn.1000-6621.2016.11.013
200433 同济大学附属上海市肺科医院结核病临床研究中心 上海市结核病(肺)重点实验室
肖和平,Email:xiaoheping_sars@163.com
2016-06-22)
