地诺单抗治疗复发或难治骨巨细胞瘤疗效和安全性的初步观察
2016-05-12杨毅郭卫杨荣利汤小东燕太强姬涛谢璐许婕董森唐顺李晓臧杰
杨毅 郭卫 杨荣利 汤小东 燕太强 姬涛 谢璐 许婕 董森 唐顺 李晓 臧杰
地诺单抗治疗复发或难治骨巨细胞瘤疗效和安全性的初步观察
杨毅 郭卫 杨荣利 汤小东 燕太强 姬涛 谢璐 许婕 董森 唐顺 李晓 臧杰
【摘要】目的 评价地诺单抗 (denosumab) 治疗骨巨细胞瘤 (giant cell tumor,GCT) 的短期疗效和安全性。方法 回顾性分析 2014 年 2 月至 12 月,于我院接受地诺单抗治疗的 25 例 GCT 患者,其中男 12 例,女13 例,平均年龄 33.7 (18~58) 岁。所有患者均有明确 GCT 病理诊断,5 例病理提示为 GCT 中的恶性。16 例(治疗用药组) 有影像学可评估病灶;9 例 (预防用药组) 用药前已经接受外科治疗,体内无影像学可评估病灶,但因为外科边界不满意或病理提示恶性变,应用地诺单抗作为预防性治疗。全部患者每 4 周接受 120 mg地诺单抗皮下注射,第 8 天和第 15 天增加 2 次负荷剂量。安全性评估指标主要包括药物副反应 (临床症状和实验室检查异常)。疗效评估包括:治疗用药组 (16 例) 应用实体瘤疗效评价标准 (response evaluation criteria in solid tumors,RECIST);预防用药组 (9 例) 观察指标为无事件生存率 (event free survival,EFS)。除 CT 和 MRI等常规影像学评估外,部分患者接受了二次活检手术和 PET-CT 检查,2 例恶性 GCT 患者用药前进行了肿瘤组织核因子 κB 活化剂受体配体 (receptor activator of nuclear factor-κB ligand,RANKL) 表达水平的检测。结果以初次用药为随访开始时间,末次随访时间为 2015 年 3 月 1 日。平均随访时间 6 (4~12) 个月。用药期间无死亡病例,患者均按计划用药,平均用药次数 7.4 (6~17) 次,依从性好。副反应包括骨痛 (4 例)、低钙血症(3 例)、发热 (3 例)、肿瘤破溃形成窦道 (2 例)、疲劳骨折 (1 例)。未见下颌骨坏死。治疗用药组 16 例中,RECIST 评估显示:完全缓解 1 例、部分缓解 8 例、疾病稳定 6 例、疾病进展 1 例。3 例接受二次活检手术,组织学均未见残留巨细胞瘤成分;1 例复查 PET-CT 可见 SUVmax 摄取降至正常肌肉组织水平;2 例用药前进行了肿瘤组织 RANKL 表达水平的检测,结果显示 RANKL 表达水平与疗效相关。预防用药组 (9 例) 4 个月和6 个月的 EFS 均为 100%。结论 地诺单抗对于复发难治的 GCT 患者是一种安全有效的治疗手段,恶性 GCT和伴发肺转移的病例也应考虑接受地诺单抗治疗。在评估地诺单抗疗效时,应在 RECIST 标准基础上结合活检和 PET-CT 结果。肿瘤组织 RANKL 表达水平与疗效具有相关性。
【关键词】骨巨细胞瘤;复发;核因子 κB 受体活化因子;地诺单抗
骨巨细胞瘤 (giant cell tumor,GCT) 好发于20~40 岁,是一种少见的交界性骨肿瘤,有一定侵袭性,以溶骨破坏为主,个别病例具有转移和恶性变潜能,手术是主要治疗手段,但发生于中轴骨(脊柱和骨盆环) 的病例术后复发率很高[1]。一直以来针对 GCT 缺乏有效的药物治疗方法。
GCT 内含有破骨细胞样巨细胞和单核基质细胞两种成分,后者表达的核因子 κB 活化剂受体配体(receptor activator of nuclear factor-κB ligand,RANKL)是启动破骨进程的关键因子[2]。回顾性分析 2014 年2 月至 12 月,于北京大学人民医院骨与软组织肿瘤治疗中心接受 RANKL 全人源化单克隆抗体——地诺单抗 (denosumab) 治疗的 25 例 GCT 患者,评价其安全性和短期疗效,报告如下。
资料与方法
一、一般资料
本组 25 例,男 12 例,女 13 例,平均年龄 33.7 (18~58) 岁。原发病变部位包括:骶骨 12 例、股骨4 例、骨盆 3 例、腰椎 2 例、胸椎 2 例、胫骨 2 例。所有患者均有明确的 GCT 病理诊断,20 例为良性GCT,5 例病理提示为 GCT 中的恶性,其中 3 例为原发恶性 GCT (骶骨 1 例、骨盆 1 例、胫骨 1 例),2 例为继发恶变 (股骨上段 1 例,股骨下段 1 例)。
二、研究分组
将本组病例分为治疗用药组和预防用药组。16 例 (治疗用药组) 有影像学可评估病灶,其中14 例病变位于脊柱和骨盆环,病变巨大或反复复发,综合考虑手术风险和预期疗效后认为不宜接受外科治疗;7 例有肺转移灶 (2 例为单纯肺转移;5 例为原发灶和肺转移并存)。9 例 (预防用药组) 用药前已经接受外科治疗,体内无影像学可评估病灶,但因为外科边界不满意 (8 例) 或病理提示恶性变 (1 例),应用地诺单抗作为预防性治疗。患者详细资料见表 1。
全部患者每 4 周接受 120 mg 地诺单抗皮下注射(腹壁),第 8 天和第 15 天增加 2 次负荷剂量,嘱患者每日口服补充钙剂 800 mg,避免行任何口腔操作(如拔牙、补牙等)。
三、安全性和疗效评估
安全性评估指标包括用药后主观不良反应、下颌骨 X 线片、血钙、碱性磷酸酶、肝肾功能、血色素、白细胞、血小板等。疗效评估包括:治疗用药组观察指标为客观反应率、临床受益率、疾病进展时间;预防用药组观察指标为无事件生存率 (event free survival,EFS)。
除 CT 和 MRI 等常规影像学评估外,3 例接受了二次活检手术 (骶骨 2 例和肺转移灶 1 例),2 例接受 PET-CT 检查 (骶骨 1 例、胸椎 1 例),2 例恶性 GCT 患者用药前进行了肿瘤组织 RANKL 表达水平的检测。
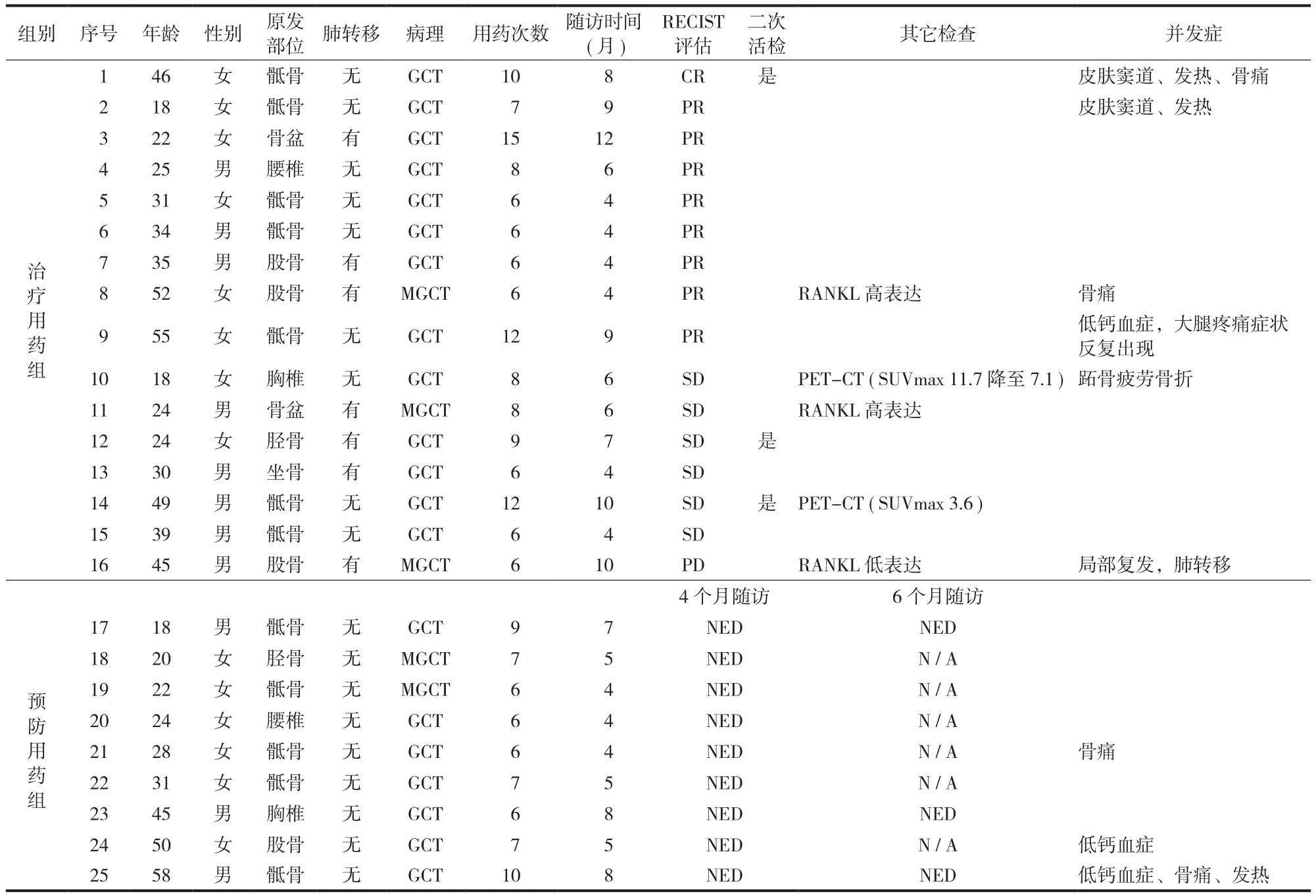
表 1 患者临床情况Tab.1 Clinical characteristics of the patients
结 果
以初次用药为随访开始时间,末次随访时间为2015 年 3 月 1 日。平均随访时间 6 (4~12) 个月。用药期间无死亡病例,患者均按计划用药,平均用药次数 7.4 (6~17) 次。副反应包括骨痛 (4 例)、低钙血症 (3 例)、发热 (3 例)、肿瘤破溃形成窦道(2 例)、疲劳骨折 (1 例)。未见下颌骨坏死。低钙血症常见于年龄>50 岁用药患者。1 例在第 10 次地诺单抗注射 (用药 8 个月) 后出现不明原因持续高热,39 ℃~40 ℃,伴肢体骨痛,全身检查未见明确感染病灶,3 天后发热症状自行缓解,停用地诺单抗注射后未出现类似症状。2 例骶骨 GCT 患者在应用地诺单抗注射后肿瘤部位出现窦道,大量坏死组织流出,经清创引流术后好转。1 例在用药期间出现跖骨疲劳骨折,经保守治疗后骨折愈合。
治疗用药组 16 例中,实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评估显示:完全缓解 1 例、部分缓解 8 例、疾病稳定 6 例、疾病进展 1 例。部分缓解和疾病稳定患者的典型 CT 扫描改变是肿瘤密度降低 (CT 值降低),骨壳形成,肿瘤内部囊性变伴液化分隔。患者疼痛症状多在注射 3 次 (负荷剂量) 地诺单抗后缓解,规律用药期间大多数患者未再次出现局部疼痛,仅1 例部分缓解患者主诉在下一次用药前疼痛加剧,用药后症状消失,药效仅维持 3 周。患者 4 个月临床受益率 93.8%。3 例接受二次活检手术,组织学均未见残留巨细胞瘤成分。2 例疾病稳定患者复查 PETCT 可见 SUVmax 摄取降低。2 例用药前进行了肿瘤组织 RANKL 表达水平的检测,结果显示 RANKL 表达水平与疗效相关,病例 16 为继发性 GCT 恶变患者,肿瘤组织 RANKL 表达水平与正常组织比值为1.213,患者接受地诺单抗 6 次后肿瘤进展,局部复发伴肺转移,再次手术,局部和肺转移灶均接受放疗,目前带瘤存活。病例 8 同样是继发性 GCT 恶变患者,肿瘤组织 RANKL 表达水平与正常组织比值为 74.56,用药 6 次后原有肺转移灶和原发灶明显缩小。7 例肺转移患者接受地诺单抗治疗后,3 例部分缓解,3 例疾病稳定,1 例疾病进展。预防用药组(9 例) 4 个月和 6 个月的 EFS 均为 100%。典型病例资料见图 1、2。

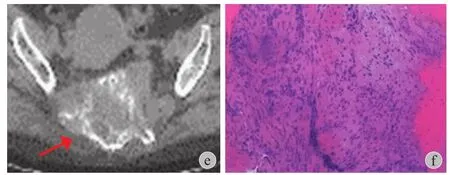
图 1 患者 (9 号病例),女,55 岁,骶骨 GCT a~c:2014 年5 月用药前 CT 扫描及穿刺病理 (HE×200);d:2014 年 9 月用药7 次后 CT 扫描;e~f:2015 年 2 月用药 12 次后复查 CT 示肿瘤缩小,钙化明显增加,穿刺病理 (HE×200) 提示无巨细胞残留Fig.1 Giant cell tumor of the sacrum.Female,55 years old,patient 9 a-c:CT scan of the pelvis and histologic examination of biopsy specimen before drugs in May 2014 (HE×200); d:CT scan after 9 months of denosumab therapy at 120 mg every 4 weeks,7 times,2014; e-f:After the February 2015,12 times of drugs,CT scan showedthat the tumor shrank significantly,calcification increased,both the stromal cells and osteoclast-like giant cells disappeared in re-biopsy specimen (HE×200)
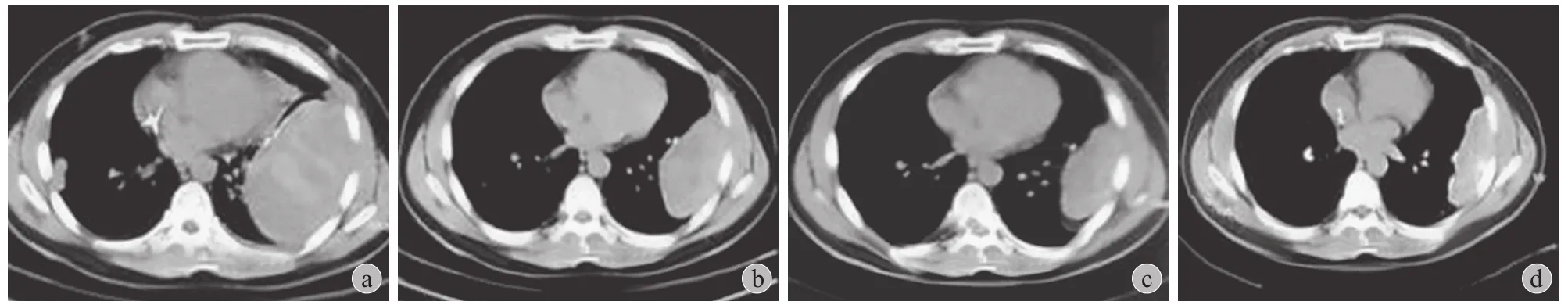
图 2 GCT 肺转移,地诺单抗用药 11 次后肺转移灶明显缩小 a:用药前;b:用药 4 次,2 个月;c:用药 8 次,6 个月;d:用药11 次,10 个月Fig.2 Responses of giant cell tumor with lung metastases to denosumab.CT scan of the thorax of patient 7 at baseline after 11 times of denosumab therapy.Lung metastases lesions decreased significantly a:Before treatment; b:Two-month later,4 times injection; c:Six-month later,8 times injection; d:Ten-month treatment,11 times injection
讨 论
一、地诺单抗与 GCT
在地诺单抗出现之前,对于那些无法切除 (病变位于脊柱、骨盆环等复杂解剖部位或反复复发) 的 GCT 病例来说,传统的治疗方法只有放疗[3],个别文献报道干扰素 α 对病变有一定控制作用[4]。
GCT 内含有破骨细胞样巨细胞和单核基质细胞两种成分,后者表达的 RANKL 与多核巨细胞表面的 RANK 结合,成为启动破骨进程的关键信号,这一过程同时被护骨素拮抗。这一生理反馈机制在骨转移癌、GCT 和骨质疏松症患者体内被打破[2]。经过大量基础和临床研究,Amgene 公司研发了第一种人 RANKL 单克隆抗体——地诺单抗 (商品名XGEVA,PROLIA)[5],最先获批用于围绝经期女性骨质疏松症[6],此后经过严格的与唑来膦酸“头对头”的三期临床观察,证实对乳腺癌等实体肿瘤骨转移的进展有控制作用,可有效延缓骨相关事件的发生时间[7]。
随后两篇关于 GCT 的 II 期临床观察结果先后发表在 Lancet 杂志[8-9],结果证实地诺单抗可有效控制GCT 的进展,经组织学检测可见大多数肿瘤组织中多核巨细胞消失。GCT 在东亚人群中发病率更高,本研究为首次在中国患者中应用地诺单抗,结果显示安全性和缓解率与高加索人种的数据相仿。
二、安全性
地诺单抗是一种非常安全的全人源化生物制剂。下颌骨坏死是国外文献报道的严重并发症[10],但本组病例中未见发生,可能与观察者在用药前叮嘱患者避免口腔治疗 (拔牙和补牙) 有关。肢体长骨骨痛 (4 例) 是最常见的副反应。低钙血症 (3 例)多发生在年龄>50 岁用药患者。1 例因不明原因发热而停止用药,2 例在用药后出现肿瘤破溃,局部经穿刺活检口形成窦道,1 例继发感染伴高热。究其原因,这些破溃主要是实体肿瘤同时大量坏死造成,Stacchiotti 等[11]曾报道 1 例脊索瘤患者经格列卫和西罗莫司靶向治疗后肿瘤大量坏死,在骶尾部形成窦道,与本组病例中的 2 例情况类似。
三、疗效
地诺单抗治疗 GCT 的疗效评估标准存在争议。绝大多数位于肢体长骨内的病变经地诺单抗治疗后肿瘤体积都不会发生太大变化[12]。本组中具有可评估病变的 16 例多为骶骨骨盆的侵袭性 GCT,局部有软组织包块或肺转移灶。经治疗后主观症状缓解率高达 93%,但 RECIST 标准的客观缓解率只有56%。对于疾病稳定患者,笔者进行了 PET-CT 和穿刺活检检查,2 例 PET-CT 结果显示,SUVmax 显著降低。在普通 CT 检查中常常见到大量分隔液化灶,强化程度明显减弱 (边缘强化);病灶周边形成钙化的骨壳。与影像学检查相比,二次活检的结果具有高度一致性,3 例经地诺单抗治疗后对可评估病灶实施切除或活检,病例结果均回报未见多核巨细胞和基质细胞,局部仅残留反应性炎症细胞和增生的纤维结缔组织。据此笔者大胆估计,组织学活检结果可能对治疗更具指导意义。
四、恶性变和肺转移病例的辅助治疗
GCT 有一定肺转移率 (1%~4%)[13-14],地诺单抗对于 GCT 肺转移的疗效此前一直限于个案报道[15]。本组中 7 例肺转移患者接受地诺单抗治疗后,3 例部分缓解,3 例疾病稳定,1 例疾病进展。其中 1 例接受胸腔镜辅助肺转移灶切除术,术后病理提示未见肿瘤组织残留,可见反应性炎症细胞和增生的纤维结缔组织。这些结果证实地诺单抗对 GCT 肺转移有确实的抑制作用。
恶性 GCT 可分为原发性和继发性两类,放疗后恶变率<1%,恶性成分多为纤维肉瘤、未分化肉瘤或骨肉瘤,对化疗不敏感,预后极差,缺乏有效治疗手段[1,13]。地诺单抗对恶性 GCT 的疗效此前无明确报道。本组 5 例病理提示为 GCT 中的恶性,其中3 例为原发恶性 GCT,2 例为继发恶变。应用地诺单抗治疗后,仅 1 例出现疾病进展。在预测疗效方面,组织与正常组织间 RANKL 表达水平差异可能是重要指标。
对于复发难治的 GCT 患者,地诺单抗是一种安全有效的治疗手段,恶性 GCT 和伴发肺转移的病例也应考虑接受地诺单抗治疗。在评估地诺单抗疗效时,应在 RECIST 标准基础上结合活检和 PET-CT 结果。肿瘤组织 RANKL 表达水平具有指导意义。地诺单抗长期用药安全性、停药指征和远期疗效是今后的研究重点。
参考文献
[1]Raskin KA,Schwab JH,Mankin HJ,et al.Giant cell tumor of bone.J Am Acad Orthop Surg,2013,21(2):118-126.
[2]Huang L,Xu J,Wood DJ,et al.Gene expression of osteoprotegerin ligand,osteoprotegerin,and receptor activator of NF-kappaB in giant cell tumor of bone:possible involvement in tumor cell-induced osteoclast-like cell formation.Am J Pathol,2000,156(3):761-767.
[3]Shi W,Indelicato DJ,Reith J,et al.Radiotherapy in the management of giant cell tumor of bone.Am J Clin Oncol,2013,36(5):505-508.
[4]Wei F,Liu X,Liu Z,et al.Interferon alfa-2b for recurrent and metastatic giant cell tumor of the spine:report of two cases.Spine,2010,35(24):E1418-1422.
[5]Abrahamsen B,Teng AY.Technology evaluation:denosumab,Amgen.Curr Opin Mol Ther,2005,7(6):604-610.
[6]McClung MR,Lewiecki EM,Cohen SB,et al.Denosumab in postmenopausal women with low bone mineral density.N Engl J Med,2006,354(8):821-831.
[7]Body JJ,Facon T,Coleman RE,et al.A study of the biological receptor activator of nuclear factor-kappaB ligand inhibitor,denosumab,in patients with multiple myeloma or bone metastases from breast cancer.Clin Cancer Res,2006,12(4):1221-1228.
[8]Thomas D,Henshaw R,Skubitz K,et al.Denosumab in patients with giant-cell tumour of bone:an open-label,phase 2 study.Lancet Oncol,2010,11(3):275-280.
[9]Chawla S,Henshaw R,Seeger L,et al.Safety and efficacy of denosumab for adults and skeletally mature adolescents with giant cell tumour of bone:interim analysis of an open-label,parallel-group,phase 2 study.Lancet Oncol,2013,14(9):901-908.
[10]Aghaloo TL,Felsenfeld AL,Tetradis S.Osteonecrosis of the jaw in a patient on Denosumab.J Oral Maxillofac Surg,2010,68(5):959-963.
[11]Stacchiotti S,Marrari A,Tamborini E,et al.Response to imatinib plus sirolimus in advanced chordoma.Ann Oncol,2009,20(11):1886-1894.
[12]Hakozaki M,Tajino T,Yamada H,et al.Radiological and pathological characteristics of giant cell tumor of bone treated with denosumab.Diagn Pathol,2014,9:111.
[13]Szendroi M.Giant-cell tumour of bone.J Bone Joint Surg Br,2004,86(1):5-12.
[14]Klenke FM,Wenger DE,Inwards CY,et al.Giant cell tumor of bone:risk factors for recurrence.Clin Orthop Relat Res,2011,469(2):591-599.
[15]Karras NA,Polgreen LE,Ogilvie C,et al.Denosumab treatment of metastatic giant-cell tumor of bone in a 10-yearold girl.J Clin Oncol,2013,31(12):e200-202.
(本文编辑:王萌)
.骨巨细胞瘤 Giant cell tumor.
Denosumab for patients with giant cell tumors of the bone in a single institute of China:a preliminary analysis of safety and efficacy
YANG Yi,GUO Wei,YANG Rong-li,TANG Xiao-dong,YAN Tai-qiang,JI Tao,XIE Lu,XU Jie,DONG Sen,TANG Shun,LI Xiao,ZANG Jie.Musculoskeletal Tumor Center,Peking University People’s Hospital,Beijing,100044,PRC
【Abstract】Objective To report preliminary safety and efficacy from a retrospective serial study of denosumab,which is a fully human monoclonal antibody against receptor activator of nuclear factor-κB ligand (RANKL) for 25 patients with giant cell tumor of the bone (GCT) in a single institute of China.Methods We did a retrospective study of patients with histologically confirmed GCT.From February to December 2014,25 cases were admitted including 12 males and 13 females.The mean age was 33.7 years (range:18-58 years).We divided patients into 2 groups:16 patients with radiographically measurable GCT,including metastatic or unresectable lesion (Group A); 9 post-operation patients without radiographically measurable GCT but surgical margins were positive (Group B).All patients received 120 mg of subcutaneous denosumab every 4 weeks with loading doses on days 8 and 15 of the first cycle.Investigator-determined disease status and clinical benefit were assessed every 8 weeks.Our primary endpoint was the safety profile of denosumab in terms of adverse events and laboratory abnormalities.Prespecifiedbook=20,ebook=25secondary endpoints were objective response to denosumab in Group A and event-free survival (EFS) at 4 and 6 months in Group B.Some patients received PET-CT,biopsy,and RANKL expression examination.Results Taking the first drug application as the start of the follow-up,the latest follow-up was on March 1st,2015.The average followup was 6.0 months (range:4-12 months).No death during the treatment.All drugs were given according to the plan.The average application of drugs was 7.4 times (range:6-17 times) with good compliance.The most common adverse events were pain in extremities (4 cases,16%),hypocalcaemia (3 cases,12%),fever (3 cases,12%),abscess and sinus tract in the site of the tumor (2 cases,8%),and stress fracture (1 cases,4%).No treatment-related death or osteonecrosis of the jaw was reported.We observed that 1 patient (6%) had complete response,8 (50%) partial responses,6 (38%) stable diseases and 1 (6%) progression disease in Group A.Event free survival (EFS) at 4 and 6 months was 100% in Group B.Histological analysis showed no osteoclast-like giant cells or stromal cells in biopsy specimen of 3 patients.PET-CT showed SUVmax intake decreased to the normal in 1 patient.RANKL was conducted in 2 patients before drugs,showing it was related with efficacy.Conclusions We have confirmed the clinical efficacy and safety of denosumab in Chinese patients with GCT,even in malignant or metastatic patients.Based on response evaluation criteria in solid tumors (RECIST),PET-CT,biopsy,and RANKL expression analysis should also be applied to assess and predict the clinical response to denosumab treatment.Long-term efficacy,safety,and the duration of drug administration need to be further explored in the future.
【Key words】Giant cell tumor of bone; Recurrence; Receptor activator of nuclear factor-kappa B; Denosumab
(收稿日期:2015-11-13)
Corresponding author:GUO Wei,Email:bonetumor@163.com
通信作者:郭卫,Email:bonetumor@163.com
DOI:10.3969/j.issn.2095-252X.2016.01.005
作者单位:100044 北京大学人民医院骨与软组织肿瘤治疗中心
中图分类号:R738.1
