冻融对土壤氮素损失及有效性的影响
2016-05-10杨世琦张晴雯周华坤张爱平韩瑞芸杨正礼中国农业科学院农业环境与可持续发展研究所农业清洁流域团队农业部农业环境重点实验室北京0008中国科学院西北高原生物研究所西宁8000北京大学城市与环境学院生态学系地表过程分析与模拟教育部重点实验室北京0087
陈 哲,杨世琦,张晴雯,周华坤,井 新,张爱平,韩瑞芸,杨正礼,*中国农业科学院农业环境与可持续发展研究所农业清洁流域团队,农业部农业环境重点实验室,北京 0008中国科学院西北高原生物研究所,西宁 8000北京大学城市与环境学院生态学系,地表过程分析与模拟教育部重点实验室,北京 0087
冻融对土壤氮素损失及有效性的影响
陈哲1,杨世琦1,张晴雯1,周华坤2,井新3,张爱平1,韩瑞芸1,杨正礼1,*
1中国农业科学院农业环境与可持续发展研究所农业清洁流域团队,农业部农业环境重点实验室,北京100081
2中国科学院西北高原生物研究所,西宁810001
3北京大学城市与环境学院生态学系,地表过程分析与模拟教育部重点实验室,北京100871
摘要:土壤冻融交替是寒冷生态系统土壤氮素循环的重要驱动力。已有研究表明冻融交替作用能够促进氮素周转,从而缓解因土壤有效氮素缺乏而引起的植物生长限制。即便如此,冻融环境下土壤有效氮素供应量远高于其利用量,过剩的氮素会通过气态(N2O-N)排放、淋溶和径流等途径损失。论述了季节冻融环境和模拟冻融条件下土壤氮素损失状况;同时分析了影响冻融土壤N2O生产的相关因素、产生途径及冻融期N2O大量排放的机制;针对冻融交替过程中土壤氮素有效性问题,探讨了氮矿化、可溶性有机氮(DON)和微生物量氮(MBN)与氮素损失的关系。评述了土壤冻融研究中存在的不足,认为模型研究、土壤微生物功能、氮素转化中间产物、土壤-植物界面过程是未来值得关注和深入探讨的研究方向。
关键词:冻融交替;氮循环;氧化亚氮;氮矿化;微生物量氮;全球气候变化
陈哲,杨世琦,张晴雯,周华坤,井新,张爱平,韩瑞芸,杨正礼.冻融对土壤氮素损失及有效性的影响.生态学报,2016,36(4):1083-1094.
Chen Z,Yang S Q,Zhang Q W,Zhou H K,Jing X,Zhang A P,Han R Y,Yang Z L.Effects of freeze-thaw cycles on soil nitrogen loss and availability.Acta Ecologica Sinica,2016,36(4):1083-1094.
冻融交替是土壤热量动态的一种表现形式,是土壤与大气季节或昼夜温差所导致的反复“冻结-融化”过程[1],这种现象在高纬度、高海拔及部分温带地区非常普遍[2]。全球具有冻融交替现象的土壤面积约占陆地总面积的70%,主要分布在北半球;在环北极及中、低纬度的高山或高原区域具有约22.79×106km2的多年冻土区,占陆地总面积25%。中国北纬30度以北约4.43×106km2(占国土面积46.3%)的土壤受季节性冻融影响;同时在青藏高原、西部高山和东北大小兴安岭,分布着约2.15×106km2的多年冻土[3]。这些区域为冻融交替的生态学研究提供了丰富的地理空间和生态类型。国际上针对冻土带和季节冻土区土壤冻融生态效应的研究早在20世纪60年代已陆续展开[4],主要集中在北极苔原带、北方针叶林、北方落叶阔叶林、高山(寒)草地以及中纬度地区的农田等生态系统。然而,中国的相关研究刚刚起步,主要研究区域和生态类型包括:东北沼泽湿地、黑土农田及西南部分高山森林生态系统。青藏高原作为气候变化的“敏感区”,土壤冻融的时空格局及生态效应研究仍然有限[5-6]。
冻融交替是寒冷区土壤氮素转化的关键驱动力,直接影响该区域生态系统土壤氮库周转。一般而言,寒冷区土壤碳氮储量高[7],由于低温会减缓土壤有机氮的分解,进而导致可供植物利用的氮素缺乏,因此,该区域的特点是植物生产力受氮素限制明显[8]。然而,已有研究表明:频繁的冻融交替会使土壤水分经历多次“液相-固相”转变,打破土壤原有物理结构和化学性质,这不仅影响微生物活动,也促进有机质分解和氮素供应[9]。而作为地气交换(能量和水分)最为关键、土壤生物活动活跃、养分丰富的表层土壤,其受冻融影响最为显著,如:多年冻土区土壤(0—10 cm)的“昼融夜冻”循环日数将近6个月(180次)[10]。频繁的冻融交替势必会改变表层土壤氮素格局,加速有机氮转化,提高有效态氮素水平,改善生长季初期植物对养分的需求。但是,冻融交替多发生在植物非生长季,使得土壤氮供应与植物氮利用存在时间上的错位。一方面有效氮含量升高可能增加微生物对氮素的奢侈利用,增强硝化反硝化作用过程中氧化亚氮(N2O)生成;另一方面冻融交替对土体结构的扰动会增加氮素流失,加剧水体富营养化和地下水硝酸盐污染;此外,气候变化会使多年冻土区深层冻土中储藏的有机氮和温室气体释放到大气中,进一步影响局域甚至全球气候。可见,冻融交替在缓解寒冷生态系统有效氮素缺乏的同时也增加了氮素损失风险,甚至导致负面环境效应。因此,加强冻融交替对土壤氮素有效性和氮素损失问题研究,有助于了解冻土带土壤氮素循环过程,解析冻融期土壤氮素迁移和损失途径,维护寒冷脆弱生态系统生态服务功能,预测全球气候变化对土壤氮库影响及其响应。
1 冻融交替下土壤N2 O-N的排放
土壤氮素气态损失主要通过N2O、N2、NO以及NH3等方式排放。受当前监测方法限制,N2和NO排放而引起的氮素损失鲜有报道。而对土壤NH3挥发的研究,主要集中于石灰性土壤和农田施肥过程中。因此本文在讨论冻融交替下土壤氮库气态损失时,以N2O-N为例。
1.1冻融期土壤N2O-N排放量
已有研究表明:冻融区土壤N2O的排放特点为“源”。如表1所示,在所列举的21项研究中有19项结果表明冻融交替使得土壤N2O的排放量增加,仅有两项研究表明N2O排放量降低或不变[11-12],其中土壤类型和冻融温度是导致N2O对冻融交替响应不一致的主要因素。
原位监测试验表明季节性冻土区,农田土壤冻融期(从土壤冻结到融化)内N2O具有较高的排放量,其累积排放量在1—19 kg N/hm2间,占年排放量的50%以上[13-15]。如Regina等[14]发现芬兰南、北部大麦田冻融期(10月—次年4月)N2O-N累积排放量为3.3—18.9 kg N/hm2,占全年排放量的53%—81%。加拿大圭尔夫(Guelph)地区以大麦、油菜、大豆和玉米等为主的农田仅春季解冻期(3—4月)N2O-N的排放量就达1.5—4.3 kg N/hm2,占全年排放量的65%,施肥后增加到5.7—7.4 kg N/hm2[15]。自然植被类型下,土壤冻融期内N2O-N排放量远低于农田,但对年排放量有较大的贡献。如王广帅等[20]发现青藏高寒草甸冻融期(10月—次年4月)N2O排放量约为0.3 kg/hm2,占全年63%;温带草原冻融期N2O排放速率为8.2 μg N m-2h-1,依此估算该时期N2O-N累计排放量约为0.2 kg N/hm2[21]。美国新罕布什尔地区枫树、桦树天然林地冻融期(12月—次年3月)N2O-N排放量约为0.3—0.4 kg N/hm2,占全年11%—41%[25]。但在德国挪威云杉林土壤中却发现这段时期内N2O排放量接近农田,达2.5 kg N hm-2,占全年73%[26],这可能与该地区地处欧洲中部,氮沉降量高有关。湿地因土壤高含水量成为N2O排放热点,仅冻融期N2O-N排放量就占全年20%—30%[29]。因此,冻融期土壤N2O排放对大气温室气体有重要贡献,特别是农田及其氮输入较高的生态系统中N2O排放值得关注。
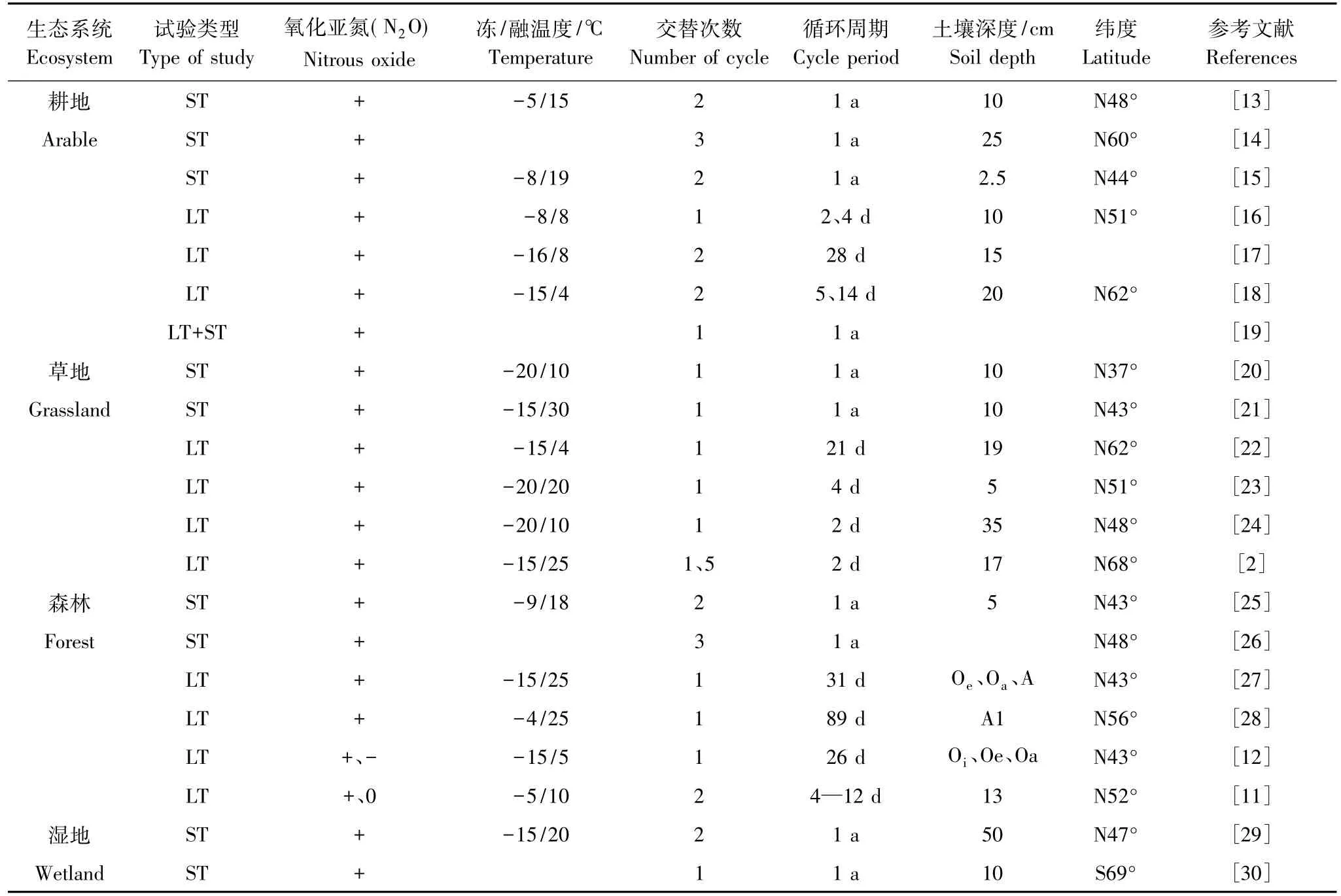
表1 冻融交替对土壤N2O排放的影响Table1 The effects of freeze-thaw cycles on soil N2O emission
室内模拟研究揭示,农田与自然植被土壤N2O-N排放量存在较大差异。其中农田土壤在短期的冻融交替作用下N2O-N释放量的波动范围大致为0.3—1.0 kg N/hm2,而北极地区土壤N2O-N的最大释放量仅为0.01 kg N/hm2[2]。这一差异可能与农田施用大量氮肥导致土壤硝酸盐累积有关。
1.2影响冻融交替下土壤N2O排放的因素
不同冻融格局(如冻结低温、冻结时长、冻融次数等)对土壤N2O排放存在显著影响。一般认为,土壤极端冻结低温(<-10℃)对N2O排放的影响要大于温和冻结处理(-5—0℃)[27]。主要是由于极端低温下土壤冻结对土体的物理作用力强,使更多的团聚体破碎;同时极端低温导致微生物死亡增加。土壤冻结时长对N2O排放的影响不容忽视,已有的研究发现,冻结时间越长,N2O的排放量也越大。如Teepe和Ludwig[11]通过模拟试验发现:农田土壤经约10d的冻结处理,N2O累积排放量比小于7 d的冻结处理高出17%—22%。冻融次数的增加同样提高N2O累积排放量[31]。通常,第一次冻融交替结束后N2O的脉冲式排放特征最明显,而多次循环后N2O排放增量幅度减小,最后趋于稳定[2,18]。这可能是由于少次冻融交替便可使土壤中不稳定氮素得以活化;同时寒冷区微生物对温度的耐性,使得死亡微生物数量随冻融次数的增加而减少[32];另外,土壤微环境、pH值、含盐量等会降低土壤的冻结温度,在一定程度上对微生物起到保护作用[33]。
冻融环境下土壤质地、剖面层次、植被类型、凋落物、积雪厚度同样影响N2O排放。Teepe和Ludwig[11]发现冻融交替显著增加了壤土N2O排放量,而沙土、黏土增加不明显。土壤融化后N2O排放高峰主要源于表层湿润土壤[17],Wagner-Riddle等[34]证实冻融处理后N2O主要来自于表层土(0—5 cm),而深层土壤对冻融期N2O排放的贡献尚不清楚。植被类型不同,土壤冻融对N2O排放的影响也不同,如Nielsen等[27]发现枫树林土壤在冻融交替过程中N2O排放量显著高于桦树林。原位监测结果也表明冻融期内农田土壤N2O排放量高于自然植被[35]。凋落物或积雪覆盖会使表土与低温大气形成隔离层,从而降低冻结强度、冻结深度。因此,覆盖层下土壤的这种温暖、嫌气的环境有利于反硝化过程中N2O的生产[25,36]。此外,凋落物质量、分解速率的差异使其能够为N2O生产供应的底物数量也不同。
1.3冻融交替下N2O生产途径及排放机制
N2O既是反硝化作用的主产物,也是硝化作用的中间产物,前者发生在厌氧条件下,而后者发生在好氧条件下[37]。频繁冻融交替会使土壤形成大量“有氧”、“无氧”或者介于二者之间的具有独特氧化还原条件的微域(Microzone)[17],这为硝化和反硝化作用创造了各自有利的条件。目前多数研究认为反硝化作用是冻融过程中N2O生产的主要贡献者。如利用乙炔抑制法,研究者发现经冻融处理后来自于反硝化作用释放的N2O占总排放量的90%以上[22];同位素标记法也证明反硝化作用所释放的N2O占83%[16];Öquist等[28]通过控制氧分压的方法也得到类似结果。有研究指出自养硝化细菌对环境比较敏感,而反硝化菌对低温的适应性高于硝化细菌[38],反硝化作用能在土壤解冻后短期内大幅提升,而硝化作用增强则相对滞后,因此一段时间内N2O排放以反硝化作用为主。短期反硝化作用的增强还可能来自于冻融交替对反硝化微生物群落活性的刺激[39]。
近年来对硝化细菌反硝化作用、氨氧化古菌(ammonia oxidizing archaea,AOA)、氨氧化细菌(ammoniaoxidizing bacteria,AOB)以及硝酸盐异化还原作用(Dissimilatory nitrate reduction to ammonium,DNRA)的研究表明,N2O生产途径复杂多样[40-41]。Wang等[42]发现非生长季AOA和AOB仍保持着较高的活性,且前者的数量高于后者,表明寒冷环境中AOA对N2O生产有较高贡献。DNRA过程中NO-3在硝酸还原酶和亚硝酸还原酶作用下转化为NH+4,同时伴有N2O的产生。在诸如高C/NO-3、厌氧条件下DNRA过程对氮素转化的影响尤为重要[43]。而寒冷区土壤既含有大量的有机碳,冻融交替过程中又形成丰富的厌氧微域,因此DNRA也可能是冻融条件下土壤N2O生产的另一重要途径,然而尚无相关报道。
温度、湿度、有机质、土壤质地、pH值,以及冻融格局等都是影响N2O排放的重要因素[44]。冻融期土壤N2O的大量排放可能存在生物、物理以及生物-物理联合等多个作用机制,如微生物机制、底物诱导机制和物理性释放机制[45]。
(1)微生物机制
Röver等[46]第一次提出冻融环境下N2O高排放量与微生物活动关系密切。首先,冻融交替会改变土壤微生物类群。如Mergel等[47]发现在秋、冬及早春时节,挪威云杉土壤反硝化细菌数量显著高于夏季。Feng等[48]利用磷脂脂肪酸分析法发现冻融交替使真菌数量大幅减少,但对细菌无影响。而参与硝化和反硝化过程的微生物恰以细菌为主,说明冻融过程中与N2O生产有关的主要微生物仍保持一定数量。其次,即便在一年中最冷的月份,土壤反硝化酶依然维持较高活性[49]。冻融强度和频次的增加甚至会增强硝酸和亚硝酸还原酶活性[50]。也有观点认为低温环境中N2O还原酶较其氧化酶活性降低更为剧烈,较少的N2O被还原为N2,因此N2O累积增加[51]。另外,在微生物功能基因的微观水平上,Sharma等[24]通过PCR技术证实,经过冻融交替处理后,反硝化微生物中控制硝酸和亚硝酸还原酶的基因片段具有更高的表达水平;Yang等[52]利用时空替换方法,也发现高寒草地土壤中参与氨化、硝化过程的微生物功能基因与N2O排放正相关。
(2)底物诱导机制
不同类型土壤中微生物脱氮作用速度缓慢,这主要是因反应所需底物供应不足所致。有研究发现当移除凋落物层后,冻融过程中N2O排放量减少70%[11],表明凋落物是冻融条件下N2O生产的主要底物供应源。模拟研究发现在土壤解冻后N2O排放量出现峰值,第一次冻融交替结束后最明显,多次循环之后排放量趋于稳定[18,27,31,36,53]。这暗示随着反应的进行,底物中有效N含量的下降会限制N2O生产。同时,冻融过程中物理作用力如胀缩拉力会造成土壤团聚体结构碎化,被包裹、吸附的部分含氮物质得以释放,增加底物含量;且破碎的团聚体能扩大微生物附着面积,增加与底物接触机会;同时冰晶的形成会杀死部分微生物,释放出小分子有机氮,可被微生物直接利用。因此冻融交替能通过提高反应所需氮素底物含量,进而刺激N2O生产。
(3)物理释放机制,也称禁锢—释放
有报道表明,积雪或凋落物覆盖可使表土(5 cm)在冬、春季土壤温度维持在-5℃以上,波动幅度小于5℃[36],同时深层土壤相对温暖,保证了微生物活动所需的温度条件。因此,即便表土完全冻结,反硝化作用在下层温暖、厌氧的土壤中仍能继续进行。而当地表被积雪覆盖或土壤出现冻结层时,地气交换微弱甚至停止[28],所以反硝化生成的N2O将被暂时禁锢在土体中。只有当积雪和冻结层融化后,这部分N2O才得以集中释放。其它温室气体监测过程中也发现在土壤解冻期存在爆发式排放特征[54]。虽然禁锢-释放机制有益于理解长期冻结或冰封状态下深层土体产生N2O的累积效应,但难以解释冻融交替对N2O生产过程的影响,因此物理释放也受到一些质疑[17,34]。
2 冻融交替下土壤N素流失
径流(侵蚀)和淋溶(下渗)是土壤N素随水流失的两条主要途径。春季融雪和冻土层融化均会加剧土壤可溶性有机氮(DON)和矿质氮的流失。前者主要包括小分子蛋白质、氨基酸、氨基糖、酰胺等,后者主要包括NH+4、NO-3、NO2-等,二者均是构成土壤有效氮素的重要组分。众多研究表明冻融交替会增加DON、NO-3、NH+4含量(表2),但冻融期为植物非生长季,因此高的氮素供应量与低的氮素利用率的矛盾,会增加该时期氮素流失风险,降低生态系统生产力[55]。
2.1冻融交替下N素径流损失
氮的径流损失是指溶解于径流液中的矿质氮或吸附于泥沙颗粒表面的氮素随水流失。一方面在融雪过程中,往往会伴随严重的土壤侵蚀,也称冻融侵蚀。冻融侵蚀很早就得到了国外研究者的关注,前人一致认为春季融雪期是土壤流失的重要时期,且在积雪较多、土壤含水量高的地区流失更为严峻[56]。Zuzel等[57]调查了美国俄勒冈东北部地区的径流侵蚀,发现86%的氮素损失是由融雪径流和冻融作用造成的。加拿大Peace河流域春季融雪径流引起的土壤氮素流失为80%[58]。美国西北部太平洋沿岸地区春季融雪径流引起的土壤氮素流失量在全年侵蚀总量中所占的比重甚至高达90%[59]。
冻融交替对土壤物理性质的改变是导致冻融侵蚀的主要原因。首先,融化初期土壤未完全解冻,土壤孔隙被冰晶填充,导致表层积雪融水不能正常下渗,从而使该层以上土壤含水量增大,而在水饱和条件下的土壤抗剪强度也随之降低。若降雪量大、气温高,冰雪融化快,一次性产生的地表径流多,冻融侵蚀将越严重。在山地、丘陵、农田坡岗地等地形下更易产生地表径流。其次,多次冻融交替会严重破坏土壤颗粒间的联结力,导致其稳定性下降,土体结构松散,土壤抗蚀性降低,因而侵蚀量增加[60]。
另一方面长期冻结使土壤中滞留的矿质氮素(NH+4、NO-3)含量升高[35],严重的冻融侵蚀会加剧这部分氮素流失。Deelstra等[61]通过调查北欧波罗的海周围以农业为主的小流域,发现冬季土壤氮素流失量与地表径流量显著正相关,氮素流失量为1.4—8.7 kg N/hm2,占全年损失量的5%—35%。在英格兰北部一流域内春季融雪期随雪水输出的NO-3-N甚至占全年损失量的69%[62]。冬季土壤温度是影响氮素径流损失的一个重要因素。Mitchell等[63]通过对美国东北部4个典型森林流域的调查,发现经过异常寒冷的冬季,次年土壤NO-3-N的径流损失量增加1.4—2.8 kg N/hm2;Callesen等[64]同样发现温度异常寒冷的冬季,德国挪威云杉林土壤NO-3-N次年流失增量高达13.0 kg N/hm2。Brooks等[65]研究表明高山土壤在经过极端低温(-11℃)冻结后,氮素径流损失量(11.4 kg N/hm2)是适度冻结(-5℃)损失量(2.7 kg N/hm2)的4.2倍。Watmough等[66]关于加拿大16个流域的研究也发现土壤的深度冻结是导致沼泽湿地NO-3含量增加的主要原因,影响到整个流域中河流的氮输出。关于冻结温度对N素径流损失的影响也受到一些科学家的质疑,Fitzhugh等[67]认为土壤的冻结程度能够解释哈伯德溪流域(Hubbard Brook Watershed)NO-3浓度的年内波动,但与NO-3径流损失量的关系微弱,损失量可能更多的受水文条件的控制。Hong等[68]模型研究结果表明,寒冷年份哈伯德溪流域氮素损失的增加不仅与土壤冻结有关,更多的是由不同冻结条件下土壤氨化和硝化作用的差异所致,尤其是土壤温湿度变异对硝化作用的影响。
2.2冻融交替下N素淋溶损失
土壤溶液中矿质氮素,特别是NO-3不易被土壤颗粒吸附,当土壤超过饱和持水量时,NO-3极易随水向下淋失。已知通过原位试验研究冻融条件下土壤氮素淋溶损失的并不多,仅有个别研究通过控制积雪厚度监测土壤溶液氮浓度变化。如Boutin和Robitaille[69]去除了糖枫林土壤表层积雪,发现40 cm土壤温度降至-5℃,对照组10 cm土壤未冻结,其中去除积雪后次年生长季30 cm土壤溶液的氮浓度显著高于对照组。Fitzhugh等[70]同样通过积雪控制试验发现糖枫林和黄桦林处理组表层土(10 cm,冻结温度-1℃)的淋溶损失量分别为29.0、54.0 kg N/hm2,分别是对照组淋溶损失量(16.0 kg N/hm2)的1.8、3.4倍;但对黄桦林深层土(B层)总的N淋溶无影响,糖枫林深层土氮素甚至增加3.0 kg N/hm2。目前对深层土壤氮淋溶损失影响的研究很少,因为不同地区和植被类型下土壤条件和氮素存在形态对氮素淋溶损失影响巨大。深层土壤氮通量净增加仅出现在每年土壤冻结之后,因此有人指出因冻融期缺少植物根系吸收、上层矿质氮素向下迁移,使深层土无机氮素得以累积[35]。Yu等[71]通过淋溶模拟装置发现冻融处理显著增加土壤氮素的淋溶量,其中3种湿地0—10、10—20、20—30 cm的土壤淋溶液NO-3含量显著低于30—40 cm;大豆农田0—10 cm土层淋溶液NO-3含量显著低于10—20、20—30、30—40 cm深处。这表明湿地0—30 cm土层中大量NO-3向下迁移进入深层土壤,而旱田土壤氮素淋溶损失主要发生在表层(0—10 cm);由于湿地表层土壤粘土的比例低于旱田,而孔隙度又高于旱田,故湿地土壤NO-3更易发生淋溶损失。
多次冻融交替中土体发生胀缩,使得土壤颗粒得以重新排列,改变原有孔隙比,进而影响土壤渗透率。渗透率的提高会减小土壤融化后氮素淋溶阻力,增加淋洗量。尽管农田土壤氮素淋溶受耕作影响较大,但对自然生态系统来说,冻融交替无疑是改变土壤孔隙、影响氮素淋溶迁移的一种重要因素。有研究表明冻融交替会使土壤的渗透系数增大约1—2个数量级[72],也有研究表明冻融使土壤孔隙比减小,但渗透系数增大,主要是由冻融过程中造成微裂隙或者冰晶融化后形成大孔隙所致[73]。传统观念认为寒冷地区在冬春季降水少,与雨季相比冬春季的淋溶量可忽略不计,但需要指出的是,由冻融交替造成土壤物理性质改变对土壤氮素淋溶损失的影响可能贯穿整个生长季。
3 冻融交替对土壤N素有效性的影响
土壤N素损失建立在有效氮素变化的基础上。一般认为,土壤氮循环主要受植物吸收无机氮素和微生物分解有机氮两个过程驱动,因此氮矿化被看作是决定土壤氮素有效性的关键环节。广义上将氨化作用和NH4+被氧化成NO-3、NO2-的过程统称为氮矿化。一般通过测定一段时间内土壤氮矿化量来衡量氮素有效性。在我们所查阅的14项研究中均表明冻融交替使矿质态氮素含量增加(表2),其中农田土壤增加量最大。DeLuca等[74]、Herrmann和Witter[75]发现经过冻结处理的农田土壤N净矿化增加2—3倍。自然植被中冻融交替对土壤氨化作用和硝化作用的影响程度不同。Edwards等[76]发现北极沼泽化草甸土NH+4在春季冻融交替时出现峰值,并且持续较长时间,在春季冻融期结束后迅速回落,而NO-3变化不大。Nielsen等[27]也发现冻融交替使落叶阔叶林土壤的NH+4含量增加,而NO-3含量减少。有观点认为这是由于土壤温度低于10℃时,土壤氨化速率通常大于硝化[38],因此冻结土壤更易累积NH+4。而Zhang等[77]对内蒙古草原土壤冻融期氮矿化的研究却发现当土壤融化后NH+4总量比冻结前下降56%,而NO-3总量却增加84%。殷睿等[78]同样发现我国川西北亚高山森林冬季土壤氮氨化量表现为“净损失”,而氮硝化量“净积累”。因此,冻融过程中土壤氮净矿化量变化仍然存在不确定性。
冻融作用对土壤矿化量的影响与冻结温度、冻融幅度以及冻融交替次数有关。Reinmann等[12]曾发现极端冻结(-15℃)处理后,云杉-冷杉混交林和糖枫-山毛榉混交林土壤NH+4含量分别由1.5、2.9 mg N/kg增加到9.6、29.1 mg N/kg,净增5、9倍;Groffman等[79]则发现温和的冻结温度(-1℃)对桦树林和枫树林土壤氮矿化无影响;Larsen等[80]甚至发现在当冻结温度为-4℃,融化温度为2℃的冻融交替条件下氮矿化量甚至低于未冻结和永久冻结处理;周旺明等[81]同样发现当冻结温度为-25℃时,融化后沼泽土壤的矿化量显著高于冻结温度为-5℃的冻融处理。可见,在冻融交替过程中极端冻结温度会增加土壤氮矿化量,冻融交替的温度波动幅度越大氮矿化量也越高。然而,冻融交替次数的增加并未持续促进氮素矿化,其中前期冻融交替过程氮矿化量脉冲式增加的特点显著。例如Schimel和Clein发现第1次冻融交替处理结束后,苔原桤木—白杨混交林土壤氮矿化提高3倍,之后随循环次数的增加氮矿化量无变化[53]。
冻融交替除通过影响氮素矿化而改变氮素有效性外,还会影响DON含量(表2)。Grogan等[2]发现1次冻融交替显著提高极地苔原土壤DON含量,而多次冻融交替后DON含量降低。这与青藏高原东部高山草甸土[82]和三江平原沼泽湿地泥炭土[81]相关的冻融作用研究结果一致。模拟试验揭示,冻融过程中土壤微生物量氮(MBN)与氨基酸氮、氨基糖氮变化趋势相反[83]。因此有理由怀疑冻融条件下DON组分变化主要与MBN有关,土壤干湿交替和氯仿熏蒸结果也支持这一观点。但DON各组分较为活跃,能够在较短时间内被转化为矿质氮。目前没有直接证据表明冻融交替初期氮矿化量急剧增加与微生物死亡引起的MBN释放有关。但Herrmann和Witter[75]曾通过同位素标记微生物量碳(MBC)的方法发现经冻融交替处理后碳矿化量(CO2)中65%的C来自于标记的MBC,间接说明冻融交替初期氮矿化量的激增可能主要来自于MBN。
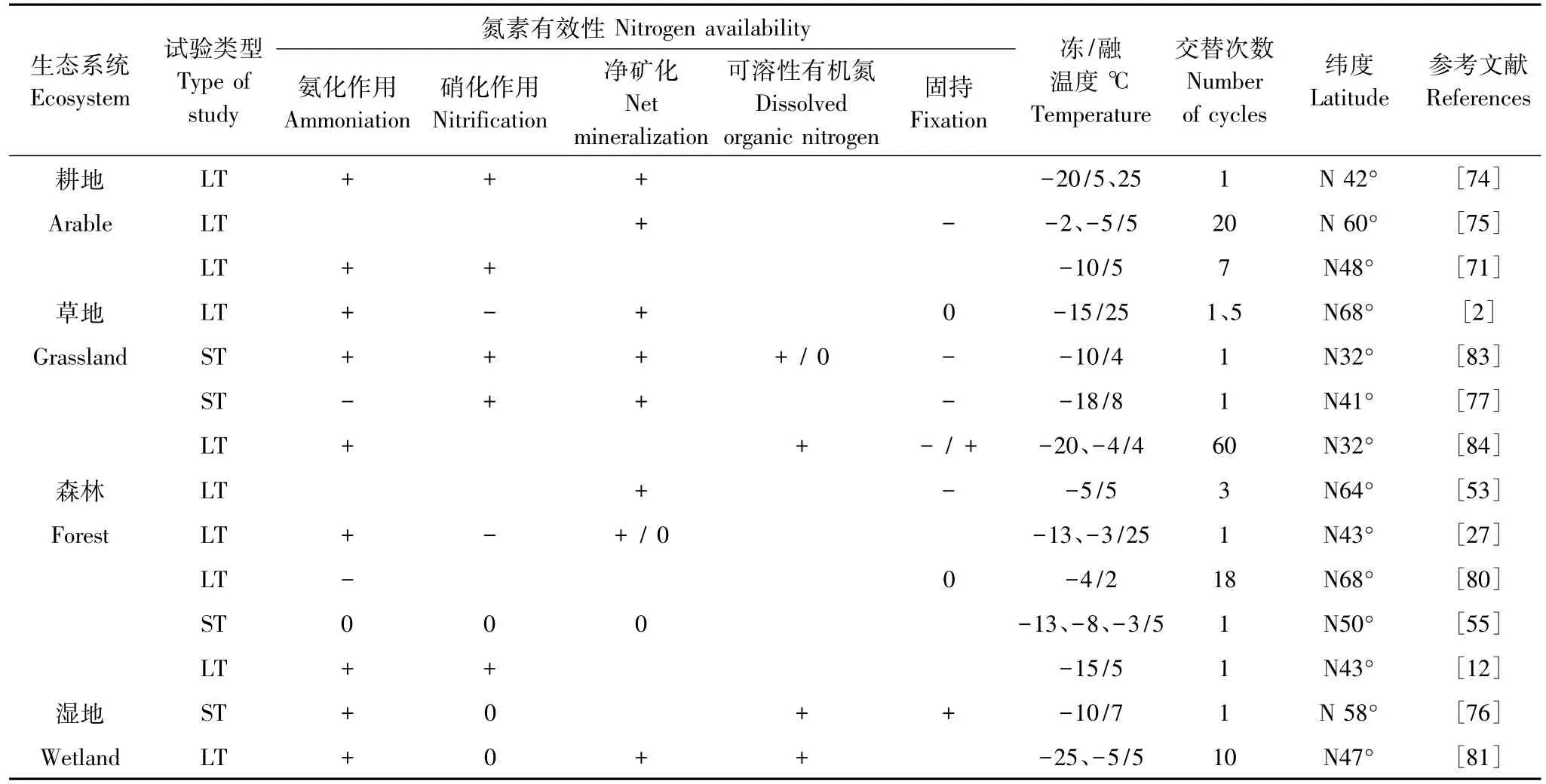
表2 冻融作用对土壤氮素有效性的影响Table2 The effects of freeze-thaw cycles on soil nitrogen availability
但MBN在土壤总氮中的比例不高,且死亡微生物的恢复需要一定时间,因此冻融交替对DON和矿化量的影响具有时效性,这可能正是诸多研究显示在前期冻融交替过程中土壤有效氮素呈脉冲式增加的原因[53,64]。虽然冻融引起部分微生物死亡,会提高土壤有效氮素,但是存活下来的微生物代谢活性较高,能迅速利用有效氮,增加对N素的固持[84](表2),使氮净矿化量降低。因此多次冻融交替后氮矿化量维持稳定也可能是由存活微生物对氮的强吸收所致。结合N2O排放的底物诱导机制,不难理解在模拟条件下冻融交替初期MBN变化决定了N2O脉冲式排放特征。综上,笔者认为冻融条件下土壤氮素有效性的变化同MBN变化密切相关;极端的冻结温度、剧烈的冻融幅度会加大微生物死亡带来的MBN释放;存活微生物能增加对有效氮素的生物固持,且随着代谢、死亡而逐渐释放部分氮素。
4 研究不足与展望
目前冻融交替的生态学研究涵盖的区域以高纬度冻土带为主,还不清楚寒带地区所得试验规律是否适用于积雪覆盖变化快、冻融格局变异大的中纬度季节冻土区以及中低纬度的高山。就生态系统类型来说,关于湿地土壤冻融期氮素损失的研究仍比较匮乏(表1,表2)。在中国,青藏高原独特的地理环境,对于讨论高海拔与高纬度不同生态系统类型下冻融生态效应具有重要价值。尽管生态学家已在这一气候变化敏感区建立了世界先进水平的增温[85]及降水联合控制试验平台,但还没有涉及温度和降水变化下冻融格局改变对土壤氮素损失及其有效性的影响。诸如美国哈伯德布鲁克森林实验站(Hubbard Brook Experimental Forest)[12,25,27]这种以流域为核心,探究流域尺度上冬季覆雪、冰冻对生态系统氮素输出、流域水体水质影响的综合研究在中国仍为空白。
由于野外实验条件差、费用高、周期长,难以实现精确控制,所以目前冻融交替对氮素转化的机理研究仍以室内模拟研究方法为主。但室内模拟研究仍存在土壤采集时段不一致,土壤样品处理方法不合理,冻融格局设置脱离真实环境等问题[36]。故关于室内模拟研究的方法学问题有待进一步探索。
除N2O排放外冻融期其它含氮气(如)体造成的氮素损失状况尚不清楚。在解冻时期冻融侵蚀造成农田土壤氮素流失可能引起面源污染和流域水质问题未受重视。且自然状态下冻融造成氮素流失对生态系统生产力影响的研究也为空缺。关于冻融交替下土壤氮素有效性问题,目前多以矿质氮素的变化为主,作为氮素转化最为活跃的微生物在冻融过程中“死亡—再生—死亡”这一土壤内部的小循环对氮素转化的影响以及微生物群落结构和功能对冻融交替的响应研究还不够深入。目前冻融的模拟研究中较多关注了土壤冻融格局对氮素转化的影响,土壤水分这一在冻融过程中会对土壤温度、通气、团聚体、pH值均带来重大改变的关键因子被忽视。
(1)原位监测与模型研究相结合。在全球变背景下,迫切需要进行系统的研究来评价关键气候特征和生态因子(如土壤、植被类型)所控制的冻融过程对生态系统氮循环的影响。原位监测试验站点数目、监测尺度和范围有限,所得观测资料在时间和空间上离散。只有应用模型对已掌握的定点观测资料加以综合,才能得出对观测变量的规律性认识,进而做出合理外推[61]。对于时间跨度大(几十年至千年)、涉及范围广(区域至全球)的研究计划在模型研究中将非生长季环境特征和冻融作用的生态效应考虑进来,有助于减少各模型预测的不确定性,增加模型间的可比性。
(2)冻融条件下土壤微生物功能研究。土壤微生物是联系有机和无机氮素转化的重要参与者。目前冻融研究仅涉及微生物量、C/N和真菌、细菌类群变化,研究方法也仍以氯仿熏蒸-浸提、平板培养等传统方法为主。如今生物化学和分子生物学方法日趋成熟,使微生物多样性、代谢模式、酶活性等研究快速发展。其中核酸分析法实现了对土壤微生物酶系及其编码基因的研究,而且通过对控制氮素转化的关键微生物功能基因的分析能为评价冻融过程中氨化、硝化、反硝化作用提供更可靠依据。因此分子生物学方法将是深入探究冻融环境下土壤氮素周转机理的重要手段和新的切入点。
(3)冻融条件下氮素转化中间产物的定量研究。Schimel等[86]指出微生物胞外酶对含氮高分子化合物的解聚作用是土壤氮素循环的限制性环节。这些含氮高分子聚合物(蛋白质、几丁质和肽聚糖等)通过解聚作用生成的单体物质(如氨基酸、氨基糖和核酸等)是后续氮素矿化过程的原料,成为氮素矿化作用的限速物质。而且这些单体物质属土壤有效氮素一部分,能同时被植物和微生物所利用。现有研究局限于土壤氨化、硝化以及反硝化作用最终产物,对中间过程定量研究的不足使冻融条件下氮素矿化、反硝化和微生物固持等变化关系的不确定性增加。
(4)冻融作用对“土壤-植物”界面过程的影响。植物作为生态系统氮库的重要组成部分,直接参与土壤氮循环。如一些耐寒植物在积雪覆盖下仍然能够存活,当土壤融化氮素有效性增加时能快速生长,大量吸收氮素;而冻融拉伸作用又会导致部分植物根系死亡[87],增加土壤中不稳定氮的输入。另外积雪厚度和覆盖时间对土壤氮库的影响直接关系到植被生产力[88],而寒冷生态系统中植物都具有增加根系氮投资的倾向,随着根系的死亡这部分氮能直接进入土壤氮库。但目前冻融作用研究多基于裸露土壤,忽略了冻融条件下土壤-植物界面氮素的输入与输出。
(5)全球变化背景下冻融作用研究新挑战。IPCC(Intergovernmental Panel on Climate Change)第五次报告指出2003—2012年全球海陆表面平均温度比1850—1900年平均温度上升了0.78℃[89]。高海拔、高纬度地区对全球变暖最为敏感,冬季温度增幅可能是全球平均水平的3倍[90]。气候变暖将深刻改变这些地区土壤冻融格局,如融化期延长、冻结期缩短、冻融温差减小、冻结强度降低、冻融交替次数增加、多年冻土活动层厚度增加[5];另外,降水(雪)格局变化同样影响到冻融交替的生态作用。中国作为世界第三大冻土国[3],青藏高原、东北黑土区、温带高山亚高山土壤冻融的生态学研究有待进一步加强。
参考文献(References):
[1]孙辉,秦纪洪,吴杨.土壤冻融交替生态效应研究进展.土壤,2008,40(4):505-509.
[2]Grogan P,Michelsen A,Ambus P,Jonasson S.Freeze-thaw regime effects on carbon and nitrogen dynamics in sub-arctic heath tundra mesocosms.Soil Biology and Biochemistry,2004,36(4):641-654.
[3]周幼吾,郭东信,邱国庆.中国冻土.北京:科学出版社,2000.
[4]McGarity J W.Effect of freezing of soil on denitrification.Nature,1962,196(4861):1342-1343.
[5]张中琼,吴青柏.气候变化情景下青藏高原多年冻土活动层厚度变化预测.冰川冻土,2012,34(3):505-511.
[6]张宝贵,张威,刘光琇,陈拓,王鹭,章高森,伍修锟,台喜生,龙昊知,毛文梁.冻融循环对青藏高原腹地不同生态系统土壤细菌群落结构的影响.冰川冻土,2012,34(6):1499-1507.
[7]Hobbie S E,Schimel J P,Trumbore S E,Randerson J R.Controls over carbon storage and turnover in high-latitude soils.Global Change Biology,2000,6(S1):196-210.
[8]Vitousek P M,Howarth R W.Nitrogen limitation on land and in the sea:how can it occur?.Biogeochemistry,1991,13(2):87-115.
[9]Freppaz M,Williams B L,Edwards A C,Scalenghe R,Zanini E.Simulating soil freeze/thaw cycles typical of winter alpine conditions: implications for N and P availability.Applied Soil Ecology,2007,35(1):247-255.
[10]杨梅学,姚檀栋,Nozomu H,Fujii H.青藏高原表层土壤的日冻融循环.科学通报,2006,51(16):1974-1976.
[11]Teepe R,Ludwig B.Variability of CO2and N2O emissions during freeze-thaw cycles:results of model experiments on undisturbed forest-soil cores.Journal of Plant Nutrition and Soil Science,2004,167(2):153-159.
[12]Reinmann A B,Templer P H,Campbell J L.Severe soil frost reduces losses of carbon and nitrogen from the forest floor during simulated snowmelt: A laboratory experiment.Soil Biology and Biochemistry,2012,44(1):65-74.
[13]Dörsch P,Palojärvi A,Mommertz S.Overwinter greenhouse gas fluxes in two contrasting agricultural habitats.Nutrient Cycling in Agroecosystems,2004,70(2):117-133.
[14]Regina K,Syväsalo E,Hannukkala A,Esala M.Fluxes of N2O from farmed peat soils in Finland.European Journal of Soil Science,2004,55 (3):591-599.
[15]Wagner-Riddle C,Thurtell G W,Kidd G K,Beauchamp E G,Sweetman R.Estimates of nitrous oxide emissions from agricultural fields over 28 months.Canadian Journal of Soil Science,1997,77(2):135-144.
[16]Ludwig B,Wolf I,Teepe R.Contribution of nitrification and denitrification to the emission of N2O in a freeze-thaw event in an agricultural soil.Journal of Plant Nutrition and Soil Science,2004,167(6):678-684.
[17]Teepe R,Brumme R,Beese F.Nitrous oxide emissions from soil during freezing and thawing periods.Soil Biology and Biochemistry,2001,33 (9):1269-1275.
[18]Koponen H T,Flöjt L,Martikainen P J.Nitrous oxide emissions from agricultural soils at low temperatures:a laboratory microcosm study.Soil Biology and Biochemistry,2004,36(5):757-766.
[19]Christensen S,Tiedje J M.Brief and vigorous N2O production by soil at spring thaw.Journal of Soil Science,1990,41(1):1-4.
[20]王广帅,杨晓霞,任飞,张振华,贺金生.青藏高原高寒草甸非生长季温室气体排放特征及其年度贡献.生态学杂志,2013,32(8): 1994-2001.
[21]Holst J,Liu C,Yao Z,Brüggemann N,Zheng X,Giese M,Butterbach-Bahl K.Fluxes of nitrous oxide,methane and carbon dioxide during freezing-thawing cycles in an Inner Mongolian steppe.Plant and Soil,2008,308(1/2):105-117.
[22]Priemé A,Christensen S.Natural perturbations,drying-wetting and freezing-thawing cycles,and the emission of nitrous oxide,carbon dioxide and methane from farmed organic soils.Soil Biology and Biochemistry,2001,33(15):2083-2091.
[23]Müller C,Martin M,Stevens R J,Laughlin R J,Kammann C,Ottow J C G,Jäger H J.Processes leading to N2O emissions in grassland soil during freezing and thawing.Soil Biology and Biochemistry,2002,34(9):1325-1331.
[24]Sharma S,Szele Z,Schilling R,Munch J C,Schloter M.Influence of freeze-thaw stress on the structure and function of microbial communities and denitrifying populations in soil.Applied and Environmental Microbiology,2006,72(3):2148-2154.
[25]Groffman P M,Hardy J P,Driscoll C T,Fahey T J.Snow depth,soil freezing,and fluxes of carbon dioxide,nitrous oxide and methane in a northern hardwood forest.Global Change Biology,2006,12(9):1748-1760.
[26]Papen H,Butterbach-Bahl K.A 3-year continuous record of nitrogen trace gas fluxes from untreated and limed soil of a N-saturated spruce and beech forest ecosystem in Germany:1.N2O emissions.Journal of Geophysical Research:Atmospheres(1984—2012),1999,104(D15): 18487-18503.
[27]Nielsen C B,Groffman P M,Hamburg S P,Driscoll C T,Fahey T J,Hardy J P.Freezing effects on carbon and nitrogen cycling in northern hardwood forest soils.Soil Science Society of America Journal,2001,65(6):1723-1730.
[28]Öquist M G,Nilsson M,Sörensson F,Kasimir-KlemedtssonÅ,Persson T,Weslien P,Klemedtsson L.Nitrous oxide production in a forest soil at low temperatures-processes and environmental controls.FEMS Microbiology Ecology,2004,49(3):371-378.
[29]Song C C,Wang Y S,Wang Y Y,Zhao Z C.Emission of CO2,CH4and N2O from freshwater marsh during freeze-thaw period in Northeast of China.Atmospheric Environment,2006,40(35):6879-6885.
[30]Zhu R B,Liu Y S,Ma J,Xu H,Sun L G.Nitrous oxide flux to the atmosphere from two coastal tundra wetlands in eastern Antarctica.Atmospheric Environment,2008,42(10):2437-2447.
[31]Syväsalo E,Regina K,Pihlatie M,Esala M.Emissions of nitrous oxide from boreal agricultural clay and loamy sand soils.Nutrient Cycling in Agroecosystems,2004,69(2):155-165.
[32]杨思忠,金会军.冻融作用对冻土区微生物生理和生态的影响.生态学报,2008,28(10):5065-5074.
[33]Yanai Y,Toyota K.Effects of soil freeze-thaw cycles on microbial biomass and organic matter decomposition,nitrification and denitrification potential of soils//Hatano R,Guggenberger G.Symptom of Environmental Change in Siberian Permafrost Region.Sapporo:Hokkaido University Press,2006:177-191.
[34]Wagner-Riddle C,Hu Q,Van Bochove E,Jayasundara S.Linking nitrous oxide flux during spring thaw to nitrate denitrification in the soil profile.Soil Science Society of America Journal,2008,72(4):908-916.
[35]Matzner E,Borken W.Do freeze-thaw events enhance C and N losses from soils of different ecosystems?A review.European Journal of Soil Science,2008,59(2):274-284.
[36]Henry H A L.Soil freeze-thaw cycle experiments:trends,methodological weaknesses and suggested improvements.Soil Biology and Biochemistry,2007,39(5):977-986.
[37]蔡延江,丁维新,项剑.土壤N2O和NO产生机制研究进展.土壤,2012,44(5):712-718.
[38]Smith J,Wagner-Riddle C,Dunfield K.Season and management related changes in the diversity of nitrifying and denitrifying bacteria over winter and spring.Applied Soil Ecology,2010,44(2):138-146.
[39]Yanai Y,Toyota K,Okazaki M.Response of denitrifying communities to successive soil freeze–thaw cycles.Biology and Fertility of Soils,2007,44(1):113-119.
[40]贺纪正,张丽梅.土壤氮素转化的关键微生物过程及机制.微生物学通报,2013,40(1):98-108.
[41]Rütting T,Boeckx P,Müller C,Klemedtsson L.Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle.Biogeosciences,2011,8(7):1779-1791.
[42]Wang A,Wu F Z,Yang W Q,Wu Z C,Wang X X,Tan B.Abundance and composition dynamics of soil ammonia-oxidizing archaea in an alpine fir forest on the eastern Tibetan Plateau of China.Canadian Journal of Microbiology,2012,58(5):572-580.
[43]Morley N,Baggs E M.Carbon and oxygen controls on N2O and N2production during nitrate reduction.Soil Biology and Biochemistry,2010,42 (10):1864-1871.
[44]朴河春,刘广深,洪业汤.全球冻融地区土壤是重要的N2O释放源的综合分析.地球科学进展,1995,10(3):283-295.
[45]蔡延江,王小丹,丁维新,鄢燕,鲁旭阳,杜子银.冻融对土壤氮素转化和N2O排放的影响研究进展.土壤学报,2013,50(5): 1032-1042.
[46]Röver M,Heinemeyer O,Kaiser E A.Microbial induced nitrous oxide emissions from an arable soil during winter.Soil Biology and Biochemistry,1998,30(14):1859-1865.
[47]Mergel A,Schmitz O,Mallmann T,Bothe H.Relative abundance of denitrifying and dinitrogen-fixing bacteria in layers of a forest soil.FEMS Microbiology Ecology,2001,36(1):33-42.
[48]Feng X J,Nielsen L L,Simpson M J.Responses of soil organic matter and microorganisms to freeze-thaw cycles.Soil Biology and Biochemistry,2007,39(8):2027-2037.
[49]Pelletier F,Prévost D,Laliberté G,van Bochove E.Seasonal response of denitrifiers to temperature in a Quebec cropped soil.Canadian Journal of Soil Science,1999,79(4):551-556.
[50]魏丽红.冻融交替对黑土土壤有机质及氮钾养分的影响[D].长春:吉林农业大学,2004.
[51]Holtan-Hartwig L,Dörsch P,Bakken L.Low temperature control of soil denitrifying communities:kinetics of N2O production and reduction.Soil Biology and Biochemistry,2002,34(11):1797-1806.
[52]Yang Y F,Gao Y,Wang S P,Xu D P,Yu H,Wu L W,Lin Q Y,Hu Y G,Li X Z,He Z L,Deng Y,Zhou J Z.The microbial gene diversity along an elevation gradient of the Tibetan grassland.The ISME Journal,2013,8(2):430-440.
[53]Schimel J P,Clein J S.Microbial response to freeze-thaw cycles in tundra and taiga soils.Soil Biology and Biochemistry,1996,28(8): 1061-1066.
[54]Mastepanov M,Sigsgaard C,Dlugokencky E J,Houweling S,Ström L,Tamstorf M P,Christensen T R.Large tundra methane burst during onset of freezing.Nature,2008,456(7222):628-630.
[55]Hentschel K,Borken W,Matzner E.Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil.Journal of Plant Nutrition and Soil Science,2008,171(5):699-706.
[56]景国臣.冻融侵蚀的类型及其特征研究.中国水土保持,2003,(10):17-18.
[57]Zuzel J F,Allmaras R,Greenwalt R.Runoff and soil erosion on frozen soils in northeastern Oregon.Journal of Soil and Water Conservation,1982,37(6):351-354.
[58]Van Vliet L J P,Hall J W.Effects of two crop rotations on seasonal runoff and soil loss in the Peace River region.Canadian Journal of Soil Science,1991,71(4):533-543.
[59]Demidov V V,Ostroumov V Y,Nikitishena I A,Lichko V I.Seasonal freezing and soil erosion during snowmelt.Eurasian Soil Science,1995,27 (10):78-87.
[60]Gatto L W.Soil freeze-thaw-induced changes to a simulated rill:Potential impacts on soil erosion.Geomorphology,2000,32(1-2):147-160.
[61]Deelstra J,KværnØS H,Granlund K,Sileika A S,Gaigalis K,Kyllmar K,Vagstad N.Runoff and nutrient losses during winter periods in cold climates-requirements to nutrient simulation models.Journal of Environmental Monitoring,2009,11(3):602-609.
[62]Likens G E.Biogeochemistry of a Forested Ecosystem.3rd ed.New York:Springer Science&Business,2013.
[63]Mitchell M J,Driscoll C T,Kahl J S,Likens G E,Murdoch P S,Pardo L H.Climatic control of nitrate loss from forested watersheds in the northeast United States.Environmental Science&Technology,1996,30(8):2609-2612.
[64]Callesen I,Borken W,Kalbitz K,Matzner E.Long-term development of nitrogen fluxes in a coniferous ecosystem:Does soil freezing trigger nitrate leaching?Journal of Plant Nutrition and Soil Science,2007,170(2):189-196.
[65]Brooks P D,Williams M W,Schmidt S K.Inorganic nitrogen and microbial biomass dynamics before and during spring snowmelt.Biogeochemistry,1998,43(1):1-15.
[66]Watmough S A,Eimers M C,Aherne J,Dillon P J.Climate effects on stream nitrate concentrations at 16 forested catchments in south central Ontario.Environmental Science&Technology,2004,38(8):2383-2388.
[67]Fitzhugh R D,Driscoll C T,Groffman P M,Tierney G L,Fahey T J,Hardy J P.Soil freezing and the acid-base chemistry of soil solutions in a northern hardwood forest.Soil Science Society of America Journal,2003,67(6):1897-1908.
[68]Hong B,Swaney D P,Woodbury P B,Weinstein D A.Long-term nitrate export pattern from Hubbard Brook Watershed 6 driven by climatic variation.Water,Air,and Soil Pollution,2005,160(1/4):293-326.
[69]Boutin R,Robitaille G.Increased soil nitrate losses under mature sugar maple trees affected by experimentally induced deep frost.Canadian Journal of Forest Research,1995,25(4):588-602.
[70]Fitzhugh R D,Driscoll C T,Groffman P M,Tierney G L,Fahey T J,Hardy J P.Effects of soil freezing disturbance on soil solution nitrogen,phosphorus,and carbon chemistry in a northern hardwood ecosystem.Biogeochemistry,2001,56(2):215-238.
[71]Yu X F,Zou Y C,Jiang M,Lu X G,Wang G P.Response of soil constituents to freeze-thaw cycles in wetland soil solution.Soil Biology andBiochemistry,2011,43(6):1308-1320.
[72]Chamberlain E J,Iskander I,Hunsiker S E.Effect of freeze-thaw cycles on the permeability and macrostructure of soils//Proceedings of the International Symposium on Frozen Soil Impacts on Agriculture,Range,and Forest Lands.1990:145-155.
[73]Zimmie T F,La Plante C.Effect of freeze/thaw cycles on the permeability of a fine-grained soil[C].Hazardous and Industrial Wastes-Proceedings of the Mid-Atlantic Industrial Waste Conference.1990:580-593.
[74]DeLuca T H,Keeney D R,McCarty G W.Effect of freeze-thaw events on mineralization of soil nitrogen.Biology and Fertility of Soils,1992,14 (2):116-120.
[75]Herrmann A,Witter E.Sources of C and N contributing to the flush in mineralization upon freeze-thaw cycles in soils.Soil Biology and Biochemistry,2002,34(10):1495-1505.
[76]Edwards K A,McCulloch J,Peter Kershaw G,Jefferies R L.Soil microbial and nutrient dynamics in a wet Arctic sedge meadow in late winter and early spring.Soil Biology and Biochemistry,2006,38(9):2843-2851.
[77]Zhang X,Bai W,Gilliam F S,Wang Q,Han X,Li L.Effects of in situ freezing on soil net nitrogen mineralization and net nitrification in fertilized grassland of northern China.Grass and Forage Science,2011,66(3):391-401.
[78]殷睿,徐振锋,吴福忠,杨万勤,李志萍,熊莉,肖洒,王滨.雪被斑块对川西亚高山两个森林群落冬季土壤氮转化的影响.生态学报,2014,34(8):2061-2067.
[79]Groffman P M,Driscoll C T,Fahey T J,Hardy J P,Fitzhugh R D,Tierney G L.Colder soils in a warmer world:a snow manipulation study in a northern hardwood forest ecosystem.Biogeochemistry,2001,56(2):135-150.
[80]Larsen K S,Jonasson S,Michelsen A.Repeated freeze-thaw cycles and their effects on biological processes in two arctic ecosystem types.Applied Soil Ecology,2002,21(3):187-195.
[81]周旺明,秦胜金,刘景双,代力民.沼泽湿地土壤氮矿化对温度变化及冻融的响应.农业环境科学学报,2011,30(4):806-811.
[82]Liu L,Wu Y,Wu N,Xu J J,Mao Y,Luo P,Zhang L.Effects of freezing and freeze-thaw cycles on soil microbial biomass and nutrient dynamics under different snow gradients in an alpine meadow(Tibetan Plateau).Polish Journal of Ecology,2010,58(4):717-728.
[83]徐俊俊,吴彦,张新全,吴宁,石福孙,刘琳.冻融交替对高寒草甸土壤微生物量氮和有机氮组分的影响.应用与环境生物学报,2011,17(1):57-62.
[84]Vitousek P M,Cassman K,Cleveland C,Crews T,Field C B,Grimm N B,Howarth R W,Marino R,Martinelli L,Rastetter E B,Sprent J I.Towards an ecological understanding of biological nitrogen fixation.Biogeochemistry,2002,57-58(1):1-45.
[85]Wang S P,Duan J C,Xu G P,Wang Y F,Zhang Z H,Rui Y C,Luo C Y,Xu B,Zhu X X,Chang X F,Cui X Y,Niu H S,Zhao X Q,Wang W Y.Effects of warming and grazing on soil N availability,species composition,and ANPP in an alpine meadow.Ecology,2012,93(11): 2365-2376.
[86]Schimel J P,Bennett J.Nitrogen mineralization:challenges of a changing paradigm.Ecology,2004,85(3):591-602.
[87]Tierney G L,Fahey T J,Groffman P M,Hardy J P,Fitzhugh R D,Driscoll C T.Soil freezing alters fine root dynamics in a northern hardwood forest.Biogeochemistry,2001,56(2):175-190.
[88]徐倩倩,刘琪璟,张国春.长白山高山苔原雪斑大白花地榆群落土壤氮素动态与生产力的关系.植物生态学报,2011,35(2):159-166.
[89]Stocker T F,Qin D H,Plattner G-K,Tignor M,Allen S K,Boschung J,Nauels A,Xia Y,Bex V,Midgley P M.Climate Change 2013:The Physical Science Basis//Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge,United Kingdom and New York,NY,USA:Cambridge University Press,2013.
[90]Serreze M C,Walsh J E,Chapin III F S,Osterkamp T,Dyurgerov M,Romanovsky V,Oechel W C,Morison J,Zhang T,Barry R G.Observational evidence of recent change in the northern high-latitude environment.Climatic Change,2000,46(1/2):159-207.
Effects of freeze-thaw cycles on soil nitrogen loss and availability
CHEN Zhe1,YANG Shiqi1,ZHANG Qingwen1,ZHOU Huakun2,JING Xin3,ZHANG Aiping1,HAN Ruiyun1,YANG Zhengli1,*
1 Agricultural Clear Watershed Group,Institute of Environment and Sustainable Development in Agriculture,Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-Environment,Ministry of Agriculture,Beijing 100081,China
2 Northwest Plateau Institute of Biology,Chinese Academy of Science,Xining 810001,China
3 Key Laboratory for Earth Surface Processes of the Ministry of Education,Department of Ecology,College of rban and Environmental Sciences,Peking University,Beijing 100871,China
Abstract:Freeze-thaw cycles are key drivers of soil nitrogen(N)cycling in cold ecosystems.Studies have shown that freeze-thaw cycles can enhance N turnover and alleviate N-limitation of plant growth due to the deficiency of soil-available N.However,loss of N is prevailing as a result of available N oversupply during freeze-thaw period.The extra available N mainly losses occurring through N2O emission,leaching and runoff.Here,we summarized the observational and experimental evidence to assess(1)the impact of freeze-thaw cycles on N loss,(2)the environmental factors and mechanisms influencing N2O emission during the process of freeze-thaw cycles,(3)the relationships between N loss and N availability(N mineralization,dissolved organic N,and microbial biomass N),and(4)the shortcomings in current research.We suggest that the main focus of research in the near future will be related to effects on N loss and availability of freeze-thaw cycles,for use in modeling,soil microbial function,mediators of N transformation,and plant-soil interactions.
Key Words:freeze-thaw cycles;nitrogen cycling;nitrous oxide;nitrogen mineralization;microbial biomass nitrogen;book=1084,ebook=196global climate change
*通讯作者
Corresponding author.E-mail:yangzl426@126.com
收稿日期:2014-06-06;网络出版日期:2015-07-09
基金项目:国家水体污染控制与治理科技重大专项(2014ZX07201-009)
DOI:10.5846/stxb201406061171
