沉水植物化感作用对西湖湿地浮游植物群落的影响
2016-05-10胡胜华孔令为刘碧云张丽萍吴振斌淡水生态与生物技术国家重点实验室中国科学院水生生物研究所武汉4300722中国科学院大学北京00049
姚 远,贺 锋,胡胜华,孔令为,刘碧云,曾 磊,张丽萍,*,吴振斌淡水生态与生物技术国家重点实验室,中国科学院水生生物研究所,武汉 4300722中国科学院大学,北京 00049
沉水植物化感作用对西湖湿地浮游植物群落的影响
姚远1,2,贺锋1,胡胜华1,孔令为1,刘碧云1,曾磊1,2,张丽萍1,*,吴振斌1
1淡水生态与生物技术国家重点实验室,中国科学院水生生物研究所,武汉430072
2中国科学院大学,北京100049
摘要:通过微宇宙实验,在控制光照和营养盐浓度的条件下分别研究了苦草(Vallisneria spiralis)、金鱼藻(Ceratophyllum demersum)和穗花狐尾藻(Myriophyllum spicatum)的化感作用对采集于杭州西湖湖西湿地的藻类密度、叶绿素a浓度、群落结构、多样性指数等的影响。其结果表明,3种沉水植物对微宇宙系统中的藻类都具有明显影响,藻类密度与叶绿素a浓度受到显著抑制,3个草-藻研究系统中藻类群落结构都发生了变化。在实验末期苦草组、金鱼藻组和穗花狐尾藻组中藻类总生物量(以细胞密度计)分别较初始值降低了37.06%、78.37%和83.40%。栅藻对3种沉水植物的化感作用敏感性较弱。藻类生物多样性方面,穗花狐尾藻系统中最高,其次是金鱼藻组,最后是苦草组,其Shannon-Wiener指数(H)分别为2.76、2.06和0.72,穗花狐尾藻组中H的显著高于苦草组(P<0.05)。
关键词:沉水植物;化感作用;藻类群落结构;微宇宙系统;杭州西湖湖西湿地
姚远,贺锋,胡胜华,孔令为,刘碧云,曾磊,张丽萍,吴振斌.沉水植物化感作用对西湖湿地浮游植物群落的影响.生态学报,2016,36(4):971-978.Yao Y,He F,Hu S H,Kong L W,Liu B Y,Zeng L,Zhang L P,Wu Z B.Effects of allelopathy of submerged macrophytes on the phytoplankton community collected from the west part of the West Lake wetland in Hangzhou,China.Acta Ecologica Sinica,2016,36(4):971-978.
沉水植物与浮游植物都是水生生态系统中的重要组成部分,两者的生态位重合度高,因此在空间、光照、营养等生存资源方面存在激烈的竞争[1-2]。沉水植物的化感作用作为种间生存竞争的一种特殊形式对维护其种群的生长和发展具有重要作用[3-4]。化感作用是指一种植物通过向环境释放化学物质而对另一种植物(包括微生物)所产生的直接或间接的伤害或促进作用[5]。研究表明苦草(Vallisneria spiralis)、金鱼藻(Ceratophyllum demersum)和穗花狐尾藻(Myriophyllum spicatum)等沉水植物能释放多种化感物质抑制藻类的生长[6-9]。
很多野外的调查表明,浅水湖泊中的沉水植物对浮游植物有明显影响[10-12],因此沉水植被重建已经作为富营养化水体生态修复工程的重要手段并有显著效果。本课题组在国家“十五”水专项武汉课题、“十一五”水专项西湖课题实施过程中,成功的在武汉汉阳地区两个富营养化湖泊:莲花湖[13]和月湖[14]以及杭州西湖湖西区域(数据尚未发表)成功重建了沉水植物群落,使其中浮游植物生物量出现显著降低。但其影响浮游植物群落的机制并不明确。
在自然水生生态系统中,藻类种类繁多,分属于不同门类。不同藻类对于化感作用的敏感度不同,并且不同沉水植物分泌的化感物质也不尽相同[15],因此不同沉水植物的化感作用对不同藻类也可能表现出不同效应,从而影响藻类群落结构,目前鲜有不同沉水植物对浮游植物群落影响方面的研究见诸报道。
本实验通过构建微宇宙系统,选用西湖湖西区域成功恢复的3种沉水植物:苦草、金鱼藻以及穗花狐尾藻和当地的自然藻种,模拟西湖湖西区域水生生态系统,研究沉水植物化感作用是否是其抑制藻类生长的主要原因;跟踪微宇宙系统中不同时间内浮游植物群落结构变化,比较3种沉水植物通过化感作用对浮游植物群落结构调节效应,为通过重建沉水植物来控制浮游植物提供理论依据。
1 实验方法
1.1微宇宙实验系统
本实验在国家水专项西湖工作站进行。实验装置为露天放置一排的12口粗陶缸(购于杭州市花鸟市场)。缸为东西向放置,以控制各缸中光照条件一致。缸的规模为底部内径45 cm、顶部内径75 cm、高75 cm。每口缸仔细用自来水清洗干净后,添加10 cm厚由50%的西湖底泥与50%黄沙均匀混合而成的底质。随后往每只缸中缓缓注入100 L自来水,静置待缸中澄清后使用。另备一套相同系统供藻类培养使用。
1.2供试沉水植物与浮游植物
选择西湖湖西区域已成功恢复的3种沉水植物:苦草、金鱼藻和穗花狐尾藻用于实验。沉水植物均于实验前一周采集自西湖湖西区域湿地,采集时保证植物具有完整根系及叶片。采集回后用自来水仔细洗去植株上附着物,随后挑选形状均一的植株体按分组移植入试验系统中进行为期一周的驯化培养,每个系统中沉水植物总生物量为300 g,密度为3.0 g/L(参考Maarten Vanderstukken[16])。浮游植物也采集自西湖湖西区域: 用25号浮游生物网在该区域4个随机位点采集浮游植物,混合后投入藻类培养系统进行驯化培养。通过投加KNO3和KH2PO4保证藻类培养系统中有足够的氮磷含量,培养时间约一周,当藻类密度达到107—108个/L左右时用于实验。
1.3实验设计
实验设空白对照组和苦草组、金鱼藻组、穗花狐尾藻组3个处理组,每个组3个平行。3个处理组都在实验前一周按分组分别移栽入形状均一的植株体。实验第1天时,各试验系统中加入1L驯化培养过的混合藻液,使其初始藻类总细胞数在106—107个/L,并通过投加KNO3和KH2PO4使系统中的TN和TP含量稳定在3.0 mg/L(参考西湖总氮[17])和0.4 mg/L,氮磷比为7.5∶1[16]。
1.4取样和测试
实验始于2013年7月31日结束于8月19日,共20d,期间装置处每日气温为28—40℃。试验期间,每天用自来水补充蒸发及采样消耗的水,每隔2d取样测试水体总氮总磷并通过投加KNO3和KH2PO4使系统中的TN和TP含量保持稳定,每隔5d取样测定水体中叶绿素a浓度,每隔10d取样测定浮游植物群落结构。取样时将缸中水搅拌均匀后,用4 L柱状采水器采水,取得的水先过20目尼龙网过滤掉沉水植物叶片等杂质,再于其中取0.5 L用于测定叶绿素a浓度,取1 L水样用于测定总氮、总磷,取1 L水样立即加入15 mL鲁哥式液固定,作为浮游植物定量样品。
总氮的测定采用过硫酸钾氧化紫外分光光度法[18]、总磷的测定采用钼锑抗比色法[18]。叶绿素a浓度的测定采用丙酮分光光度法[18]。浮游植物细胞数的测定用显微镜视野计数法[19]。浮游植物的鉴定参考《中国淡水藻类——系统,分类及生态》中的方法[20]。
1.5浮游植物群落功能多样性指数计算
本研究中用到的生物多样性指数选择为:
式中,p=ni/N,ni为i种的个体数,N为所有种类总个体数,S为物种数[21]。
1.6数据分析
采用SPSS 13.0统计分析软件进行单因素方差分析,P<0.05表明显著差异。
2 结果
2.1各实验组中叶绿素a浓度变化
实验期间各实验组叶绿素a浓度变化见图1:空白组中,前15d叶绿素a浓度呈对数增长,从起始值470 mg/m3快速增加至24790 mg/m3;第15—20天叶绿素a浓度增长速度减慢,逐渐增加至26020 mg/m3。相对于空白组,3个水草组中叶绿素a浓度都长期保持非常低的水平,介于200—230 mg/m3之间。苦草组中,实验前10d,叶绿素a浓度从560 mg/m3增加约两倍至1680 mg/m3后由回落至790 mg/m3,并在随后的10d中稳定在300—400 mg/m3之间;金鱼藻组中,整个实验期间,叶绿素a浓度从起始时的720 mg/m3逐渐降低至280 mg/m3。狐尾藻组中,叶绿素a浓度在实验前5d基本不变,保持在1050 mg/m3左右,在第5—10天时增加1倍至2290 mg/m3,随后迅速降低,并在最后10d一直都保持在270 mg/m3左右。实验的前10d,各组水体叶绿素a浓度之间差异均不显著(P>0.05);从第15天开始,到第20天,空白组水体叶绿素a浓度显著高于3个水草组(P<0.01)。实验期间,各水草组间水体叶绿素a浓度始终无显著差异(P>0.05)。
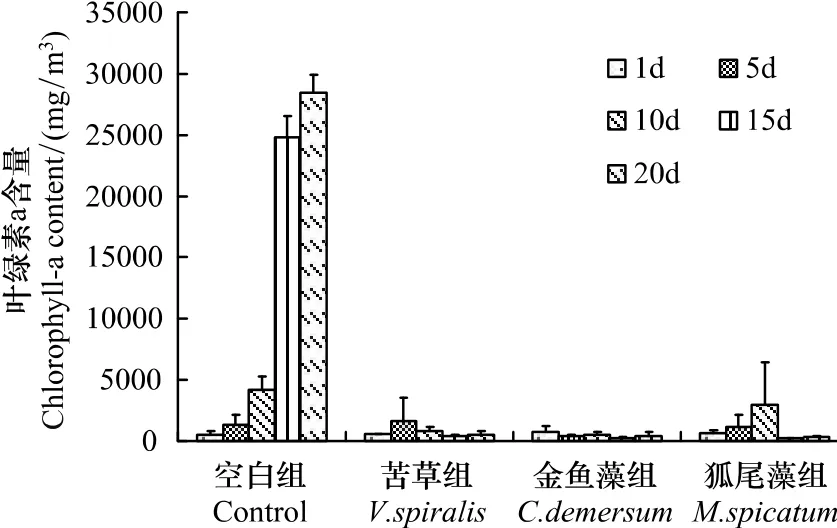
图1 各实验组叶绿素a浓度变化Fig.1Dynamics of chlorophyll-a content in different treatments
2.2各实验组中浮游植物的密度变化
实验期间各实验组中藻类总细胞密度(图2)与叶绿素a(图1)变化趋势接近。空白组中藻类总细胞密度基本上都保持每10d增加一个数量级的趋势,经过20d时间,从2.51×106个/L增加到2.14×108个/L;第10天时,在苦草组中藻类总细胞密度较实验开始时下降了接近一半,为4.32×105个/L,随后藻细胞密度有所提高,但是最后藻类总细胞密度还是较起始值降低了37.06%;金鱼藻组中,从实验开始藻类总细胞密度一直保持下降趋势,第20天实验结束时为5.11×105个/L,比初始值降低了78.37%,;而狐尾藻组中,藻类总细胞密度表现出另一种趋势,在实验第10天增加到9.75×106个/L,随后迅速下降,到第20天藻类总细胞密度为5× 105个/L,较初始值降低了83.40%。实验起始时,各处理组间藻类总细胞密度无显著性差异(P>0.05);实验进行至第10天时,空白组与3个水草组间藻类总细胞密度均差异显著(P<0.05),第20天时,差异更加显著(P<0.01)。实验过程中3个水草组中藻类总细胞密度变化趋势不同,但均处于较低水平,3组间无显著差异(P>0.05)。
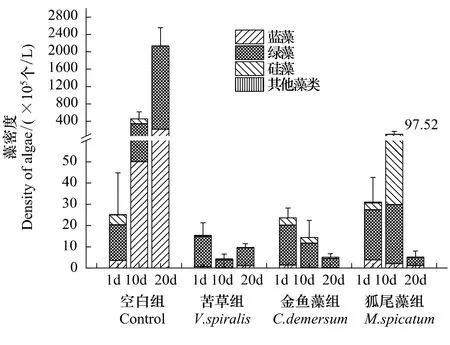
图2 各实验组藻类密度变化Fig.2Dynamics of phytoplankton density in different treatments
对系统中藻类分类发现,实验起始时空白组中蓝藻占藻类总细胞数比例为14.22%,在第10天和第20天均保持在10.05%左右;3个水草组中蓝藻比例均先下降后上升,其中苦草组中由4.12%降至0.81%又增加至11.24%,金鱼藻组中由6.12%降至1.61%又增加至3.65%,狐尾藻组中由12.59%降至2.15%又增加至22.17%。实验第20天时空白组蓝藻密度达到2.18×107个/L,而水草组的蓝藻细胞密度均介于104—105个/L之间。
对于实验系统中的绿藻,空白组中绿藻比例在第1天和第10天都保持在65%左右,第20天时增至89.68%;苦草组中绿藻比例一直维持在88%左右,变动不大;金鱼藻组中绿藻比例在第1天和第10天均保持在79%左右,第20天时增至86.35%;穗花狐尾藻组中第1天时绿藻比例为76.22%,第10天时降至28.54%,但不同平行间误差较大,第20天时又恢复至74.01%。实验第20天时空白组绿藻密度达到1.92×108个/L,而水草组的绿藻细胞密度均在5×105个/L左右。
就硅藻而言,实验过程中所有组中硅藻比例都出现先增加后下降趋势,第20天时,空白组、苦草组和穗花狐尾藻组中的硅藻基本消失,金鱼藻组中硅藻比例为10%。甲藻裸藻等其他藻类在实验过程中偶见。
2.3浮游植物群落属类组成变化
从浮游植物总属数方面来看(图3),空白组、苦草组以及金鱼藻组中属类总数均在实验过程中降低:空白组中总属数从16.00逐渐降低至8.00;苦草组中总属数在前10d保持在22.00,随后降至11.00;金鱼藻组中总属数从17.33逐步降低至9.00,;狐尾藻组中总属数变化不大,介于14.00—15.00之间。各组中总属数变化不显著(P>0.05)。
在属类组成方面(图3),各门藻类对属类组成贡献的趋势与其密度比例的趋势比较接近。观察到各实验组中存在两个趋势:3个水草组中蓝藻对于属类组成的贡献都是在实验前10d降低后10d升高;所有实验组中硅藻对属类组成的贡献都是在实验前10d升高后10d降低,正好与蓝藻变化情况相反。实验前10d,狐尾藻组中这两种趋势变化幅度最大,其中蓝藻从12.59%降低到2.15%,硅藻从10.02%增加到69.24%;空白组、苦草组和金鱼藻组中变化幅度较小。从第10天至第20天,狐尾藻组中硅藻对属类组成的降幅最明显,从69.24%降低至2.92%,空白组和苦草组中硅藻门基本消失,分别从第10天时的24.64%和19.76%降至0.1%和0.26%,金鱼藻组中硅藻门比例降至10%。

图3 各实验组浮游植物群落属类组成变化Fig.3Dynamics of genus composition in different treatments
2.4优势属变化
各实验组中浮游植物的优势种类随着时间而变化(表1)。实验起始时,虽然投加的藻种是一样的,空白组与3个水草组之间优势属不完全相同,推测这是由于适应培养期间系统中本土浮游植物的自然生长导致的,但由于每个处理组中藻类种类、细胞数以及多样性系数相差不大,可以认为该差异对于实验结果不会产生太大影响。试验期间,空白组中的优势属由蓝藻门的平裂藻转变为绿藻门的盘星藻和十字藻,各平行间虽然优势属不完全相同,但其中浮游植物各门所占比例以及多样性指数差异不显著(P>0.05)。苦草组中的优势属从绿藻门的栅藻转变为绿球藻和团藻,其中团藻虽然出现几率不大,但群体中包含丰富的微小的藻细胞,故其成为优势属;金鱼藻组中优势属从绿藻门的栅藻属转变为小球藻属和盘星藻属;狐尾藻属中优势属从绿藻门的栅藻属和月牙藻属转变为绿球藻属。在整个实验过程中,只有空白组在实验起始阶段和第10天时优势属为蓝藻门的平裂藻,3个水草组在整个实验阶段优势属都只限于绿藻门并且都包含栅藻属,说明本实验中3种沉水植物的化感作用可能对于绿藻门中栅藻属藻类抑制效果较弱。

表1 试验期间各处理组浮游植物优势属变化Table1 Dominant genus in water of four treatments during experiment time
2.5多样性指数的变化
实验过程中,虽然空白组与苦草组在细胞密度方面差异显著,但两者的Shannon-Wiener多样性指数(H)变化趋势非常接近(图4),都由实验初始时的3.22左右逐步降低至0.80左右;金鱼藻组中H下降趋势较缓,从起始时的2.94降至2.06;狐尾藻组中H从实验起始时的2.90降至1.86,并在接下来的10d中又恢复到2.76。实验初始与第10天时,各处理组间H均无显著差异(P>0.05),实验进行至第20天时,空白组和苦草组之间H无显著差异(P>0.05),但两者均与穗花狐尾藻组中H存在显著性差异(P<0.05),金鱼藻组与其他处理组间的H均无显著差异(P>0.05)。本实验中Pieou指数和Simpson指数变化趋势与Shannon-Wiener指数相同(图4)。
3 讨论
很多野外实验表明,水体中的沉水植物能够有效抑制浮游植物生物量[10-11],沉水植物对藻类的化感作用被认为是可能的策略之一。利用可控的微宇宙实验,可以在模拟野外环境的同时减少很多水生生态系统中环境因子和生物因子的干扰,更准确的探索沉水植物抑藻机理。在本实验中,3个水草组中浮游植物的生物量都受到了显著的抑制,在第20天时,3个水草组中浮游植物生物量大约只有空白组中浮游植物生物量的1%(图1,图2)。实验过程中通过控制光照和连续补充氮磷元素,使系统中TN、TP始终保持稳定,消除了光和营养竞争对藻类细胞密度的影响。结合Vanderstukken等的实验显示微宇宙系统中光竞争对藻类细胞密度影响不显著[16]以及Švanys等证明了微宇宙试验系统中,浮游动物的牧食作用不能够解释观察到的不同处理组间浮游植物生物量与群落组成的差异等结果[22],可以推断本实验结果是因为沉水植物对藻类化感作用所致。
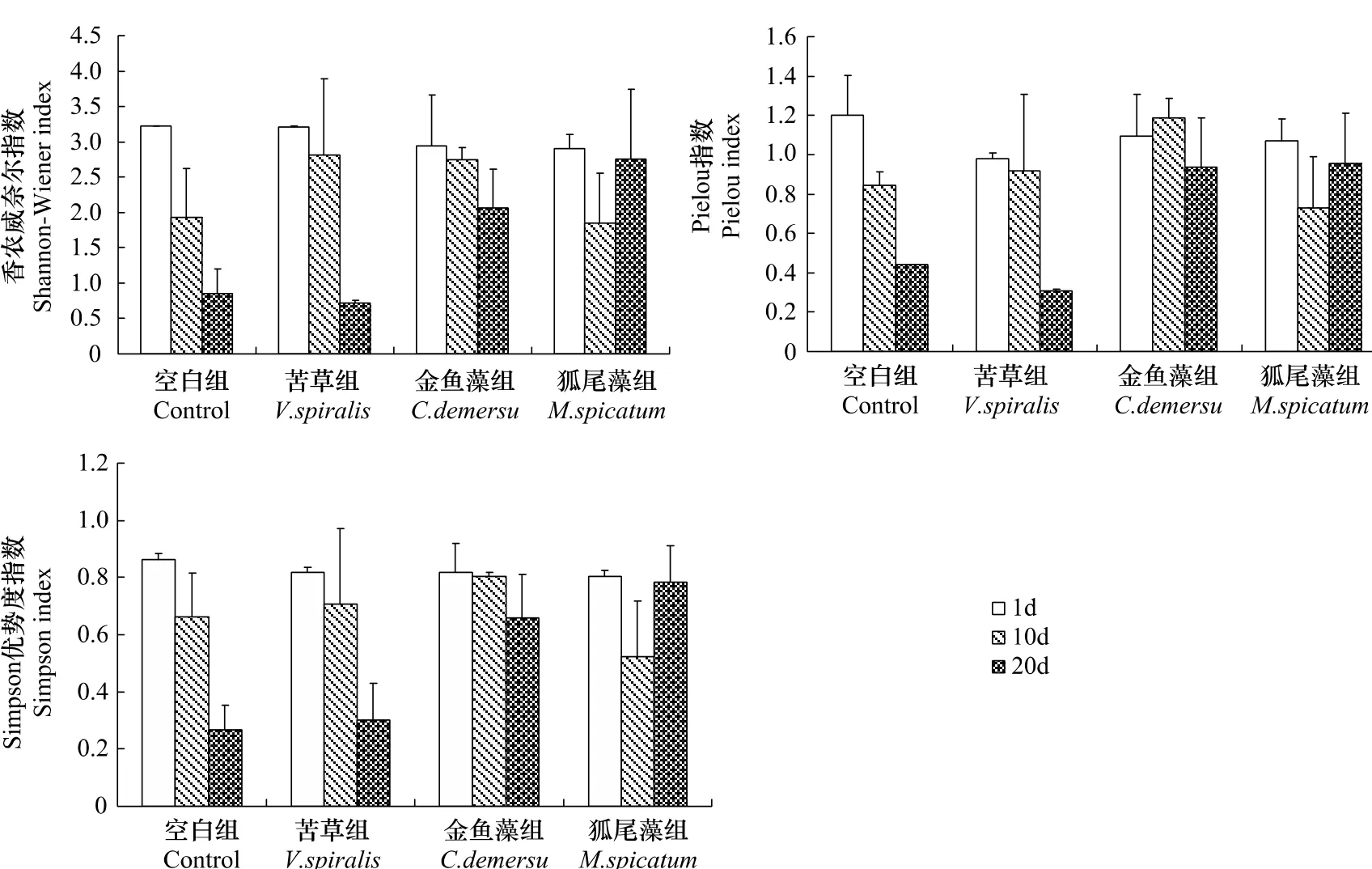
图4 各实验组浮游植物种类多样性变化Fig.4Dynamics of Bio-diversity of the phytoplankton community in different treatments
在本实验的4个体系中绿藻门藻类在生物量方面均占优势,可能是由于以下原因:首先,已有的研究表明在淡水体系中绿藻相对于蓝藻对化感作用更加不敏感[15,23]。Jasser在野外试验与投加沉水植物提取物的室内实验中发现,金鱼藻和穗花狐尾藻都能够显著抑制沼泽颤藻(Oscillatoria limnetica),鞘丝藻(Lyngbya vacuolifera Skuja)和水化束丝藻(Aphanizomenon flos-aquae L)等蓝藻门藻类的生长,并且促使绿藻群落中的衣藻Chlamydomonas)、小球藻(Chlorella)和栅藻(Scenedesmus)等小型藻(小于50um)成为优势种[10],试验期间各实验组浮游植物优势属变化(表1)也与这一结果相符。其次绿藻占优势可能还与绿藻门藻类的生物学特性和培养环境相关,因为本实验在夏季进行,此时温度较高(室外温度可达40℃),较适合蓝绿藻生长[24]。虽然3个水草组中蓝藻和硅藻细胞数与种类数比例分别有相似的变化趋势,但是其细胞数水平低于1×105个/ L,种类数比例也不高,并且这两种趋势不显著。各实验组中硅藻和其他藻类比例变化趋势相近(图2)这一结果与Jasser的实验结果[10]相同,说明沉水植物的化感作用可能对于硅藻抑制效果不大。
实验期间,不同沉水植物组在不同时间藻类生物量变化趋势不同(图2),苦草组中,藻类总细胞数先下降后增加,金鱼藻组中,藻类总细胞数持续下降,狐尾藻组中藻类总细胞数先增加后下降。苦草组中,从第10天开始,团藻(Volvox)成为系统中的优势种,可能是因为苦草所分泌的化感物质对团藻抑制效果较差。虽然团藻在系统中出现频率较低,但每一个团藻群体中包含数千个微小的藻细胞,所以从藻类总细胞数方面看,虽然从第10天至第20天苦草组中藻类总细胞数上升了近1倍(图1),但从叶绿素方面看该增加趋势不显著(图1)。金鱼藻组中,藻类总细胞数变化趋势与袁峻峰[25],李小路[8]等所做的共培养实验中藻类细胞数变化趋势相近。狐尾藻组中,在第8天时,有一口缸中发生了短期的小环藻(Chlorella)水华,水华于数天后消失,所以图2中可以看到狐尾藻组中第10天时较第1天时硅藻大量增加,并且平行间标准差也较大,达到7.16×106个/L。该次水华发生的原因可能与该套系统中实验前期穗花狐尾藻长势不好分泌化感物质较少有关。
在实验末期,3个水生植物体系中藻类细胞密度和叶绿素含量均显著低于空白组(P<0.05)。尽管各水生植物组间生物量方面差异不显著,但利用Shannon-Weiner多样性(H)等3种多样性指数表示的其藻类群落结构存在差异(图4)。穗花狐尾藻组中H显著高于苦草组和空白组(P<0.05),金鱼藻组中H与其他组相比无显著差异,可见其Shannon-Weiner指数可能位于狐尾藻组与金鱼藻组之间,按Shannon-Weiner指数排序为空白组<苦草组<金鱼藻组<狐尾藻组,对于这些差异,原因可能有以下几点:首先,3种植物所分泌的化感物质不尽相同:Xian等从苦草中分离出了4-氧代-β-紫罗兰酮,二氢猕猴桃内酯,2-乙基-3-甲基顺丁烯二酰亚胺等6种对铜绿微囊藻有抑制作用的化合物,其中主要化感物质2-乙基-3-甲基顺丁烯二酰亚胺是叶绿素光氧化的副产物,另5种都是β-胡萝卜素的派生物[26]。Wium-Andersen等从金鱼藻中分离鉴定出了具有抑藻效果的元素硫和一些不稳定的含硫化合物[27]。徐洁等从金鱼藻种植水的二氯甲烷洗脱物中检测出了已有文献报道对藻类具有化感作用的N-苯基-2-萘胺、脱氢枞酸甲酯和脱氢枞酸乙酯[28]。穗花狐尾藻中分离鉴定出的化感物质主要是多酚类物质,Gross等从狐尾藻中分离鉴定出了一种具有抑藻活性的水解多酚-特里马素II (Tellimagrandin II),其占植物干重的1.5%并对多种球状和丝状蓝藻有抑制效果[29]。Nakai等从穗花狐尾藻中分离出了鞣花酸、五倍子酸、焦酸和原儿茶酸4种多酚类物质,并证明其对于铜绿微囊藻(Microcystis aeruginos)有抑制效果[30]。其次,很多相关实验证明相同条件下同一植物的化感作用对于不同藻类效果不同[31],并且蓝藻相对于绿藻等其他藻类对植物化感作用更敏感[15,24]。这可能与不同门类不同属藻类的细胞结构不同有关。因为蓝藻是淡水藻类中唯一的原核生物,而其他藻类皆为真核生物,在进化上处于较高等级,两者细胞结构差异巨大[20]。再次,微宇宙实验中,不能完全避免潜在的能够对浮游植物群落结构产生影响的其他生态因子,实验结果很难完全与野外实验或者室内沉水植物对单一藻类共培养实验的结果一致。本实验中,因为所用的不是单一藻种,故共培养时,各藻种之间也会产生激烈的种间竞争,该竞争在没有水草的空白组中最为激烈。实验末期,空白组藻类总细胞密度高达2.14×108个/L,Simpson优势度指数达到0.27,盘星藻和十字藻共占藻类总细胞数近90%。沉水植物与藻类,以及藻类间的各种相互关系可能共同影响藻类的组成变化。此外,虽然水体中的很多微生物也能通过各种直接或间接作用影响藻类群落结构,例如水体中的一些溶藻细菌可以通过直接或间接方式抑制藻类生长,但这些溶藻细菌一般需要经过筛选和富集培养,才能够较好的发挥抑藻作用[32]。下一步有关水生植物化感作用影响浮游植物群落结构的研究应该从扩展实验周期、排除更多其他生态因子的干扰、对浮游植物群落做更细致的分析等方面,为更深入的研究化感作用机理并将之用于实践提供理论依据。
4 结论
本实验证明,微宇宙实验条件下,苦草、金鱼藻和穗花狐尾藻3种沉水植物都能够通过化感作用特异性抑制藻类生长从而调控藻类群落结构。3种沉水植物在对藻细胞数和叶绿素抑制效果方面无显著差异,但在浮游植物群落结构和多样性方面存在差异,对浮游植物Shannon-Weiner多样性指数而言苦草组<金鱼藻组<狐尾藻组。3种沉水植物的化感作用对绿藻门栅藻属藻类的抑制效果较差。
致谢:中国科学院水生物研究所张甬元研究员对本实验方案给予建议,魏印心研究员和叶艳婷对浮游植物鉴定给予帮助,特此致谢。
参考文献(References):
[1]Van Donk E,Gulati R D,Iedema A,Meulemans J T.Macrophyte-related shifts in the nitrogen and phosphorus contents of the different trophic levels in a biomanipulated shallow lake.Hydrobiologia,1993,251(1/3):19-26.
[2]Howard-Williams C,Allanson B R.Phosphorus cycling in a dense Potamogeton pectinatus L.Bed.Oecologia,1981,49(1):56-66.
[3]Timms R M,Moss B.Prevention of growth of potentially dense phytoplankton populations by zooplankton grazing,in the presence of zooplanktivorous fish,in a shallow wetland ecosystem.Limnology and Oceanography,1984,29(3):472-486.
[4]Schriver P E R,BØgestrand J,Jeppesen E,SØndergaard M.Impact of submerged macrophytes on fish-zooplanl phytoplankton interactions:largescale enclosure experiments in a shallow eutrophic lake.Freshwater Biology,1995,33(2):255-270.
[5]Rice E L.Allelopathy.New York:Academic Press,1974.
[6]陈卫民,张清敏,戴树桂.苦草与铜绿微囊藻的相互化感作用.中国环境科学,2009,29(2):147-151.
[7]高云霓,刘碧云,王静,贺锋,梁威,徐栋,张丽萍,吴振斌.苦草(Vallisneria spiralis)释放的酚酸类物质对铜绿微囊藻(Microcystis aeruginosa)的化感作用.湖泊科学,2011,23(5):761-766.
[8]李小路,潘慧云,徐洁,鲜啟鸣,高士祥,尹大强,邹惠仙.金鱼藻与铜绿微囊藻共生情况下的化感作用.环境科学学报,2008,28(11): 2243-2249.
[9]朱俊英,刘碧云,王静,高云霓,葛芳杰,梁威,张丽萍,吴振斌.穗花狐尾藻化感作用对铜绿微囊藻光合效率的影响.环境科学,2011,32(10):2904-2908.
[10]Jasser I.The influence of macrophytes on a phytoplankton community in experimental conditions.Hydrobiologia,1995,306(1):21-32.
[11]Mjelde M,Faafeng B.Ceratophyllum demersum hampers phytoplankton development in some small Norwegian lakes over a wide range of phosphorus concentrations and geographical latitude.Freshwater Biology,1997,37(2):355-365.
[12]Norlin J I,Bayley S E,Ross L C M.Submerged macrophytes,zooplankton and the predominance of low-over high-chlorophyll states in western boreal,shallow-water wetlands.Freshwater Biology,2005,50(5):868-881.
[13]马剑敏,贺锋,成水平,左进城,李今,吴振斌.武汉莲花湖水生植被重建的实践与启示.武汉植物学研究,2007,25(5):473-478.
[14]马剑敏,成水平,贺锋,左进城,赵强,张征,吴娟,吴振斌.武汉月湖水生植被重建的实践与启示.水生生物学报,2009,33(2): 222-229.
[15]Hilt S,Gross E M.Can allelopathically active submerged macrophytes stabilise clear-water states in shallow lakes?.Basic and Applied Ecology,2008,9(4):422-432.
[16]Vanderstukken M,Mazzeo N,Van Colen W,Declerck S A J,Muylaert K.Biological control of phytoplankton by the subtropical submerged macrophytes Egeria densa and Potamogeton illinoensis:a mesocosm study.Freshwater Biology,2011,56(9):1837-1849.
[17]张志兵,施心路,杨仙玉,刘桂杰,赵元莙,刘晓江.杭州西湖与京杭大运河杭州城区段水质对比研究.杭州师范大学学报:自然科学版,2011,10(1):59-63.
[18]魏复盛.水和废水监测分析方法(第四版).北京:中国环境科学出版社,2002.
[19]章宗涉,黄祥飞.淡水浮游生物研究方法.北京:科学出版社,1991:333-335.
[20]胡鸿钧,魏印心.中国淡水藻类——系统、分类及生态.北京:科学出版社,2006:23-948.
[21]Ma K P.The measurement of community diversity//Qian Y Q,ed.Principles and Methodologies of Biodiversity Studies.Beijing:Chinese Science and Technology Press,1994:141-165.
[22]Švanys A,Paškauskas R,Hilt S.Effects of the allelopathically active macrophyte Myriophyllum spicatum on a natural phytoplankton community:a mesocosm study.Hydrobiologia,2014,737(1):57-66.
[23]Hilt S.Allelopathic inhibition of epiphytes by submerged macrophytes.Aquatic Botany,2006,85(3):252-256.
[24]Sommer U.Plankton Ecology.Succession in Plankton Communities.Berlin,New York:Springer Verlag,1989.
[25]袁峻峰,章宗涉.金鱼藻(Ceratophyllum demersum Kom.)对藻类的生化干预作用.生态学报,1992,13(1):45-50.
[26]Xian Q M,Chen H D,Liu H L,Zou H X,Yin D Q.Isolation and Identification of Antialgal Compounds from the Leaves of Vallisneria spiralis L.by Activity-Guided Fractionation(5 pp).Environmental Science and Pollution Research,2006,13(4):233-237.
[27]Wium-Andersen S,Anthoni U,Houen G.Elemental sulphur,a possible allelopathic compound from Ceratophyllum demersum.Phytochemistry,1983,22(11):2613.
[28]徐洁,李小路,陈海东,鲜啟鸣,尹大强,邹惠仙.金鱼藻中抑藻化感物质的研究.环境污染与防治,2008,30(1):28-32.
[29]Gross E M,Meyer H,Schilling G.Release and ecological impact of algicidal hydrolysable polyphenols in Myriophyllum spicatum.Phytochemistry,1996,41(1):133-138.
[30]Nakai S,Hosomi M,Okada M,Murakami A.Control of algal growth by macrophytes and macrophyte-extracted bioactive compounds.Water Science and Technology,1996,34(7-8):227-235.
[31]吴晓辉.常见眼子菜科沉水植物对浮游藻类的化感作用研究[D].武汉:中国科学院水生生物研究所,2005.
[32]史顺玉.溶藻细菌对藻类的生理生态效应及作用机理研究[D].武汉:中国科学院水生生物研究所,2006.
Effects of allelopathy of submerged macrophytes on the phytoplankton community collected from the west part of the West Lake wetland in Hangzhou,China
YAO Yuan1,2,HE Feng1,HU Shenghua1,KONG Lingwei1,LIU Biyun1,ZENG Lei1,2,ZHANG Liping1,*,WU Zhenbin1
1 State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China
2 University of Chinese Academy of Sciences,Beijing 100049,China
Abstract:Submerged macrophytes play an important role in maintaining clear water in shallow eutrophic lakes.The submerged macrophytes exert strong influence on the phytoplankton by several mechanisms,including the excretion of allelopathic substances.However,the allelopathic substances from various submerged macrophytes are not completely the same.Allelopathy of different submerged macrophytes may have various effects on the biomass and community structure of natural plankton.This paper investigated the allelopathic effects of three species of submerged macrophytes,Vallisneria spiralis,Ceratophyllum demersum,and Myriophyllum spicatum,on the biomass and community structure of the phytoplankton collected from the west part of Hangzhou West Lake wetland,using mesocosms under controlled environmental factors,such as light and nutrients.The changes in the phytoplankton density,chlorophyll-a content,phytoplankton community composition,and Shannon-Weiner Index(H)were monitored.The results showed that the total phytoplankton density and chlorophyll-a content were significantly reduced,and that the phytoplankton community structure also changed in all three co-culture systems.At the end of the experiment,the total biomass of algae(cell density)was 37.06%,78.37%,and 83.40%lower than the initial values of each system.However,the phytoplantkton-inhibitory ratiosbook=972,ebook=84were not significantly different among the three species of submerged marcophytes(P>0.05).The dominant algal genera in the control group were Pediastrum and Crucigenia;in the V.Spiralis group were Chlorococcum and Volvox;in the C.demersum group were Chlorella and Pediastrum;in the M.spicatum groups was Chlorococcum.Scenedesmus exhibited less sensitivity to the allelopathic substances from the three submerged macrophytes.The highest phytoplankton species richness was observed in the M.spicatum group.The Shannon-Weiner Index(H)was 2.76,2.06,and 0.72 for the V.spiralis,C.demersum,and M.spicatum groups,respectively.Furthermore,the phytoplankton biodiversity index(H)of the M.spicatum group is significantly higher than that of the V.spiralis group(P<0.05).
Key Words:submerged macrophyte;allelopathy;phytoplankton community structure;mesocosm;the west part of the West Lake wetland in Hangzhou
*通讯作者
Corresponding author.E-mail:liping_zhang@ihb.ac.cn
收稿日期:2014-07-03;网络出版日期:2015-07-09
基金项目:国家“十二五”水专项(2012ZX07101007-005);淡水生态与生物技术国家重点实验室开放课题(2013FB20);国家“十二五”科技支撑项目(2012BAJ21B03)
DOI:10.5846/stxb201407031369
