不同生境种源盐地碱蓬幼苗生长发育对盐分胁迫的响应和适应
2016-05-10彭斌,许伟,邵荣等
不同生境种源盐地碱蓬幼苗生长发育对盐分胁迫的响应和适应
彭斌,许伟,邵荣,封功能,石文艳
(盐城工学院,江苏省海洋滩涂生物化学与生物技术重点建设实验室,江苏 盐城 224041)
摘要:为探讨盐地碱蓬适应不同生境的生理机制,研究了不同盐分处理(0,200和400 mmol/L的NaCl;0,200和400 mmol/L的KCl)对盐碱地和潮间带两种种源盐地碱蓬的生长发育、植株离子积累、叶片光合荧光指标和植株抗氧化系统的影响。结果表明,与对照相比,200 mmol/L的NaCl处理使盐地碱蓬的地上部鲜重、干重、肉质化程度显著增加,400 mmol/L的NaCl处理和两种浓度的KCl处理使盐地碱蓬的鲜重、干重、肉质化程度显著降低。不同浓度的NaCl处理使盐地碱蓬地上部Na+和Cl-含量显著增加,K+含量显著降低;不同浓度的KCl处理使盐地碱蓬地上部K+和Cl-含量显著增加,Na+含量显著降低。200 mmol/L的NaCl处理对碱蓬叶片的净光合速率、光合放氧速率、Fv/Fm值和φPSⅡ值无明显影响,而KCl处理则使碱蓬叶片各光合荧光参数显著降低。低浓度(200 mmol/L)NaCl处理使碱蓬SOD活性显著增加,但高浓度(400 mmol/L)NaCl处理和两种浓度的KCl处理均使碱蓬SOD活性显著降低。两种离子的不同浓度处理均使碱蓬POD活性显著增加。潮间带种源盐地碱蓬的地上部鲜重、干重、肉质化程度、光合荧光参数、地上部离子含量(Na+和Cl-)均显著低于盐碱地生境。钾盐对盐地碱蓬的胁迫效应显著大于钠盐。盐碱地生境种源盐地碱蓬对盐分胁迫的响应显著高于潮间带。
据报道,目前全世界有盐碱地1.0×109hm2,其中盐渍耕地6.6×106hm2,盐渍荒地2.0×107hm2,日益严重的土壤盐渍化已成为制约农业生产的一大难题[1]。我国是世界盐碱地大国之一,各种类型盐渍土的总量为9913.3万hm2,其中现代盐渍化土壤约3693.3万hm2,残余盐渍化土壤约4486.7万hm2,潜在盐渍化土壤为1733.3万hm2,据统计海涂土壤占海岸带土壤总面积的17%,主要分布在东北、华北、西北内陆地区及长江以北沿海地带,迄今为止,我国还有80%左右盐渍土尚未得到开发利用。土壤盐渍化已成为限制我国农业生产的最大障碍。国内外沿海滩涂土地资源的开发利用,一方面采用盐渍土改良,降低土壤盐分,以适应一般作物生长;另一方面,选育耐盐植物品种直接在滨海盐土上种植,而后者越来越成为世界范围内滨海盐土农业的研究热点。大力引种具有一定经济价值的盐生植物,增加地面覆盖以减少地表蒸发,既可改良土壤,扼制土地的盐渍化,又可实现盐荒地的利用。
盐生植物作为在盐土上完成整个生活世代的天然植物,在其与环境协同演化过程中形成了一系列的适应性策略,在盐碱地改良和作物耐盐方面起到了重要作用[2]。盐地碱蓬(Suaedasalsa)是一种典型的真盐生植物,具有耐盐碱[3]、耐旱[4]、耐涝[5]等特性,其嫩茎叶营养丰富,可做蔬菜,种子可榨油,保健价值极高[6],盐碱地种植可显著降低土壤含盐量,增加土壤有机质含量[7],具有重要的经济价值和生态价值。盐地碱蓬有两种生长环境,一是在潮水经常浸没的潮间带生境,二是距离海边较远的内陆盐碱地生境,前者主要受高盐、低温和涝渍的影响,其植株在整个生长期间地上部分呈紫红色,后者主要受盐分和干旱的影响,其植株呈绿色。
前人对盐分胁迫下盐地碱蓬的生长发育及耐盐生理特征等方面进行了广泛的研究[8-10],但不同离子的盐分胁迫对碱蓬的影响有何区别,不同生境条件的碱蓬对盐分胁迫的响应是否存在差异?前人对此鲜有报道。据此,本研究以盐碱地生境和潮间带生境碱蓬种子培育幼苗为材料,设置Na+和K+不同浓度处理,研究不同生境盐地碱蓬对盐分胁迫的响应和适应,试图为探讨盐地碱蓬适应不同生境的生理生态机制及其开发利用提供一定参考。
1材料与方法
1.1试验材料
试验所用盐碱地及潮间带盐地碱蓬棕色大种子,于2014年11月采集自江苏如东境内的内陆盐碱地(土壤Na+和K+含量分别为1.9和2.3 g/kg干土)及潮间带(土壤Na+和K+含量分别为4.5和5.8 g/kg干土)。自然晒干的种子于冰箱中冷藏保存。
1.2材料的培育及试验处理
挑选籽粒饱满的盐碱地及潮间带生境盐地碱蓬棕色大种子,播前用500 mg/L的KMnO4溶液浸种20 min,换清水浸种4 h,播种于干净河沙(用去离子水冲洗掉沙中离子)的塑料花盆(底部直径15 cm,高32 cm)中,每天用Hoagland营养液浇灌。长至2~3片真叶时间苗。待植株长至10~12 cm时,每盆留8株,开始盐分处理。NaCl设3个浓度:0,200,400 mmol/L,KCl设3个浓度:0,200,400 mmol/L,以KOH和H2SO4调节pH值在6.2左右,每个处理4盆(两种生境各4盆),每天定时浇灌,浇灌量约为细沙持水量2倍,约2/3溶液流出,以确保盐分不在沙中积累。为避免盐分冲击,盐分溶液开始处理时每天以50 mmol/L递增,在400 mmol/L的处理达到其终浓度后再处理10 d,测定相关试验指标。
1.3项目测定
1.3.1生长指标在每盆碱蓬幼苗中选取其平均长度左右的4株,取出冲选干净后,将根部与地上部分开,吸干水分后测定地上部每株鲜重;然后放至烘箱中105℃杀青15 min,75℃烘干至恒重,测定其干重;肉质化程度按鲜重/干重计算。
1.3.2离子含量测定将植物材料用去离子水快速冲洗干净,吸干水分,称取0.5 g 相同叶位(从主茎顶端第3片到第8片完全伸展叶)叶片并剪碎,放入试管,加入10 mL去离子水,封口后于沸水浴中50 min后取出,过滤并定容至25 mL。Na+和K+用火焰光度计测定,Cl-用PXSJ-216型离子分析仪氯离子选择性电极测定。
1.3.3光合荧光参数测定净光合速率采用GFS-3000便携式光合作用测定系统,通过功能键控制好测定光强为(1200±20) μmol/(m2·s),温度为25℃左右,设置CO2浓度为0.37‰左右,重复10次,取其平均值。
叶片光合放氧速率采用英国Oxy-lab系统(Chlorolab 2 型液相氧电极)测定。冷光源提供光照条件,反应杯内光强为1000 μmol/(m2·s),反应杯内温度由恒温水浴控制在(22±0.2)℃[11]。
叶绿素荧光参数采用GFS-3000便携式光合作用测定系统,结合荧光附件3050-F测定,暗适应30 min后测定叶片Fv/Fm值,计算φPSⅡ值。
1.3.4抗氧化系统指标采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性[12],采用愈创木酚法测定过氧化物酶(POD)活性[12]。
1.4数据处理
采用Excel软件进行统计作图,用SPSS 统计软件进行方差分析(ANOVA),结果以平均值±标准误(mean±SD)表示,以P<0.05表示差异显著,采用字母标注法。
2结果与分析
2.1不同生境种源盐地碱蓬幼苗生长对盐分胁迫的响应
盐分处理对不同生境种源盐地碱蓬植株生长的影响见表1。与对照(0 mmol/L盐分处理,下同)相比,200 mmol/L的NaCl处理使潮间带种源盐地碱蓬地上部鲜重略有增加,使盐碱地种源碱蓬地上部鲜重显著增加(50.7%);400 mmol/L的NaCl处理使盐碱地和潮间带种源碱蓬地上部鲜重比对照分别降低11.3%和10.0%,差异均未达显著。KCl处理使两种种源碱蓬地上部鲜重均不同程度降低,其中200 mmol/L的处理使盐碱地和潮间带种源地上部鲜重分别比对照降低29.0%(P<0.01)和10.3% (P>0.05),400 mmol/L的处理分别降低55.1%(P<0.01)和23.1%(P<0.05)。从不同种源来看,所有处理条件下潮间带种源碱蓬地上部鲜重均低于盐碱地,总体平均降低41.5%,达极显著水平。
200 mmol/L的NaCl处理使盐碱地和潮间带种源碱蓬地上部干重比对照分别增加14.3%(P<0.05)和4.4%(P>0.05);400 mmol/L的NaCl处理使对应种源分别降低10.7%和8.9%,均未达显著水平。KCl处理使两种种源的碱蓬地上部干重均不同程度降低,其中200 mmol/L的处理使盐碱地和潮间带种源地上部干重比对照分别降低9.6%和4.7%,均未达显著水平;400 mmol/L的处理则分别降低26.5%和14.0%,均达显著水平。从不同种源来看,所有处理条件下潮间带生境碱蓬地上部干重均低于盐碱地生境,总体平均降低46.4%,达极显著水平。
盐地碱蓬肉质化程度表明了植株含水量的高低。从表1可以看出,200 mmol/L的NaCl处理使盐碱地种源碱蓬肉质化程度比对照显著增加31.9%,但对潮间带生境碱蓬肉质化程度无显著影响,400 mmol/L的NaCl处理对两种种源的肉质化程度均无明显影响。200和400 mmol/L的KCl处理使盐碱地种源碱蓬肉质化程度比对照分别显著降低21.4%和38.9%;使潮间带种源碱蓬肉质化程度分别降低5.9%(P>0.05)和10.6%(P<0.05)。从不同种源来看,两种种源的盐地碱蓬植株肉质化程度对盐分处理的响应差异较大,盐碱地种源碱蓬肉质化程度受盐分处理影响较显著,而潮间带种源植株肉质化程度受盐分处理的影响则不显著。

表1 盐分处理对不同生境种源盐地碱蓬幼苗植株生长的影响(平均值±标准误)
注:同列不同小写字母表示不同浓度下在P<0.05水平上差异显著,下同。
Note:Different small letters within the same cloumn indicate significantly different atP<0.05 level under the different concentration, the same below.
2.2不同生境种源盐地碱蓬地上部离子含量对盐分胁迫的响应
2.2.1不同种源盐地碱蓬地上部Na+含量对盐分胁迫的响应不同盐分处理对不同生境盐地碱蓬地上部Na+含量的影响见图1。不同处理下潮间带生境碱蓬地上部Na+含量均低于盐碱地生境,所有处理平均低7.2%,差异不显著。从不同盐分处理的差异来看,不同浓度的NaCl处理使碱蓬Na+含量呈增加趋势,不同浓度的KCl处理使碱蓬Na+含量呈降低趋势。200 mmol/L的NaCl处理使盐碱地生境和潮间带生境的碱蓬地上部Na+含量分别比对照极显著增加85.7%和76.9%,400 mmol/L的NaCl处理使两种生境的Na+含量分别比对照极显著增加153.6%和134.6%。200 mmol/L的KCl处理使盐碱地生境和潮间带生境的碱蓬地上部Na+含量比对照分别降低11.1%和7.4%,均未达显著水平;400 mmol/L的KCl处理使两种生境的Na+含量比对照分别降低22.2%和18.5%,均达显著水平。
2.2.2不同种源盐地碱蓬地上部K+含量对盐分胁迫的响应由图2可知,与盐碱地种源相比,潮间带种源碱蓬地上部K+含量平均降低5.9%,未达显著水平。从盐分处理的差异来看,NaCl处理使碱蓬K+含量均呈降低趋势,KCl处理使碱蓬K+含量均呈增加趋势。200 mmol/L的NaCl处理使盐碱地和潮间带种源的碱蓬地上部K+含量比对照分别显著降低21.4%和17.9%;400 mmol/L的NaCl处理使两种种源的K+含量比对照分别显著降低50.0%和44.1%。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬地上部K+含量比对照分别极显著增加87.2%和65.5%;400 mmol/L的KCl处理使两种种源的K+含量比对照分别极显著增加174.5%和128.2%。
2.2.3不同种源盐地碱蓬地上部Cl-含量对盐分胁迫的响应图3表明,与盐碱地相比,潮间带生境碱蓬地上部Cl-含量呈降低趋势,总体平均降低11.7%,达显著水平。从盐分处理的差异来看,所有浓度的盐分处理均使碱蓬地上部Cl-含量呈增加趋势。200 mmol/L的NaCl处理使盐碱地和潮间带种源的碱蓬地上部Cl-含量比对照分别显著增加123.1%和104.5%;400 mmol/L的NaCl处理使两种种源的Cl-含量比对照分别极显著增加226.9%和184.7%。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬地上部Cl-含量比对照分别极显著增加132.9%和106.3%;400 mmol/L的KCl处理则分别显著增加244.9%和184.9%。
2.3不同种源盐地碱蓬光合荧光指标对盐分胁迫的响应
2.3.1不同种源盐地碱蓬叶片净光合速率对盐分胁迫的响应由图4可见,与盐碱地相比,潮间带种源碱蓬叶片净光合速率呈降低趋势,总体平均降低35.1%,达显著水平。从盐分处理的差异来看,200 mmol/L的NaCl处理对两种生境碱蓬叶片净光合速率无显著影响,但400 mmol/L的NaCl处理使盐碱地和潮间带种源碱蓬叶片净光合速率比对照分别显著降低12.3%和9.6%。KCl处理使盐地碱蓬叶片净光合速率均呈降低趋势,其中200 mmol/L的处理使盐碱地和潮间带种源的碱蓬叶片净光合速率比对照分别降低9.6%(P<0.05)和7.3%(P>0.05);400 mmol/L的处理则分别显著降低21.1%和16.8%。

图1 盐分处理对不同种源盐地碱蓬地上部Na+含量的影响Fig.1 Effect of NaCl and KCl treatments on Na+ content of S. salsa from saline inland or intertidal zone

图2 盐分处理对不同种源盐地碱蓬地上部K+含量的影响Fig.2 Effect of NaCl and KCl treatments on K+ content of S. salsa from saline inland or intertidal zone
不同小写字母表示不同浓度下在P<0.05水平上差异显著,下同。Different small letters indicate significantly different atP<0.05 level under the different concentration, the same below.
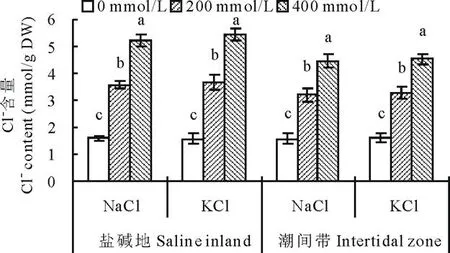
图3 盐分处理对不同种源盐地碱蓬地上部Cl-含量的影响Fig.3 Effect of NaCl and KCl treatments on Cl-content of S. salsa from saline inland or intertidal zone

图4 盐分处理对不同种源盐地碱蓬叶片净光合速率的影响Fig.4 Effect of NaCl and KCl treatments on net photosynthesis rate (Pn) in leaves of S. salsa from saline inland or intertidal zone
2.3.2不同种源盐地碱蓬叶片光合放氧速率对盐分胁迫的响应图5表明,与盐碱地相比,所有处理潮间带种源碱蓬叶片光合放氧速率呈降低趋势,总体平均降低12.3%,达显著水平。从盐分处理的差异来看,两种离子的盐分处理使碱蓬叶片光合放氧速率均呈降低趋势。200 mmol/L的NaCl处理使盐碱地和潮间带种源碱蓬叶片光合放氧速率比对照分别显著降低7.1%和7.2%,400 mmol/L的NaCl处理则比对照分别显著降低12.4%和11.4%。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬叶片光合放氧速率比对照分别显著降低14.1%和10.3%;400 mmol/L的KCl处理则比对照分别显著降低24.2%和15.9%。
2.3.3不同种源盐地碱蓬叶片Fv/Fm值对盐分胁迫的响应由图6可知,潮间带种源碱蓬叶片Fv/Fm值极显著低于盐碱地,所有处理平均低5.9%。从盐分处理来看,NaCl处理对两种生境碱蓬叶片Fv/Fm值均无显著影响,但KCl处理则使碱蓬叶片Fv/Fm值呈降低趋势,其中200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬叶片Fv/Fm值比对照分别显著降低1.2%和1.1%,400 mmol/L的KCl处理比对照分别显著降低2.5%和1.8%。

图5 盐分处理对不同种源盐地碱蓬叶片光合放氧速率的影响Fig.5 Effect of NaCl and KCl treatments on photosynthetic oxygen evolution rate in leaves of S. salsa from saline inland or intertidal zone

图6 盐分处理对不同种源盐地碱蓬叶片Fv/Fm值的影响Fig.6 Effect of NaCl and KCl treatments on Fv/Fm in leaves of S. salsa from saline inland or intertidal zone
2.3.4不同种源盐地碱蓬叶片φPSⅡ值对盐分胁迫的响应图7表明,与盐碱地相比,所有处理潮间带种源碱蓬叶片φPSⅡ值呈降低趋势,总体平均降低13.1%,达极显著水平。从盐分处理来看,200 mmol/L的NaCl处理对两种种源碱蓬叶片φPSⅡ值均无显著影响,400 mmol/L的NaCl处理使盐碱地碱蓬叶片φPSⅡ值比对照显著降低7.9%。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬叶片φPSⅡ值比对照分别显著降低7.2%和6.4%; 400 mmol/L的KCl处理则比对照分别显著降低14.1%和12.7%。
2.4不同生境种源盐地碱蓬抗氧化系统对盐分胁迫的响应
2.4.1不同种源盐地碱蓬SOD活性对盐分胁迫的响应由图8可见,所有处理潮间带种源碱蓬SOD活性均显著高于盐碱地,总体平均高14.4%。从盐分处理来看,200 mmol/L的NaCl处理使盐碱地和潮间带种源碱蓬SOD活性比对照分别显著增加28.8%和13.9%;400 mmol/L的NaCl处理则比对照分别降低13.5%(P<0.05)和7.7%(P>0.05)。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬SOD活性比对照分别显著降低13.7%和10.8%;400 mmol/L的KCl处理则比对照分别显著降低24.0%和20.6%。

图7 盐分处理对不同种源盐地碱蓬叶片φPSⅡ值的影响Fig.7 Effect of NaCl and KCl treatments on φPSⅡ in leaves of S. salsa from saline inland or intertidal zone

图8 盐分处理对不同种源盐地碱蓬SOD活性的影响Fig.8 Effect of NaCl and KCl treatments on activity of SOD of S. salsa from saline inland or intertidal zone
2.4.2不同种源盐地碱蓬POD活性对盐分胁迫的响应盐分处理对不同种源盐地碱蓬过氧化物酶(POD)活性的影响见图9。所有处理潮间带生境碱蓬POD活性均显著高于盐碱地,总体平均高9.2%。两种盐分不同浓度处理使盐地碱蓬POD活性均呈增加趋势。其中200 mmol/L的NaCl处理使盐碱地和潮间带种源的碱蓬POD活性比对照分别增加20.4%(P<0.01)和9.8%(P>0.05);400 mmol/L的NaCl处理则使以上两种种源的碱蓬叶片POD活性比对照分别显著增加34.7%和29.5%。200 mmol/L的KCl处理使盐碱地和潮间带种源的碱蓬叶片POD活性比对照分别显著增加22.2%和10.5%;400 mmol/L的KCl处理使以上两种种源比对照分别显著增加39.4%和32.5%。
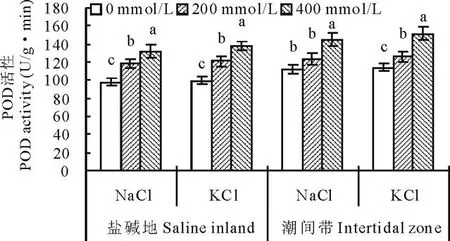
图9 盐分处理对不同种源盐地碱蓬POD活性的影响Fig.9 Effect of NaCl and KCl treatments on activity of POD of S. salsa from saline inland or intertidal zone
3结论与讨论
有研究指出,盐分影响盐生植物的生长发育有其直接因素和间接因素,直接因素是盐分造成的离子毒害,间接因素是由于高离子浓度带来的低水势[13]。高离子浓度直接抑制叶绿素的合成,降低光合作用,使蛋白质代谢异常,从而造成离子毒害[14],而离子浓度过高带来植物生长环境的低水势,造成植物体内产生生理干旱,进一步抑制了植物的生长[15]。但盐生植物的生长发育需要一个较为适宜的盐分环境,盐分过低也会造成生长不利[16-17]。从本研究结果来看,200 mmol/L的NaCl处理使盐碱地生境的碱蓬鲜重和干重均显著增加,使潮间带生境的略有增加。而400 mmol/L NaCl处理对两种生境碱蓬的生长造成不同程度的抑制(表1)。可见,对真盐生植物而言,同样也需要一个适宜的盐分环境。
盐生植物碱蓬适应盐旱环境和盐渍环境的一个重要方式就是叶片的肉质化,从而在逆境条件下储存水分,保证叶片进行光合作用,完成正常生理功能[18]。从本研究结果来看,200 mmol/L的NaCl处理使盐碱地碱蓬肉质化程度明显提高,与碱蓬鲜重和干重的响应一致,但对鲜重的促进作用更为显著,增加了叶片的含水量,有效地促进了生长。而高浓度的NaCl处理和两种浓度的KCl处理则明显降低了碱蓬的肉质化程度,对鲜重的影响程度大于干重,抑制了植株的生长(表1)。
盐生植物在其进化过程中形成了一系列的生理机制以适应盐碱或盐渍环境,其中一个重要的生理机制就是吸收和积累无机离子进行渗透调节,而Na+和Cl-就是其中很重要的无机渗透调节物质。前人研究表明,盐渍环境下,盐生植物通过吸收Na+和Cl-来降低渗透势,从而从土壤中吸收水分[6,19]。盐渍条件下外界大量盐离子进入碱蓬植株体内,通过区域化作用将Na+贮存在液泡中,从而达到渗透调节和降低离子毒害作用[20]。本研究表明,随着盐分离子处理浓度的增加,盐地碱蓬体内积累的对应离子浓度和Cl-亦相应增加,但由于Na+和K+交换通道的关系,碱蓬体内Na+和K+浓度变化呈相反趋势(图1和图2)。K+是植物必需元素,但当碱蓬生长在高浓度的KCl条件下,植株细胞吸收的大量K+很难进入液泡而滞留在细胞质中,造成离子毒害,抑制了植株的生长代谢[21]。本研究也可以看出,200和400 mmol/L的KCl处理不同程度地抑制了碱蓬的生长发育。从不同生境种源的差异来看,不同盐分浓度条件下,特别是高盐分处理条件下,盐碱地种源碱蓬幼苗地上部离子含量(主要是Na+和Cl-)高于潮间带,表明在盐碱地种源碱蓬更能积累较多无机离子,从而降低渗透势,提高植株吸收水分的能力,这可能也是盐碱地生境碱蓬更耐干旱的原因之一[10]。
光合作用是植物体内非常重要的合成代谢过程,其直接影响了植株的生长发育状况和最终物质积累量。而净光合速率是反映光合作用的关键指标。姚佳等[22]对耐盐植物扁蓿豆(Melissilusruthenicus)的研究表明,低盐处理使扁蓿豆净光合速率明显提高,但高浓度盐分处理则使其净光合速率显著降低。本研究表明,200 mmol/L的NaCl处理对盐地碱蓬叶片净光合速率无明显影响,但高浓度的离子浓度处理使碱蓬叶片净光合速率呈显著降低,与前人耐盐植物的研究结论类似。可见,对真盐生植物碱蓬而言,适宜的盐分条件不会对光合作用造成显著影响,但离子浓度过高则会明显抑制其光合作用。从不同生境种源的差异来看,盐碱地种源碱蓬叶片净光合速率显著高于潮间带(图4),这可能是盐碱地生境下的碱蓬生长发育显著好于潮间带的主要原因。本研究通过测定碱蓬叶片光合放氧速率进一步验证了盐分胁迫对光合作用的影响,结果表明,盐分胁迫对碱蓬叶片光合放氧速率的影响与净光合速率趋势一致:随着离子浓度的增加,对叶片光合放氧速率的影响程度显著提高。从不同生境种源差异来看,盐碱地碱蓬叶片光合放氧速率显著高于潮间带。
叶绿素荧光参数被认为是研究植物光合作用与环境之间的重要指标。其中Fv/Fm是最大光化学效率,能反映光能吸收与转化的完整程度,反映了植物对光能的利用效率,也是反映植物在盐分胁迫条件下光合作用受抑制的理想指标[23]。φPSⅡ是反映照光条件下,PSⅡ反应中心在部分关闭条件下的实际光化学效率[24]。前人有研究表明,盐胁迫下盐碱地生境盐地碱蓬最大光化学效率Fv/Fm和实际光化学效率φPSⅡ没有显著变化,说明盐碱地生境下碱蓬形成了对高盐环境的适应性机制[25]。本研究结果与前人研究有所差异:200 mmol/L的NaCl处理对盐地碱蓬Fv/Fm和φPSⅡ无显著影响,但400 mmol/L的NaCl处理和不同浓度的KCl处理均使碱蓬的Fv/Fm和φPSⅡ值显著降低(图6和图7)。可见,盐地碱蓬经过盐生环境的长期进化,已适应轻中度盐分环境,其光系统Ⅱ能够保持相对稳定的高活性,但当环境中盐度过高时,其光合系统也会受到伤害[26]。
逆境条件下植物抗氧化保护酶活性高低一方面与植株抗逆性程度有关,另外在一定程度上也指示了植株受逆境的胁迫程度。而其中的超氧化物歧化酶(SOD) 是存在于植物中活性氧清除系统的主要酶之一,它通过催化活性氧发生歧化反应产生H2O2,清除超氧自由基,从而提高植物的抗氧化能力。本研究表明,适宜程度的盐分胁迫(200 mmol/L的NaCl处理)使碱蓬的SOD活性显著提高,但过高的离子浓度(400 mmol/L的NaCl和KCl处理)反而显著抑制了碱蓬SOD活性(图8)。在活性氧清除系统中,过氧化物酶(POD)的功能主要是催化H2O2,促使其分散,从而降低逆境条件下产生的活性氧对植物细胞的伤害作用[27]。本研究结果表明,盐分胁迫使碱蓬体内POD活性显著增加,且增幅随着离子浓度的增加而显著提高(图9),可见,盐地碱蓬POD活性高低更多可作为其受胁迫程度的指示性标志。
本试验选择了潮水经常浸没的潮间带和距离海边较远的盐碱地两种生境下的碱蓬种子进行培育作为供试材料。从研究结果来看,盐碱地种源碱蓬叶片净光合速率和光合放氧速率均显著高于潮间带,这种差异带来的直接后果就是盐碱地生境下的碱蓬生长发育显著好于潮间带,本研究结果中碱蓬的鲜重、干重以及肉质化程度在两种生境下的差异也证实了这点。关于KCl胁迫对碱蓬的影响前人研究不多,有研究结果表明,K+对植物的胁迫效应可能比Na+更为严重[28-29]。本试验设置了Na+和K+的不同浓度处理,从研究结果来看,两种离子的盐分胁迫对碱蓬的胁迫效应存在一定差异,低浓度的NaCl处理对真盐生植物碱蓬的生长发育具有一定的促进效应,而不同浓度的KCl处理均显著抑制碱蓬的生长发育,且抑制程度明显大于NaCl处理。可见,钾盐对盐地碱蓬的生长抑制效应明显大于钠盐。前人在其他植物中的研究也有类似报道[30]。推测这两种离子胁迫下碱蓬生长发育的差异是因为适宜浓度NaCl处理下Na+和Cl-的积累调节了渗透势,增加了植株的肉质化程度,增大了光合面积,使物质生产量明显增加[31]。而KCl处理下使得K+和Cl-的积累,破坏了Na+/K+平衡,使光合作用减弱,有机物积累显著下降。
本试验首次进行了对碱蓬的不同盐分处理与不同生境种源的互作研究。从研究结果来看,适宜的Na盐浓度有利于盐地碱蓬的生长发育,但盐分浓度过高使碱蓬的生长发育受抑;钾盐对碱蓬的胁迫程度大于钠盐;潮间带碱蓬各项指标对盐分胁迫的响应程度显著低于盐碱地,表明盐分胁迫对盐碱地生境碱蓬的影响显著大于潮间带,这也在一定程度上解释了潮间带生境碱蓬能够适应潮间带持续高盐的生态环境。
References:
[1]Zhang Y F, Lin H M, Yang Z H,etal. Study on the effects of land cover on salt content and moisture content in saline or alkaline soil during thawing. Arid Zone Research, 2005, 22(1): 17-23.
[2]Zhao K F, Li F C. Chinese Halophytes[M]. Beijing: Science Press, 1999.
[3]Song J, Fan H, Zhao Y Y,etal. Effect of salinity on germination, seedling emergence, seedling growth and ion accumulation of a euhalophyteSuaedasalsain an intertidal zone and on saline inland. Aquatic Botany, 2008, 88: 331-337.
[4]Huang W, Li Z G, Qiao H L,etal. Interactive effect of sodium chloride and drought on growth and osmotica ofSuaedasalsa. Chinese Journal of Eco-Agriculture, 2008, 16: 173-178.
[5]Song J. Root morphology is related to the phenotypic variation in water logging tolerance of two populations ofSuaedasalsaunder salinity. Plant and Soil, 2009, 324: 231-240.
[6]Zhao K F, Fan H, Jiang X Y,etal. Criticalday-length and photoinductive cycles for the induction of flowering in halophyteSuaedasalsa. Plant Science, 2002, 162(1): 27-31.
[7]Zhao K F, Fan H, Jiang X Y,etal. Improvement and utilization of saline soil by planting halophytes. Chinese Journal of Applied and Environmental Biology, 2002, 8(1): 31-35.
[8]Gao B, Song J, Liu J P,etal. Effects of salt stress on photosynthesis and ion accumulation patterns ofSuaedasalsaunder different habitats. Chinese Journal of Plant Ecology, 2010, 34(6): 671-677.
[9]Liu Y, Zhou J C, Zhang X D,etal. Adaptations of dimorphic seeds and seedlings ofSuaedasalsato saline environments. Acta Ecologica Sinica, 2013, 33(17): 5162-5168.
[10]Liu J P, Gao B, Li X,etal. The effects of salinity and drought interaction on seed germination and seedling growth ofSuaedasalsaL. from different habitats. Acta Ecologica Sinica, 2010, 30(20): 5485-5490.
[11]Xu D Q. Efficiency of Photosynthesis[M]. Shanghai: Shanghai Science and Technology Press, 2002: 29-35.
[12]Zou Q. Experimental Instruction Manual[M]. Beijing: Chinese Agricultural Press, 2000: 129-174.
[13]Ungar I A. Ecophysiology of Vascular Halophytes[M]. London: CRC Press, 1999.
[14]Flowers T J, Hajibagheri M A, Clipson N J. Halophytes. Quarterly Review of Biology, 1986, 61: 313-317.
[15]Schilmper A F. Saline Environment and Plant Growth[M]. India: Agrobotanical Publishers, 1986: 64-66.
[16]Gao Y S, Wang S M, Gong H J,etal. Molecular biological research on the transport of ions in plants under salt stress. Acta Prataculturae Sinica, 2013, 12(5): 18-25.
[17]Gao Y S, Wang S M, Zhang C L. Plant adaptive and regulatory mechanism under salt stress. Acta Prataculturae Sinica, 2003, 12(2): 1-6.
[18]Wang J L, Ding T L, Wang B S. Succulent plants and their adaptions to drought and saline environment. Journal of Shandong Normal University (Natural Science), 2005, 20(4): 74-75.
[19]Shi G W, Song J, Gao B,etal. The comparation on seedling emergence and salt tolerance ofSuaedasalsaL. from different habitats. Acta Ecologica Sinica, 2009, 29(1): 138-143.
[20]Storey R, Wyn Jones R G. Responses ofAtriplexspongiosaandSuaedamaritimeto salinity. Plant Physiology, 1979, 63: 156-162.
[21]Flowers T J, Toke P T, Yeo A R. The mechanism of salt tolerance in halophytes. Annual Review of Physiology, 1977, 28: 89-121.
[22]Yao J, Liu X B, Cui X,etal. Effects of NaCl stress on substance linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seeding stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[23]Hao X Y, Han X, Li P,etal. Effects of elevated atmospheric CO2concentration on mung bean leaf photosynthesis and chlorophyll fluorescence parameters. Chinese Journal of Applied Ecology, 2011, 22(10): 2776-2780.
[24]Xu D Q, Zhang Y Z, Zhang R X. Photo inhibition of photosynthesis in plant. Plant Physiology Communications, 1992, 28(4): 237-243.
[25]Lu C M, Qiu N W, Lu Q T,etal. Does salt stress lead to increased susceptibility of photosystem II to photo inhibition and changes in photosynthetic pigment composition in halophyteSuaedasalsagrown outdoors. Plant Science, 2002, 163(5): 1063-1068.
[26]Yin H L, Tian C Y. Photosynthetic characteristics ofSuaedasalsaseedlings under different salt conditions. Arid Zone Research, 2014, 31(5): 850-855.
[27]Liu J W, Tong D D, Guan L Y. Effects of NaCl stress on different SOD isozymes of alfalfa. Journal of Heilongjiang August First Land Reclamation University, 2006, 18(6): 4-7.
[28]Bhandal T J, Malik C P. Potassium estimation, uptake and its role in the physiology and mechanism of flowering plants. Survey of Cell Biology, 1988, 110: 205-254.
[29]Eshel A. The effect of NaCl and KCl on the growth and ionic composition of the halophytic C4succulent chenopodsSalsakali,SuaedamaritimaandSuaedaaegyptiaca. Australian Journal of Plant Physiology, 1985, 12: 319-382.
[30]Zhao K F. Physiology of Salt Resistance in Vascular Plants[M]. Beijing: China Science and Technology Press, 1993.
[31]Wang B S, Lǜttge U, Ratajczak R. Effects of salt treatment and osmotic stress on V-ATPase and V-PPase in leaves of the halophyteSuaedasalsa. Journal of Experimental Botany, 2001, 52: 2355-2365.
参考文献:
[1]张永福, 蔺海明, 杨自辉, 等. 解冻期覆盖盐渍土地表对土壤盐分和水分的影响. 干旱区研究, 2005, 22(1): 17-23.
[2]赵可夫, 李法曾. 中国盐生植物[M]. 北京: 科学出版社, 1999.
[7]赵可夫, 范海, 江行玉, 等. 盐生植物在盐渍土壤改良中的作用. 应用与环境生物学报, 2002, 8(1): 31-35.
[8]高奔, 宋杰, 刘金萍, 等. 盐胁迫对不同生境盐地碱蓬光合及离子积累的影响. 植物生态学报, 2010, 34(6): 671-677.
[9]刘艳, 周家超, 张晓东, 等. 盐地碱蓬二型性种子及其幼苗对盐渍环境的适应性. 生态学报, 2013, 33(17): 5162-5168.
[10]刘金萍, 高奔, 李欣, 等. 盐旱互作对不同生境盐地碱蓬种子萌发和幼苗生长的影响. 生态学报, 2010, 30(20): 5485-5490.
[11]许大全. 光合作用效率[M]. 上海: 上海科学技术出版社, 2002: 29-35.
[12]邹奇. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000: 129-174.
[16]高永生, 王锁民, 宫海军, 等. 盐胁迫下植物离子转运的分子生物学研究. 草业学报, 2003, 12(5): 18-25.
[17]高永生, 王锁民, 张承烈. 植物盐适应性调节机制的研究进展. 草业学报, 2003, 12(2): 1-6.
[18]王家利, 丁同楼, 王宝山. 肉质植物及其对盐渍和干旱环境的适应. 山东师范大学学报(自然科学版), 2005, 20(4): 74-75.
[19]史功伟, 宋杰, 高奔, 等. 不同生境盐碱地碱蓬出苗及幼苗抗盐性的比较研究. 生态学报, 2009, 29(1): 138-143.
[22]姚佳, 刘信宝, 崔鑫, 等. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99.
[23]郝兴宇, 韩雪, 李萍, 等. 大气CO2浓度升高对绿豆叶片光合作用及叶绿素荧光参数的影响. 应用生态学报, 2011, 22(10): 2776-2780.
[24]许大全, 张玉忠, 张荣铣. 植物光合作用的抑制. 植物生理学通讯, 1992, 28(4): 273-243.
[26]尹海龙, 田长彦. 不同盐度环境下盐地碱蓬幼苗光合生理生态特征. 干旱区研究, 2014, 31(5): 850-855.
[27]刘金文, 佟丹丹, 关利娅. NaCl胁迫对不同苜蓿品种超氧化物歧化酶同工酶的影响. 黑龙江八一农垦大学学报, 2006, 18(6): 4-7.
[30]赵可夫. 植物抗盐生理[M]. 北京: 中国科学技术出版社, 1993.
Growth ofSuaedasalsatin response to salt stress in different habitats
PENG Bin, XU Wei, SHAO Rong, FENG Gong-Neng, SHI Wen-Yan
JiangsuKeyLaboratoryofBiochemistryandBiotechnologyofSeaSpreads,YanchengInstituteofTechnology,Yancheng224041,China
Abstract:The influence of salt (0, 200 and 400 mmol/L NaCl; 0, 200 and 400 mmol/L KCl) on growth, ion accumulation, chlorophyll fluorescence and gas exchange in leaves and antioxidant levels was assessed in Suaeda salsa plants from different habitats; intertidal and inland saline. 200 mmol/L NaCl significantly increased shoot fresh weight and dry weight and succulence of S. salsa plants, while 400 mmol/L NaCl and all KCl treatments resulted in reduced growth. The concentrations of Na+ and Cl- were increased by NaCl treatments while the concentration of K+ significantly decreased. Similarly KCl treatments resulted in increasing K+ and Cl- concentrations accompanied by a marked reduction in Na+ concentration. The 200 mmol/L NaCl treatment had no effect on net photosynthesis, photosynthetic oxygen evolution rate, Fv/Fm and φPSⅡin S. salsa, but KCl treatments resulted in a significant decrease in these traits. In addition, 200 mmol/L NaCl resulted in a significant increase in the SOD activity whereas 400 mmol/L NaCl and all KCl treatments markedly decreased SOD activity. Interestingly, the POD activity in S. salsa was significantly increased by all NaCl and KCl treatments. Shoot fresh weight and dry weight, succulence, net photosynthesis, photosynthetic oxygen evolution rate and ion concentration (Na+ and Cl-) of S. salsa plants from the intertidal zone were lower than that those from an inland saline areas. The salt stress effect of KCl was greater than that of NaCl. Saline stress in S. salsa plants from saline inland habitats was significantly greater than plants from an intertidal zone.
Key words:Suaeda salsa; habitats; salt stress; growth; response
作者简介:彭斌(1975-),男,江苏盐都人,副教授,博士。E-mail:pb@ycit.cn
基金项目:国家海洋局公益性行业科研专项(201505023)和江苏省盐城市农业科技创新专项引导资金项目(YK2014001)资助。
*收稿日期:2015-06-18;改回日期:2015-08-19
DOI:10.11686/cyxb2015312
http://cyxb.lzu.edu.cn
彭斌,许伟,邵荣,封功能,石文艳. 不同生境种源盐地碱蓬幼苗生长发育对盐分胁迫的响应和适应. 草业学报, 2016, 25(4): 81-90.
PENG Bin, XU Wei, SHAO Rong, FENG Gong-Neng, SHI Wen-Yan. Growth ofSuaedasalsatin response to salt stress in different habitats. Acta Prataculturae Sinica, 2016, 25(4): 81-90.
关键词:盐地碱蓬;生境;盐分胁迫;生长;响应
