二苯乙烯苷对糖尿病大鼠心肌损伤的保护作用
2016-05-10李彩蓉甘受益黄红霞
李彩蓉,甘受益,黄红霞,蔡 飞
(1.湖北科技学院临床医学院内科学教研室;2.咸宁市中心医院心内科;3.湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北咸宁 437100)
二苯乙烯苷对糖尿病大鼠心肌损伤的保护作用
李彩蓉1,甘受益2,黄红霞2,蔡 飞3
(1.湖北科技学院临床医学院内科学教研室;2.咸宁市中心医院心内科;3.湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北咸宁 437100)
目的 探讨二苯乙烯苷(TSG)对糖尿病大鼠心肌损伤的作用及对沉默信息调节因子2的哺乳动物同源体1 (SIRT1)和磷酸腺苷活化的蛋白激酶(AMPK)蛋白影响。方法 建立2型糖尿病大鼠模型,分组给药,16周时处死大鼠,生化法测定血糖、血脂、肝功能及肌酸激酶(CK)、乳酸脱氢酶(LDH)和心肌组织游离脂肪酸(NEFA);酶联免疫吸附法测定心肌肌钙蛋白Ⅰ(cTnⅠ)、心肌组织脂代谢相关酶脂肪酸跨膜转运载体蛋白(FATPs)和脂肪酸β氧化酶(FA-β-oxidase)的含量;放射免疫法测定血浆炎症因子肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)的含量,Western blot检测心肌组织中TNF-α、IL-6、IL-1β、SIRT1和AMPK蛋白的表达;并测定左心室胶原含量。结果TSG干预后能减低血脂水平,对血糖和胰岛素水平无明显影响。TSG能减低糖尿病大鼠心肌组织中胶原含量,减少心脏游离脂肪酸含量,增加心肌组织脂代谢相关酶(FATPs和FA-β-oxidase)含量,抑制外周血和心肌组织中炎症因子(TNF-α、IL-6、IL-1β)的分泌。TSG能明显增加糖尿病大鼠心脏SIRT1和pAMPK蛋白表达。结论 TSG对糖尿病大鼠心肌具有保护作用,其机制可能与抑制心肌炎症因子和改善能量代谢有关。
糖尿病心肌病;二苯乙烯苷;沉默信息调节因子2的哺乳动物同源体1;磷酸腺苷活化的蛋白激酶;脂肪酸β氧化酶;肿瘤坏死因子
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者所特有的心脏病,是糖尿病常见的心血管并发症之一[1]。糖尿病心肌病变表现为心肌细胞肥大、心肌间质纤维化、心室扩张及舒张功能障碍,若不积极治疗,最终将发展为充血性心力衰竭[2]。高糖环境下微血管内皮功能异常、心肌的胰岛素信号传导障碍及心肌代谢紊乱是糖尿病心肌重构和心肌舒张功能障碍致心功能不全的始动环节[3]。然而糖尿病心肌病发病机制尚不明确,亦无理想的临床药物治疗。2,3,5,4′-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside,TSG),简称二苯乙烯苷,是传统中药寥科植物何首乌中提取的一种水溶性有效成分,具有降血脂、抗炎症、抗衰老、免疫调节和心血管活性等功能[4]。本实验采用高脂饮食和链脲佐菌素腹腔注射建立2型糖尿病模型,探讨TSG干预后对糖尿病大鼠心脏损伤的保护作用,以及SIRT1和AMPK蛋白在其中的作用。
1 材料与方法
1.1 仪器与试剂 血糖测定仪(ONE TOUCH Ultra稳豪系列,LifeScanInc,美国);全自动酶标仪(MUL-TISKAN MK3,Thermo产品,美国);紫外分光光度计(AGILENT 8453,Agilent Techologies,德国);pH计(Mettler Toledo公司);全自动发光凝胶成像系统(Syngene)。二苯乙烯苷(北京中国药品生物制品鉴定所,纯度98%);链脲佐菌素(streptozotocin,STZ;Sigma);游离脂肪酸(nonesterified fatty acids,NEFA;南京建成生物工程研究所);脂肪酸跨膜转运载体蛋白(FATPs)和脂肪酸β氧化酶(FA-β-oxidase)酶联免疫吸附测定试剂盒(加拿大Groudwork Biotech-nology Diagnosticate Ltd);肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(serum lactate dehydrogenase,LDH)试剂盒(上海科华公司);心肌肌钙蛋白I(car-diac troponin I,cTnI)酶联免疫吸附测定试剂盒(武汉优尔生科技股份有限公司);肿瘤坏死因子-α (tumor necrosis factor alpha,TNF-α)、白介素-6(in-terleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)、AMP活化蛋白激酶(AMP-activated protein ki-nase,AMPK)、SIRT1(silent mating type information regulation 2 homolog 1)和β-actin抗体(Santa Cruz, USA)。
1.2 动物分组及给药 清洁级♂Wister大鼠(200 ±20)g,由湖北省医学科学院实验动物中心提供,许可证号:SCXK(鄂)2014-0007。大鼠适应性喂养1周后,分为正常对照组和糖尿病模型组,正常对照组予以基础饲料喂养,糖尿病模型组参照文献[5]建模:大鼠喂高脂饮食诱导大鼠胰岛素抵抗,6周后STZ腹腔注射(30 mg·kg-1溶于0.1 mol·L-1的枸橼酸钠缓冲液,pH 4.4)破坏大鼠部分胰岛β功能。72 h后测血糖≥11.1 mmol·L-1的大鼠即为2型糖尿病大鼠(共34只)。造模成功后取血糖较高的30只随机分为3组:糖尿病模型组(10只),糖尿病模型组+TSG小剂量(腹腔注射,10 mg·kg-1)干预组(10只),糖尿病模型组+TSG大剂量(腹腔注射20 mg·kg-1)干预组(10只),继续给予高脂饮食,所有动物继续喂养8周后处死大鼠。
1.3 血清生化指标、肌钙蛋白含量及心肌组织游离脂肪酸 给药结束后,大鼠进食12 h,颈动脉取血(肝素化),自动生化分析仪测定血清空腹血糖(fast-ing bloodglucose,BFS)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、谷草转氨酶(glu-tamic oxalacetictraninase,AST)、谷丙转氨酶(ALT)、肌酸激酶和乳酸脱氢酶的含量。留取各组大鼠同部位心脏组织,采用预冷生理盐水充分洗净,匀浆,3 500 r·min-1,离心10 min后,留取上清,生化测定心肌组织游离脂肪酸含量。酶联免疫法检测肌钙蛋白含量。
1.4 左心室胶原含量测定 取各组大鼠同部位左心室0.1 g组织,依据胶原中羟脯氨酸含量13.4%比例,胶原(collgen)含量以羟脯氨酸×7.46计算,按照试剂盒说明书测定左心室样品中羟脯氨酸含量。结果以mg·kg-1组织表示。
1.5 心肌组织脂代谢相关酶的测定 心肌组织以生理盐水制作匀浆,按照试剂盒说明书,酶联免疫吸附法(ELISA)测定大鼠心肌组织中FATPs,FA-β-oxidase含量。
1.6 放射免疫法测定血浆炎症因子和血胰岛素颈动脉取血,将3 mL血以3 500 r·min-1离心10 min,取上清-70℃保存,按照试剂盒说明书操作,分别进行放射免疫法测定外周血肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)的含量。血清胰岛素水平采用放射免疫法测定。
1.7 Western blot检测心肌组织中TNF-α、IL-6、IL-1β、SIRT1和AMPK的表达 从-80℃中取出大鼠左室心尖部心肌,称取50 mg组织,用预冷的PBS洗组织块3次,然后进行裂解,置4℃,采用超速离心法分离提取总蛋白,用BCA蛋白定量试剂盒定量。SDS-PAGE分离蛋白后,转膜到PVDF膜上,封闭、漂洗后加入洗膜后加入一抗(Santa Cruz公司,1∶500稀释)4℃过夜。再用辣根过氧化酶标记的羊抗小鼠多抗(1∶500稀释)杂交1 h;洗膜后加ECL(增强化学发光),然后将硝酸纤维膜放入X线片暗盒,压片,显影,定影。免疫印迹条带IOD值最后用Gel-Pro Analyzer3.1图像分析系统分析。
2 结果
2.1 糖尿病大鼠心室重塑指标的变化 与正常对照相比,糖尿病模型组大鼠心脏体重明显降低,心脏指数(cardiac weight index)和左室指数(left ventricu-lar weight index)明显增高(P<0.01),TSG干预组也明显增高(P<0.05,P<0.01)。与模型组比较,TSG各剂量干预组大鼠心脏指数和左室指数均明显降低(P<0.01),以大剂量干预组明显。见Tab 1。
2.2 大鼠血糖、血脂和胰岛素的变化 与正常对照相比,糖尿病模型组大鼠血糖、胆固醇、甘油三酯、糖化血红蛋白及胰岛素水平明显升高(P<0.01),TSG干预组也明显增高(P<0.05,P<0.01)。与模型组比较,大剂量TSG干预后大鼠血TC和TG明显降低(P<0.05)。TSG干预后对大鼠血FBG、HbA1c和FINS无明显改善。见Tab 2。
2.3 血清肌酸激酶、乳酸脱氢酶含量、肌钙蛋白和肝功能的变化 与正常对照组比较,糖尿病大鼠血清中CK、LDH和cTnI含量增加(P<0.05,P<0.01)。TSG干预组大鼠血清中CK、LDH和cTnI含量有不同程度的减少,与糖尿病模型组比较,差异有统计学意义,尤以大剂量干预组效果明显(P<0.05)。与正常对照组比较,糖尿病大鼠血清AST与正常对照组比较差异有统计意义(P<0.05),余各组大鼠血AST和ALT差异无统计学意义。见Tab 3。
2.4 左心室胶原含量的变化 心室收缩和舒张功能障碍与心肌胶原纤维增生密切相关。如Tab 4所示,与正常对照组比较,糖尿病大鼠心肌胶原含量明显增加(P<0.05)。经TSG干预后,心肌胶原含量明显下降,尤以大剂量组干预效果明显,与糖尿病模型组比较,差异有统计学意义(P<0.05)。
2.5 心肌组织中游离脂肪酸和脂肪酸代谢相关酶的变化 与正常对照组比较,高脂饮食喂养的糖尿病大鼠心肌组织游离脂肪酸含量增加(P<0.01),TSG干预后心肌组织游离脂肪酸含量明显改善,与糖尿病模型组比较,差异有统计学意义(P<0.05,P <0.01)。脂肪酸代谢相关酶(FATPs,FA-β-oxi-dase)与脂肪酸(FAs)从细胞外转移至细胞内,参与氧化还原反应有关。高脂饮食喂养的糖尿病大鼠心肌组织中FATPs和FA-β-oxidase含量与正常对照组大鼠比较明显下降,差异有统计学意义(P<0.05),提示脂肪酸转运和氧化能力下降,经TSG干预后,心肌组织中FAPs和FA-β-oxidase含量增加(P<0.05),提示TSG可增加心肌组织中脂肪酸的转运和氧化利用。见Tab 5。
Tab 1 Effects of TSG on indexes of left ventricular remodeling in experimental diabetic candiomyopathy(±s,n=10)

Tab 1 Effects of TSG on indexes of left ventricular remodeling in experimental diabetic candiomyopathy(±s,n=10)
*P<0.05,**P<0.01 vs control;#P<0.05 vs DM
Treatment n Weight after/g Weight before/g Cardiac weight index/mg·g-1 Left ventricular weight index/mg·g -1 Control 10 226.53±31.56 524.51±31.56 2.61±0.25 1.91±0.07 DM 9 235.32±19.64** 278.32±29.14** 3.71±0.28* 2.99±0.07**DM+TSG10 mg·kg-1 10 231.31±24.65* 313.43±27.32* 2.97±0.22** 2.42±0.06*DM+TSG 20 mg·kg-1 10 229.72±31.78*# 387.51±37.75*# 2.81±0.23*# 2.11±0.05*#
Tab 2 Effects of TSG on FBG,TC,TG,HbA1c and FINS level in experimental diabetic cardiomyopathy(±s)

Tab 2 Effects of TSG on FBG,TC,TG,HbA1c and FINS level in experimental diabetic cardiomyopathy(±s)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs DM
Treatment n FBG/mmol·L-1 TC/mmol·L-1 TG/mmol·L-1 HbA1c /A·(10 g)-1Pro FINS/mmol·L -1 Control 10 5.11±0.73 4.87±0.71 1.62±0.32 26.47±5.74 15.72±1.43 DM 9 19.57±2.77** 7.83±1.58** 3.21±0.52** 44.73±15.37** 22.71±2.62**DM+TSG 10 mg·kg-1 10 18.97±2.83** 6.71±0.93* 2.79±0.61** 43.78±16.79** 22.31±2.71**DM+TSG 20 mg·kg-1 10 17.04±2.72** 5.94±0.97# 1.89±0.52*## 42.87±16.91** 21.53±2.53*
Tab 3 Effects of TSG on blood CK,LDH and cTnI level in experimental diabetic cardiomyopathy(±s)

Tab 3 Effects of TSG on blood CK,LDH and cTnI level in experimental diabetic cardiomyopathy(±s)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs DM
Treatment n AST/U·L-1 ALT/U·L-1 CK/U·L-1 LDH/U·L-1 cTnI/μg·L -1 Control 10 56.78±9.76 51.46±8.46 162.3±21.5396.7±81.2 0.07±0.81 DM 9 70.67±9.16* 61.75±6.14 312.4±51.6** 874.3±95.8** 0.32±0.21**DM+TSG 10 mg·kg-1 10 67.59±8.79 59.47±5.87 271.7±41.3* 704.8±82.7* 0.27±0.17*DM+TSG 20 mg·kg-1 10 64.78±8.74 53.56±6.13 211.3±42.4# 523.6±81.9*# 0.19±0.13*#
Tab 4 Effects of TSG on left ventricular collagen concentration in experimental diabetic cardiomyopathy(±s)

Tab 4 Effects of TSG on left ventricular collagen concentration in experimental diabetic cardiomyopathy(±s)
*P<0.05 vs control;#P<0.05 vs DM
Treatment n Collgen/mg·g-1Tissue Control 10 2.1±0.4 DM 9 3.5±0.7*DM+TSG 10 mg·kg-1 10 3.1±0.5 DM+TSG 20 mg·kg-1 10 2.7±0.4#
2.6 血浆炎症因子的变化 糖尿病心肌病大鼠外周血外周血TNF-α、IL-6、IL-1β分泌增加,与正常对组比较差异有统计学意义(P<0.01)。不同剂量TSG干预组炎症因子表达不同程度下降,尤以TSG高剂量干预组效果明显,与糖尿病模型组比较差异有统计学意义(P<0.05)。见Tab 6。
2.7 心肌组织中TNF-α、IL-6和IL-1β蛋白的变化 糖尿病心肌病心肌组织TNF-α、IL-6和IL-1β蛋白表达明显增加,与正常对组比较差异有统计学意义(P<0.01)。不同剂量TSG干预组TNF-α、IL-6和IL-1β蛋白表达不同程度下降,与糖尿病模型组比较差异有统计学意义(P<0.05)。见Fig 1。
Tab 5 Effects of TSG on mycocardial non-esterified fatty acids,FATPs and FA-β-oxidase concentration in experimental diabetic cardiomyopathy(±s)

Tab 5 Effects of TSG on mycocardial non-esterified fatty acids,FATPs and FA-β-oxidase concentration in experimental diabetic cardiomyopathy(±s)
*P<0.05,**P<0.01 vs control;#P<0.05 vs DM
Treatment n NEFA/μmol·g-1Pro FATPs/mg·g-1Pro FA-β-oxidase/mg·L-1·g-1Pro Control 10 49±18 2.98±0.64 21.7±7.8 DM 9 101±23** 1.37±0.52** 10.2±6.2**DM+TSG 10 mg·kg-1 10 61±19* 1.88±0.71* 12.1±5.7*DM+TSG 20 mg·kg-1 10 71±21# 2.24±0.73*# 15.9±6.3*#
Tab 6 Effects of TSG on serum TNF-α,IL-6 and IL-1β level in experimental diabetic cardiomyopathy(±s)

Tab 6 Effects of TSG on serum TNF-α,IL-6 and IL-1β level in experimental diabetic cardiomyopathy(±s)
*P<0.05,**P<0.01 vs control;#P<0.05 vs DM
Treatment n TNF-α/μg·L-1 IL-6/μg·L-1 IL-1β/μg·L -1 Control 10 1.18±0.77 6.78±1.29 0.07±0.81 DM 9 2.04±1.52** 41.31±15.82** 0.32±0.21**DM+TSG 10 mg·kg-1 10 1.79±1.13* 31.38±12.21* 0.27±0.17*DM+TSG 20 mg·kg-1 10 1.57±1.01# 23.54±10.72*# 0.19±0.13*#
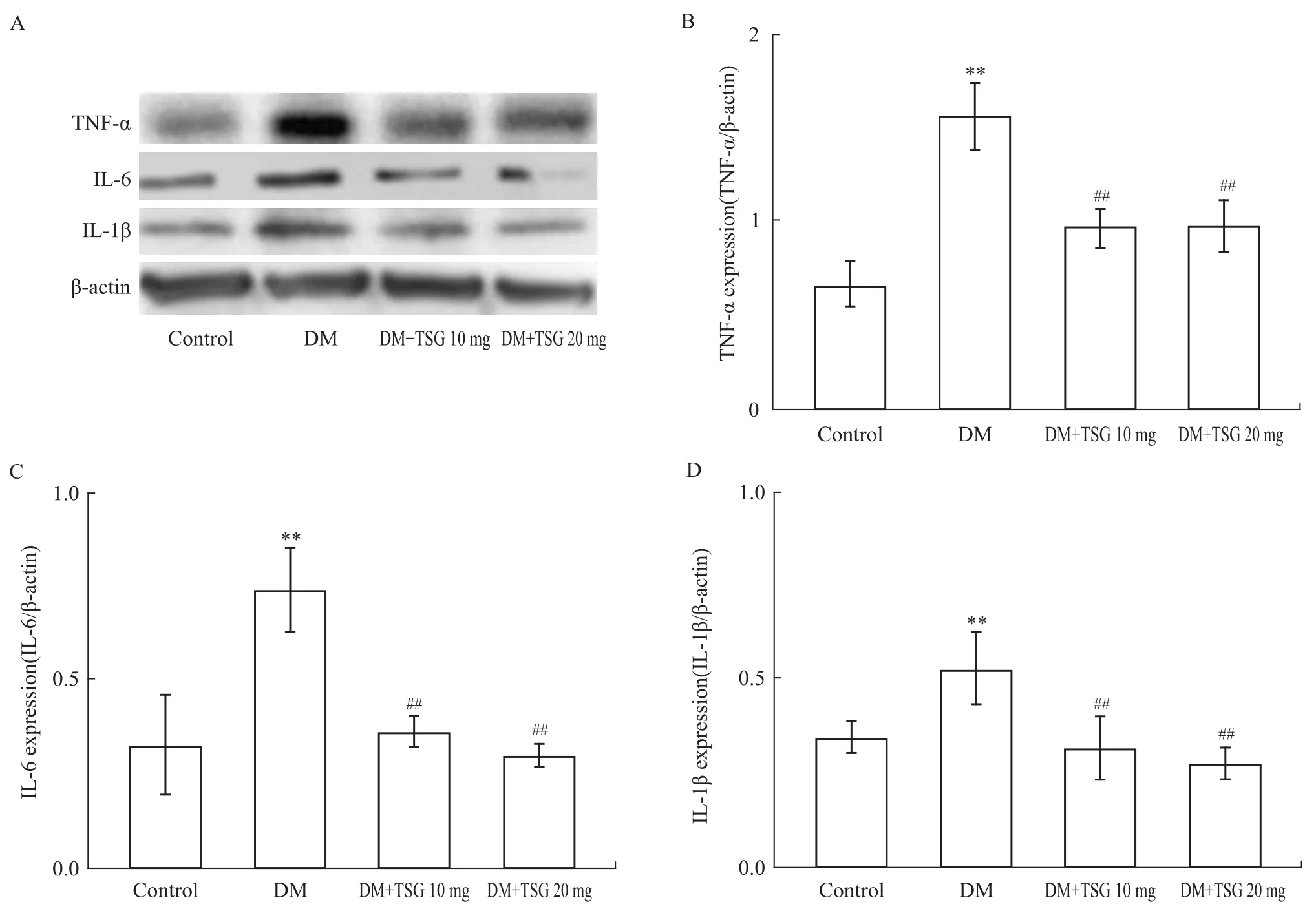
Fig 1 Effects of TSG on mycocardial TNF-α,IL-6 and IL-1β expressions in experimental diabetic cardiomyopathy(±s)
2.8 心肌组织中SIRT1和AMPK的变化 与正常组比较,糖尿病模型组大鼠心脏组织SIRT1蛋白表达明显下降,TSG干预后干预能增加糖尿病大鼠心脏组织中SIRT1蛋白的表达,以TSG大剂量干预组效果明显。与正常组比较,糖尿病模型组大鼠心肌组织中AMPK蛋白无明显变化,但是pAMPK蛋白表达明显下降,TSG干预后心脏组织中pAMPK蛋白均明显升高。见Fig 2。
3 讨论
糖尿病患者心力衰竭发生率高且预后较差,提示存在心脏基础性病变,使心肌易发生缺血而不易恢复,众多证据提示确实存在真正的特异性糖尿病心肌病,与缺血性损害不同。研究提示心肌组织中氧化应激、凋亡、炎症、能量代谢紊乱、线粒体损伤和心肌细胞纤维化被认为是糖尿病心肌病发生发展的可能机制[6]。
糖尿病患者心肌活检中发现心肌的形态学改变主要是心肌肥厚、心肌细胞肥大、肌原纤维缺失、间质纤维化、微血管基底膜增厚、小动脉壁中基质增多和心肌内微血管病变。在无心脏病的糖尿病患者中发现早期即有心肌纤维化,1型和2型糖尿病患者左室功能减退时,心内胶原纤维明显增多。而心脏胶原纤维增生可导致心肌组织紧张度增加,是心室收缩和舒张功能损伤的重要病理因素[7]。本研究发现糖尿病大鼠模型组心肌胶原含量明显增加,而TSG干预能降低胶原含量。
有研究认为糖尿病其实是一种慢性炎症性疾病,在糖尿病状态下,血多炎症因子如C反应蛋白(CRP)、TNF-α、IL-6、IL-1β等细胞因子分泌增加。炎症因子的释放参与糖尿病心肌病变的发生发展[8]。本研究结果显示,高脂饮食和链脲佐菌素腹腔注射建立2型糖尿病模型组大鼠外周血外周血TNF-α、IL-6、IL-1β分泌增加,同时也发现在心肌组织中TNF-α、IL-6和IL-1β蛋白表达明显增加,TSG能抑制这些炎症因子的产生。

Fig 2 Effects of TSG on mycocardial SIRT1and AMPK expressions in experimental diabetic cardiomyopathy(±s)
高血糖和胰岛素抵抗的直接效应导致糖尿病患者的左室功能减退,与心肌能量底物的供应和利用改变有密切关系。正常情况下心肌在有氧灌注和正常做功负荷是利用游离脂肪酸作为主要的能源,在做功增加时,心脏增加糖酵解和丙酮酸氧化。由于糖尿病患者运送到心肌的葡萄糖减少,心肌缺血是依靠糖酵解的ATP生成受损。游离脂肪酸及其氧化产物积聚对心肌细胞直接产生毒性,导致糖尿病心肌病形成[9]。本研究结果发现高脂饮食喂养的糖尿病大鼠心肌组织游离脂肪酸含量增加,而脂肪酸代谢相关酶(FATPs,FA-β-oxidase)的含量与正常对照组大鼠比较明显下降,提示脂肪酸转运和氧化能力下降,而TSG干预后心肌组织游离脂肪酸和脂肪酸代谢相关酶含量明显改善。
能量代谢异常是糖尿病心肌病变发生、发展的重要原因之一,AMPK是一种重要的丝氨酸/苏氨酸蛋白激酶,在哺乳动物组织包括心肌组织中都有表达。AMPK可调节血浆葡萄糖、脂肪酸氧化及糖原合成等,是全身能量平衡的关键调节因素,称为“能量代谢总开关”,在能量代谢和能量平衡等方面起着枢纽作用[10]。SIRT1是一种具有NAD2依赖的蛋白去乙酰化酶活性的多功能转录调节因子,对细胞能量变化和细胞氧化还原状态的变化起着重要的调节作用[11]。当热量限制或禁食时,在脑、心脏、脂肪、肾脏、肌肉以及肝脏中水平上调。过表达SIRT1的转基因小鼠对胰岛素敏感,同时减少食物摄入和自发性活动,从而减少能量消耗;在各种胰岛素抵抗和糖尿病模型中,SIRT1的转基因小鼠能够改善糖耐量,增加脂联素水平。热量限制能够通过激活SIRT1从而对2型糖尿病有防治作用。研究发现敲除SIRT1可加重小鼠心肌缺血/再灌注损伤,SIRT1的激活剂resveratrol可通过上调SIRT1活性而对氧化应激所致的心肌细胞损害有保护作用[12]。以上研究提示SIRT1是防治糖尿病能量代谢异常及心肌细胞损伤的重要调节因素。本研究结果提示糖尿病模型组大鼠心肌组织中AMPK蛋白无明显变化,而心脏组织中SIRT1和pAMPK蛋白表达明显下降,TSG干预后能升高SIRT1和pAMPK蛋白表达表达。抑制AMPK和SIRT1活性将导致缺血缺氧心肌组织中糖摄取、糖酵解增加等能量反射消失,ATP和肌酸激酶等高能磷酸物含量明显减少,左室收缩功能受损,心肌细胞凋亡和坏死加剧。本研究结果提示TSG对糖尿病大鼠心肌细胞的能量代谢有改善作用,但其具体机制尚需进一步探讨。
(致谢:本实验在糖尿病心脑血管病变湖北省重点实验室完成,感谢实验室工作人员对本实验的支持。感谢实验室余薇博士对本实验的帮助。)
[1] Bugger H,Abel E D.Molecular mechanisms of diabetic cardiomy-opathy[J].Diabetologia,2014,57(4):660-71.
[2] Kayama Y,Raaz U,Jagger A,et al.Diabetic cardiovascular dis-ease induced by oxidative stress[J].Int J Mol Sci,2015,16 (10):25234-63.
[3] Pereira L,Ruiz-Hurtado G,Rueda A,et al.Calcium signaling in diabetic cardiomyocytes[J].Cell Calcium,2014,56(5):372- 80.
[4] Zhou X,Yang Q,Xie Y,et al.Tetrahydroxystilbeneglucoside ex-tends mouse life span via upregulating neural klotho and downregu-lating neural insulin or insulin-like growth factor 1[J].Neurobiol Aging,2015,36(3):1462-70.
[5] 吴 铿,游 琼,黄瑞娜,等.柚皮苷调控心肌PPARγ表达对实验性2型糖尿病心肌病大鼠模型心肌损伤的防治作用[J].中国药理学通报,2012,28(4):526-30.
[5] Wu K,You Q,Huang R N,et al.Protective effects of Naringin on expremental rats model of Type 2 diabetic cardiomyopathy via regu-lation of PPARγsignaling[J].Chin Pharmacol Bull,2012,28 (4):526-30.
[6] Liu Q,Wang S,Cai L.Diabetic cardiomyopathy and its mecha-nisms:Role of oxidative stress and damage[J].J Diabetes Inves-tig,2014,5(6):623-34.
[7] Trachanas K,Sideris S,Aggeli C,et al.Diabetic cardiomyopa-thy:from pathophysiology to treatment[J].Hellenic J Cardiol,2014,55(5):411-21.
[8] 张一驰,解砚英,牟艳玲,等.葛根素对糖尿病大鼠心功能及血清TNF-α水平的影响[J].中国药理学通报,2011,27(12):1700-4.
[8] Zhang Y C,Xie Y Y,Mou Y L,et al.Effects of puerarin on the heart function and the lecel of serum TNF-αin diabetic rats[J].Chin Pharmacol Bull,2011,27(12):1700-4.
[9] 董世芬,洪 缨,汪瑞祺,等.小檗碱对实验性2型糖尿病心肌病大鼠模型心脏保护作用研究[J].中国药理学通报,2013,29(9):1216-21.
[9] Dong S F,Hong Y,Wang R Q,et al.Berberine attenuates cardiac dysfunction in expremental type 2 diabetic cardiomyopathy rats model[J].Chin Pharmacol Bull,2013,29(9):1216-21.
[10]Zhang Z,Wang S,Zhou S,et al.Sulforaphane prevents the devel-opment of cardiomyopathy in type 2 diabetic mice probably by re-versing oxidative stress-induced inhibition of LKB1/AMPK path-way[J].J Mol Cell Cardiol,2014,77:42-52.
[11]Guo R,Liu W,Liu B,et al.SIRT1 suppresses cardiomyocyte ap-optosis in diabetic cardiomyopathy:An insight into endoplasmic reticulum stress response mechanism[J].Int J Cardiol,2015,191:36-45.
[12]Wang B,Yang Q,Sun Y Y,et al.Resveratrol-enhanced autoph-agic flux ameliorates myocardial oxidative stress injury in diabetic-mice[J].J Cell Mol Med,2014,18(8):1599-611.
Protective effects of tetrahydroxystilbeneglucoside on cardiac dysfunction in experimental diabetic cardiomyopathy
LI Cai-rong1,GAN Shou-yi2,HUANG Hong-xia2,CAI Fei3
(1.Dept of Medicine,Hubei University of Science and Technology;2.Dept of Cardiovascular Medicine,Xianning Centre Hospital;3.Hubei Province Key Laboratory on Cardiovascular,Cerebrovascular,and Metabolic Disorders,Hube University of Science and Technology,Xianning Hubei 437100,China)
Aim To study the protective effect of tetra-hydroxystilbeneglucoside(TSG)on cardiac injury and the mechanism involved in silent mating type informa-tion regulation 2 homolog 1(SIRT1)and adenosine monophosphate-activated protein kinase(AMPK)in the diabetic rats.Methods Type 2 diabetic rats were sac-rificed after administration with TSG for 8 weeks.Blood glucose,blood lipids,liverfunction,creatine ki-nase(CK),lactate dehydrogenase(LDH)as well as myocardial nonesterified fatty acids(NEFA)were deter-mined by using biochemical test.The concentration of myocardial fatty acid transport proteins(FATPs)and-fatty acid β-oxidase(FA-β-oxidase),and the levels of tumor necrosis factor alpha(TNF-α),interleukin-6 (IL-6),interleukin-1β(IL-1β)in serum were also measured by ELISA method and radio immunoassay re-spectively.The protein expressions of TNF-α,IL-6,IL-1β,SIRT1 and AMPK were detected by Western blot.Results Treatment of TSG reduced the contentof blood lipids,NEFA and collagen without affecting the content of blood glucose and insulin.The levels of TNF-α,IL-6 and IL-1β in serum as well as the protein expressions of TNF-α,IL-6 and IL-1β of cardia were also inhibited by administration with TSG.Treatment of TSG caused a significantly increased concentration of myocaidial FATPs and FA-β-oxidase,and dramatically restored the decreased protein expressions of SIRT1 and pAMPK in diabetic rats.Conclusion The protec-tive mechanisms of TSG against diabetic rats are in-volved in the alleviation of inflammatory mediator injury and improving energy metabolism.
tetrahydroxystilbeneglucoside;diabetic cardiomyopathy;silent mating type information regula-tion 2 homolog 1(SIRT1);adenosine monophosphate-activated protein kinase(AMPK);fatty acid β-oxidase;tumor necrosis factor alpha
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.044.html
10.3969/j.issn.1001-1978.2016.03.022
A
1001-1978(2016)03-0410-06
R-332;R322.11;R392.12;R587.1;R977.3;R977.6
2015-11-13,
2015-12-25
湖北省教育厅项目资助(No D20162802);湖北省卫生厅项目(No WJ2015Z122);湖北科技学院培育项目(No PY1007);湖北科技学院糖尿病专项基金(No ZX1303)
李彩蓉(1977-),女,硕士,副教授,研究方向:糖尿病微血管并发症的临床和实验,E-mail:xnlcr@163.com;蔡 飞(1976-),男,博士,教授,研究方向:糖尿病微血管并发症的临床和实验,通讯作者,E-mail:xncf@163.com
◇复方药物药理学◇