紫花苜蓿对DDT污染土壤的修复
2016-05-09李思雯孙丽娜郑冬梅
李思雯, 李 鹏, 孙丽娜, 郑冬梅
(沈阳大学 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044)
紫花苜蓿对DDT污染土壤的修复
李思雯, 李鹏, 孙丽娜, 郑冬梅
(沈阳大学 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳110044)
摘要:研究了豆科植物紫花苜蓿(Medicago sativa)对DDT污染土壤的修复情况.在修复性盆栽实验中添加复合肥肥料、植物根际促生菌X1巴氏葡萄球菌(Staphylococcus pasteuri)和植物根际促生菌X2根癌农杆菌(Agrobacterium tumefaciens)作为调控措施.结果显示,紫花苜蓿在同时添加植物根际促生菌X1巴氏葡萄球菌(10.0 mL)和植物根际促生菌X2根癌农杆菌(10.0 mL)作为调控措施的情况下,植物的去除能力最强,去除率可达58.71%;且该实验组植物长势良好,生物量可观,植物体内DDT残留量不高.在权衡各方面因素下,紫花苜蓿和两种植物促生菌X1巴氏葡萄球菌和植物根际促生菌X2根癌农杆菌被认为是效果最好的植物和调控措施组合.
关键词:DDT; 紫花苜蓿; 植物根际促生菌
DDT是一种有机氯农药,属于持久性有机污染物[1-3].研究表明[4-5]我国土壤DDT污染情况比较广泛且严峻,对人体健康造成严重危害,亟需开展污染土壤修复工程.目前植物修复相较于其他修复技术而言,更适合用于现场修复,不仅经济实用、能源消耗少,更对大面积污染区域奏效[6-10].
豆科植物紫花苜蓿(Medicagosativa)具有对有机污染物降解效率高、根系发达等特点,适合用于DDT污染土壤植物修复.但同时也存在修复周期漫长、修复不彻底易残留等不足.据文献可知,肥料可影响土壤中化学成分的变化,激发土壤中微生物的活性,改变土壤的物理性质,影响地上部分植物的生长[11-12].植物根际促生菌(Plant growth promoting rhizobacteria,简称PGPR)能够分泌维生素、生长激素、抗生素,直接或间接地促进植物生长、防止病虫害、增加作物产量,植物可以从中获得营养,也能增强对环境的忍耐能力[13].本研究以紫花苜蓿为供试植物,添加复合肥肥料和两种植物根际促生菌作为调控措施,进行DDT污染土壤植物修复技术的优化研究,以期能为DDT污染土壤的植物修复技术发展提供一定的理论依据.
1材料与方法
1.1实验仪器
紫外可见分光光度计(CRY50 美国里安公司),超声波清洗器(KQ5200DB昆山市超声仪器公司),离心机(TDL-60B上海金鹏分析仪器有限公司),加速溶剂萃取仪(Dionex ASE300美国),旋转蒸发仪(上海荣化玻璃仪器有限公司),固相萃取装置(Supelco SPE装置),Varian CP-3800气相色谱仪(Varian CP-3800美国瓦里安公司)等.
1.2实验药品
硅藻土,丙酮,分析纯正己烷,色谱纯正己烷,浓硫酸,分析纯无水硫酸钠(500 ℃烘2 h,冷却后密封储存备用),脱脂棉等,以上均购于沈阳禹王化学试剂有限公司.DDT标准样品(纯度99.99%,购于国家标准物质研究中心).
1.3实验方案
选取沈阳市某蔬菜基地(N 41°56.206′;E 122°57.300′)田间土壤作为供试土样进行盆栽实验,供试土壤基本理化性质见表1.

表1 供试土壤的基本理化性质
紫花苜蓿作为供试植物,复合肥肥料(磷酸二铵:N-P2O5-K2O,15-42-0,总养分质量分数≥57%)作为调控措施之一(均购于沈阳农业大学富友种子商店),课题组植物根际促生菌X1巴氏葡萄球菌(Staphylococcuspasteuri)和X2根癌农杆菌(Agrobacteriumtumefaciens)作为其他调控措施,配置培养基(活化植物根际促生菌):牛肉膏1.50 g,蛋白胨10.00 g,NaCl 5.00 g,琼脂10.00 g,蒸馏水500 mL,高温灭菌121 ℃,15 min.在洁净工作台上进行菌种转接实验,重复两次,将活化后菌种放置于恒温培养箱中29 ℃培养,8~12 h后用紫外可见分光光度计测量,菌液的吸光值OD分别为X1=1.517,X2=1.518(λ=600 nm,纯水吸光度为0),喷洒至盆栽中.设置不同的实验对照组,进行以下处理:A组,不种植植物的空白盆栽作为对照(CK表示);B3组,仅种植植物(Z表示);C3组,种植植物,并施以复合肥肥料F(Z+F表示);D3组,种植植物,并添加植物根际促生菌X1巴氏葡萄球菌10.0 mL(Z+X1表示);E3组,种植植物,并添加植物根际促生菌X2根癌农杆菌10.0 mL(Z+X2表示);F3组,种植植物,并同时添加植物根际促生菌X1巴氏葡萄球菌10.0 mL和X2根癌农杆菌10.0 mL(Z+X1+X2表示),具体设计如表2所示.
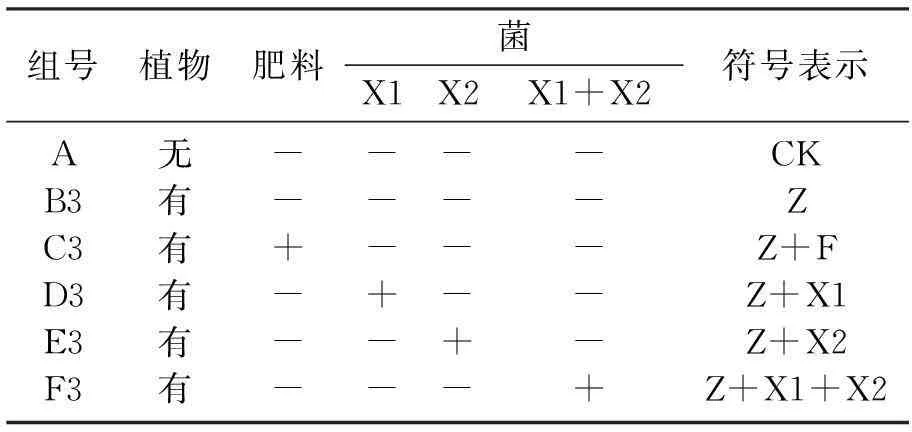
表2 盆栽实验设计
注: -代表不添加处理; +代表添加处理.
每个实验组种植三盆作为平行对照,待植物出苗后选取长势较好的植株保留15株,生长周期设置为60 d,统一处理植物地上部分和地下部分样品,洗净后自然风干用粉碎机粉碎后,过0.25 mm孔径筛,以待上机前前处理.将土壤中的植物根茎、树叶残骸、碎屑垃圾等去除,风干后混匀研磨,过0.25 mm孔径筛,以待上机前前处理.
1.4实验分析方法
采用实验室加速溶剂萃取法提取土壤中DDT.样品萃取:在Dionex ASE300加速溶剂萃取仪的萃取池底部放入纤维滤膜,称取5.00 g待测土壤样品与适量硅藻土混合均匀,置于萃取池中,待进行萃取.萃取条件:以分析纯正己烷与丙酮按1∶1体积比作为萃取溶剂,预热平衡时间5 min,静态萃取温度100 ℃,压力10 342.5 kPa,静态萃取时间5 min,淋洗体积为60%萃取池体积,载气(高纯氮气)吹拖时间100 s,静态萃取2次.收集萃取液至集液瓶,然后将集液瓶中的萃取液移至鸡心瓶中,用5.0 mL丙酮两次润洗,润洗液一并倒入鸡心瓶中,旋转蒸发至近干,用2.0 mL色谱纯正己烷定容,并移至聚四氟乙烯分液漏斗中.
样品净化:向上述分液漏斗加5.0 mL浓硫酸,进行磺化,待静置后上下液面分层,弃去下层无机相浓硫酸溶液,重复上述操作直至上下两相液体均为无色澄清.然后取质量分数为10%的NaCl溶液5.0 mL清洗样品,重复两次.将样品经无水硫酸钠脱水后旋转蒸发至近干,用1.0 mL色谱纯正己烷定容并转移至气相色谱小瓶中,待测.
采用超声萃取法提取植物中DDT.样品萃取:准确称量已粉碎的植物地下/地上部分样品1.00 g,放置于进口离心管中,并加入1.00 g无水硫酸钠.加入15.0 mL分析纯的混合溶剂(V(正己烷):V(丙酮)=4∶1)作为萃取液,超声30 min后,3 000 r/min离心5 min,将上清液转至鸡心瓶中.样品提取重复3次,合并3次萃取液至鸡心瓶中,旋转蒸发至近干,用2.0 mL色谱纯正己烷定容,并将样品倒入聚四氟乙烯分液漏斗中.样品净化同土壤部分实验.土壤和植物样品中DDT的加标回收率分别为86.7%~105.2%和84.9%~110.6%.
1.5数据统计分析
植物对土壤中DDT的去除率(%)=1-植物修复后土壤中DDT的残留质量分数/植物修复前土壤中DDT的残留质量分数;植物对DDT的转运系数(TF)=[地上部分污染物浓度]/[地下部分污染物浓度];植物对DDT的富集系数(BCF)=[植物地上部分污染物浓度]/[土壤中污染物浓度][9,14].所有数据统计分析采用Excel办公软件.
2结果与分析
2.1紫花苜蓿对土壤中DDT的去除率
由紫花苜蓿修复后土壤中DDT的质量分数与原供试土壤中DDT的质量分数之间的对比,可以得出紫花苜蓿在不同的调控措施处理下,各实验组对土壤中DDT的去除率有一定差异.其中F3组(Z+X1+X2)对土壤中DDT的去除率最高,可达58.71%.其他实验组的去除率从大到小排序依次为C3组(Z+F)、D3组(Z+X1)、E3组(Z+X2)、B3组(Z)、A组(CK),分别为55.38%、43.60%、37.72%、30.47%,而A组(CK)的去除率仅为7.68%,如图1所示.王玉红[15]等的研究证明种植紫花苜蓿的土壤中,DDTs含量从0.463~0.238 mg/kg,污染物的去除率大约达到了50%,本实验中紫花苜蓿对DDT的去除率在30.47%~58.71%,与文献的结果相当.
在同时添加两种促生菌X1和X2的处理下,F3组(Z+X1+X2)去除率最高,菌X1和X2的协同作用明显提高了植物的去除能力.在添加复合肥肥料的处理条件下,C3组(Z+F)的去除率也有明显提升.添加菌X1的处理比添加菌X2的处理更能对紫花苜蓿的去除能力起到促进作用.总体来看,同时添加两种菌X1和X2对土壤中DDT的去除率产生的影响最为明显,添加复合肥肥料的效果比单独添加菌X1或X2更明显.
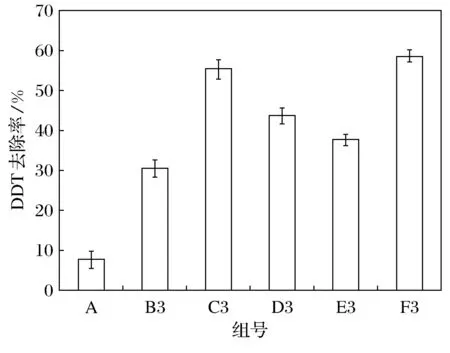
图1 紫花苜蓿对土壤中DDT的去除率
2.2紫花苜蓿生物量
各实验对照组中的紫花苜蓿长势一般,生物量较小,图2所示为紫花苜蓿生物量.其中F3组(Z+X1+X2)的地下部分生物量最大,其他实验组的地下部分生物量从大到小排序依次为C3组(Z+F)、D3组(Z+X1)、B3组(Z)、E3组(Z+X2).各实验对照组中地上部分生物量从大到小的排序与地下部分略有不同,分别为F3组(Z+X1+X2)、C3组(Z+F)、D3组(Z+X1)、E3组(Z+X2)、B3组(Z),具体见图2.
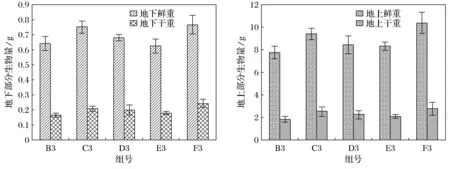
图2 紫花苜蓿生物量
同时添加植物根际促生菌X1和X2的处理对紫花苜蓿生物量的增长起到最为明显的促进作用. 添加复合肥肥料的处理也对紫花苜蓿的生长起到一定的作用, 但是单独植物根际促生菌X1或X2不如肥料的效果明显, 并且菌X2对紫花苜蓿地下部分生物量的影响几乎没有任何意义, 甚至低于不添加任何处理的B3组(Z), 可见添加菌X2对紫花苜蓿的生长不能产生任何促进作用.
2.3紫花苜蓿中DDT残留质量分数
紫花苜蓿地下部分DDT残留质量分数从高到低排序依次为D3组(Z+X1)、B3组(Z)、C3组(Z+F)、F3组(Z+X1+X2)、E3组(Z+X2),见图3.
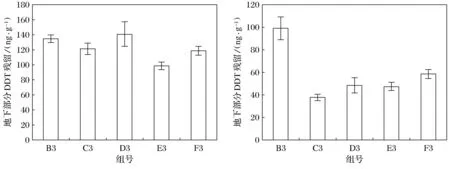
图3 紫花苜蓿中DDT残留量
其中残留质量分数最高的是D3组(Z+X1),为140.842 ng/g;最低的是E3组(Z+X2),为98.981 ng/g.在添加植物根际促生菌X1处理下,紫花苜蓿地下部分DDT残留质量分数最高.
紫花苜蓿地上部分DDT残留质量分数从高到低排序依次为B3组(Z)、F3组(Z+X1+X2)、D3组(Z+X1)、E3组(Z+X2)、C3组(Z+F),见图3.其中残留质量分数最高的是B3组(Z),为99.246 ng/g;最低的是C3组(Z+F),为37.787 ng/g.未添加任何调控措施处理的B3组(Z)的残留质量分数比添加菌剂和肥料的实验组都高,且是其他实验组的两倍左右.添加调控措施的实验组中,添加菌剂实验组的地上部分DDT残留质量分数要高于添加肥料实验组.从整体来看,紫花苜蓿的地下部分残留质量分数要高于地上部分.
不同处理条件下紫花苜蓿对DDT的转运系数存在一定差异,B3组(Z)的转运系数最大,为0.736;C3组(Z+F)的转运系数最小,为0.313,各实验组平均值为0.475,具体如图4所示.不同处理下紫花苜蓿对DDT的富集系数存在一定差异,B3组(Z)的富集系数最大,为0.738;E3组(Z+X2)的富集系数最小,为0.395,各实验组平均值为0.551(图4).
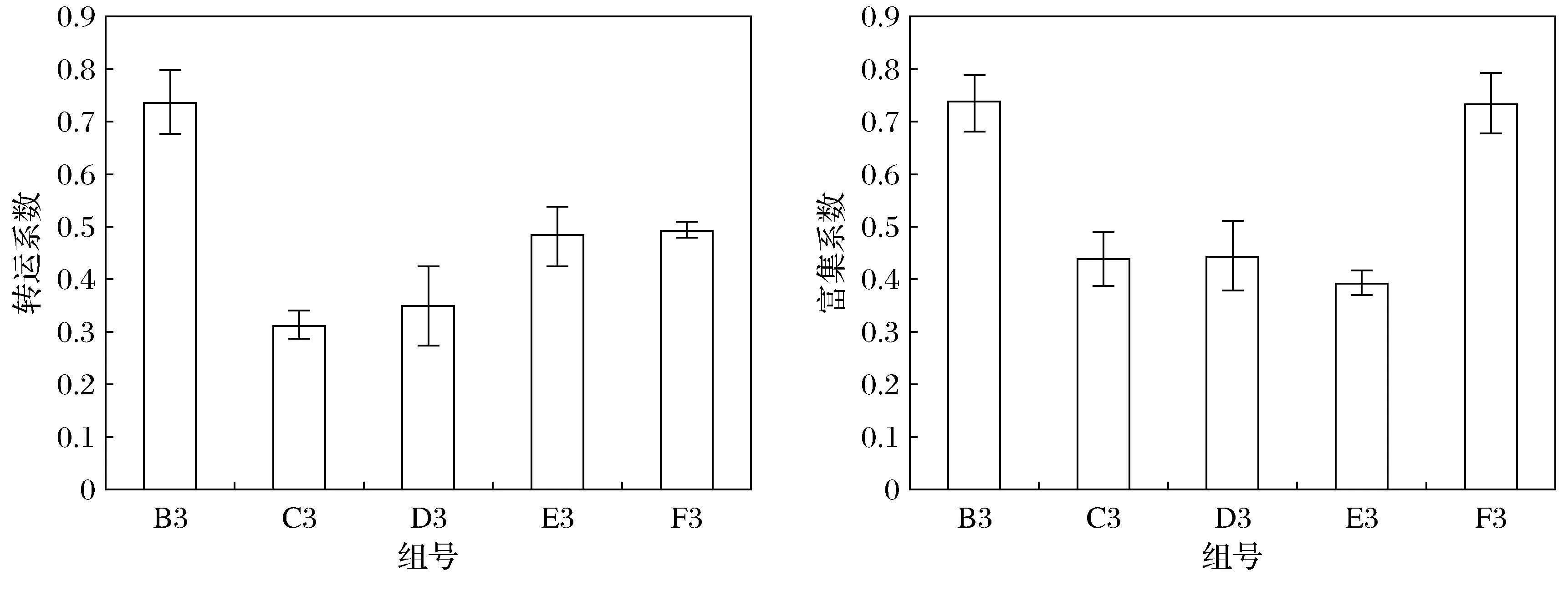
图4 紫花苜蓿转运系数和富集系数
从结果来看,不同处理下紫花苜蓿转运系数均小于1.在未添加任何调控措施处理的情况下,紫花苜蓿的转运系数明显高于其他实验组,紫花苜蓿本身对DDT有一定的转运能力,但转运能力在调控措施的影响下反而弱化.总体而言,紫花苜蓿对DDT的吸收主要固持在植物地下部分.同时发现,未添加任何调控措施的处理和同时添加两种植物根际促生菌X1和X2的处理中,紫花苜蓿的富集系数高于其他实验组.
3讨论
当添加复合肥肥料作为调控措施时,从去除率来看,C3组(Z+F)>B3组(Z).从生物量来看,C3组(Z+F)>B3组(Z).从植物体内DDT残留质量分数来看,B3组(Z)>C3组(Z+F).从转运系数和富集系数来看,B3组(Z)>C3组(Z+F).由此可知,复合肥肥料在提高紫花苜蓿去除率和生物量的方面效果明显,被认为是一种理想的调控措施.
当添加植物根际促生菌作为调控措施时,从去除率来看,F3组(Z+X1+X2)>D3组(Z+X1)>E3组(Z+X2)>B3组(Z),即添加两种菌X1和X2>添加菌X1>添加菌X2>未添加任何菌剂.从生物量来看,F3组(Z+X1+X2)>D3组(Z+X1)>B3组(Z)>E3组(Z+X2),即添加两种菌X1和X2>添加菌X1>未添加任何菌剂>添加菌X2.从植物体内DDT残留质量分数来看,B3组(Z)>D3组(Z+X1)>F3组(Z+X1+X2)>E3组(Z+X2),即未添加任何菌剂>添加菌X1>添加两种菌X1和X2>添加菌X2.从转运系数来看,B3组(Z)>F3组(Z+X1+X2)>E3组(Z+X2)>D3组(Z+X1),即未添加任何菌剂>添加两种菌X1和X2>添加菌X2>添加菌X1.从富集系数来看,B3组(Z)>F3组(Z+X1+X2)>D3组(Z+X1)>E3组(Z+X2),即未添加任何菌剂>添加两种菌X1和X2>添加菌X1>添加菌X2.由此可知对于紫花苜蓿,同时添加两种植物根际促生菌X1和X2是效果最好的菌剂措施.
4结论
(1) 复合肥肥料对紫花苜蓿DDT去除能力有一定的促进作用,同时还可以提高紫花苜蓿的生物量.
(2) 紫花苜蓿+植物根际促生菌X1巴氏葡萄球菌(Staphylococcuspasteuri)和植物根际促生菌X2根癌农杆菌(Agrobacteriumtumefaciens)对DDT污染土壤的去除效果最好,去除率可达58.71%.两种促生菌的协同作用能够提高紫花苜蓿对DDT的去除能力.
参考文献:
[1] 朱治强. Cd-DDT复合污染土壤的植物与微生物联合修复及机理[D]. 杭州:浙江大学, 2012:6-32.
(ZHU Z Q. Plant-microbe remediation of Cd-DDT co-contaminated soils and its mechanisms[D]. Hangzhou: Zhejiang University, 2012:6-32.)
[2] 李宛泽. 滴滴涕污染土壤的植物修复研究[D]. 长春:吉林农业大学, 2007:2-4.
(LI W Z. Study on the phytoremediation of DDT in soil[D]. Changchun: Jilin Agriculture University, 2007:2-4.)
[3] 蒋金会. DDT和DDE降解细菌的筛选和降解特性的研究[D]. 泰安:山东农业大学, 2010:6-24.
(JIANG J H. Isolation, identification and degrading characters of DDT and DDE degrading strain DXZ9[D]. Tai’an: Shandong Agriculture University, 2010:6-24.)
[4] TAO S, XU F, WANG X, et al. Organochlorine pesticides in agricultural soil and vegetables from Tianjin, China[J]. Environmental Science & Technology, 2005,39(8):2494-2499.
[5] BEARD J, COLLABORATION A R. DDT and human health[J]. Science of the Total Environment, 2006,355(1):78-89.
[6] ZHANG H, GAO R, JIANG S, et al. Spatial variability of organochlorine pesticides (DDTs and HCHs) in surface soils of farmland in Beijing, China[J]. Scientia Agricultura Sinica, 2006,39(7):1403-1410.
[7] 周际海,袁颖红,朱志保,等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015,24(2):343-351.
(ZHOU J H, YUAN Y H, ZHU Z B, et al. A review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environmental Sciences, 2015,24(2):343-351.)
[8] 李玉双,胡晓钧,侯永侠,等. 利用白菜修复污灌区重金属污染土壤的螯合诱导植物修复技术[J]. 沈阳大学学报(自然科学版), 2014,26(1):9-13.
(LI Y S, HU X J, HOU Y X, et al. Chelate-induced phytoextraction of heavy metal contaminated soil of irrigation area by cabbage[J]. Journal of Shenyang University (Natural Science), 2014,26(1):9-13.)
[9] WHITE J C, PARRISH Z D, LSLEYEN M, et al. Uptake of weathered p, p′-DDE by plant species effective at accumulating soil elements[J]. Microchemical Journal, 2005,81(1):148-155.
[10] 安凤春,莫汉宏,郑明辉,等. DDT及其主要讲解产物污染土壤的植物修复[J]. 环境化学, 2003,22(1):19-24.
(AN F C, MO H H, ZHENG M H, et al. Phytoremediation of DDT and its main degradation product-contaminated soil using grass[J]. Environmental Chemistry, 2003,22(1):19-24.)
[11] LUPWAYI N, HAQUE I, HOLL F. Strain-specific response of Trifolium semipilosum to inoculation with Rhizobium and the significance of waterlogging in vertisols[J]. The Journal of Agricultural Science, 1997,129(4):439-446.
[12] 李云辉,文荣联,莫测辉. 土壤有机污染的植物修复研究进展[J]. 广东农业科学, 2007(12):96-98.
(LI Y H, WEN R L, MO C H. Advances in phytoremediation of organic pollutants in soil[J]. Guangdong Agriculture Science, 2007(12):96-98.)
[13] 杨婷,林先贵,胡君利,等. 丛枝菌根真菌对紫花苜蓿与黑麦草修复多环芳烃污染土壤的影响[J]. 生态与农村环境学报, 2009,25(4):72-76.
(YANG T, LIN X G, HU J L, et al. Effects of Arbuscular Mycorrhizal Fungi on Pyutoremediation of PAHs-contaminated soil by Medicago sativa and Lolium muhiflorum[J]. Journal of Ecology and Rural Environment, 2009,25(4):72-76.)
[14] SUN Y B, ZHOU Q X, AN J, et al. Chelator-enhanced phytoextraction of heavy metals from contaminated soil irrigated by industrial wastewater with the hyperaccumulator plant (Sedum alfredii Hance)[J]. Geoderma, 2009,150(1):106-112.
[15] 王玉红. 紫花苜蓿(Medicagosativa)对有机氯农药DDT污染土壤的修复研究[D]. 南京:南京林业大学, 2006:15-30.
(WANG Y H. Remediation of DDTs-contaminated soil byMedicagosativa[D]. Nanjing: Nanjing Forestry University, 2006:15-30.)
【责任编辑: 曹一萍】
Phytoremediation of DDT-Contaminated Soil byMedicagosativa
LiSiwen,LiPeng,SunLina,ZhengDongmei
(Key Laboratory of Regional Environment and Eco-Remediation, Ministry of Education, Shenyang University, Shenyang 110044, China)
Abstract:Phytoremediation of DDT-contaminated soil by Medicago sativa is studied. Compound fertilizer, Staphylococcus pasteuri, Agrobacterium tumefaciens are taken as adjustment measures. The results show that the best combination of plant and adjustment measures is Medicago sativa with Staphylococcus pasteuri (10.0 mL) and Agrobacterium tumefaciens(10.0 mL), and the removal rate of the best combination could reach up to 58.71%. Because of the strong removal capacity, the vigorous growth, the tremendous biomass and the nethermore residual quantity, Medicago sativa with Staphylococcus pasteuri and Agrobacterium tumefaciens can be used as the best combination.
Key words:DDT; Medicago sativa; plant growth promoting rhizobacteria
中图分类号:X 53
文献标志码:A
文章编号:2095-5456(2016)02-0105-06
作者简介:李思雯(1990-),女,辽宁开原人,沈阳大学硕士研究生; 李鹏(1958-),男,天津人,沈阳大学教授,博士生导师; 孙丽娜(1960-),女,辽宁北票人,沈阳大学教授,博士生导师.
基金项目:国家重点基础研究计划项目(2014CB441106).
收稿日期:2015-11-10
