二唑类熔铸炸药载体的分子设计
2016-05-09王建华刘玉存张晓玉常双君于雁武荆苏明
闫 涛, 王建华, 刘玉存, 张晓玉, 黄 明, 常双君, 于雁武, 荆苏明
(1. 中北大学化工与环境学院, 山西 太原 030051; 2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621999)
1 引 言
熔铸炸药由于性能优良,制造简单以及装药方便等优势而成为应用最广泛的一类军用混合炸药,占军用混合炸药的90%以上[1]。目前传统TNT基熔铸炸药已不能满足武器火力系统作战能力的发展,需要进一步提高熔铸炸药的能量水平和安全性,寻找替代TNT的新型低熔点炸药[2]。目前对于新型炸药的研究仍然沿袭传统的“尝试-失败-再尝试”模式来寻找合适的炸药分子,随机性较大,且筛选出符合要求的炸药的工作量很大。将分子设计引入到现代炸药的研究中,可大大提高新型炸药的合成效率[3]。王伯周等[4]针对呋咱醚类含能化合物开展了分子设计,随后王锡杰等[5]在此基础上对三呋咱并氧杂环庚三烯进行了合成表征与量子化学研究。另外,南京理工大学采用计算机辅助研究技术开展了新型高能氮杂环化合物[6]和高氮笼状化合物[7]的分子设计。熔点和分解温度是决定炸药能否成为熔铸炸药载体的重要参考指标,其中熔点是炸药分子微观结构及分子间相互作用强弱的外在表现,是决定炸药实际应用进程的主要因素之一。基于炸药铸装和成型工艺的要求,熔铸炸药载体的熔点一般不超过110 ℃,80~90 ℃为最佳,以便采用蒸汽熔化炸药; 载体炸药在温度高于熔点20~25 ℃时,应具有较强的安定性[8]。目前有关炸药熔点的理论研究主要集中于熔点预测模型的建立[9- 10],而怎样选取合适的取代基团、连接基团和氮杂环进行合理有效的组合,并筛选出具有性能良好且稳定性高的体系仍然是一项难题。
杂环分子由于在提高炸药的耐热性和降低炸药的机械感度等方面的优势[11],被考虑引入到炸药分子设计的过程中。其中二唑类氮杂环含能化合物具有能量高感度低以及与其它炸药相容性好等优点,逐渐成为新兴高能密度材料领域的研究焦点,但已有合成报道的咪唑和吡唑氮杂环类含能化合物的种类还较少[12]。本研究探讨了分子结构对二唑类化合物熔点的影响,提出了低熔点二唑类熔铸炸药载体在设计过程中需要注意的问题,总结归纳了不同结构单元与取代基团对炸药熔点的影响规律。同时,设计出7种新型低熔点炸药分子,并对目标分子的爆轰性能进行预估,为新型熔铸炸药的合成研究提供依据。
2 二唑类熔点影响因素分析
在一定压力下,晶体融化过程是晶相向液相转化的热力学平衡过程,全过程自由能是恒定不变的。可用以下的热力学函数关系来描述:
ΔGm=ΔHm-TmΔSm
(1)
平衡时,ΔGm=0,公式(1)转化为:
(2)
即熔点可以看做是熔融热(ΔHm)和熔融熵(ΔSm)的函数,二者都与分子的化学结构有关。当ΔSm一定时,分子间作用力越大,ΔHm越大,Tm越高; 当ΔHm一定时,熔融前后混乱程度越大,ΔSm越大,Tm越低。其中ΔH取决于分子中原子和基团的分子间相互作用,数值上等于相互吸引的两个分子间作用力的总和,主要为范德华力和氢键力,不同分子内原子和基团对这种作用力的贡献值不同[13]。一般情况下,烃基之间的相互作用力比较弱,相对应的ΔHm贡献值也比较低。而在分子中引入极性基团或可以形成氢键的基团,可使ΔHm增大,提高熔点。在杂环体系上引入—NH2可与炸药中—NO2里的氧原子形成氢键,C—H键一般不能构成氢键。由于含有分子间氢键的化合物在融化的过程中要克服巨大的非键力,导致熔点比没有氢键时的同类型化合物为高,这是含有—NH2的炸药熔点普遍比较高的原因[14]。但是由于氢键具有饱和性和方向性等特征,熔点的高低还与形成氢键的强度有关,所以并不是任意位置的—NH2都能够使熔点升高。ΔSm与分子中基团构成的排布情况有关,还与分子运动、分子和原子的能级状态有关。在从晶相变成液相的过程中,分子的多种运动形式(平动、振动和转动等)会引起分子的瞬间变形以及空间位置和方向的变化,导致微观状态数目的增大,进而导致熵增。由于纯物质在液相状态时的各项同性,要想增大ΔSm需尽可能选取晶相结构有序且在两相中混乱度差异较大的取代基,避免引入庞大的刚性取代基如苯基、苦基等。此外,增加分子结构的对称性和规整性,可使熔融过程中ΔSm减小,提高熔点[15],所以要避免设计对称性较高的联二唑类化合物和并二唑类化合物。
由于分子间氢键对熔点的影响较大,—CH3取代基由于本身极性较小,不易形成氢键等特点被优先考虑引入分子中,而在引入—NH2时需要考虑不同位置氨基对分子结构的影响。此外—CN、—N3、—NNO2CH3等取代基由于本身极性较小也可以成为候选取代基团。
3 咪唑类炸药分子结构与熔点之间的关系
3.1 咪唑的结构与化学性质
咪唑(结构式如图1所示)具有芳香性,6电子共轭体系分布在5个原子上。碳原子和N(3)各提供了一个电子,N(1)为6π电子体系贡献了两个电子,从而引起了整个分子体系环流的微扰激变,使得分子内原子间作用力更加强烈,稳定了π体系[16]。从核磁共振谱可看出,π 电子离域化程度很大,但主要集中在氮原子上。硝化等亲电取代反应发生在电子云密度较大的C(4)或C(5)上,亲核进攻则发生在π电子云密度小于1的2-位碳上,且速度较慢,需要剧烈的反应条件,用混酸硝化咪唑时,硝酰阳离子NO2+进攻咪唑的C(4)、C(5)位优于C(2)位,而当咪唑的4-位或5-位上有硝基存在时能提高C(2)位亲核反应活性[17]。
图1咪唑结构式
Fig.1Structure of imidazole
硝基咪唑类含能材料具有生成热高、感度较低、热稳定性好和密度较高等特点[18]。目前在含能领域研究主要为硝基咪唑类化合物,如2,4-二硝基咪唑(2,4-DNI)[18],4,5-二硝基咪唑(4,5-DNI)[19], 2,4,5-三硝基咪唑(2,4,5-TNI)[20]。这类化合物的—NH上可以发生甲基化、胺化、偶氮化、离子化等多种反应[16],是构建新型炸药的重要结构单元,它们的甲基化产物如1-甲基-2,4,5-三硝基咪唑(MTNI)[21]和1-甲基-4,5-二硝基咪唑(MDNI)[22],因其钝感低熔的特性有望替代TNT。
3.2 取代基对单咪唑类含能化合物熔点的影响
取代基对单咪唑类含能化合物熔点的影响列于表1。从表1可以看出,硝基咪唑及其含能衍生物存在以下几种现象: (1)硝基咪唑的甲基取代物熔点普遍较低,尤其是咪唑的1-位被甲基取代。通过比较化合物2、5和3、6和4、7的熔点可知,1-位引入一个甲基熔点降低2~3倍,降低程度的大小与硝基取代基的个数没有关系。(2)在2-位引入硝基后,熔点要比其他相同数量不同位置的硝基取代基的物质熔点高; (3)通过观察表1可知在1-甲基-2,4-二硝基咪唑的基础上,在5-位引入—NH2会使熔点发生较大幅度的增加,而—N3、—NHCH3和—NO2能够不同程度降低熔点。这是因为在咪唑环上引入氨基后,可以与相邻硝基氧原子形成分子内氢键,也可以与相邻分子中硝基氧原子形成分子间氢键,使整个分子接近平面结构,缩短分子间距而使堆积系数升高,使分子间的晶格能增加,导致熔点增加。同时,由于氨基是强供电子基团,它的电子诱导效应可使芳香环获得额外的电子云密度,可以提高分子的稳定性[23]。
表1取代基对咪唑类含能化合物熔点的影响
Table1Effect of substituting group on imidazole energetic compounds melting point
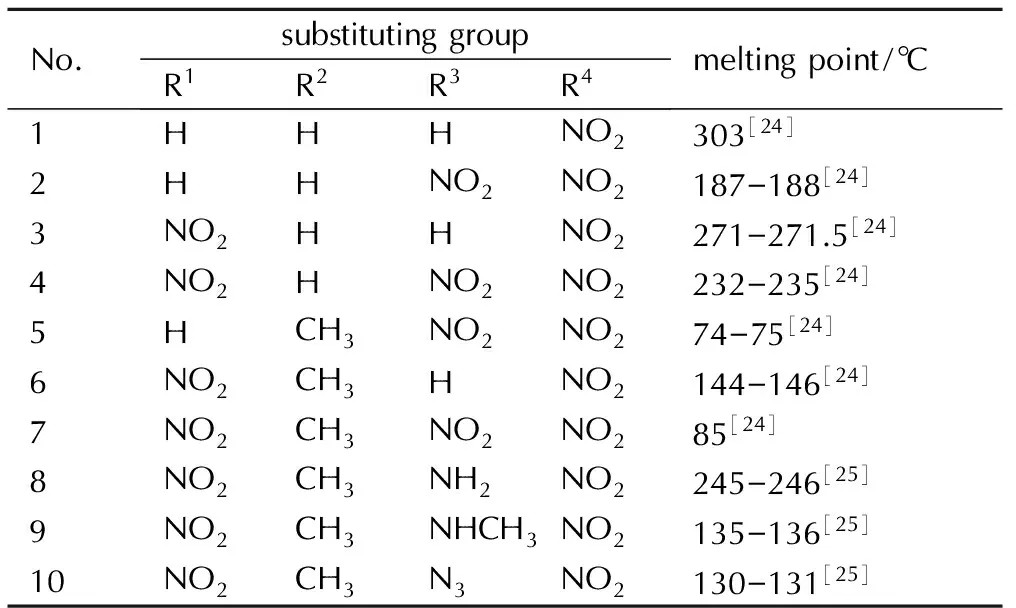
No.substitutinggroupR1R2R3R4meltingpoint/℃1HHHNO2303[24]2HHNO2NO2187-188[24]3NO2HHNO2271-271.5[24]4NO2HNO2NO2232-235[24]5HCH3NO2NO274-75[24]6NO2CH3HNO2144-146[24]7NO2CH3NO2NO285[24]8NO2CH3NH2NO2245-246[25]9NO2CH3NHCH3NO2135-136[25]10NO2CH3N3NO2130-131[25]
3.3 取代基对联咪唑类含能化合物熔点的影响
联咪唑(结构式如图2所示)是通过C—C键将两个咪唑环连在一起,含氮量高达 41.18%,具有较强的质子接受和给予性,可以在联咪唑的基础之上引入硝基,合成新的能量更高的化合物,因此联咪唑是作为含能材料的良好母环。取代基对联咪唑类含能化合物熔点的影响列于表2。观察表2可知2,2′-联咪唑熔点大于300 ℃,这是因为联咪唑既可以作为氢键的受体,又可以作为氢键的供体,分子间的氢键使其熔点较高[26]。通过比较其他联咪唑含能化合物的熔点,发现随着1-位甲基数量的增多,熔点越来越低,尤其是引入第一个甲基熔点下降的幅度要比第二个大得多。同时,当联咪唑硝基化合物上仅有一个1-位甲基时,其熔点比较高,熔点范围为200~300 ℃,而且取代基配置越均匀熔点越高,这些规律验证了关于联二唑类化合物对熔点影响的相关讨论。虽然甲基等取代基团的引入能够有效地降低熔点,但是从熔铸炸药载体的要求来看,联咪唑类含能化合物的熔点整体偏高。
图2联咪唑结构式
Fig.2Structure of biimidazole
表2取代基对联咪唑类含能化合物熔点的影响
Table2Effect of substituting group on biimidazole energetic compounds melting point
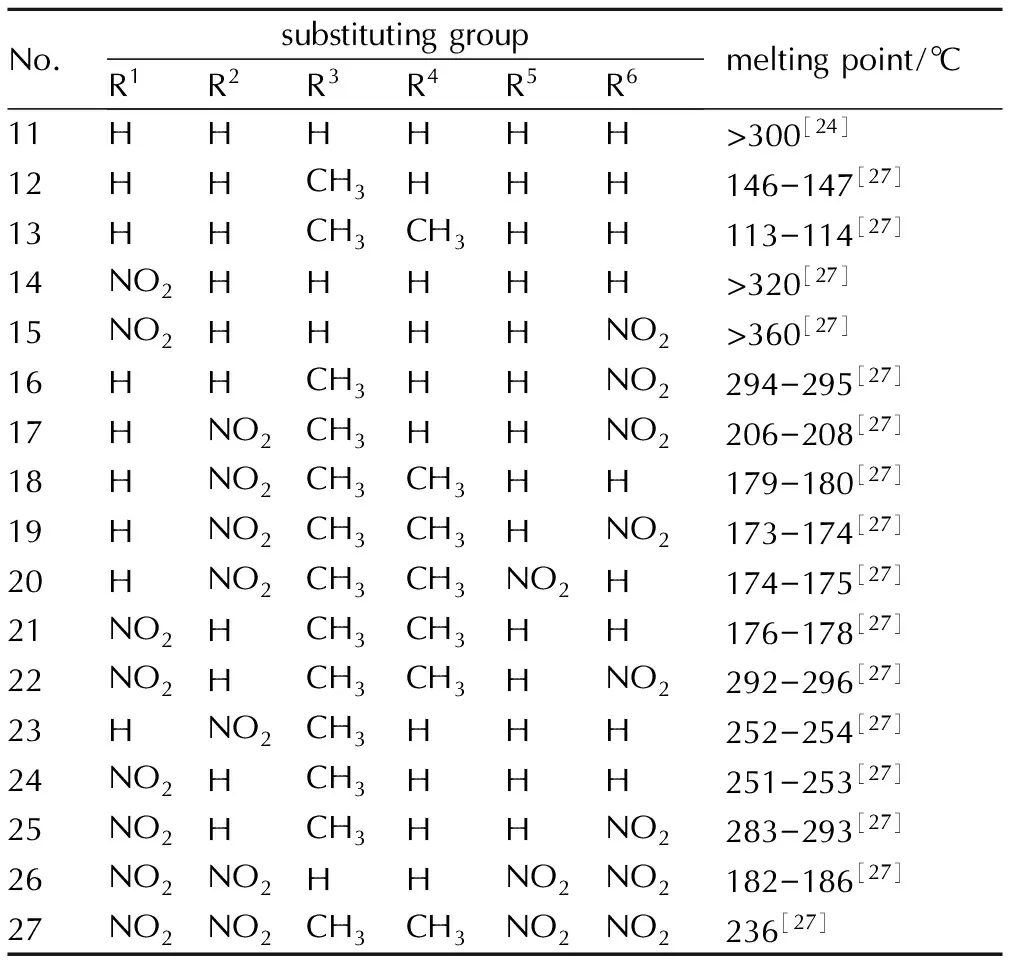
No.substitutinggroupR1R2R3R4R5R6meltingpoint/℃11HHHHHH>300[24]12HHCH3HHH146-147[27]13HHCH3CH3HH113-114[27]14NO2HHHHH>320[27]15NO2HHHHNO2>360[27]16HHCH3HHNO2294-295[27]17HNO2CH3HHNO2206-208[27]18HNO2CH3CH3HH179-180[27]19HNO2CH3CH3HNO2173-174[27]20HNO2CH3CH3NO2H174-175[27]21NO2HCH3CH3HH176-178[27]22NO2HCH3CH3HNO2292-296[27]23HNO2CH3HHH252-254[27]24NO2HCH3HHH251-253[27]25NO2HCH3HHNO2283-293[27]26NO2NO2HHNO2NO2182-186[27]27NO2NO2CH3CH3NO2NO2236[27]
4 吡唑类炸药分子结构与熔点之间的关系
吡唑(结构式如图3所示)和咪唑一样具有芳香性,其中N—N键是吡唑环中最弱的键,3-位和4-位之间的C—C键最长[17]。吡唑能进行亲电取代反应,优先发生在3-位和5-位,但由于第二个氮原子的引入相当于在环上增加了一个吸电子基,使得环碳原子的π电子云密度都有所降低,但当环上有推电子基时,反应条件可降低。例如当 4-位上有推电子基—CH3时,在温度为70 ℃时即可硝化成3-甲基-4-硝基吡唑。可见,当吡唑环上的电子云密度发生改变时,提高了环的亲电取代反应能力[28]。吡唑类含能化合物常见的取代基团主要有硝基、氨基和甲基等,它们对吡唑类化合物熔点的影响不同。
图3吡唑结构式
Fig.3Structure of pyrazole
4.1 硝基对吡唑类含能化合物熔点的影响
在硝基吡唑中,硝基的数量对熔点的影响远没有取代位置的影响大。硝基对吡唑类含能化合物熔点的影响列于表3。由表3中硝基吡唑1、5、7和2、6、7相比较,在3-硝基吡唑的5-位上引入硝基后,熔点变化幅度很小,接着在4-位再引入一个硝基,熔点增加了15 ℃左右; 而在4-硝基吡唑的3-位引入硝基后,熔点降低接近一倍,接着在5-位引入硝基熔点反而升高100 ℃以上。而分析比较不同取代位置的硝基吡唑化合物可知硝基位于1-位时熔点较低,4-位其次,这是在设计吡唑类低熔点化合物时需要注意的。
表3硝基对吡唑类含能化合物熔点的影响
Table3Effect of nitro on pyrazole energetic compounds melting point
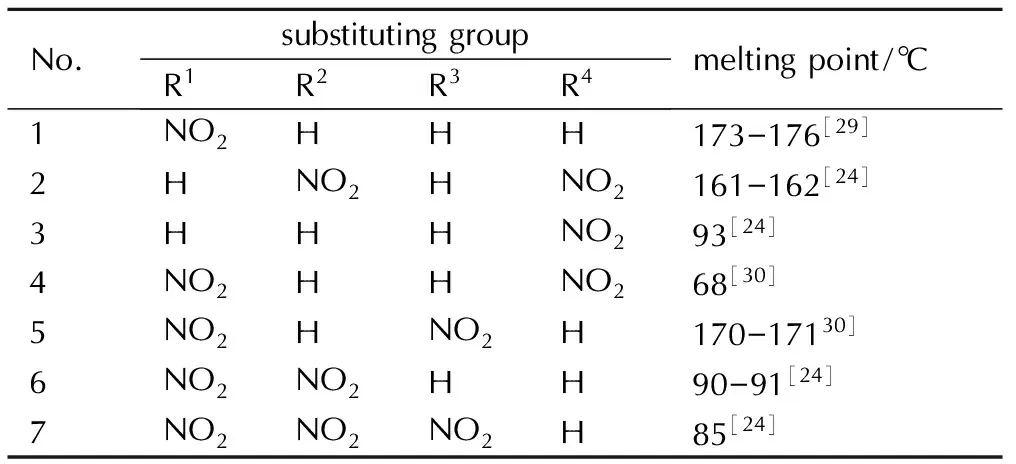
No.substitutinggroupR1R2R3R4meltingpoint/℃1NO2HHH173-176[29]2HNO2HNO2161-162[24]3HHHNO293[24]4NO2HHNO268[30]5NO2HNO2H170-17130]6NO2NO2HH90-91[24]7NO2NO2NO2H85[24]
4.2 甲基和氨基对吡唑类含能化合物熔点的影响
甲基和氨基对吡唑类含能化合物熔点的影响分别列于表4和表5。对由表4可知,炸药分子中含有甲基熔点普遍较低,但是并不是甲基的数量越多熔点越低,这与甲基的位置以及其它取代基有关。含有1-位甲基取代基的吡唑类化合物熔点普遍较低,这和咪唑类化合物的熔点规律一致,推测可能与两种物质的分子内原子电场有关。从电子云密度可以看出,二者在1-位氮原子上的电子云密度都比较大(大于1.5[17]),可能在具有电子云密度排布相似性的原子上引入相同的取代基可能导致物化性质改变的相似性。同时从表5显示的熔点来看,吡唑类含能化合物在1-位氮原子上引入氨基时熔点也普遍较低,所以单从结构与性能之间的构效关系来看,吡唑类含能化合物在1-位引入氨基也能降低熔点,但是氨基咪唑类含能材料的熔点还要受到氢键等其他因素的影响。而且氨基的位置对熔点的影响也比较大,例如10、25、26和31等氨基吡唑衍生物的熔点在同类型取代基化合物中熔点最高。
表4甲基对吡唑类含能化合物熔点的影响
Table4Effect of methyl on pyrazole energetic compounds melting point
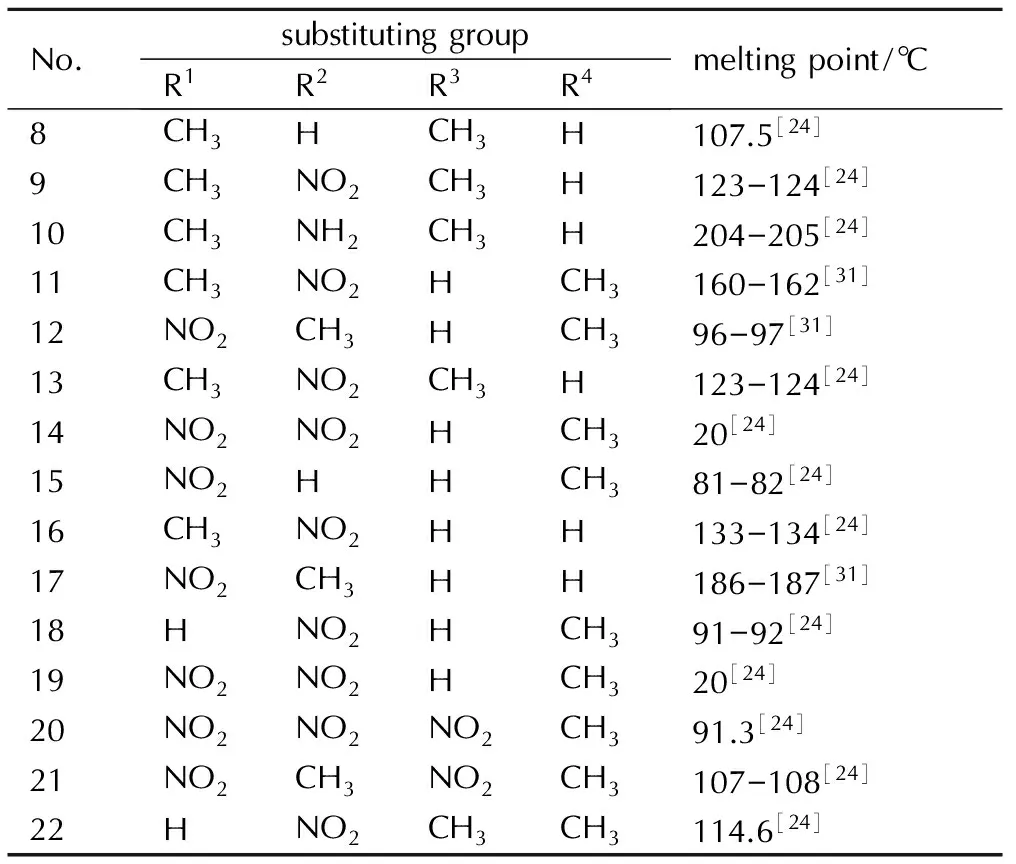
No.substitutinggroupR1R2R3R4meltingpoint/℃8CH3HCH3H107.5[24]9CH3NO2CH3H123-124[24]10CH3NH2CH3H204-205[24]11CH3NO2HCH3160-162[31]12NO2CH3HCH396-97[31]13CH3NO2CH3H123-124[24]14NO2NO2HCH320[24]15NO2HHCH381-82[24]16CH3NO2HH133-134[24]17NO2CH3HH186-187[31]18HNO2HCH391-92[24]19NO2NO2HCH320[24]20NO2NO2NO2CH391.3[24]21NO2CH3NO2CH3107-108[24]22HNO2CH3CH3114.6[24]
表5氨基对吡唑类含能化合物熔点的影响
Table5Effect of amino on pyrazole energetic compounds melting point
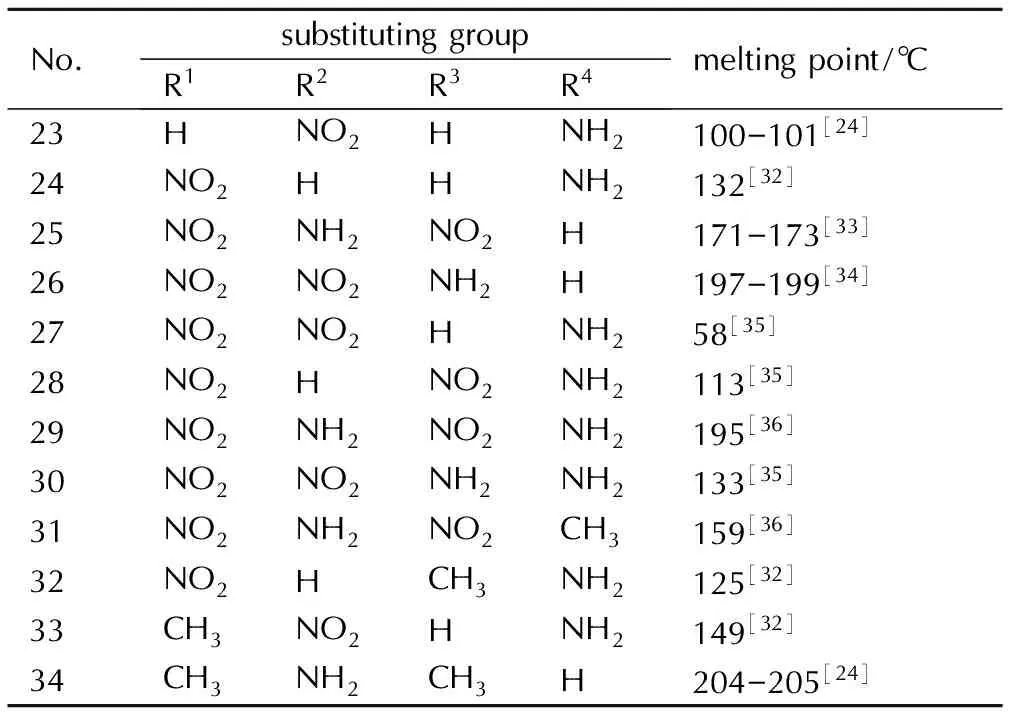
No.substitutinggroupR1R2R3R4meltingpoint/℃23HNO2HNH2100-101[24]24NO2HHNH2132[32]25NO2NH2NO2H171-173[33]26NO2NO2NH2H197-199[34]27NO2NO2HNH258[35]28NO2HNO2NH2113[35]29NO2NH2NO2NH2195[36]30NO2NO2NH2NH2133[35]31NO2NH2NO2CH3159[36]32NO2HCH3NH2125[32]33CH3NO2HNH2149[32]34CH3NH2CH3H204-205[24]
4.3 其它取代基对吡唑类含能化合物熔点的影响
其它取代基对吡唑类含能化合物熔点的影响列于表6。从表6可以看出,除了—NO2、—NH2和—CH3以外,将—CN、—N3、—NNO2CH3等取代基引入吡唑环中也可以较小幅度的降低熔点。甲硝胺类吡唑含能化合物的熔点较低可能是因为—NNO2CH3中甲基与硝基对熔点的影响,与—NO2吸电子能力比较接近的—CN对熔点的贡献值与—NO2相似,略小于—N3。此外,比较36和38两种吡唑类化合物可知当—N3位于4-位时熔点要比5-位时低。
表6其他取代基对吡唑类含能化合物熔点的影响
Table6Effect of other substituting group on pyrazole energetic compounds melting point
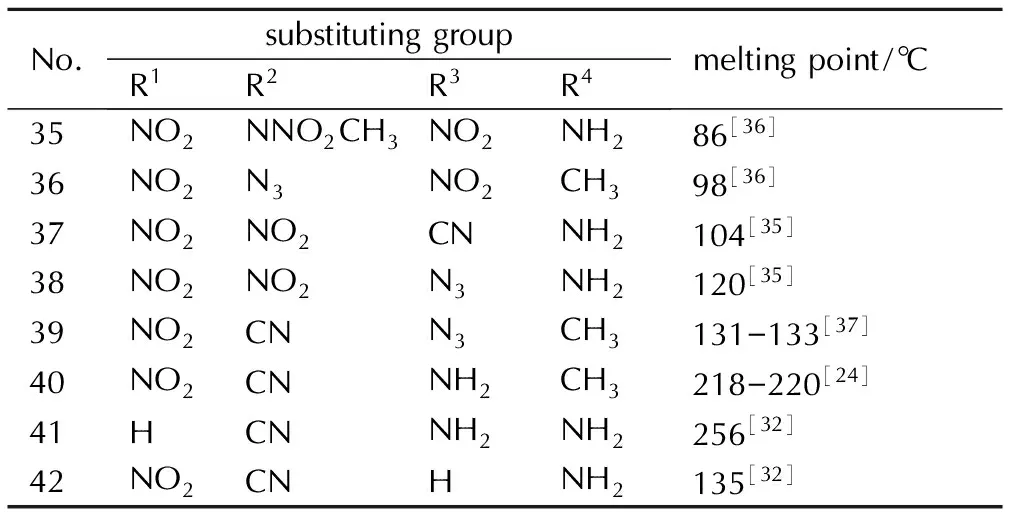
No.substitutinggroupR1R2R3R4meltingpoint/℃35NO2NNO2CH3NO2NH286[36]36NO2N3NO2CH398[36]37NO2NO2CNNH2104[35]38NO2NO2N3NH2120[35]39NO2CNN3CH3131-133[37]40NO2CNNH2CH3218-220[24]41HCNNH2NH2256[32]42NO2CNHNH2135[32]
4.4 新型吡唑类含能化合物的设计与性能预估
以吡唑环为基本结构单元,设计了7种低熔点吡唑类含能化合物结构,并对炸药分子的熔点采用公式(3)[10]进行了预估,具体设计化合物化学结构、预测熔点、密度以及爆轰参数见表7。
Tm(K)= 326.9+5.524a+2.646b+14.60c-2.130d+
101.1TIn,m+68.08TDe,m
(3)
式中,a,b,c,d分别是C,H,O和N原子的个数,TIn,m和TDe,m分别代表了不同母体结构和分子结构中硝基、氨基、甲基等取代基团的不同位置和数量关系对熔点的贡献值。从表7可以看出1-氨基-3,4,5-三硝基吡唑相比TNT具有密度大、能量高的优点,显示出了良好的应用前景。
表7设计炸药的分子结构和计算的爆轰性能
Table7Molecular structures and calculated detonation performance of designed explosives
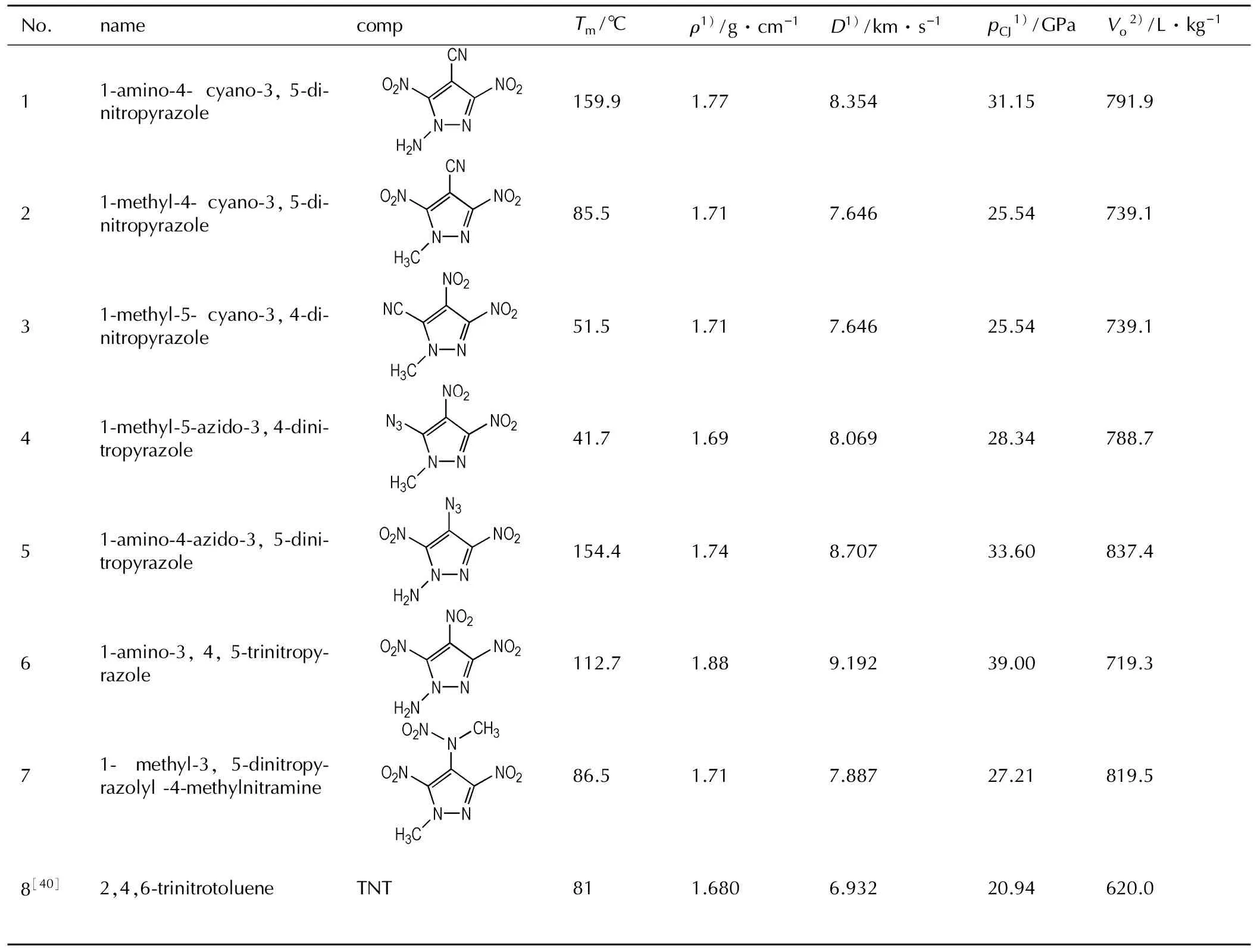
No.namecompTm/℃ρ1)/g·cm-1D1)/km·s-1pCJ1)/GPaVo2)/L·kg-111⁃amino⁃4⁃cyano⁃3,5⁃di⁃nitropyrazole159.91.778.35431.15791.921⁃methyl⁃4⁃cyano⁃3,5⁃di⁃nitropyrazole85.51.717.64625.54739.131⁃methyl⁃5⁃cyano⁃3,4⁃di⁃nitropyrazole51.51.717.64625.54739.141⁃methyl⁃5⁃azido⁃3,4⁃dini⁃tropyrazole41.71.698.06928.34788.751⁃amino⁃4⁃azido⁃3,5⁃dini⁃tropyrazole154.41.748.70733.60837.461⁃amino⁃3,4,5⁃trinitropy⁃razole112.71.889.19239.00719.371⁃methyl⁃3,5⁃dinitropy⁃razolyl⁃4⁃methylnitramine86.51.717.88727.21819.58[40]2,4,6⁃trinitrotolueneTNT811.6806.93220.94620.0
Note: 1) Caulculated by using methods from Ref.[38]; 2) Caulculated by using methods from Ref.[39]; 3)Tmis the calculated melting point by using formula (3),ρis the calculated desity,Dis the calculated detonation velocity,pCJis the calculated detonation pressure,Vois the calculated detonation volume.
5 结 论
熔点是界定、研究炸药分子及其使用过程的一个重要参考指标, 它受到炸药分子结构和分子间相互作用力的影响,结构中基团种类及数量、基团配置及排列方式等都有很大影响。首先,含有甲基的二唑类炸药熔点普遍比较低,而且甲基的位置对熔点的影响比数量更大,尤其当甲基位于二唑类含能化合物的1-位时,其熔点都是同类型化合物中熔点最低的; 其次,除了位于吡唑环的1-位以外,含有氨基的二唑类炸药分子熔点普遍比较高,这与氨基能够形成分子内和分子间氢键影响了分子间作用力有关; 另外,炸药分子的对称性和配置均匀性都会不同程度的影响炸药的熔点。在联咪唑类含能化合物中,取代基团具有一定配置均匀性时熔点一般较高。
设计出7种吡唑类硝基含能化合物,并采用经验公式预估了其熔点、密度及爆轰性能。其中,1-氨基-3,4,5-三硝基吡唑和1-甲基-3,5-二硝基吡唑基-4-甲硝胺两种吡唑类含能化合物预测熔点分别为112.7 ℃和86.5 ℃,其爆轰性能均优于TNT,爆速达7800 m·s-1以上,有望成为替代TNT的新型熔铸炸药载体。
参考文献:
[1] 曹端林, 李雅津, 杜耀, 等. 熔铸炸药载体的研究评述[J]. 含能材料, 2013, 21(2): 157-165.
CAO Duan-lin, LI Ya-jin, DU Yao, et al. Review on carriers for melt-cast explosives[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2013, 21(2): 157-165.
[2] 张光全, 黄明. 低熔点钝感高能炸药(IHE)的发展探讨[J]. 含能材料, 2015, 23(2): 103-105.
ZHANG Guang-quan, HUANG Ming. Discussion of research on the low melting insensitive high explosive (IHE)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2015, 23(2): 103-105.
[3] 黄辉. 钝感高能炸药研究进展[R]. 中国工程物理研究院科技年报, 2013: 3-8.
HUANG Hui. Research on the progress of insensitive high explosives[R]. Chinese Academy of Engineering Physics Technology Report, 2013: 3-8.
[4] 王伯周, 李辉, 李亚南, 等. 呋咱醚含能化合物研究进展[J]. 含能材料, 2012, 20(4): 385-390.
WANG Bo-zhou, LI Hui, LI Ya-nan, et al. Review on energetic compounds based on furoxanyl ether[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(4): 385-390.
[5] 王锡杰, 尉涛, 廉鹏, 等. 环状含能呋咱醚三呋咱并氧杂环庚三烯合成表征与量子化学研究[C] ∥2014′含能材料与钝感弹药技术研讨会, 四川,成都, 2014.
WANG Xi-jie, WEI Tao, LIAN Peng, et al. Synthesis, characterization and crystal structure study on an energetic cyclic furazan ether trifurazanooxacycloheptatriene[C]∥2014′Energetic Materials and Insensitive Munitions Technology Symposium, Chengdu, Sichuan, China, 2014.
[6] 夏雪兰. 新型高能氮杂环化合物的分子设计[D]. 南京: 南京理工大学, 2013.
XIA Xue-lan. Molecular designs of new energetic nitrogen-containing heterocycle compounds[D]. Nanjing: Nanjing University of Science&Technology, 2013.
[7] 张建英. 有机笼状化合物的分子设计与性质研究[D]. 南京: 南京理工大学, 2013.
ZHANG Jian-ying. Molecular design and theoretical study on organic cage compounds[D]. Nanjing: Nanjing University of Science&Technology, 2013.
[8] 郑保辉, 罗观, 舒远杰, 等. 熔铸炸药研究现状与发展趋势[J]. 化工进展, 2013, 32(6): 1341-1346.
ZHENG Bao-hui, LUO Guan, SHU Yuan-jie, et al. Research status and prospect of melt-cast explosive[J].ChemicalIndustryandEngineeringProgress, 2013, 32(6): 1341-1346.
[9] Keshavarz M H, Zakinejad S, Esmailpour K. An improved simple method for prediction of entropy of fusion of energetic compounds[J].FluidPhaseEquilibria, 2013, 340: 52-62.
[10] Keshavarz M H. A new computer code for prediction of enthalpy of fusion and melting point of energetic materials[J].Propellants,Explosives,Pyrotechnics, 2015, 40(1): 150-155.
[11] 张雪娇, 李玉川, 刘威, 等. 三嗪类含能化合物的研究进展[J]. 含能材料, 2012, 20(4): 491-500.
ZHANG Xue-jiao, LI Yu-chuan, LIU Wei, et al. Review on triazines energetic compounds[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(4): 491-500.
[12] 殷明. 唑类氮杂环化合物结构与性能关系的理论研究[D]. 绵阳: 中国工程物理研究院, 2009.
YIN Ming. Theoretical study on structure and performance of azole N heterocycle compounds[D]. Mianyang: Chinese Academy of Engineering Physics, 2009.
[13] Pinal R. Effect of molecular symmetry on melting temperature and solubility[J].Organic&BiomolecularChemistry, 2004, 2(18): 2692.
[14] Yalkowsky S H. Carnelley′s rule and the prediction of melting point[J].JournalofPharmaceuticalSciences, 2014, 103(9): 2629-2634.
[15] Brown R J C, Brown R F C. Melting point and molecular symmetry[J].JournalofChemicalEducaton, 2000, 77(6): 724-731.
[16] 王秀玲. 1-苦基硝基咪唑衍生物的合成研究[D]. 南京: 南京理工大学, 2012.
WANG Xiu-ling. Study on the synthesis of 1-picrylnitroimidazole derivatives[D]. Nanjing: Nanjing University of Science & Technology, 2012.
[17] 艾歇尔T, 豪普特曼. 杂环化学——结构、反应、合成与应用[M]. 李润涛, 葛泽梅, 王欣, 译. 北京: 化学工业出版社, 2006: 135-148.
Hauptmann T, Eicher S. S. Heterocyclic Chemistry--structures, reactions, synthesis and applications[M]. LI Run-tao, GE Ze-mei, WANG Xin, Translate. Beijing:Chemical Industry Press, 2006: 135-148.
[18] 杨威, 姬月萍. 多硝基咪唑及其衍生物的研究进展[J]. 火炸药学报, 2008, 31(5): 46-50.
YANG Wei, JI Yue-ping. Research progress on polynitroimidazoles and their derivatives[J].ChineseJournalofExplosives&Propellants, 2008, 31(5): 46-50.
[19] 杨国臣, 刘慧君, 曹端林. 4-5-二硝基咪唑的制备[J]. 含能材料, 2006, 14(5): 349-351.
YANG Guo-chen, LIU Hui-jun, CAO Duan-lin. Prepration of 4,5-nitroimidazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2006, 14(5): 349-351.
[20] JIN Xing-hui, HU Bing-cheng, LIU Zu-liang. One-pot Synthesis of 2,4,5-trinitroimidazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(5): 722-724.
[21] 杨威, 姬月萍, 汪伟, 等. 1-甲基-2,4,5-三硝基咪唑(MTNI)的合成[J]. 精细化工中间体, 2008, 38(5): 30-33.
YANG Wei, JI Yue-ping, WANG Wei, et al. Synthesis of 1-methyl-2,4,5-trinitroimidazole(MTNI)[J].FineChemicalIntermediates, 2008, 38(5): 30-33.
[22] 曹端林, 王小军, 杨彩云, 等. 1-甲基-4,5-二硝基咪唑合成工艺[J]. 含能材料, 2009, 17(6): 678-680.
CAO Duan-lin, WANG Xiao-jun, YANG Cai-yun, et al. Synthesis of 1-methyl-4,5-dinitroimidazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 17(6): 678-680.
[23] 曹霞. 氨基对炸药结构和性能的影响[D]. 重庆: 重庆大学, 2012.
CAO Xia. Effects of amino groups on the structures and the properties of explosives[D]. Chongqing: Chongqing University, 2012.
[24] SciFinder化学文摘的在线版数据库学术版. https:// origin-scifinder.cas.org, 2015-5-23.
[25] Raja Duddu , Paritosh R Dave , Reddy Damavarapu, et al. Nucleophilic substitution reactions of 1-methyl-2,4,5-trinitroimidazole (MTNI)[J].SyntheticCommunications, 2009, 39: 4282-4288.
[26] Piero Melloni, Emanuele Dradi, Willy Logemann. Synthesis and antiprotozoal activity of methylnitro derivatives of 2,2′-biimidazole[J].JournalofMedicina1Chemistry, 1972, 15(9): 926-930.
[27] 李京海. 联咪唑及其硝基衍生物的合成研究[D]. 太原: 中北大学, 2013.
LI Jing-hai. The synthesis and study of nitro derivatives in imidazole and biimidazole[D]. Taiyuan: North university of China, 2013.
[28] 李雅津. 1-甲基-3,4,5-三硝基吡唑大论文[D]. 太原: 中北大学, 2014.
LI Ya-jin. Study on the synthesis of 1-methyl-3,4,5-trinitropyrazole[D]. Taiyuan: North university of China, 2014.
[29] 李洪丽, 熊彬, 姜俊, 等. 3-硝基吡唑及其盐类的合成与表征[J]. 火炸药学报, 2008, 31(2): 102-104.
LI Hong-li, XIONG Bin, JIANG Jun, et al. Synethsis and characterization of 3-nitropyrazole and its salts[J].ChineseJournalofExplosives&Propellants, 2008, 31(2): 102-104.
[30] 汪营磊, 张志忠, 王伯周, 等. 3,5-二硝基吡唑合成研究[J]. 含能材料, 2007, 15(6): 574-576.
WANG Ying-lei, ZHANG Zhi-zhong, WANG Bo-zhou, et al. Synthesis of 3,5-dinitropyrazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2007, 15(6): 574-576.
[31] Ravi P, Gore G M, Tewari S P, et al. A simple and environmentally benign nitration of pyrazoles by impregnated bismuth nitrate[J].JournalofHeterocyclicChemistry, 2013, 50(6): 1322-1327.
[32] Vinogradov V M, Dalinger L L, Gulevskaya V L, et al. Nitropyrazoles 4.*N-amination under control of the pH of the medium[J].RussianChemicalBulletin, 1993, 42(8): 1369-1371.
[33] 汪营磊, 张志忠, 王伯周, 等. VNS反应合成LLM-116[J]. 火炸药学报, 2007, 30(6): 20-23.
WANG Ying-lei, ZHANG Zhi-zhong, WANG Bo-zhou, et al. Synthesis of LLM-116 by VNS reaction[J].ChineseJournalofExplosives&Propellants, 2007, 30(6): 20-23.
[34] Dalinger I L, Cherkasova T I, Popova G P, et al. Nitropyrazoles 14. Synthesis of 1,3,4-trinitropyrazole and its behavior in the nucleophilic substitution reactions. General method of synthesis of 5-substituted 3,4-dinitropyrazoles[J].RussianChemicalBulletin(InternationalEdition), 2009, 58(2): 410-413.
[35] Yin P, Zhang J, He C, et al. Polynitro-substituted pyrazoles and triazoles as potential energetic materials and oxidizers[J].JournalofMaterialsChemistryA, 2014, 2(9): 3200.
[36] He C, Zhang J, Parrish D A, et al. 4-Chloro-3,5-dinitropyrazole: a precursor for promising insensitive energetic compounds[J].JournalofMaterialsChemistryA, 2013, 1(8): 2863.
[37] Zaitsev A A, Cherkasova T I, Dalinger I L, et al. Nitropyrazoles 13.*Synthesis and reactivity of 1-methyl-3,5-dinitropyrazole-4-carbonitrile. Site of nucleophilic displacement of the nitro group in 4-R-1-methyl-3,5-dinitropyrazoles[J].RussianChemicalBulletin(InternationalEdition), 2007, 56(10): 2074-2084.
[38] 金韶华, 松全才. 炸药理论[M]. 西安: 西北工业大学出版社. 2010: 260-271.
JIN Shao-hua, SONG Quan-cai. Explosive theory[M]. Xi′anNorthwestern Polytechnical University Press. 2010: 260-271.
[39] 王军, 景梅, 张晓玉, 等. 硝基二唑炸药爆炸参数的经验计算(Ⅱ)[J]. 含能材料, 2013, 21(5): 609-611.
WANG Jun, JING Mei, ZHANG Xiao-yu, et al. Empirical calculation of the explosivn parameters of nitrodiazole explosives(Ⅱ)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2013, 21(5): 609-611.
[40] 汪飞. 炸药爆轰性能五因素综合评估技术及关键指标研究[D]. 南京: 南京理工大学, 2013.
WANG Fei. Evaluation method of explosive detonation performance by five detonation parameters and study on crucia index[D]. Nanjing: Nanjing University of Science & Technology, 2013.
