神经干细胞移植减少脑出血大鼠神经功能的凋亡
2016-05-09祁绍艳刘晓静刘小军
祁绍艳 祁 景 刘晓静 刘小军
郑州大学第二附属医院重症医学科 郑州 450014
神经干细胞移植减少脑出血大鼠神经功能的凋亡
祁绍艳 祁 景 刘晓静 刘小军
郑州大学第二附属医院重症医学科 郑州 450014
目的 探讨神经干细胞移植对脑出血大鼠神经功能的影响。方法 采用立体定位仪制作脑出血大鼠模型,随机将大鼠分为sham组、ICH组及NSCs组,通过mNSS评分定量评价细胞移植后,观察脑出血大鼠在第1、3、7、14、28天的神经功能的行为学的动态变化;进行Caspase-3的免疫组织化学及灰度分析,观察其表达情况。结果 NSCs组mNSS评分在14、28 d均较ICH组明显改善(P<0.05)。NSCs组大鼠脑血肿周围组织的Caspase-3的表达水平较ICH组明显降低(P<0.05)。结论 NSCs移植能有效改善脑出血大鼠的神经功能评分,其机制可能是通过调节Caspase-3的表达减少细胞凋亡。
NSCs;脑出血;凋亡
脑出血(intracerebral hemorrhage,ICH)是一种高的病死率及高致残率的严重威胁人类健康的重大疾病,目前尚无有效的办法治疗脑出血引起的严重神经功能障碍,干细胞移植治疗是目前脑出血研究的主要方向之一,但干细胞移植治疗脑出血的机制仍不明确[1]。本文对NSCs移植治疗脑出血在细胞凋亡方面的机制进行探讨。
1 材料和方法
1.1 实验材料 动物:SD大鼠的饲养及相关实验程序均经过郑州大学伦理委员会批准。选取SPF级雄性SD大鼠30只(250~300 g)均来自河南省实验动物中心提供;细胞:NSCs为本实验室自已保存。
1.2 主要试剂和仪器 DMEM、DMEM/F12、胰蛋白酶、青霉素-链霉素溶液(Pen-Strep solution),抗体Caspase-3(美国invitrogen公司);DMSO、Polyrene(sigma公司);胎牛血清(hyclone公司);Ⅶ型胶原酶(sigma公司),鼠脑立体定位仪(日本Narishige SN-3公司),DAB试剂盒(北京中杉金桥生物技术公司);倒置显微镜(德国LEICA公司)。
1.3 实验方法
1.3.1 实验动物的分组及动物模型的制作:随机选取雄性SD大鼠30只分为sham组(立体定位仪定位穿刺但不打入Ⅶ型胶原酶)10只,ICH模型组(立体定位仪定位穿刺并打入Ⅶ型胶原酶)10只,NSCs干预组(模型鉴定成功后24 h内采用立体定位仪定位穿刺立体定位注射NSCs)10只,模型制作方法:将大鼠俯卧位固定在大鼠脑立体定位仪上,参照George Paxinos大鼠脑立体定位图谱[2],取大鼠左侧纹状体为定位点,选取前囟后0.2 mm,左侧旁开3 mm,垂直进针6 mm。以10 μL微量进样器缓慢注入0.5 U(2 μL)Ⅶ型胶原酶溶液,留针10 min,之后缓慢退针。针退出后,清洁创面,缝合头皮。术后24 h进行mNSS评分,纳入8~12分的大鼠。
1.3.2 NSCs细胞的培养:将复苏的NSCs(本实验室保存)传代直至达到移植细胞数(1×106L-1)。
1.3.3 大鼠的神经功能评分:采用mNSS(modified neurological severity scores)评分评价大鼠神经功能缺损和恢复情况[3],各组大鼠分别在术后1、3、7、14、28 d进行评分。
1.3.4 组织的取材、切片及染色:造模后28 d分别提取各组大鼠的脑组织标本,采取多聚甲醛灌注固定法固定大鼠脑组织,进行梯度蔗糖脱水以后进行冰冻冠状切片(厚12 mm);各组切片分别进行Caspase-3的免疫组织化学染色。
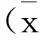
2 结果
2.1 大鼠神经功能评分 注射胶原酶大鼠脑出血后,24 h内大鼠迅速出现神经功能缺损的表现,其症状体征在造模术后1~3 d达到高峰,随后随时间延长逐渐恢复。NSCs组较模型组术后14、28 d的mNSS评分均较低,差异有统计学意义(P<0.05)。见表1。
表1 各组各时间点mNSS评分比较
2.2 免疫组化染色阳性细胞 光学显微镜下观察为胞浆被染为棕褐色或棕黄色、淡黄色颗粒状,Caspase-3在NSCs组较假手术组,与模型组表达减少 (图1)。NSCs组与假手术组的阳性细胞数差异有统计学意义(P<0.05)。见图2。

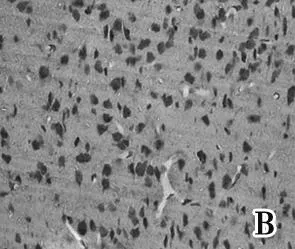

图1 Caspase-3免疫组化染色 A:假手术组;B:模型组;C:NSCs组(400×)
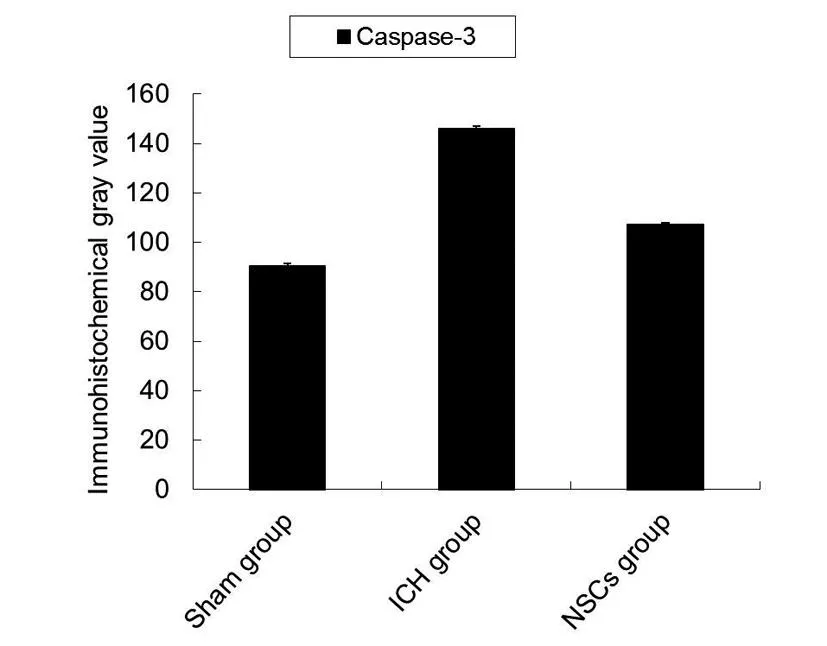
图2 NSCs组较ICH组Caspase-3的灰度值明显降低
3 讨论
脑出血是一种具有高发病率、高致死率、高致残率严重影响患者神经功能障碍的疾病。多数患者预后均遗留不同程度的神经功能障碍[4],目前尚无针对脑出血后神经功能障碍确切有效的治疗手段。干细胞治疗脑出血成为治疗脑出血的研究方向,但其治疗机制尚不明确。本实验采用向大鼠纹状体立体定位注入胶原酶的方法,制作大鼠脑出血模型,模型成功后出现典型的大鼠神经功能缺损的症状,可持续1~3 d,随后有不同程度的功能恢复,假手术组无神经功能缺损的症状。我们将NSCs移植入ICH大鼠脑内,观察其治疗效果。NSCs组自第14天起,mNSS评分优于模型组,第14、28天评分显著优于模型组。行为学表明NSCs移植具有明确的治疗作用。
脑出血引发机体的三种明显的病理变化:神经细胞及胶质细胞的凋亡,血管源性脑水肿,以及血脑屏障破坏。但脑出血出现的病理变化的确切机制目前还未确定,近来的研究表明Caspase-3可激活特定的信号系统,产生核皱缩、DNA片段形成等凋亡现象,继而调控着细胞凋亡的发生和发展[5]。此外,研究报道,Caspase-3还可以通过破坏细胞抗凋亡因素(如bcl-2)破坏细胞的结构,如结构蛋白actin、fodrin、lamin。通过本实验可以观察到NSCs组的Caspase-3表达较ICH组明显减少。Caspase-3的激活在脑出血后神经细胞的凋亡过程中起着极为重要的调控作用。NSCs是一种神经干细胞[6],具有可以替代凋亡神经细胞的功能,同时也可以通过调控Caspase-3的表达,从而减少组织细胞的凋亡,继而促进大鼠神经功能的恢复。本实验以ICH模型大鼠为研究对象,采用NSCs移植治疗。研究表明,NSCs移植能有效改善ICH模型大鼠的神经功能障碍,其作用机制可能与调控凋亡有关。
[1] Han N, Ding SJ, Wu T, et al.Correlation of free radical level and apoptosis after intracerebral hemorrhage in rats[J].Neurosci Bull, 2008,24(12):351-358.
[2] Marchetto MC, Winner B, Gage FH.Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases[J].Human Molecular Genetics, 2010,19(1):71-76.
[3] Jeong SW, Chu K, Jung KH, et al.Human neural stem cell transplantation promotes functional recovery in rats with experimental intracerebral hemorrhage[J].Stroke, 2003,34(9):2258-2263.
[4] Steiner T, Bösel J.Options to restrict hematoma expansion after spontaneous intracerebral hemorrhage[J].Stroke, 2010,41(21):402-409.
[5] Uccelli AF, Laroni BA, Giunti D.Neuroprotective features of mesenchymal stem cells[J].Best Pract Res Clin Haematol, 2011,24(1):59-64.
[6] 祁景,刘小军,周明锴.神经干细胞移植减轻ICH 模型大鼠神经功能障碍[J].中国实用神经疾病杂志,2015,18(13):49-50.
(收稿 2015-03-21)
R-332
A
1673-5110(2016)07-0076-02
