硝基胍自催化热分解特性及绝热安全性
2016-05-08刘大斌蔡高文史良煜卜令涛
王 凯, 刘大斌, 徐 森, 蔡高文, 史良煜, 卜令涛
(1. 南京理工大学化学工程学院, 江苏 南京 210094; 2. 山东天宝化工股份有限公司, 山东 平邑 273300)
1 引 言
硝基胍(NQ)是一种常用的、重要的火炸药[1],爆炸威力略高于TNT(104%TNT当量),具有爆温低(约2400 K)、感度低(摩擦感度、撞击感度均为0)、原材料便宜易得、生产工艺简单等优点。硝基胍制得的火药能量较高而烧蚀较低,炮口焰炮尾焰较少,温度系数也较低,是一种良好的火药原料[2-4]。因此,其热分解特性和热安全性一直备受关注。
文献[1-5]利用差热分析研究了硝基胍的热分解温度及熔点。Oyumi等[6]研究了硝基胍在快加热和慢加热的情况下的气相产物,并研究了气相产物浓度与气氛压力的关系。文献[7-8]则研究了硝基胍衍生物的热分解动力学及热安全性。上述研究对硝基胍的热分解进行了深入研究,但都没有涉及其热分解的自催化特性及热履历对其热分解的影响。
Roduit等[9]发现,对于自催化反应,受热部分分解的样品其动态DSC将会发生很大变化。基于Roduit的理论,本研究用“中断回归实验”(又称热履历法)[10-11]研究了热履历对硝基胍热分解的影响,用动态DSC实验研究了硝基胍的热分解特性,并用等温实验进行了验证。用绝热量热仪(ARC)研究了硝基胍在绝热条件下的热安全性,得到了其起始分解温度,最大温升速率等参数。
2 实验
2.1 实验样品与仪器
试剂: 硝基胍,化学纯,上海晶纯试剂有限公司。
差示扫描量热仪DSC1,瑞士Mettler-Toledo公司; 所用坩埚为高压密封不锈钢坩埚并配有镀金垫片; 参比为空的不锈钢坩埚。
绝热量热仪es-ARCTM,英国THT公司,测试温度25~500 ℃; 灵敏度0.02 ℃·min-1。
2.2 实验方法
(1)动态DSC实验: 吹扫气与保护气均为高纯氮气,流量为40 mL·min-1,温升速率为2,5,10,20 ℃·min-1,温度50~400 ℃。
(2)中断回归实验: 步骤①: 对待测样品进行完整的动态DSC实验,升温速率为10 ℃·min-1,得到第一条DSC曲线。从第一条DSC曲线中得到起始反应温度(Tonset),峰温(Tp),放热量(ΔHr)等数据,曲线标记为10 ℃·min-1-1。步骤②: 重新装样,在同样的实验条件下,升温至中断温度Ts,然后将样品冷却。对冷却后的样品进行完整的DSC动态试验,得到第二条DSC曲线。同样得到第二条DSC曲线的起始分解温度,峰温,放热量等数据。为了验证该方法的可重复性,Ts取三个温度,得到的不同曲线标记为10 ℃·min-1-2,10 ℃·min-1-3,10 ℃·min-1-4。Ts的取值方法是: 对步骤①得到的曲线进行面积积分,得到转化率为0.1,0.2和0.3时所对应的反应温度,此温度为Ts所取的三个温度。对步骤①和②得到的DSC曲线进行比较,观察热履历对样品热分解的影响。
(3)等温DSC实验: 实验温度为207 ℃。
(4)ARC实验: 实验样品量为0.181 g,实验温度120~205 ℃,温度梯度5 ℃,等待时间10 min; 样品球为SS-MCQ,质量15.34 g。
3 结果与讨论
3.1 DSC动态实验
硝基胍在不同升温速率下的DSC动态曲线如图1所示,实验条件及结果如表1所示。从图1可以看出,随着升温速率的升高,硝基胍的放热分解峰向高温方向偏移。其起始分解温度为213.8~249.9 ℃,峰温215.0~255.2 ℃。在升温速率为10,20 ℃·min-1时,在分解反应的起始阶段有明显熔融吸热峰,说明硝基胍是熔融分解型含能材料。在升温速率为2,5 ℃·min-1时,在硝基胍熔融之前已开始明显的热分解,吸热峰与放热峰耦合在一起。
基于DSC动态实验数据,用Kissinger[12](式(1))和 Ozawa[13](式(2))法分别计算硝基胍热分解反应的活化能。
(1)
(2)
式中,β为升温速率,℃·min-1;Tp为不同升温速率下放热峰峰温,℃;A为指前因子,s-1;R为理想气体常数,8.314 J·mol-1·K-1;E为活化能,kJ·mol-1。分别以ln(β/Tp)和logβ对1/Tp作图,拟合得到如图2所示的直线,根据直线的斜率求得硝基胍分解反应的活化能为111.6 kJ·mol-1和114.2 kJ·mol-1,两种方法得到的活化能相近,说明DSC动态实验数据可靠。
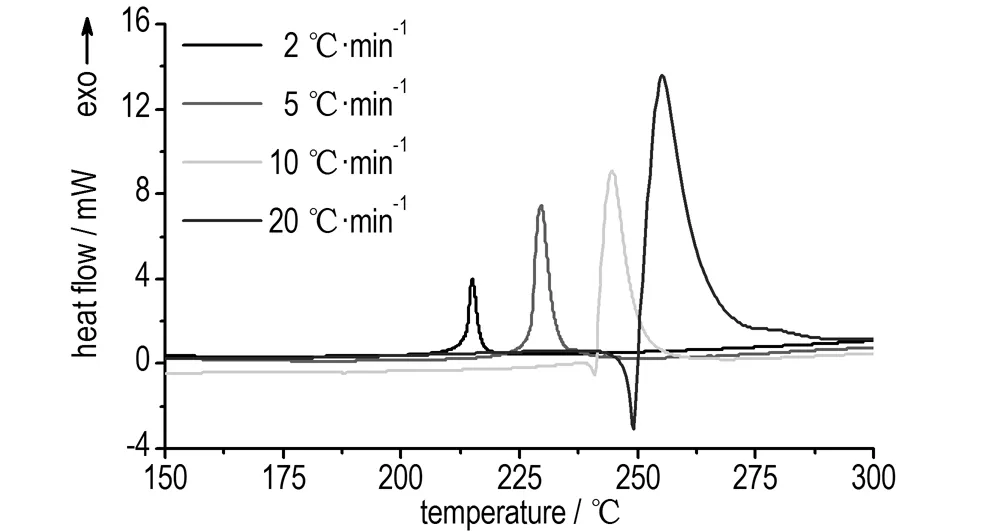
图1 硝基胍在不同升温速率下的动态DSC曲线
Fig.1 The dynamic DSC curves of NQ at different heating rates
表1 硝基胍DSC动态实验的条件及结果
Table 1 Conditions and results of the dynamic DSC experiments
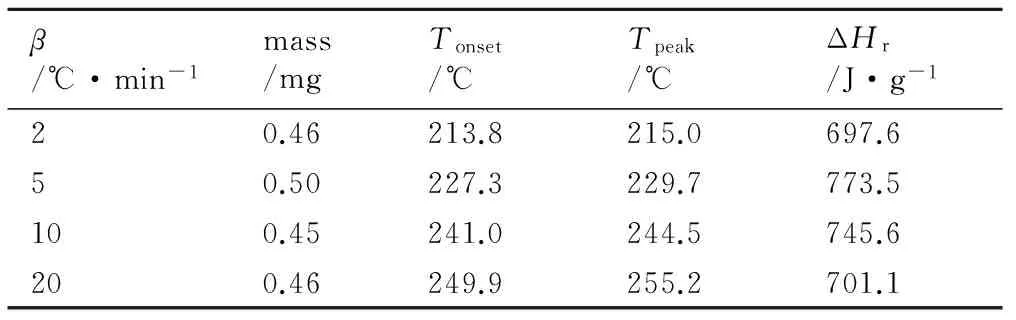
β/℃·min-1mass/mgTonset/℃Tpeak/℃ΔHr/J·g-120.46213.8215.0697.650.50227.3229.7773.5100.45241.0244.5745.6200.46249.9255.2701.1
Note:βis the heating rate,Tonsetis the initial thermal decomposition temperature,Tpeakis the peak temperature of thermal decomposition, ΔHris the decomposition enthalpy change.

图2 硝基胍的ln(β/Tp)-1/Tp和 logβ-1/Tp曲线
Fig.2 Curves of ln(β/Tp) and logβvs 1/Tpof NQ using Kissinger and Ozawa method
3.2 中断回归实验
由于硝基胍为熔融分解型物质,其起始分解温度不易得到,也无法对其曲线精确积分。且硝基胍一旦溶解,反应速率迅速升高,在极短的时间内达到其最大反应速率,所以在中断回归实验中其Ts无法按照2.2节中所述的方法取值。本研究中的Ts的取值是根据多次摸索实得到的结果。如在某中断温度下,中断时得到的分解转化率过小,则提高中断温度。中断温度的具体取值见表2。图3为中断回归实验得到的DSC曲线。
由图3及表2可以看出,中断回归之后,硝基胍的分解放热峰明显向低温方向偏移,且随着中断温度的增大,分解放热峰向低温方向的偏移越严重。在中断实验之后,硝基胍部分热分解产生了一定量的产物,这些产物将对硝基胍的热分解产生催化作用。步骤②得到的10 ℃·min-1-2,10 ℃·min-1-3,10 ℃·min-1-4三条曲线都没有出现吸热峰,说明硝基胍在未熔融之前,催化性的产物已经使其热分解达到了较高的反应速率,吸热峰与放热峰耦合在一起。上述实验结果也验证了3.1节中硝基胍为熔融分解型物质的结论,同时也证明硝基胍的热分解是自催化反应。

图3 硝基胍的中断回归实验曲线
Fig.3 DSC curves of NQ obtained by the “interruption and re-scanning” method
表2 硝基胍中断回归法实验的条件及结果
Table 2 Conditions and results of the “interruption and re-scanning” method
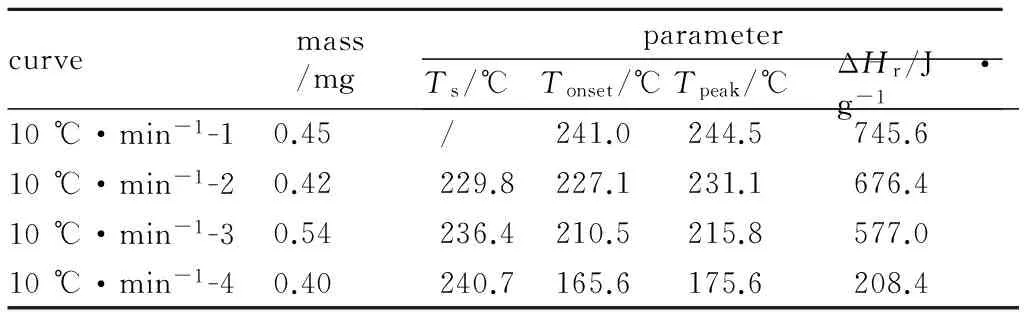
curvemass/mgparameterTs/℃Tonset/℃Tpeak/℃ΔHr/J·g-110℃·min-1-10.45/241.0244.5745.610℃·min-1-20.42229.8227.1231.1676.410℃·min-1-30.54236.4210.5215.8577.010℃·min-1-40.40240.7165.6175.6208.4
Note:Tsis the interruption temperature.
在中断回归实验中,也就是硝基胍获得热履历的情况下,其热分解的起始反应温度和峰温大大提前,说明其热分解安全性降低。尤其在10 ℃·min-1-4的曲线中,其起始反应温度降低至165.6 ℃。根据放热量之比算得此次中断回归实验中,中断之后硝基胍的转化率为0.72。虽然在实际生产应用中,硝基胍很难获得这样的热履历,但是不排除大量存放的硝基胍缓慢分解产生的催化性产物在某一点聚集,从而降低整个体系的热稳定性的可能。
3.3 DSC等温实验
等温DSC实验可检测和表征自催化分解: 若物质放热速率随时间逐渐下降,说明其分解遵循n级规律; 若物质在等温实验中出现钟形放热速率曲线,说明这种物质的分解具有自催化特性[14- 15]。硝基胍的DSC等温实验结果如图4所示。等温条件下硝基胍热分解的放热量为724.5 J·g-1,与DSC动态实验的放热量相当,说明等温实验的结果是有效的。
由图4可以看出,硝基胍的等温放热曲线为钟形曲线,证明其热分解为自催化反应。
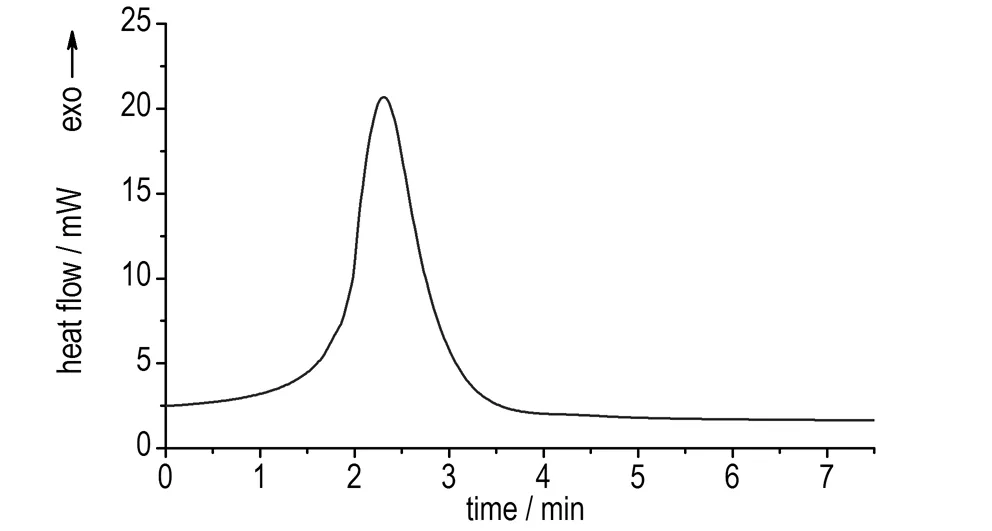
图4 硝基胍的DSC等温实验曲线
Fig.4 Isothermal DSC curve of NQ
3.4 ARC实验
硝基胍绝热分解温度与压力随时间的变化如图5所示,两者的变化速率如图6所示。由图5可以看出,测试开始阶段数据点较稀疏,这是由于样品分解的开始阶段速率较慢,而设定的采样速率为固定值(1 ℃记录一个数据)。绝热条件下,硝基胍在170.6 ℃时开始热分解,此时温升速率为0.047 ℃·min-1(图6)。174.9 ℃,温升速率达到最大,1.414 ℃·min-1。硝基胍热分解过程中产生大量气体,系统的压力急剧升高,其变化情况与温度相吻合。
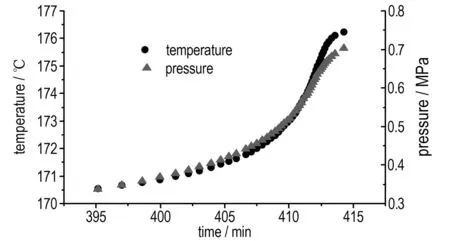
图5 硝基胍绝热分解的温度(压力)-时间曲线
Fig.5 Temperature and pressure vs time for NQ under adiabatic decomposition condition

图6 硝基胍绝热分解的温升速率(压升速率)-温度曲线
Fig.6 Temperature rate and pressure rate curves of NQ under adiabatic decomposition condition
硝基胍热分解的能量不仅用来加热药品本身,还用来加热样品球。在ARC实验中,为了保证仪器的安全,对于火炸药类样品实验量需非常小,这导致实验的温升较小。在绝热实验中,硝基胍由170.6 ℃升至176.2 ℃,温升很小。但随着实验的进行,硝基胍的热分解速率(温升速率)急剧升高,说明在硝基胍的热分解过程中产生了催化性的产物使其分解速率大大加快。这与中断回归法以及DSC等温实验的结论相吻合,说明硝基胍的热分解为自催化反应。
4 结 论
(1)硝基胍的热分解为自催化反应,其熔融吸热峰与分解放热峰耦合。
(2)中断回归实验表明,热履历降低了硝基胍的起始分解温度和峰温,降低了其热分解安全性。在上述方法的实验中,硝基胍起始分解温度最低时为165.6 ℃,峰温为175.6 ℃。硝基胍在长期储存以及受热以后,其热安全性应引起关注。
(3)在动态DSC实验中,其起始反应温度为213.8~249.9 ℃,峰温215.0~255.2 ℃,表观活化能为111.6,114.2 kJ·mol-1。在绝热实验中,其起始反应温度为170.6 ℃,最大温升速率为1.414 ℃·min-1。
参考文献:
[1] 卞君和,赵宝昌. 硝基胍及其火药的热分解[J]. 火炸药, 1982, 3: 1-6.
[2] WANG Rui-hu, GUO Yong, SA Rong-jian, et al. Nitroguani-
dine-Fused bicyclic guanidinium salts: a family of high-density energetic materials[J].Chemistry-AEuropeanJournal, 2010, 16(28): 8522-8529.
[3] 李艳春. 热分析动力学在含能材料中的应用[D]. 南京: 南京理工大学, 2010.
LI Yan-chun. The application of thermal analysis kinetics on energetic materials[D]. Nanjing: Nanjing University of Science and Technology, 2010.
[4] Engelen K. Properties of a gas-generating composition related to the particle size of the oxidizer[J].Propellants,Explosives,Pyrotechnics, 2002, 27(5): 290-299.
[5] 刘靖疆, 任绍宣, 齐珠钗, 等. 硝基胍的结构研究[J]. 兵工学报, 1982, 4: 28-34.
LIU Jing-jiang, REN Shao-xuan, QI Zhu-chai, et al. The investigation of the structure of nitroguanidine[J].ActaArmamentarii, 1982, 4: 28-34.
[6] Oyumi Y, Rheingold A L, Brill T B. A comparison of the crystal structures, IR spectra, thermolysis and impact sensitivities of nitroguanidine and trinitroethylni-roguanidine[J].Propellants,Explosives,Pyrotechnics, 1987, 12: 46-52.
[7] 胡拥鹏, 赵旭芳, 赵宁宁, 等. DNGTz的非等温热分解动力学及热安全性[J]. 含能材料, 2014, 22(6): 767-773.
HU Yong-peng, ZHAO Xu-fang, ZHAO Ning-ning, et al. Non-isothermal thermal decomposition kinetics and thermal safety of DNGTz[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(6): 767-773.
[8] 贾欢庆,胡炳成,金兴辉. 1,2-二硝基胍的合成及热性能[J]. 含能材料. 2013, 21(6): 730-733.
JIA Huan-qing, HU Bing-cheng, JIN Xing-hui. Synthesis and thermal properties of 1, 2-dinitroguanidine[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2013, 21(6): 730-733.
[9] Rouduit B, Hartmanna M, Follyb P, et al. Parameters influencing the correct thermal safety evaluations of autocatalytic reactions[J].ChemicalEngineeringTransactions, 2013, 31.
[10] 杨庭, 陈利平, 陈网桦, 等. 分解反应自催化性质快速鉴别的实验方法[J]. 物理化学学报,2014, 30(7): 1215-1222.
YANG Ting, CHEN Li-ping, CHEN Wang-hua, et al. Experimental method on rapid identification of autocatalysis in decomposition reactions[J].ActaPhysico-ChimicaSinica, 2014, 30(7): 1215-1222.
[11] Wang K, Liu D B, Xu S, et al. Research on the thermal history′s influence on the thermal stability of EHN and NC[J].ThermochimActa, 2015, 610: 23-28.
[12] Kissinger H E. Reaction kinetics in differential thermal analysis [J].AnalyticalChemistry, 1957, 29(11): 1702-1706.
[13] Lee J, Hsu C, Chang C. A study on the thermal decomposition behaviors of PETN, RDX, HNS and HMX[J].ThermochimicaActa, 2002, 392-393(1-2): 173-176.
[14] Vyazovkin S, Burnham A K, Criado J M, et al. ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data[J].ThermochimicaActa, 2011, 520(1-2): 1-19.
[15] Long G T, Brems B A, Wight C A. Autocatalytic thermal decomposition kinetics of TNT[J].ThermochimicaActa, 2002, 388(1-2): 175-181.
