苯酚在Ti/IrO2O5电极上的电化学反应
2016-05-08李皓月刘有智
李皓月, 高 璟, 刘有智
(1. 中北大学山西省超重力化工工程技术研究中心, 山西 太原 030051; 2. 中北大学超重力化工过程山西省重点实验室, 山西 太原 030051)
1 引 言
含苯酚类化合物是重要的工业原料,广泛应用于合成炸药、医药、塑料等领域。在炸药工业排放的废水中,含苯酚类废水对生态环境及人体健康危害严重[1-3],在我国已被列为需要重点解决的有害废水之一[4]。因此,苯酚废水的有效处理至关重要。酚类物质中含有苯环,难开环降解,传统直接化学法处理时效率低、沉淀多等[5-6],而电化学氧化法因其清洁高效,无二次污染,溶液中产生的·OH易进攻苯环等优点备受关注[7-10]。但电化学氧化过程中存在的析氧竞争副反应会导致电流利用率降低、能源消耗量增加,而抑制析氧竞争副反应的关键在于电极材料的选择[11-12]和传质性能优良的电化学反应器的研制[13]。
本实验室前期已研制出一种超重力多级同心圆筒电化学反应器[14],在含苯酚废水的处理过程中可强化苯酚降解反应的传质过程,减弱析氧副反应的影响,体现出超重力的过程强化效果[15]。但由于该反应器所采用的阳极材料析氧电位不高,影响了苯酚的降解效率[16]。因此,具有高析氧电位、性能优良的电极材料的选用对于进一步提高苯酚降解效率、降低能耗以及发挥超重力的过程强化效果具有重要作用。目前,Ti基IrO2-Ta2O5电极被认为是较优的析氧用阳极[17-18],其制备工艺已得到广泛而深入的研究[19-23]。但将该电极应用于废水处理的研究鲜有报道,而相关研究对于探索废水处理的清洁技术具有重要作用。
本研究用Ti/IrO2-Ta2O5电极进行苯酚的电化学反应。采用循环伏安法测试Ti/IrO2-Ta2O5电极的催化活性及稳定性,在电极性能优良的情况下,考察含苯酚模拟废水的电化学行为,得到了反应适宜条件。通过高效液相色谱(HPLC)、总有机碳(TOC)测定仪、化学需氧量(COD)消解装置研究了苯酚在Ti/IrO2-Ta2O5电极上的电化学降解效果,为今后进一步探索苯酚在该电极上的降解中间产物和机理,以及确保深度降解的措施提供基础理论依据。
2 实验部分
2.1 试剂与仪器
(1)含苯酚模拟废水配制
准确称取2.000 g苯酚分析纯,加200 mL去离子水溶解,用去离子水稀释定容至1000 mL容量瓶中,摇匀后备用。其余各浓度废水均由2 g·L-1苯酚模拟废水稀释定容。废水中加入适量无水硫酸钠作为支持电解质。
(2)主要仪器
上海辰华CHI660E电化学工作站,普通三电极体系,其中工作电极为Ti/IrO2-Ta2O5电极片(1 cm×1 cm),对电极为Pt片电极(1 cm×1 cm),参比电极为饱和硫酸亚汞电极(25 ℃时其标准电极电位为0.616 V); 戴安Ultimate 3000高效液相色谱仪; 美国OI-1030型TOC测定仪; XJ-I型COD消解装置。
2.2 电化学行为测试
将预处理过的Ti/IrO2-Ta2O5电极用蒸馏水反复清洗后,在0.5 mol·L-1H2SO4溶液中进行循环伏安扫描,扫描电位为-0.6~1.0 V(相对参比电极),扫描速度为50 mV·s-1,待循环伏安曲线稳定后,说明电极表面得以活化,可进行稳态测试。
测试溶液分别为: (1)空白体系Na2SO4溶液; (2)不同浓度Na2SO4与C6H6O的混合溶液; (3)不同浓度C6H6O与Na2SO4的混合溶液。其中,处理量为50 mL,扫描电位为-1.0~1.2 V(相对参比电极),扫描速度为50 mV·s-1。
2.3 分析检测方法
Ti/IrO2-Ta2O5电极电化学降解苯酚废水的处理效果以苯酚去除率、化学需氧量(COD)去除率和总有机碳(TOC)去除率表示。
(1)苯酚去除率
废水中苯酚浓度采用高效液相色谱仪测定。检测波长: 270 nm; 色谱柱: C18反相柱(250 mm×4.6 mm×5 μm); 流动相: 甲醇/水(60∶40); 流速: 1 mL·min-1; 柱温25 ℃; 进样量20 μL。
苯酚去除率η1的计算公式为:
式中,c0,phenol和ct,phenol分别为废水处理前后的苯酚浓度,mg·L-1。
(2)COD去除率
废水中COD值采用重铬酸钾法(GB11914-1989)测定。COD去除率η2的计算公式为:
式中,c0,COD和ct,COD分别为废水处理前后的COD浓度,mg·L-1。
(3)TOC去除率
废水中TOC值采用差减法由TOC测定仪测定。
TOC去除率η3的计算公式为:

式中,c0,TOC和ct,TOC分别为废水处理前后的TOC浓度,mg·L-1。
(4)平均电流效率(ACE)
苯酚降解过程中的平均电流效率采用化学需氧量浓度(cCOD)可表达为:
式中,F为法拉第常数,96485 C·mol-1;I为电流,A。
3 结果与讨论
3.1 Ti/IrO2-Ta2O5电极性能测试
一般对于金属氧化物电极而言,其析氧电位取决于金属/氧化物电对或者该金属的低价氧化态/高价氧化态电对[24],而决定Ti-IrO2/Ta2O5电极析氧电位的电对为IrO2/Ir2O3。
图1为实验所选用的Ti/IrO2-Ta2O5电极在0.5 mol·L-1H2SO4介质中的循环伏安曲线。由图1可知,在0.25 V处对应有一对氧化还原峰,说明是涂层表面活性组元Ir3+/Ir4+相互转化的结果,可由式(1)表示:
2IrO2+2H++2e-↔Ir2O3+H2O
(1)
该反应是可逆反应,IrO2作为催化剂起催化和桥梁作用。当电位大于0.8 V时,电流急剧上升,说明该电极发生极化现象,开始出现析氧反应。由图1循环伏安曲线的形状可看出,该电极的可逆性较好,催化活性较高,在适当条件下可用于含苯酚模拟废水的处理。

图1 Ti/IrO2-Ta2O5电极的循环伏安曲线图
Fig.1 Cyclic voltammetry curve of Ti/IrO2-Ta2O5electrode
3.2 苯酚在Ti/IrO2-Ta2O5电极上的电化学行为
实验以苯酚为目标污染物,考察苯酚在Ti/IrO2-Ta2O5电极上的电化学行为,研究不同支持电解质(Na2SO4)浓度和不同苯酚初始浓度下,Ti/IrO2-Ta2O5电极降解苯酚的电化学反应过程。
3.2.1 苯酚的加入对空白体系的影响
将空白体系H2O-5 g·L-1Na2SO4溶液体系与1000 mg·L-1C6H6O-5 g·L-1Na2SO4溶液体系的循环伏安曲线对比,结果如图2所示。

图2 Ti/IrO2-Ta2O5电极在C6H6O-Na2SO4体系与H2O-Na2SO4体系的循环伏安对比图
Fig.2 Cyclic voltammetry curves of Ti/IrO2-Ta2O5electrode in C6H6O-Na2SO4and H2O-Na2SO4system
图2中还原过程相差不大,但在正扫氧化过程中,H2O-Na2SO4体系在0.25 V处出现一氧化峰,而C6H6O-Na2SO4体系在0.25 V和0.7 V处均出现氧化峰,说明苯酚的加入影响了体系中的电化学反应,苯酚可在Ti/IrO2-Ta2O5电极上发生电化学氧化反应。首先,溶液中的H2O分子在Ti/IrO2-Ta2O5电极表面放电并生成吸附的·OH,如式(2)所示; 然后,吸附的·OH和IrO2中的氧原子相互作用,并使·OH中的氧原子进入到IrO2的晶格中,形成过氧化物IrO3,如式(3)所示; 这两种状态的活性氧可直接氧化溶液中的苯酚,反应如式(4)、式(5)所示。
IrO2+H2O→IrO2(·OH)+H++e-
(2)
IrO2(·OH)→IrO3+H++e-
(3)
C6H6O+28IrO2(·OH)→28IrO2+6CO2+17H2O
(4)
C6H6O+14IrO3→14IrO2+6CO2+3H2O
(5)
因此,图2中0.7 V处对应的氧化峰为苯酚的直接电化学氧化峰。但氧化峰电流值变化不明显,说明苯酚在电极上发生的直接电化学氧化反应较弱。且图2中0.7 V处对应的氧化峰电流与还原峰电流的比值不等于1,说明苯酚在Ti/IrO2-Ta2O5电极上发生的直接电化学氧化反应不可逆。由此可见,苯酚在该电极上可发生少量的不可逆的直接电化学氧化过程,而大部分氧化降解过程是发生在析氧反应区的间接氧化过程。
在-1~1.2 V,C6H6O-Na2SO4体系的氧化电流大于H2O-Na2SO4空白体系的电流值。而且在析氧电位范围内,C6H6O-Na2SO4体系的阳极电流增加速度明显快于空白体系,同样说明该电极性能良好,降解苯酚时可取得较优效果。
3.2.2 Na2SO4添加量对电化学行为的影响
实验选取苯酚初始浓度为1000 mg·L-1,考察电解质Na2SO4添加量对电化学氧化降解苯酚反应的影响,Na2SO4添加量控制在2~7 g·L-1,选取氧化峰电流作为评价Ti/IrO2-Ta2O5电极在不同浓度电解质下降解苯酚的能力,结果如图3所示。

图3 Ti/IrO2-Ta2O5电极在不同浓度Na2SO4电解质下的线性伏安图
Fig.3 Linear voltammetry curves on Ti/IrO2-Ta2O5electrode in different concentration of Na2SO4electrolyte
由图3可知,随着支持电解质浓度的增加,电荷的投入量增加,氧化峰电流逐渐增加,在Na2SO4添加量为5 g·L-1时,氧化峰电流达到最大值; 继续增加Na2SO4的添加量,氧化峰电流值反而降低。产生这个结果的原因是由于电解质投入量过多时,溶液中存在过多自由移动的离子而发生离子间的碰撞,从而影响降解效率。
另外,图3中析氧电位随着支持电解质浓度的增加发生负移,而析氧副反应的有利进行将不利于苯酚的电化学氧化降解。因此,在Na2SO4添加量为5 g·L-1时,相比其他条件,电荷利用率更高,苯酚的降解效果更好。
3.2.3 苯酚初始浓度对电化学行为的影响
图4为不同苯酚初始浓度对电化学氧化降解苯酚反应的影响,取各循环的第五次循环数据作图,将苯酚初始浓度控制在100~2000 mg·L-1。
图4中不同浓度的苯酚在Ti/IrO2-Ta2O5电极上所形成的峰电位、峰电流和析氧电位值稍有差别。苯酚初始浓度越低,在0.25 V处对应的峰电流越大,析氧电位越低,越有利于间接氧化反应的进行。但0.7 V处对应的氧化峰电流随苯酚初始浓度的增大逐渐增大,说明高浓度苯酚有利于在Ti/IrO2-Ta2O5电极表面发生直接电化学氧化反应。这是因为苯酚的初始浓度较大时,体系中苯酚之间的空隙变小,在电极表面反应的几率变大。而Ti/IrO2-Ta2O5电极降解苯酚的过程主要是依靠电化学反应产生的·OH,间接氧化苯酚的过程。因此,低浓度苯酚可获得较好的降解效果。

图4 Ti/IrO2-Ta2O5电极在不同浓度苯酚溶液中的循环伏安图
Fig.4 Cyclic voltammetry curves on Ti/IrO2-Ta2O5electrode in different concentration of phenol solution
3.3 苯酚在Ti/IrO2-Ta2O5电极上的电化学降解效果
选用上述适宜的实验条件: 苯酚初始浓度100 mg·L-1,电解质浓度5 g·L-1,考察反应时间和反应电流对苯酚去除率η1、COD去除率η2及TOC去除率η3的影响,研究Ti/IrO2-Ta2O5电极降解苯酚的电化学反应效能。
3.3.1 反应时间对苯酚电化学降解效果的影响
控制苯酚初始浓度100 mg·L-1,电解质浓度5 g·L-1,反应电流为40 mA,考察不同反应时间对苯酚电化学降解效果的影响。结果如图5所示。
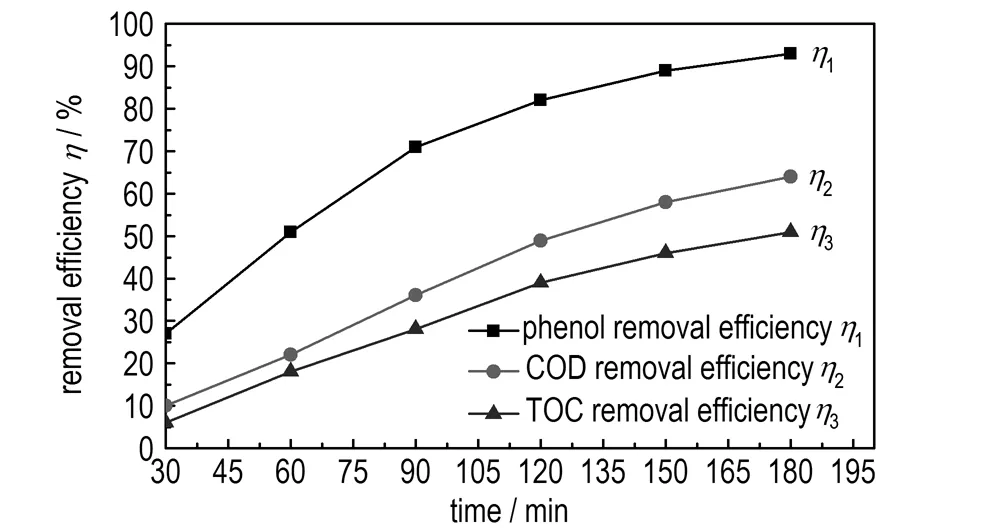
图5 反应时间对苯酚、COD及TOC去除率的影响
Fig.5 Effects of reaction time on the removal efficiency of phenol,COD and TOC
由图5可知,随着反应时间的延长,苯酚去除率η1、COD去除率η2及TOC去除率η3均逐渐增大。在反应时间为120 min时,η1、η2、η3分别为82%、49%、39%。继续延长反应时间,η1、η2、η3的去除速率趋于缓慢,且能源消耗量也随之增加。因此,选择适宜的电化学反应时间为120 min。
3.3.2 电流对苯酚电化学降解效果的影响
控制苯酚初始浓度100 mg·L-1,电解质浓度5 g·L-1,电化学反应时间120 min,考察不同电流对苯酚电化学降解效果的影响。结果如图6所示。
由图6可知,随着电流的增大,苯酚去除率η1呈现先增大后平缓的趋势,而COD和TOC的去除率η2、η3呈近似线性增加的趋势。当电流为40 mA时,η1、η2、η3分别为82%、49%、39%。以COD去除率η2为指标表征苯酚降解过程中的平均电流效率(ACE),不同电流下苯酚降解的平均电流效率(ACE)如表1所示。

图6 电流对苯酚、COD及TOC去除率的影响
Fig.6 Effects of current on the removal efficiency of phenol,COD and TOC
表1 不同电流下苯酚降解的电流效率
Table 1 Current efficiency for degradation of phenol at various current

current/mA102030405060η2/%273441495559ACE/%54.034.027.324.522.019.7
Note:η2is CODremoval efficiency;ACEis average current efficiency.
表1的数据显示,随着电流的逐渐增大,ACE呈逐渐减小的趋势。由图4研究可知,低浓度苯酚在Ti/IrO2-Ta2O5电极上主要发生的是间接氧化反应,是依靠电化学反应过程中产生的·OH来氧化苯酚及中间产物。其中,水在电极表面放电生成·OH的反应由式(6)表示,有机物与·OH的反应由式(7)表示。
反应随着电流的增大,体系内参与反应的电子数增多,产生的具有强氧化性的·OH的数目增多,有机物的降解速率随之增大。但持续增加的电流会使体系产生更多的·OH,过量的·OH会发生如式(8)所示的反应生成O2,该副反应会降低ACE。同时中间产物的降解会与苯酚形成竞争反应,导致η1趋于平缓,而η2和η3仍在增加。
H2O→·OH+H++e-
(6)
·OH+R→RO+H++e-→CO2+H2O
(7)
2·OH→O2+2H++2e-
(8)
由此可见,在电流较低时,析氧反应较少发生,溶液中产生的·OH主要用于降解有机物,此时ACE较高,但η1、η2及η3较低。而电流较高时,η1、η2及η3均较高,但析氧反应所占比重增大,ACE逐渐降低。在电流为40 mA时,ACE可达24.5%,η1可达82%。所以,在苯酚初始浓度100 mg·L-1,电解质浓度5 g·L-1,反应时间120 min,电流40 mA时,苯酚降解效率最高,苯酚去除率η1可达82%,电流效率ACE可达24.5%。
4 结 论
(1) 苯酚在Ti/IrO2-Ta2O5电极上的电化学反应主要发生在析氧反应区,苯酚初始浓度越低,越有利于间接氧化反应的进行。而较高浓度苯酚溶液在析氧反应前会发生少量的不可逆的直接电化学氧化反应。
(2) 在支持电解质Na2SO4添加量为5 g·L-1,苯酚初始浓度为100 mg·L-1时,可获得较大的氧化峰电流,进而可提高电荷利用率,提高苯酚降解效率。
(3) 在苯酚初始浓度100 mg·L-1,电解质浓度5 g·L-1,反应时间120 min,电流为40 mA时,可达到82%的苯酚去除率和24.5%的电流效率。说明,Ti/IrO2-Ta2O5电极可应用于苯酚类难降解炸药废水的处理领域,可为超重力技术与电化学氧化处理炸药废水技术的耦合提供理论依据。
参考文献:
[1] Feng Y J, Li X Y. Electro-catalytic oxidation of phenol on several metal-oxide electrodes in aqueous solution[J].WaterResearch,2003, 37(10): 2399-2407.
[2] 肖忠良,胡双启,吴晓青,等. 火炸药的安全与环保技术[M]. 北京: 北京理工大学出版社,2006: 260-278.
[3] Busca G, Berardinelli S, Resini C, et al. Technologies for the removal of phenol form fluid streams: A short review of recent development[J].JournalofHazardousMaterials, 2008, 160(2-3): 265-288.
[4] Jiang Hong, Fang Ying, Fu Yao, et al. Studies on the extraction of phenol in wastewater[J].JournalofHazardousMaterials, 2003,101(2): 179-190.
[5] Rui C. Martins, Andre F. Rossi, Rosa M. Fenton′s oxidation process for phenolic wastewater remediation and biodegradability enhancement[J].JournalofHazardousMaterials, 2010,180(1-3): 716-721.
[6] Ma H Z, Zhang X H,Ma Q L, et al. Electrochemical catalytic treatment of phenol wastewater[J].JournalofHazardousMaterials,2009,165(1-3): 475-480.
[7] Rasha Tolba. Electrochemical oxidation of lignin at IrO2-based oxide electrodes[J].JournalofElectroanalyticalChemistry, 2010,649(1-2): 9-15.
[8] Duan Xiao-yue, Zhao Yuan-yuan, Liu Wei, et al. Electrochemical degradation of p-nitrophenol on carbon nanotube and Ce-modified-PbO2electrode[J].JournaloftheTaiwanInstituteofChemicalEngineers,2014,45(6): 2975-2985.
[9] 焦纬洲, 郭亮, 刘有智, 等. Fenton氧化法深度降解HMX生产废水[J]. 含能材料, 2014, 22(1): 94-99.
JIAO Wei-zhou, GUO Liang, LIU You-zhi, et al. Degradation of HMX production wastewater by fenton oxidation[J].ChineseJournalofEnergeticmaterials(HannengCailiao),2014,22(1): 94-99.
[10] 郭亮,焦纬洲,刘有智,等. 不同臭氧组合工艺处理含硝基苯类化合物废水的实验研究[J].含能材料,2014,22(5): 702-708.
GUO Liang, JIAO Wei-zhou, LIU You-zhi, et al. Treatment of nitrobenzene-containing wastewater using different combined processes with ozone[J].ChineseJournalofEnergeticmaterials(HannengCailiao), 2014, 22(5): 702-708
[11] 张震,司银平. 金属氧化物电极材料在降解含酚废水中的应用[J]. 水处理技术,2010,36(3): 29-54.
ZHANG Zhen, SI Yin-ping. Application of metal oxidation anode in the degradation of phenol wastewater[J].TechnologyofWaterTreatment,2010,36(3): 29-54.
[12] 吴越, 催化化学[M]. 北京:科学出版社,2000: 1293-1295.
[13] 林海波, 伍振毅, 黄卫民, 等. 工艺废水电化学处理技术的进展及其发展方向[J]. 化工进展, 2008, 27(2): 223-230.
LIN Hai-bo, WU Zhen-yi, HUANG Wei-min, et al. Development and direction of electrochemical technologies for industrial wastewater treatment[J].ChemicalIndustryandEngineeringProgress,2008, 27(2): 223-230.
[14] 刘有智, 高璟, 焦纬洲. 一种连续操作的超重力多级同心圆筒式电解反应装置及工艺. 中国: 201010033393.8[P], 2010.07.28.
[15] GAO Jing, LIU Youzhi, CHANG Lingfei. Treatment of phenol wastewater using high gravity electrochemical reactor with multi-concentric cylindrical electrodes[J].ChinaPetroleumProcessingandPetrochemicalTechnology, 2012,14(2): 71-75.
[16] 张珺. 超重力电解含酚废水的基础研究[D]. 太原:中北大学, 2013.
ZHANG Jun. Basic Research of Phenolic Wastewater Electrolysis under High Gravity Field[D]. Taiyuan: North University of China, 2013.
[17] 张招贤. 钛电极工学(第二版)[M]. 北京:冶金工业出版社,2003: 283-289.
[18] LI Bao-song, LIN An, GAN Fu-xing. Preparation and electrocatalytic propeties of Ti/IrO2-Ta2O5anodes for oxygen evolution[J].TransactionsofNonferrousMetalsSocietyofChina,2006, 16(5): 1193-1199.
[19] 李保松, 林安, 甘复兴. Ti/IrO2-Ta2O5阳极的制备及其析氧电催化性能研究[J]. 稀有金属材料与工程,2007,36(2): 245-249.
LI Bao-song, LIN An, GAN Fu-xing. Reparation and characterization of Ti/IrO2-Ta2O5anodes for oxygen evolution used to sulfate electrolysis[J].RareMetalMaterialsandEngineering,2007,36(2): 245-249.
[20] Xin Y L, Xu L K. Effect of sintering temperature on mi-erostructure and electrocatalytic properties of Ti/IrO2-Ta2O5anodes by pechini method[J].RareMetalMaterialsandEngineering,2010, 39(11): 1903-1907.
[21] Changa C C, Wen T C. Influence of calcination temperature of IrO2/Ti electrodes on oxygen reduction[J].MaterialsChemistryandPhysics,2009,115(1): 93-97.
[22] 白少金, 魏宗平, 王欣, 等. 添加纳米IrO2的新型涂层IrO2-Ta2O5钛阳极的制备及性能[J]. 中国有色金属学报,2011, 21(3): 669-674.
BAI Shao-jin, WEI Zong-ping, WANG Xin, et al. Preparation and performance of novel IrO2-Ta2O5coated titanium anode with embedded nanoscale IrO2[J].TheChineseJournalofNonferrousMetals. 2011, 21(3): 669-674.
[23] 徐海清, 胡耀红, 陈力格, 等. SnO2掺杂IrO2-Ta2O5涂层阳极的电催化活性及稳定性[J]. 电镀与涂饰,2014,33(6): 267-270.
XU Hai-qing, HU Yao-hong, CHEN Li-ge, et al. Electrocatalytic activity and stability of SnO2-doped IrO2-Ta2O5coated anode[J].ElectroplatingandFinishing,2014,33(6): 267-270.
[24] D.普莱彻教授, 著, 肖利芬, 译. 电极过程简明教程[M]. 北京:化学工业出版社, 2013: 100-103.
