毛竹种群向针阔林扩张的根系形态可塑性
2016-05-07白尚斌周国模王懿祥温国胜
沈 蕊,白尚斌,周国模,王懿祥,王 楠,温国胜,陈 娟
浙江农林大学浙江省森林生态系统碳循环与固碳减排重点实验室,临安 311300
毛竹种群向针阔林扩张的根系形态可塑性
沈蕊,白尚斌*,周国模,王懿祥,王楠,温国胜,陈娟
浙江农林大学浙江省森林生态系统碳循环与固碳减排重点实验室,临安311300
摘要:为了弄清毛竹(Phyllostachys edulis)向针阔林扩张过程中根系的形态可塑性反应,在浙江天目山自然保护区毛竹向针阔林扩张的典型过渡地带,连续区域上设置毛竹纯林、针阔-毛竹混交林(以下简称过渡林)、针阔林3种样地。用根钻法采集样地毛竹根系、针阔树根系并比对其生物量密度、细根比根长、相邻同级侧根节点距等形态特征参数变化。结果表明:随着毛竹的扩张程度增加,林内根系生物量密度增加;且与针阔树竞争过程中毛竹将更多的根系放置于表层;同时在水平方向上随离样株距离的增加未出现明显变化,而针阔树根系则随离样木距离的增加而逐渐减少;毛竹根系比根长明显增加,平均增幅15%;一、二级侧根节点距则均有所下降,毛竹侧根数量增多。这些结果表明毛竹种群可通过根系生物量密度、细根比根长、相邻同级侧根节点距等形态可塑性方式实现向周边森林扩张。
关键词:毛竹扩张;地下竞争;根系塑性;天目山自然保护区
沈蕊,白尚斌,周国模,王懿祥,王楠,温国胜,陈娟.毛竹种群向针阔林扩张的根系形态可塑性.生态学报,2016,36(2): 326-334.
Shen R,Bai S B,Zhou G M,Wang Y X,Wang N,Wen G S,Chen J.The response of root morphological plasticity to the expansion of a population of Phyllostachys edulis into a mixed needle-and broad-leaved forest.Acta Ecologica Sinica,2016,36(2): 326-334.
毛竹(Phyllostachys edulis)属禾本科竹亚科刚竹属植物,因其良好的经济价值在我国南方而得以广泛种植。然而有研究表明,毛竹克隆生长使其向邻近群落扩张现象明显,给生态系统带来的负面影响日渐突出[1-2]。有关毛竹扩散的机理和规律,国内外已有一些研究:涉及毛竹生物学特性[3-4],环境改变[5-6],竞争[3,7],化感作用[8-9]等方面,但对地下生态过程关注的还不够。从竞争的角度来看,在竹类研究领域,其地下部分竞争比地上部分更为重要[10]。而地下根系竞争会引起根系塑性的反应,高根系塑性会使植物在长期竞争中占据优势[11]。其中形态可塑性与生物量分配可塑性的响应是树种适应环境变化的一种重要模式[12]。如在水曲柳(Fraxinus mandshurica)和落叶松(Larix gmelinii)混载竞争时,混载改变了水曲柳根系的形态和空间分布[13],细根比根长(SRL,m/g,即单位重量的根的长度)和根长度均有所增加,有利于水曲柳吸收较多的养分和水分,提高其竞争效率[14-15]。
以往关于毛竹根系的研究多集中在毛竹鞭根系统结构的研究,对其扩散过程中的根系塑性知之甚少,这妨碍了我们对毛竹扩张过程中地下生态学的理解和认识。根系塑性是根系对土壤各种异质性的表型变化响应。既然毛竹通过地下竹鞭向邻近森林可逐渐扩散,那么必将引起地下根系竞争。为此,毛竹根系会做出怎样的响应?以及这些响应变化是否有利于其在竞争中获取优势?目前的研究报道还较少[7]。为了弄清以上问题,本文在天目山自然保护区毛竹向针阔混交林扩张的典型地段,连续区域上设置毛竹纯林、毛竹-针阔混交林、针阔林3种样地,对比研究3种林分内毛竹根系、针阔树根系的生物量密度(RBD,g/m2,单位面积中的根系总生物量)、细根比根长、相邻同级侧根节点距(LRIL,mm,为同一级别根分枝间隔之间的平均距离)等形态特征参数变化,探讨毛竹根系生物量及其形态特征随竹林扩张的变化规律,揭示毛竹根系形态在竞争中的可塑性反应,为研究毛竹种群扩张机制提供新的理论参考。
1材料和方法
1.1研究区概况
试验地在浙江省临安市天目山自然保护区内进行,保护区位于30°18'30″—30°21'37″N,119°24'11″—119°27'11″E;年平均气温8.9—15.8℃,最冷月气温2.6—3.4℃,极端最低气温-20.2℃,最热月气温19.9—28.1℃,无霜期209—235 d,年降水量1390—1870 mm。土壤为亚热带红黄壤类型。主要乔木树种为苦槠(Castanopsis sclerophylla)、青冈(Cyclobalanopsis glauca)、柳杉(Cryptomeria fortunei)、木荷(Schima superba)、杉木(Cunninghamia lanceolata)等;灌木有毛花连蕊茶(Camellia fraterna)、马银花(Rhododendron ovatum)、山矾(Symplocos caudata)和山胡椒(Lindera glauca)等;草本植物主要为菊科(Compositae)、禾本科(Gramineae)、鳞毛蕨科(Dryopteridaceae)和莎草科(Cyperaceae)等的植物。研究发现,近年来区内毛竹以平均4.47 hm2/a的增长速度迅速蔓延,严重蚕食了周围的原始植被[2]。
1.2实验设计
为检验毛竹扩张过程中根系形态塑性和生物量分配塑性反应,在浙江省临安市天目山国家级自然保护区前期已利用全站仪(TCR 702Xrange)布设并连续监测了7a的3条30 m宽的固定样带(位于海拔458—590 m之间,样带长度(80—120 cm)依过渡区宽度而定)[1]旁设置副样带。样带沿等高线平行设置,在连续区域上包含有毛竹林、有毛竹扩张形成的竹-针阔混交林和尚未扩张进入的针阔叶林3种林分,毛竹林为周边放弃经营的毛竹林扩张进入针阔林后,针阔叶树逐渐枯死而形成的毛竹纯林;竹-针阔混交林是监测期间毛竹向针阔林扩张而形成;针阔林为天然次生林(表1)。样带内3种林分所处的地形(坡度、坡位、坡向)、海拔等生境因子基本一致。在以上3条样带每种林分内各设置2个10 m×10 m的样地,即每种林分各6个样地,3种林分共计18个固定样地。2012年12月初和2013年6月初两次在样地内进行取样。采用根钻法(内径10 cm)在每样地随机选取5个采样点分3层(0—10,10—20,20—30 cm)钻取土样,同一土层5样点数据的平均值作为一个重复,即每种林分6个重复。另为研究根系的水平放置格局,在毛竹林、过渡林、针阔林样地内各选取标准毛竹样株、针阔树样木5株,分别于其上下左右4个方向距离树干20 cm、40 cm、60 cm处作为采样点,以同样方法分层钻取土样,同一距离和土层4个方向样点数据的平均为一个重复,共5个重复。
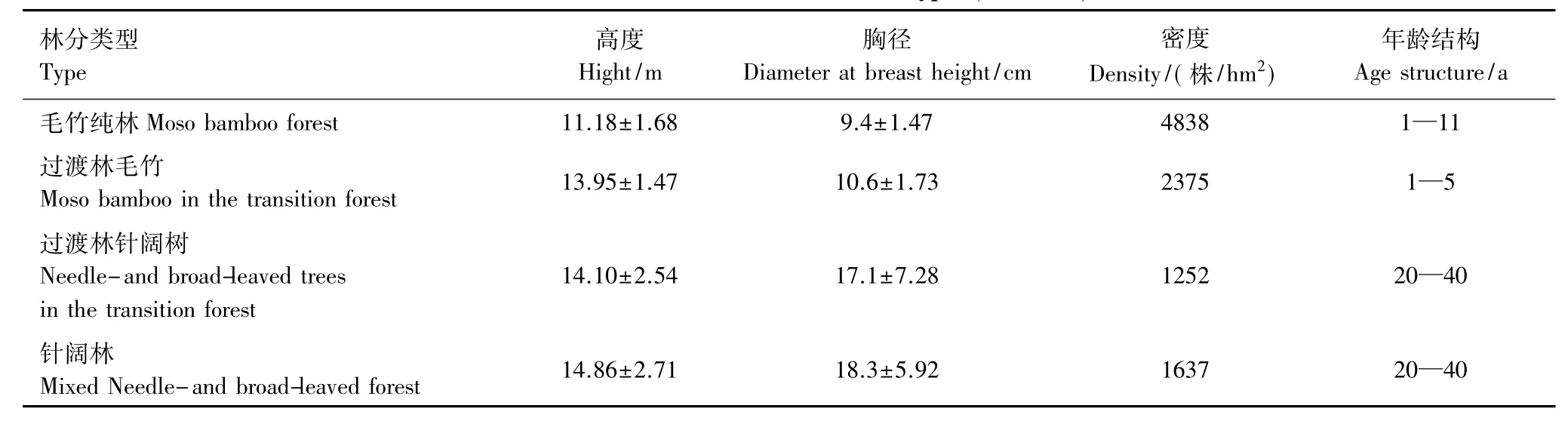
表1 3种林分基本特征(平均值±标准误差)Table 1 Characteristics of three forest types(mean±SE)
1.3根系参数测定
将土样带回实验室,仔细挑选出所有竹鞭和根系,将过渡林中的毛竹鞭根与针阔树根分开,用自来水洗净,用镊子把湿润的根系理直。将毛竹根系末梢的根定为一级根,一级根着生于二级根,用装有测微尺的显微镜(×10)测定毛竹根系一、二级侧根的节点距离(0.01 mm)。各层根系按照直径≤2 mm、2—5 mm、>5 mm分为3级,测量竹鞭及每级根系的鲜重,总长度(0.01 mm)。后置于75℃(48 h)烘箱(德国Binder)中烘干至恒重,天平(瑞士梅特勒)上测量其干重(0.001 g)。根系生物量计算公式为:根生物量(g/m2)=平均每土芯根干质量(g)÷[π×(0.1/2)2],0.1为根钻内径(m)。
1.4数据处理
采用单因素方差分析(One-Way ANOVA)和最小显著差数法(LSD)对不同林分根系生物量、根系比根长和毛竹的相邻同级侧根节点距等进行差异显著性检验(α=0.05)。方差分析前,对数据进行正态性和方差齐性检验,未通过者,进行使之齐性的转换。统计分析和制图通过SPSS17.0(SPSS公司,美国芝加哥)以及Excel2003软件实现。
2结果与分析
2.1根系分布格局
不同林分、不同径级、不同深度、距离主干不同距离处的根系分布各有其特征(表2,图1,图2)。其中毛竹鞭根除竹鞭大于5 mm外,其余根系均小于5 mm。而针阔树的根系直径为≤2 mm、2—5 mm、>5 mm的均有。
2.1.1垂直分布格局
由表2可知,0—30 cm土层自上而下,3种林分总根系生物量密度均表现出逐渐减少的趋势,但不同径级根系有所不同,毛竹≤2 mm、2—5 mm根系生物量密度无论是纯林还是过渡林均与总生物量密度趋势一致,而针阔树≤2 mm根系表现出逐渐减少的趋势,2—5 mm及>5 mm的根系则表现出0—10 cm土层中最高,20—30 cm次之,而10—20 cm最小。根系生物量在同一土层中不同林分间差异显著(P<0.05),表现为毛竹纯林>过渡林>针阔林。毛竹林竹鞭生物量显著高于过渡林(P<0.05),且均为自上而下逐渐增加。
由表2还可以看出,不同林分下各土层中根系分布的比例不尽相同,在毛竹纯林中0—10 cm,10—20 cm,20—30 cm土层的根系生物量分别占总根量的44%,32%,24%,而在过渡林3个土层内,毛竹根系生物量分别占总根量的56%,24%,20%。其中≤2 mm根系在3个土层中的比例分别由毛竹纯林的46%,32%,22%变化为过渡林的63%,20%,17%。针阔树根系生物量在针阔林3个土层中分别占总根量的46%,29%,26%。在过渡林3个土层中,分别为41%,26%,33%。其中≤2 mm根系在3个土层中的比例分别由针阔林的54%,33%,13%变化为过渡林的46%,28%,26%。可见在毛竹向针阔林扩张过程中,毛竹主要吸收根系趋向表层分布,而针阔树主要吸收根系则向深层发展。
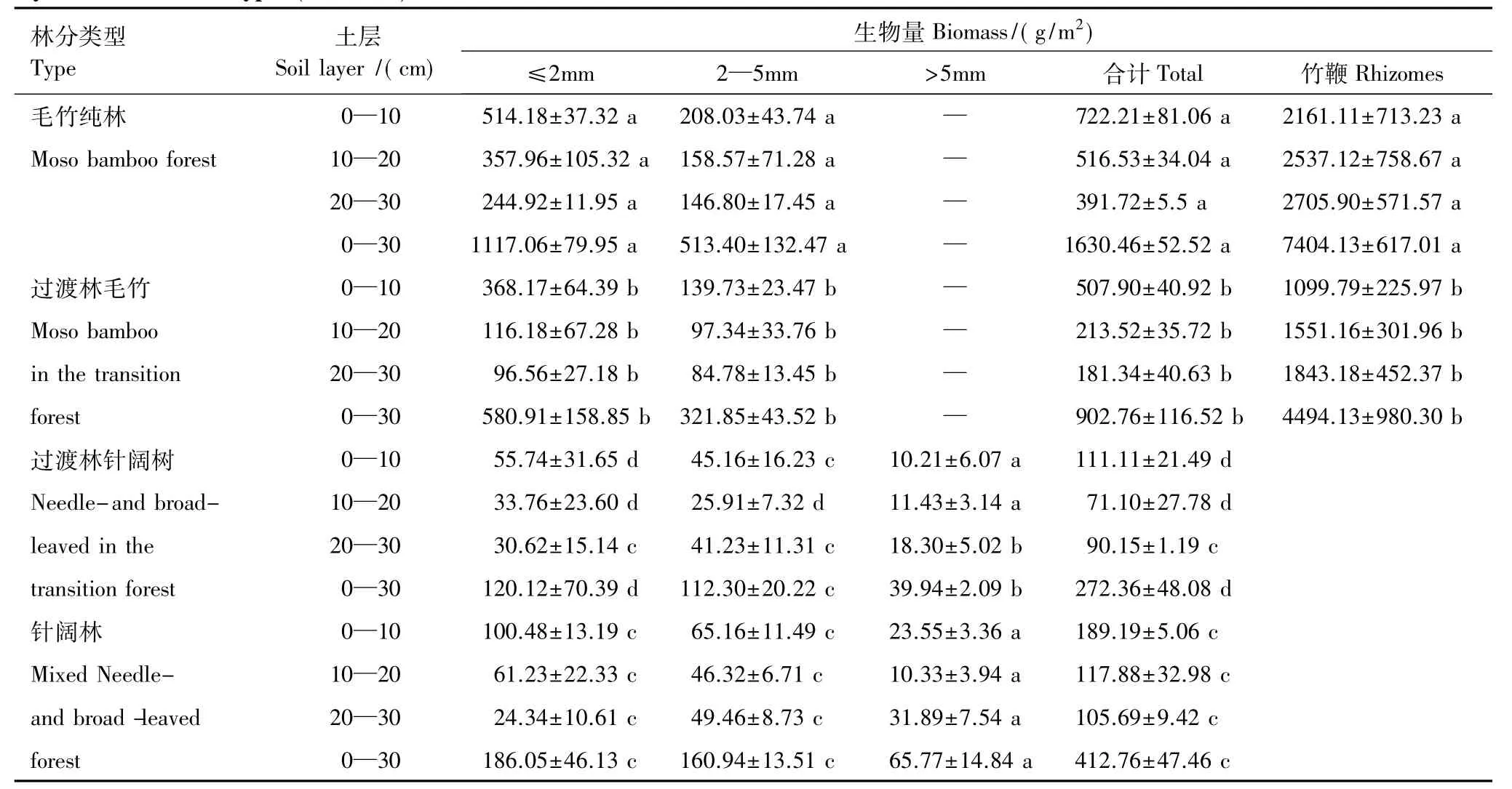
表2 3种林分3个土壤层次毛竹、针阔树根系和竹鞭生物量密度的垂直分布(平均值±标准误差)Table 2 Vertical placement patterns of root/rhizome biomass density of Moso bamboo and root of Needle-and broad-leaved trees in there soil layers of there forest types(mean±SE)
2.1.2水平分布格局
毛竹纯林毛竹根系生物量随离竹距离的增加,表现出先减少后保持稳定的趋势(图1)。≤2 mm的毛竹根系在3个土层的根系密度均表现为离竹20 cm处最高,离竹较远的60 cm处次之,离竹40 cm处最低。2—5 mm的竹根系除表层随距离逐渐降低外,10—20 cm、20—30 cm土层根系密度与≤2 mm的趋势一致。
针阔树3个径级根系生物量密度在3个土壤层次的水平放置格局趋势各不相同(图2)。针阔林≤2 mm根系整体表现出随离树距离增加逐渐减少的趋势。而2—5 mm的根系则在20—30 cm土壤层内距40 cm点相对较低。>5 mm的根系随离树干距离的增加呈下降趋势,尤以0—10 cm土层中明显。从图1、图2中还可以看出,同样距主干的距离,毛竹各级根系生物量密度明显高于针阔树。
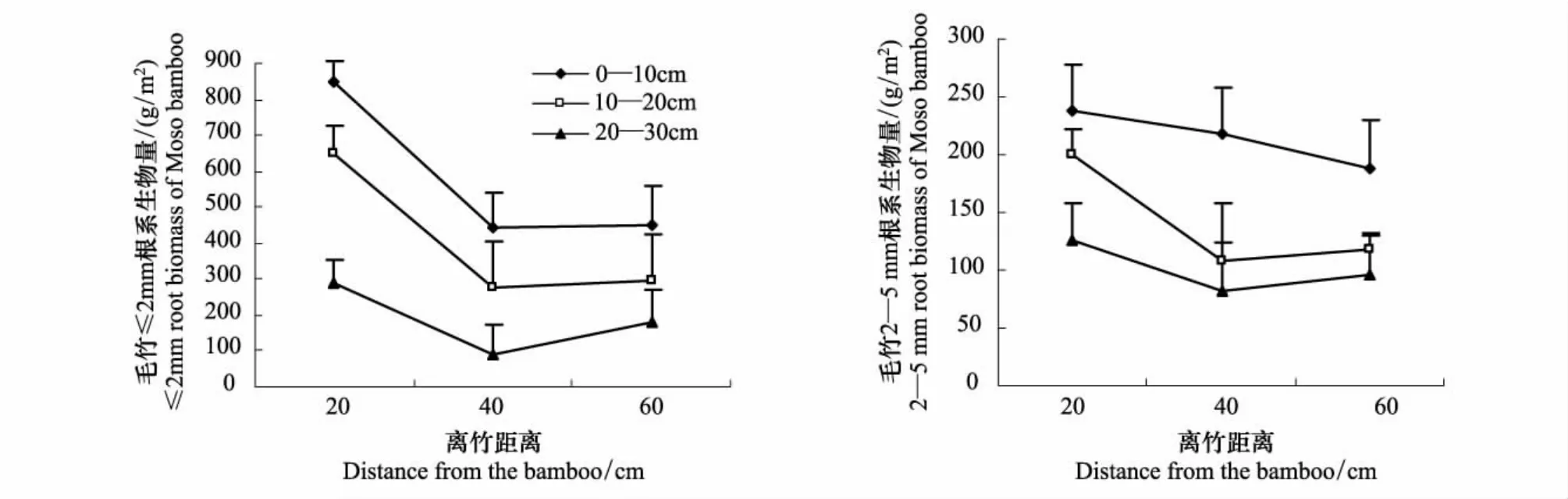
图1 毛竹纯林不同径级根系生物量密度在3个土壤层次的水平分布变化(平均值±标准误差)Fig.1 Horizontal placement patterns of the biomass density of the different diameter root of Moso bamboo forest in three soil layers(mean ±SE)

图2 针阔林不同径级根系生物量密度在3个土壤层次的水平分布变化(平均值±标准误差)Fig.2 Horizontal distribution of the biomass density of the different diameter root of the mixed Needle-and broad-leaved forest in three soil layers(mean±SE)
如表3所示,在过渡林中,毛竹、针阔树周围针阔树、毛竹根系水平分布不同。毛竹≤2 mm根系除离竹20 cm处生物量最高,为758.52 g/m2,离树20 cm处生物量最小,为224.87 g/m2外,其余水平分布点间差异均不显著(P>0.05)。2—5 mm根系则表现为离竹40、60 cm,离树60 cm处根系生物量差异不显著(P>0.05)。针阔树周围分布有大量毛竹根系,尽管毛竹根系因接近针阔树有所下降,但是离树40、60 cm处毛竹根系生物量仍大于针阔树。过渡林中,针阔树3径级根系均随离树距离增加,离竹距离减小,呈现持续下降趋势。毛竹周围仅有少量针阔树根系分布,在离竹20 cm处,无>5 mm针阔树根系分布。

表3 过渡林毛竹、针阔树不同径级根系生物量密度在0—30 cm土层的水平分布变化(平均值±标准误差)Table 3 Horizontal distribution of the biomass density of the different diameter root of Moso bamboo and the Needle-and broad-leaved trees in 0—30 cm soil layers in the transition forest(mean±SE)
2.2细根比根长
过渡林带的毛竹细根(≤2 mm)、针阔叶树细根(≤2 mm)的比根长较毛竹纯林、针阔林均发生明显改变(图3)。在0—10 cm、10—20 cm、20—30 cm 3个土层中,毛竹细根的比根长分别由毛竹纯林的4.10、4.35、5.75 m/g增加至过渡林中的4.41、5.30、6.91 m/g,平均增幅为15%,且10—20 cm,20—30 cm土层中两种林分间差异显著(P<0.05)。而各层土壤中针阔树细根的比根长在过渡林与针阔林间差异不显著(P>0.05)。在0—10 cm、10—20 cm土层中分别由针阔林中的5.87、6.91 m/g下降至过渡林中的5.16、5.94 m/g,2个土层平均下降了13%。然而在20—30 cm土层中却由针阔林中的7.87 m/g增加至过渡林的8.68 m/g。

图3 毛竹、针阔树≤2 mm细根在不同林分3个土壤层次中比根长变化比较(平均值±标准误差)Fig.3 Comparison special root length of Moso bamboo and the Needle-and broad-leaved trees(≤2 mm)in there soil layers f there forest types(mean±SE)不同小写字母表示同一土层中毛竹、针阔树细根比根长在林分间存在显著差异(P<0.05)
2.3毛竹根系LRIL
过渡林中的毛竹一、二级LRIL在3个土壤层次中较毛竹纯林均有所下降,且一级侧根的节点距在10—20 cm,20—30 cm土层中两种林分间差异显著(P<0.05)(图4),分别由毛竹纯林中的1.16、1.24 mm下降到过渡林中0.65、0.81 mm,二级侧根也有所下降但差异不显著(P>0.05)。另外,两种林分中毛竹的一级、二级LRIL在不同土层也有差异,越接近土壤表层,毛竹侧根的节点距离越小,侧根数目增多。

图4 毛竹纯林、过渡林中3个土壤层次毛竹一、二级侧根节点距的比较(平均值±标准误差)Fig.4 Comparison of the internodes length of first and second lateral roots of Moso bamboo in three soil layers between Moso bamboo forest and the transition forest(mean±SE)不同小写字母表示同一土层中同一级侧根节点距在毛竹纯林、过渡林中的差异显著(P<0.05)
3结论和讨论
3.1根系分布与毛竹扩张
本研究表明,毛竹纯林根系生物量密度(1630.46 g/m2)>过渡林毛竹根系(902.76 g/m2)>针阔林(412.76 g/m2)>过渡林针阔树根系(272.36 g/m2)。生物量的大小反映了根系广布性[16]以及对土壤资源的竞争能力[17]。毛竹密度显著高于针阔树,在向针阔林扩张时形成的混交林中其立竹度不断增加[18],相应的根系生物量也较高。这使得毛竹可以通过较多的根系占居较大的土壤空间,获取较多的养分水分资源,从而减少竞争对手可获得的资源,形成根系竞争中的利用型竞争优势[19]。另一方面,毛竹可以通过化感作用来抑制周边常绿阔叶林主要树种根系的生长[8-9],从而形成干扰型竞争优势[19],因此毛竹化感作用对其根系扩展程度的影响也是不言而喻的。根系的广布性是根系形态塑性的特征之一[11,16-17]。毛竹根系生物量远高于针阔树根系生物量,表征了毛竹具有较高的生物量可塑性。
分根方式和根系深浅度是根系结构的两个基本组成部分,根系在土壤中的分布和空间结构决定了植物获取土壤资源的多寡,明显影响着根系间的土壤资源竞争[20]。本项研究发现,毛竹在其扩张过程中根系分布格局发生明显的变化。通常根系密度随土层深度和距主干距离的增加而减少[21]。针阔林中各径级根系在3个土层中水平分布整体表现出距树干距离增加而减少的趋势。而毛竹林中根系的水平分布则表现为随距主干距离的增加,根系未明显减少,在针阔树周围分布有大量的毛竹根系。随着与毛竹的接近,针阔树根系持续下降,在毛竹周围仅有少量的针阔树根系分布。毛竹具有横向生长的鞭系结构,竹鞭在土壤中蔓延生长,发笋长竹,形成竹林,其整个地下系统是一个有机的整体,其克隆生长的特性决定了距毛竹主干较远部分的根系密度相差不大[22]。而鞭根双向和沿表面生长的生长方式可以让根系沿土壤面水平延伸,以占据更多的肥沃土壤,形成竞争优势。
根据根效率(Eroot)假说,即Eroot是单位C成本下的资源(包括养分、水分等)吸收量[23]。在营养相对丰富的斑块,克隆植物给根系投入更大比例的生物量[24]。毛竹物种属于典型的无性系繁殖(即克隆生长),在其扩张过程中,毛竹将更多的根系生物量放置于表层,0—10 cm土层的根系由纯林中的44%增加到过渡林的56%,而将针阔叶树根系排挤到深层。由于土壤中植物易利用的水分和养分大都分布在土壤表层,如果植物根系能够大量地占领土壤表层,也有可能获得更大的竞争优势[25-26]。毛竹根系扩张到针阔林后,在土壤表层的高养分斑块中大量增殖,说明毛竹根系形态塑性对竞争影响显著,符合根系塑性理论[27],体现出毛竹扩张过程中根系可塑性在获取资源的代价和效益方面的重要性。
3.2根系构筑与毛竹扩张
根系构筑在反映根系生理生态功能方面的意义更加突出,不论是种内还是种间对土壤资源的有效竞争很大程度取决于树种的细根结构和效率[28-29]。SRL反映了植物对养分与水分的吸收能力[30],SRL是与细根吸收功能直接相关的指标,通常用来估计细根的吸收能力,SRL越大,吸收能力越强[31]。本研究中发现过渡林、针阔林内针阔树细根(≤2 mm)的比根长均大于毛竹细根(≤2 mm)的比根长,这可能与二者生长繁殖特性不同有关。但在毛竹扩散过程中,其细根SRL增幅约15%,而针阔树细根SRL在0—20 cm土层中平均下降13%,表明毛竹扩散时能够通过增加细根比根长来提高养分吸收和资源竞争的能力。这与刘骏[7]等的研究结果基本一致。
有研究认为,根级可能与根形态和功能的关系更加密切[32-33]。个体根数量随根级的降低而增加,即较低级的根数量相对巨大,这有利于占据大的土壤空间来吸取更多的营养供植物体生长,是根系行使吸收功能的主要部分[34-35]。毛竹一、二级LRIL在两种林分中的变动范围仅为0.59—1.24 mm、2.32—2.63 mm,较小的侧根节点距离也就意味着更多的侧根数目。而过渡林中的毛竹侧根一、二级LRIL在3个土壤层次中较毛竹纯林均有所下降,即随着毛竹向针阔林扩张毛竹同级侧根节点之间的距离均减小,侧根数目增多,丰富的侧根数目使毛竹在与其他物种争夺土壤营养物质时更占优势。因此,SRL、LRIL两个形态参数的研究结果表明毛竹根系在扩张过程中表现出了较高的形态塑性反应和竞争优势。
本文根系形态可塑性研究仅仅反映了根系塑性的一个方面,植物根系的塑性还包括生理塑性、生长动态塑性和菌根塑性等多个方面[36]。植物根系的各种塑性往往是同时表达的,因此要研究毛竹扩张过程中根系塑性与根竞争之间的关系,以及这种关系对森林群落生物多样性的影响,还要综合考虑各种塑性在竞争中的表现,弄清根系各种塑性在根竞争中的地位,有助于更好地了解毛竹扩张过程中的根系竞争机制。
参考文献(References):
[1]白尚斌,周国模,王懿祥,梁倩倩,陈娟,程艳艳,沈蕊.天目山保护区森林群落植物多样性对毛竹入侵的响应及动态变化.生物多样性,2013,21(3): 288-295.
[2]丁丽霞,王祖良,周国模,杜晴洲.天目山国家级自然保护区毛竹林扩张遥感监测.浙江林学院学报,2006,23(3): 297-300.
[3]Kiyoshi O,Shigeyuki S,Hiroko F.Causal analysis of the invasion of broad-leaved forest by bamboo in Japan.Journal of Vegetation Science,1996,7(5): 723-728.
[4]Isagi Y,Torii A.Range expansion and its mechanisms in a naturalized bamboo species,Phyllostachys pubescens,in Japan.Journal of Sustainable Forestry,1998,6: 127-141.
[5]刘烁,周国模,白尚斌.基于光照强度变化的毛竹扩张对杉木影响的探讨.浙江农林大学学报,2011,28(4): 550-554.
[6]宋庆妮,杨清培,刘骏,余定坤,方楷,徐佩,何宇娟.毛竹扩张对常绿阔叶林土壤氮素矿化及有效性的影响.应用生态学报,2013,24(2): 338-344.
[7]刘骏,杨清培,宋庆妮,余定坤,杨光耀,祁红艳,施建敏.毛竹种群向常绿阔叶林扩张的细根策略.植物生态学报,2013,37(3): 230-238.
[8]白尚斌,周国模,王懿祥,梁倩倩,陈娟,程艳艳,沈蕊.毛竹入侵对常绿阔叶林主要树种的化感作用研究.环境科学,2013,34(10): 4066-4072.
[9]Chou C H,Yang C M.Allelopathic research of subtropical vegetation in TaiwanⅡ.Comparative exclusion of understory by Phyllostachys edulis and Cryptomeria japonica.Journal of Chemical Ecology,1982,8(12): 1489-1507.
[10]周本智,傅懋毅.竹林地下鞭根系统研究进展.林业科学研究,2004,17(4): 533-540.
[11]王鹏,牟溥,李云斌.植物根系养分捕获塑性与根竞争.植物生态学报,2012,36(11): 1184-1196.
[12]Curt T,Prévosto B.Rooting strategy of naturally regenerated beech in Silver birch and Scots pine woodlands.Plant and Soil,2003,255(1): 265-279.
[13]王政权,张彦东.水曲柳落叶松根系之间的相互作用研究.植物生态学报,2000,24(3): 346-350.
[14]张彦东,白尚斌,王政权,沈有信.混交条件下水曲柳落叶松根系的生长与分布.林业科学,2001,37(5): 18-23.
[15]Wang Q C.Spatial distribution of fine roots of larch and ash in the mixed plantation stand.Journal of Forestry Research,2002,13(4): 265-268.
[16]Wijesinghe D K,John E A,Beurskens S,Hutchings M J.Root system size and precision in nutrient foraging: responses to spatial pattern of nutrient supply in six herbaceous species.Journal of Ecology,2001,89(6): 972-983.
[17]王庆成,程云环.土壤养分空间异质性与植物根系的觅食反应.应用生态学报,2004,15(6): 1063-1068.
[18]白尚斌,周国模,王懿祥,余树全,李艳华,方飞燕.天目山国家级自然保护区毛竹扩散过程的林分结构变化研究.西部林业科学,2012,41(1): 77-82.
[19]Schenk H J.Root competition: beyond resource depletion.Journal of Ecology,2006,94(4): 725-739.
[20]Rubio G,Walk T,Ge Z Y,Yan X L,Liao H,Lynch J P.Root gravitropism and below-ground competition among neighbouring plants: A modelling approach.Annals of Botany,2001,88(5): 929-940
[21]王世伟,潘存德.干旱区绿洲灌溉条件下不同树龄轮台白杏根系的空间分布.应用生态学报,2012,23(9): 2353-2360.
[22]柯世朕,李德志,范旭丽,王超华,周燕,李红,宋云,王春叶,孙玉冰.克隆植物中的劳动分工及其生态学效应.热带亚热带植物学报,2008,16(6): 586-594.
[23]Eissenstat D M,Wells C E,Yanai R D,Whitbeck J L.Building roots in a changing environment: implications for root longevity.New Phytologist,2000,147(1): 33-42.
[24]Hutchings M J,John E A.Distribution of roots in soil,and root foraging activity.Ecological Studies,2003,168: 33-60.
[25]Mommer L,van Ruijven J,de Caluwe H,Smit-Tiekstra A E,Wagemaker C A M,Ouborg N J,Bögemann G M,van der Weerden G M,Berendse F,de Kroon H.Unveiling below-ground species abundance in a biodiversity experiment: a test of vertical niche differentiation among grassland species.Journal of Ecology,2010,98(5): 1117-1127.
[26]Genney D R,Alexander I J,Hartley S E.Soil organic matter distribution and below-ground competition between Calluna vulgaris and Nardus stricta.Functional Ecology,2002,16(5): 664-670.
[27]Makita N,Hirano Y,Mizoguchi T,Kominami Y,Dannoura M,Ishii H,Finér L,Kanazawa Y.Very fine roots respond to soil depth: biomass allocation,morphology,and physiology in a broad-leaved temperate forest.Ecological Research,2011,26(1): 95-104.
[28]梅莉,王政权,韩有志,谷加存,王向荣,程云环,张秀娟.水曲柳根系生物量、比根长和根长密度的分布格局.应用生态学报,2006,17(1): 1-4.
[29]刘聪,项文化,田大伦,方晰,彭长辉.中亚热带森林植物多样性增加导致细根生物量“超产”.植物生态学报,2011,35(5): 539-550.
[30]Ostonen I,Püttsepp Ü,Biel C,Alberton O,Bakker M R,Lõhmus K,Majdi H,Metcalfe D,Olsthoorn A F M,Pronk A,Vanguelova E,Weih M,Brunner I.Specific root length as an indicator of environmental change.Plant Biosystems,2007,141(3): 426-442.
[31]Metcalfe D B,Meir P,Aragão L E O C,Costa A C L,Braga A P,Gonçalves P H L,Junior J A S,Almeida S S,Dawson L A,Malhi Y,Williams M.The effects of water availability on root growth and morphology in an Amazon rainforest.Plant and Soil,2008,311(1-2): 189-199.
[32]Pregitzer K S,Deforest J L,Burton A J,Allen M F,Ruess R W,Hendrick R L.Fine root architecture of nine North American trees.Ecological Monographs,2002,72(2): 293-309.
[33]Guo D L,Xia M X,Wei X,Chang W J,Liu Y,Wang Z Q.Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species.New Phytologist,2008,180(3): 673-683.
[34]Guo D L,Mitchell R J,Hendricks J J.Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest.Ecosystem Ecology,2004,140: 450-457.
[35]王向荣,王政权,韩有志,谷加存,郭大立,梅莉.水曲柳和落叶松不同根序之间细根直径的变异研究.植物生态学报,2005,29(6): 871-877.
[36]Hodge A.The plastic plant: root responses to heterogeneous supplies of nutrients.New Phytologist,2004,162(1): 9-24.
The response of root morphological plasticity to the expansion of a population of Phyllostachys edulis into a mixed needle-and broad-leaved forest
SHEN Rui,BAI Shangbin*,ZHOU Guomo,WANG Yixiang,WANG Nan,WEN Guosheng,CHEN Juan
Zhejiang Provincial Key Laboratory of Carbon Cycling in Forest Ecosystems and Carbon Sequestration,Zhejiang Agriculture&Forestry University,Lin'an 311300,China
Abstract:Moso bamboo(Phyllostachys edulis),an economically important plant,is often cultivated not only for its delicious shoots and versatile culms,but also as an important biomass resource in southern China.However,with its robust growth and strong rhizomes,Moso bamboo populations have been expanding rapidly into adjacent forests.Root plasticity may enable the bamboo to efficiently forage for nutrients in heterogeneous soils.The ability of a Moso bamboo plant to respond to competition through root plasticity may be an important trait for the species,but little information is available on how root systems respond to belowground competition during colony expansion.To provide baseline information on the morphological plasticity of the response of Moso bamboo roots during population expansion,we continuously sampled three forest types.These were 1)Moso bamboo forest; 2)mixed bamboo,needle- and broad-leaved forest(or transition forest); and 3)mixed needle-and broad-leaved forest.This study was conducted in a typical transition zone in the TianMu Mountain Nature Reserve,Zhejiang Province,China,where there is ongoing bamboo expansion.Rhizomes and roots from Moso bamboo,and roots from mixed needle- and broad-leaved trees were collected by the soil core method to analyze root morphological parameters,including root biomass density,special root length,and internodes length of lateral roots of the same order.The results showed that(1)the root/rhizome system biomass of the three forest types could be ranked as Moso bamboo forest(Moso bamboo root/rhizome system biomass = 1630.46 g/m2)>Moso bamboo in the transition forest(902.76 g/m2)>book=327,ebook=55the mixed needle-and broad-leaved forest(the needle-and broad-leaved trees root system biomass = 412.76 g/m2)>the needle-and broad-leaved trees root system biomass in the transition forest(272.36 g/m2).As Moso bamboo expanded into a mixed needle-and broad-leaved forest,Moso bamboo culm density increased gradually,with a corresponding increase in root biomass.(2)In a vertical direction,the root system biomass of Moso bamboo in the 0–10 cm soil layer increased from 44% of all root biomass in the Moso bamboo forest to 56% in the transition forest.Simultaneously,the root biomass of needle-and broad-leaved trees shifted from the upper to lower soil layers.The root system of Moso bamboo managed to place more biomass in upper soil layers when it encountered other trees,allowing it to gain a competitive advantage.(3)In the horizontal direction,the root biomass of Moso bamboo did not significantly decline with an increase in distance from the sample tree,while the root biomasses of needle-and broad-leaved trees decreased with increasing distance from the sample tree.(4)The special root length of Moso bamboo in the transition forest increased by an average of 15% compared to the Moso bamboo forest,while the internodes length of first and second lateral roots decreased.The number of bamboo lateral roots also increased.Moso bamboo,with its ability to increase the special root length and decrease the length of the lateral root internodes,would outcompete trees in the belowground environment.These findings indicate that the morphological plasticity of Moso bamboo,shown by its root biomass,special root length,and internode length of the same order lateral roots,easily results in the expansion of Moso bamboo populations into surrounding forest.
Key Words:belowground competition; invasive species; root plasticity; Tianmu Mountain Nature Reserve
*通讯作者
Corresponding author.E-mail: sequia96@ 163.com
收稿日期:2014-01-19;网络出版日期: 2015-06-10
基金项目:国家自然科学基金项目(31170594; 31270497);浙江省自然科学基金项目(LY14C160010);浙江农林大学科研发展基金资助项目(2009FR060);临安市科技发展计划项目(05067)
DOI:10.5846/stxb201401190143
