3种镰刀菌对小扁豆生长的影响
2016-05-07安欢乐宋雨阳李彦忠
安欢乐,燕 翀,徐 娜,宋雨阳,李彦忠,2
(1.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃兰州 730020; 2.中国农业科学院草原研究所,内蒙古呼和浩特 010010)
3种镰刀菌对小扁豆生长的影响
安欢乐1,燕 翀1,徐 娜1,宋雨阳1,李彦忠1,2
(1.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃兰州 730020; 2.中国农业科学院草原研究所,内蒙古呼和浩特 010010)
小扁豆(Lens culinaris)是甘肃中部地区普遍栽培的小杂粮之一,既是经济作物,又是轮作倒茬和肥地作物。会宁县种植的小扁豆近年来死亡严重,为查明其死亡原因,开展了田间调查与病原物研究。2012年,当地小扁豆根腐病的发病率为58.4%,死亡率为43.2%,从发病植株的根部分离出的真菌从形态学上鉴定为尖孢镰刀菌(Fusarium oxysporum)、锐顶镰刀菌(F.acuminatum)和木贼镰刀菌(F.equiseti),分离率分别为55%、18%和9%,以ITS为引物扩展真菌的DNA,测序后构建的系统发育树支持以上形态学鉴定结果。接种试验结果显示,此3种镰刀菌均能显著(P<0.05)降低植株的根长和干重,其中尖孢镰刀菌的影响最大,其次为木贼镰刀菌,此2种镰刀菌还显著降低植株的鲜重和株高,但3种镰刀菌均未对出苗率和死亡率产生影响(P>0.05)。在发病田间采集的土壤中播种小扁豆,与灭菌土壤中栽培的植株相比,未灭菌土壤中植株的根长和根干重显著降低。3种镰刀菌对小扁豆菌有致病性,但致病性均不强,干旱可能是导致镰刀菌在田间危害程度加大的主要原因。
小扁豆;镰刀菌;鉴定;致病性测定
小扁豆(Lens culinaris)又名滨豆、鸡眼豆、眉豆等,富含蛋白质、矿物质、纤维素、维生素和抗氧化物化合物,栽培历史已有8 000~12 000年,是许多发展中国家主要的蛋白质来源[1-2]。在我国,小扁豆是小杂粮作物的一种,主要栽培于陕西、甘肃、宁夏、山西、内蒙古、云南和西藏等省(区)[3]。甘肃省会宁县有悠久的种植杂粮作物历史,享有“中国小杂粮之乡”的美称。
世界上小扁豆的主要叶部病害有壳二孢叶枯病(Ascochyta lentils)、炭疽病(Colletotricum lindemuthianum)、葡萄孢灰霉病(Botrytis cinerea)、链格孢枯萎病(Alternaria alternata)等,小扁豆根腐病也是影响产量的重要病害,其病原菌有立枯丝核菌(Rhizoctonia solani)、齐整小核菌(Sclerotium rolfsii)、镰刀菌(Fusarium spp.)、核盘菌(Sclerotinia sclerotiorum)、豌豆根腐丝囊菌霉(Aphanomyces euteiches)、瓜果腐霉(Pythium aphanidermatum)、根串珠霉(Thielaviopsis basicola)、甘薯丝核菌(Rhizoctonia bataticola)[4-6]。
小扁豆生长期间植株死亡,造成较大损失。但对其死亡原因研究较少,其中张彦梅和李敏权[7]于2007年报道甘肃省定西地区小扁豆死亡的原因为镰刀菌根腐病(Fusarium spp.),优势种为尖孢镰刀菌(F.oxysporum)。在甘肃中部地区,豌豆(Pisum sativum)在开花前后大量死亡的情况最早始于2000前,后来由于病害的发生,各地陆续减少了种植面积,目前已极少种植。近年来,在会宁等甘肃中部地区扁豆死亡的情况逐年加剧,已有不少农民放弃了种植。对于甘肃豌豆死亡的原因,前人分析主要是由腐皮镰孢(F.solani)、链孢粘帚霉(Gliocladium catenulatum)、豌豆根腐丝囊菌霉(A.euteiches)、根串珠霉、立枯丝核菌、尖孢镰刀菌(F.oxysporum)、腐霉(Pythium spp.)、壳二孢(Ascochyta spp.)等病原菌引起的[8-9]。由于我国记录的小扁豆根腐病的病原种类较少,除镰刀菌根腐病之外,其他均未报道。为确定小扁豆死亡的原因是否为病原菌所致,如果是病原菌,是何种病原菌,因此在甘肃会宁开展田间调查与病原菌的研究。
1 材料和方法
1.1研究地点
病害调查与标本采集在甘肃省会宁县翟所乡观音村杨岔社进行,该地属典型黄土高原地区。
1.2供试土壤和植物材料
用两种土壤培养小扁豆幼苗供接种所用,其一取自甘肃省会宁县小扁豆发病样地,采用五点取样,每点取0―10 cm的土约500 g,带回实验室后用2 mm孔径的筛子剔除植物秸秆和大块土石,将细碎的土粒置于冷藏箱4℃保存备用,其二为购自花市的土壤,按黑壤土、腐熟牛粪和植株腐殖质7∶2∶1的比例混合而成。小扁豆种子为2012年在会宁当地采收所得,品种不详。
1.3田间调查与标本采集
于2012年6月于小扁豆结荚中期在研究地按如下方法开展病害调查:选取3块扁豆地,采用“Z”型调查,每块地共调查5个点,每地选1 m2,统计植株总数和死亡植株数,按如下公式计算死亡率:
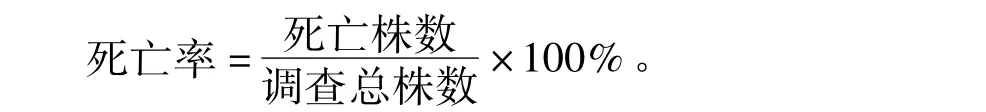
同时在各样点上随机挖取带根的植株10株,将植株带回室内供分离病原。
1.4根腐植株统计与病原分离
1.4.1根腐植株统计 将带回的小扁豆根部剪下,将根部在自来水下冲洗干净,观察根部是否变色腐烂,有变色者记为发生根腐病的植株,并计算根腐病的发病率:
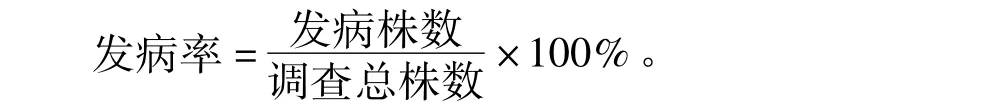
1.4.2病原分离 将洗净的根部,用70%酒精消毒1 min,然后用1%的次氯酸钠消毒3 min,再用无菌水洗3次,用灭菌的滤纸吸干表面水分,将其切成0.5 cm长的小段,均匀摆放在马铃薯葡萄糖琼脂培养基(PDA)上,在22℃培养箱中培养4 d后统计组织小块上长出各种真菌的种类及数量,纯化所有分离菌,于第7天再次统计一次,校正首次统计的结果,根据每种菌在组织小块上出现的次数计算其分离率。PDA培养基的制作方法为:称200 g去皮的土豆,加入1 000 mL蒸馏水,煮沸30 min,双层纱布过滤,滤液清液中加入17 g琼脂粉和20 g葡萄糖,缓缓加入蒸馏水然后定容1 000 mL,121℃下灭菌30 min,再将培养皿倒入培养皿(9 cm)中,每个培养皿中25 mL,制成平板[10]。
1.5菌株鉴定
1.5.1形态学鉴定 根据菌落和孢子及其产孢结构的形状、颜色和大小鉴定菌种[11]。
1.5.2分子方法鉴定 用真菌DNA提取试剂盒(型号为D3195-1)提取3种菌的DNA,用引物ITS1 (AGGAGAGTCGTAACAAGGT )和ITS4 (TCCTCCGCTTATTGATATGC)进行PCR扩增,将PCR产物委托上海生工生物有限公司测序。将测得的序列进行BLAST比对并用MEGA5.1软件系统发育树,确定其与所选的菌种的亲缘关系[12]。
1.6分离出真菌的致病性测定
1.6.1接种幼苗的准备 挑选颗粒饱满的小扁豆种子,经常规表面消毒后摆放在铺有两层灭菌滤纸的培养皿中,每皿摆放100粒,加无菌水3~5 mL,放置在25℃下使之发芽,发芽后用于接种。
1.6.2孢子悬浮液的配制 将培养2周的分离物每皿加灭菌蒸馏水5 mL,用灭菌的载玻片轻轻刮下孢子,用双层灭菌纱布过滤,将滤液摇匀制成孢子悬浮液,用血球计数板测量孢子的浓度,将孢子浓度调节为106·mL-1后用于接种之用。
1.6.3接种及接种后测定指标 采用植物幼苗蘸真菌孢子悬浮液的接种方法,即将小扁豆的幼苗在真菌孢子悬浮液中浸泡30 min后移栽到装有灭菌土壤的纸杯中。共接种3种真菌,每种真菌设5个重复(杯),以幼苗蘸无菌水作为空白对照,对照5个重复(杯)。接种后移栽于装有200 g灭菌土壤的纸杯中,每杯3株,纸杯口径7 cm,底部开孔。接种后将幼苗放置在22℃的光照植物培养箱中。6周后观察发病情况,并收获植株,清洗每株植株的根部,测量株高和根长,挑选部分植株用于接种菌的再分离,分离方法同1.4.2。称鲜重后在65℃烘箱中烘24 h,称干重。
1.7田间土壤带菌试验
将采集于小扁豆死亡田间土壤分成两部分,一部分在167℃的烘箱中灭菌4 h后播种小扁豆,另一部分土壤不经灭菌直接播种小扁豆。设5个重复(纸杯),每重复(纸杯)播种5粒小扁豆种子,播种后管理和测定指标同1.6.3。
1.8数据分析
采用SPSS 19.0软件对所测数据统计分析,用平均值和标准误表示测定结果,分别对株高和根长,烘干后测定单株干重进行单因素方差分析,并用新复极差法对各测定数据进行多重比较,采用Excel 2003制图。
2 结果与分析
2.1田间发病症状、发病率与死亡率
在田间,小扁豆植株底部的叶片开始退绿变黄,并向上延伸至整个植株(图1A),发病植株的根部呈红褐色至黑色,根瘤极少(图1B)。大量植株死亡,死亡植株多发生于地块边缘(图1C,D)。田间根腐病的平均发病率为58.4%,平均死亡率为43.2%。
2.2病原分离
从田间采集的小扁豆的根部主要分离出3种真菌,菌株编号分别为yanch1、yanch3和yanch2,分离率分别为55%、18%和9%(图2)。
2.2.1形态学鉴定 根据形态特征初步鉴定分离出的3种真菌均为镰刀菌。yanch1在PDA上生长迅速,菌落灰白,绒状且菌丝中间致密周围稀疏,小型分生孢子数量较多,卵形或肾形,没有隔膜,有厚垣孢子产生。yanch2在PDA上生长迅速,气生菌丝茂密,初生菌丝白色,随着培养时间的不断延长菌丝颜色逐渐由白色变化为粉红色,大型分生孢子为镰刀形,没有小型分生孢子。yanch3在PDA上生长迅速,菌丝白色絮状,不形成小型分生孢子;大型分生孢子较为弯曲,顶胞钩状,厚垣孢子团状或链状。根据形态学鉴定,yanch1为尖孢镰刀菌,yanch2为锐顶镰刀菌(F.acuminatum),yanch3为木贼镰刀菌(F.equiseti)。
2.2.2分子鉴定 将3种镰刀菌的序列与其它已有的镰刀菌的序列用MEGA5.1进行分析,做系统发育树。系统发育树结果(图3)显示,yanch2与F.acuminatum聚在一个枝上,其自展值为84; yanch3 与F.equiseti聚在一个枝上,自展值为99; yanch1与F.oxysporum聚在一个枝上,自展值为82。故根据分子方法鉴定出3种镰刀菌与形态学鉴定的结果相吻合。
2.3致病性测定
2.3.1 3种镰刀菌致病性测定 接种3种镰刀菌6周后,与对照相比较,接种的3种镰刀菌的小扁豆植株无退绿变黄,根部并未出现明显的变黑或者变褐等田间症状,但是其植株的高度和根系的形状有所不同。从接种小扁豆植株的根部分离出接种菌,尖孢镰刀菌、锐顶镰刀菌、木贼镰刀菌的再分离率分别为83.2%、8.4%和6.9%。

图1 小扁豆田间发病症状和根部观察Fig.1 Lentil field symptoms and root observation
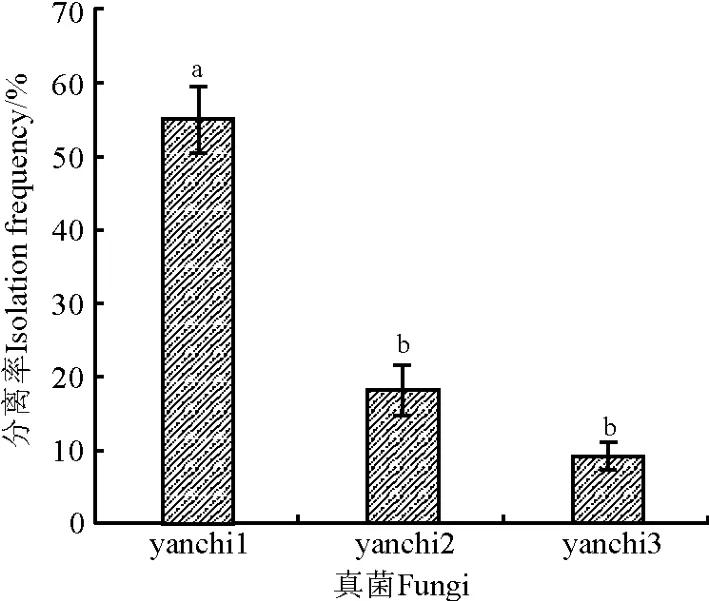
图2 小扁豆根部分离出真菌Fig.2 Fungi isolated from lentil roots
2.3.2对植株生长的影响 尖孢镰刀菌显著降低植株鲜重(P<0.05),其次为木贼镰刀菌,而接种锐顶镰刀菌的植株的鲜重与对照之间差异不显著(P>0.05)(图5)。接种3种镰刀菌后,植株的干重显著低于对照。木贼镰刀菌和尖孢镰刀菌均使植株的株高显著降低,而接种锐顶镰刀菌对株高无显著影响。接种3种镰刀菌均显著降低植株的根长,其中尖孢镰刀菌影响最大,其次为木贼镰刀菌,最后为锐顶镰刀菌(图4)。
2.4病土栽培
与灭菌土壤相比,未灭菌土壤植株的根长(图5)、根鲜重和根干重(表1)显著(P<0.05)降低,但株高、地上鲜重和地上干重未灭菌和灭菌土壤差异不显著。
3 讨论与结论
国内外已有研究的小扁豆上的镰刀菌有尖孢镰刀菌、锐顶镰刀菌、木贼镰刀菌、燕麦镰刀菌(F.avenaceum)、黄色镰刀菌(F.culmorum)、腐皮镰刀菌、串珠镰刀菌7种[7,13]。张彦梅和李敏权[7]曾对甘肃省定西的小扁豆根腐病进行研究,结果显示,其病原菌为尖孢镰刀菌、茄镰刀菌、串珠镰刀菌和木贼镰刀菌,其中尖孢镰刀菌为优势种,本试验分离的镰刀菌为尖孢镰刀菌、锐顶镰刀菌、木贼镰刀菌。镰刀菌为土壤习居菌,普遍存在于土壤中,所分离到的镰刀菌与国内外有所不同,故当地是否存在其他镰刀菌尚有待进一步研究。
本研究分离出的3种镰刀菌在室内接种试验中均未造成小扁豆死亡,但对小扁豆的株高、根长、单株鲜重及单株干重都有一定影响。病土栽培试验中,土壤中的镰刀菌对小扁豆的根系生长有影响。在根腐病发病率统计时,观察到小扁豆根系较小,几乎观察不到根瘤。试验结果说明当地土壤中的镰刀菌对小扁豆具有侵染力,但致病性较弱,影响了植株的生长却未造成植株死亡,故田间小扁豆死亡不是镰刀菌单因素引起的,可能还有其他因素的影响。
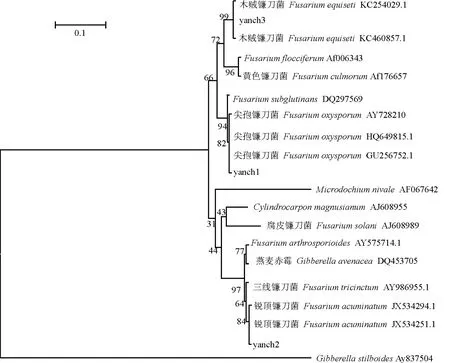
图3 基于小扁豆根部分离出镰刀菌构建的系统发育树Fig.3 Phylogenetic tree based on Fusarium spp.isolated from lentil root
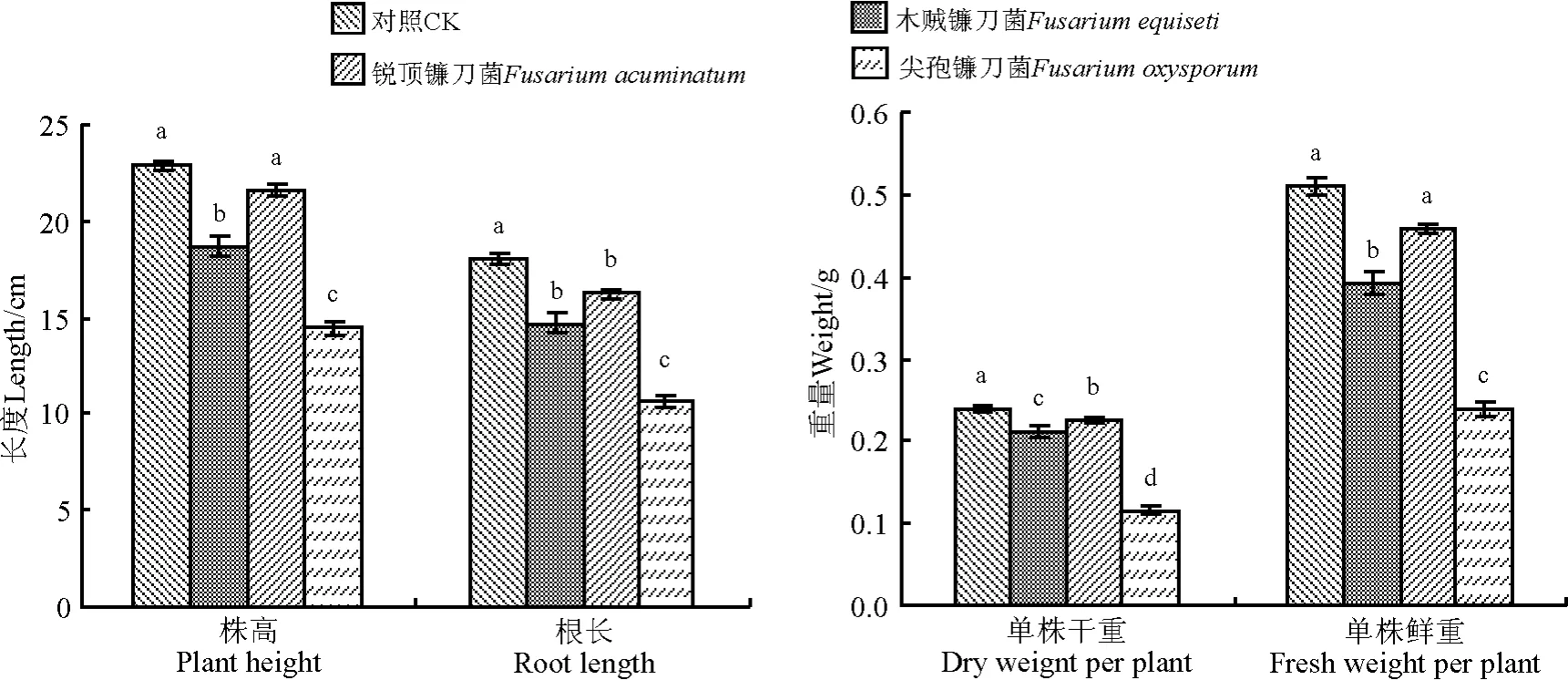
图4 分离出的3种镰刀菌对小扁豆生长的影响Fig.4 Effects of 3 fusariums isolated to lentils growth
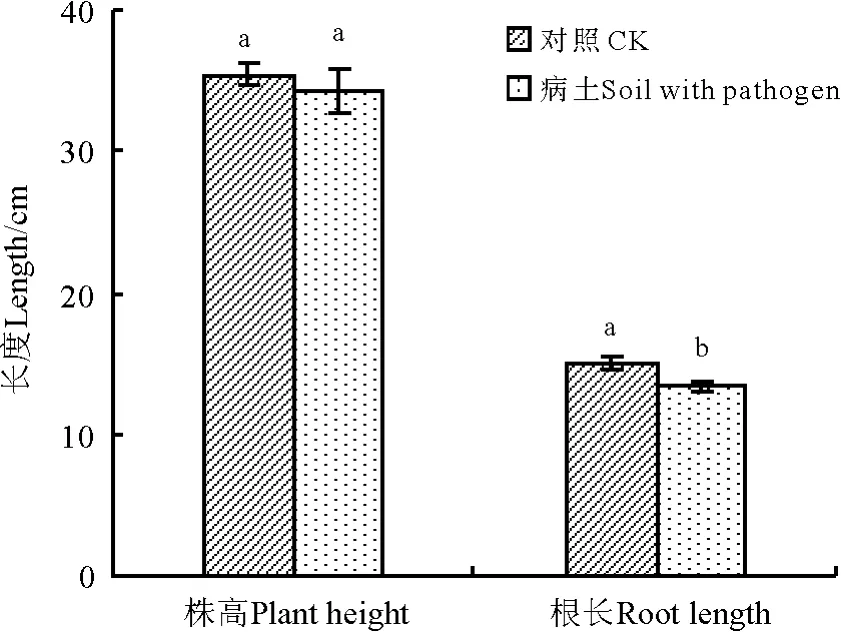
图5 采集田间病土栽培结果Fig.5 The result of cultivation in field soil with pathogen
研究[14]表明,低温、干旱、高温、营养物质缺乏、营养物质毒性等都是小扁豆非生物胁迫的主要因素,其中水分和温度被认为是最主要的胁迫因素,包括是过度干旱、土壤水分过多、温度过低、温度过高等[15]。小扁豆适宜于年降水量155~483 mm的地区[16-17],而会宁县的四季分明,昼夜温差大,夏季炎热高温,日照较强,年平均气温12.15℃,7月份平均气温24℃,年降水量仅在340 mm左右,且分布不均匀,主要集中在7-9月,年蒸发量却高达1 800 mm[18]。据此,增加根部深度可以作为减少干旱胁迫的一种方式[14]。会宁当地6 -7月小扁豆处于开花结荚期,消耗水分多,但此时降雨少、气温高、光照强,可引起小扁豆代谢水分的机能下降。就镰刀菌而言,干旱反而有利于其生长,因为土壤中的镰刀菌属好氧型的,在干燥的土壤环境中生长比较活跃,土壤干燥比土壤湿润更有利于该菌生存[19]。Stover[20]研究6种镰刀菌最适合生长的土壤条件为土壤水分饱和度的15%。在会宁小扁豆根部的镰刀菌中,尖孢镰刀菌为优势种,该菌是世界范围内小扁豆萎蔫病的主要菌种,可发生于小扁豆的整个生长时期。据报道,20~25℃的土壤温度有利于该菌生长,但较强光照和较高温度增强了植株的蒸腾作用,故夏季高温是决定症状的关键因素[21]。
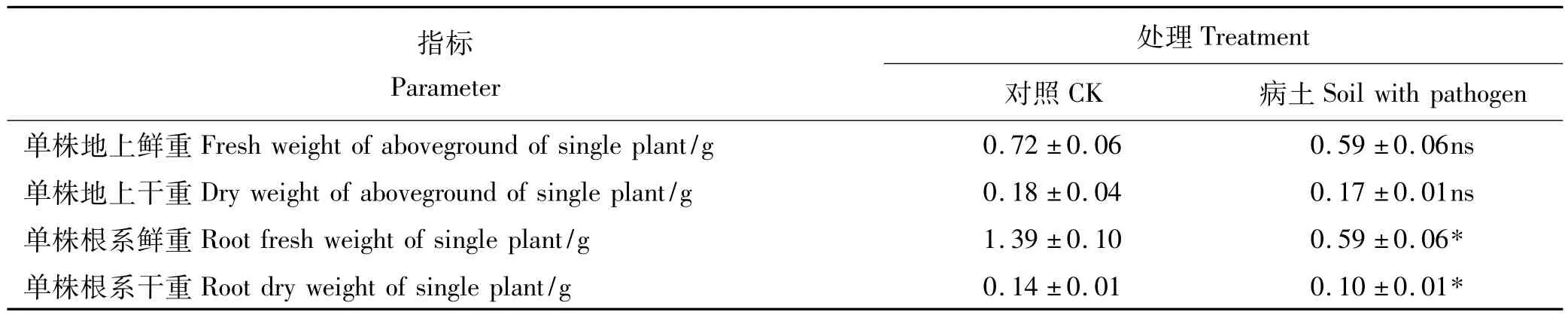
表1 病土对小扁豆生长影响Table 1 Effects of filed soil with pathogen to lentils growth
镰刀菌不仅影响小扁豆植株的生长,而且影响根瘤菌的形成,使病株根部的根瘤数量下降,从而影响植株的生长和产量[22-23]。研究表明,根瘤菌通过其固氮作用、根瘤菌和苜蓿共生免疫作用、对植物自身组成变换或其生理应答机制进行改变从而提高苜蓿的抗旱、耐盐、抗高温及非机械损伤等非生物胁迫能力[24]。本试验观察到小扁豆根系上根瘤菌的数量很少,故根瘤菌的不正常生长影响小扁豆抗逆性和氮素的固定。根瘤菌可以提供小扁豆生长的3 /4的氮素,也通过共生作用能增强植物抗逆性[25],根瘤菌结瘤受到阻碍,小扁豆的氮素供应不足并且抗逆性减弱,影响小扁豆有机物的积累及根系的生长,进而影响其在干旱条件下吸收深层土壤的水分,同时利于病原菌的侵入。
本研究对甘肃省会宁县小扁豆的死亡进行调查研究结果显示,所分离到的3种镰刀菌对小扁豆致病性弱,对小扁豆生长有影响,病土栽培试验及小扁豆根部根瘤菌的生长状况进一步印证镰刀菌对小扁豆根部有影响,但是镰刀菌并未造成小扁豆死亡。会宁当地气候条件适宜土壤中镰刀菌的生长,对小扁豆的生长存在胁迫因素,同时镰刀菌的生长抑制根瘤菌的生长,从而减弱了植株的抗逆性。病原菌和干旱共同作用下小扁豆遇到高温天气可能是导致当地小扁豆根腐病发生的原因,这还需要进一步的研究验证。
References)
[1]Taylor P,Lindbeck K,Chen W,Ford R.Lentil Diseases.Germany: Springer Netherlands,2007: 291-313.
[2]陈喜明,高克昌,韩云丽,赵随堂,赵壮芳,赵力.小扁豆特征特性及高产栽培技术.中国农业信息,2011(4) : 31-31.Chen X M,Gao K C,Han Y L,Zhao S T,Zhao Z F,Zhao L.Lentils characteristics and high yield cultivation techniques.China Agricultural Information,2011(4) : 31-31.(in Chinese)
[3]叶静渊.《马首农言》中的"扁豆"考辨.中国农史,1995,14(1) : 13-18.Ye J Y.Study“Lentils”in《Ma Shounong words》.Agriculture History of China,1995,14(1) : 13-18.(in Chinese)
[4]Beniwal S,Bayaa B,Weigand S,Makkouk K,Saxena M.Field Guide to Lentil Diseases and Insect Pests.Aleppo: International Center for Agricultural Research in the Dry Areas,1993: 5-106.
[5]Datta S,Choudhary R,Shamim M,Singh R,Dhar V.Molecular diversity in indian isolates of Fusarium oxysporum f.sp.lentis inciting wilt disease in lentil (Lens culinaris Medik).African Journal of Biotechnology,2011,10(38) : 7314-7323.
[6]Jermyn W A.Guidelines for Growing Lentils.Lincoln: Crop Research Division,1982.
[7]张彦梅,李敏权.甘肃定西小扁豆镰刀菌根腐病病原鉴定及致病性测定.杂粮作物,2007,27(3) : 235-237.Zhang Y M,Li M Q.Identification and pathogenicity test of pathogenic of lentil root diease in Dingxi of Gansu Province.Rain Fed Crops,2007,27(3) : 235-237.(in Chinese)
[8]王华.定西豌豆根腐病的发生流行与综防意见.甘肃农业科技,1995(6) : 32-33.Wang H.Epidemic and integrated control opinion of pea root rot in Dingxi.Gansu Agriculture Science and Technology,1995(6) : 32-33.(in Chinese)
[9]伍克俊,谢正团,李秀君.甘肃中部地区豌豆根腐病病原研究.甘肃农业大学学报,1992,27(3) : 225-231.Wu K J,Xie Z T,Li X J.Study on the pathogens of root rot of pea in the central region of Gansu Province.Journal of Gansu Agricultural University,1992,27(3) : 225-231.(in Chinese)
[10]方中达.植病研究方法.北京:中国农业出版,1998: 46.Fang Z D.Methodology for Plant Pathology.Beijing: China Agricultural Press,1998: 46.(in Chinese)
[11]John F L,Summerell B A.The Fusarium Laboratory Manual.England: Blackwell Publishing Professional,2006: 274-275.
[12]龚弘强.西藏地区青稞籽粒镰孢属真菌及其致病性研究.西安:西北农林科技大学硕士学位论文,2006.Gong H X.Studies on isolation and pathogenicity of Fusarium ssp.from highland barley kernels in Tibet.Master Thesis.Yangling: Northwest Agriculture and Forestry University,2006.(in Chinese)
[13]Fletcher J,Broadhurst P,Bansal R.Fusarium avenaceum: A pathogen of lentil in New Zealand.New Zealand Journal of Crop and Horticultural Science,1991,19(2) : 207-210.
[14]Muehlbauer F J,Cho S,Sarker A,McPhee K E,Coyne C J,Rajesh P,Ford R.Application of biotechnology in breeding lentil for resistance to biotic and abiotic stress.Euphytica,2006,147(1-2) : 149-165.
[15]Webb C,Hawtin G.Lentils.Farnham Royal: Commonwealth Agricultural Bureaux,1981: 216.
[16]Rathore R,Khandwe R,Khandwe N,Singh P.Effect of irrigation schedules,phosphorus levels and phosphate solublizing organism on lentil yield.Lens,1992,19: 17-19.
[17]Saraf C S,Baitha.Effect of varying soil moisture regimes and phosphorus levels on growth,yield and consumptive use of water by lentils planted on different dates under llelhi condition.LENS Newsletter,1979(6) : 1-7.
[18]李曼.气候变化对会宁县粮食作物单产的影响研究.兰州:兰州大学硕士学位论文,2011.Li M.The impact of climate change on cereal crop unit yield in Huining.Master Thesis.Lanzhou: Lanzhou University,2011.(in Chinese)
[19]Cook R,Papendick R.Influence of water potential of soils and plants on root disease.Annual Review of Phytopathology,1972,10(1) : 349-374.
[20]Stover R.The effect of soil moisture on Fusarium species.Canadian Journal of Botany,1953,31(5) : 693-697.
[21]Stoilova T,Chavdarov P.Evaluation of lentil germplasm for disease resistance to Fusarium wilt (Fusarium oxysporum f.sp.lentis).Journal of Central European Agriculture,2006,7(1) : 121-126.
[22]Hwang S,Howard R,Chang K,Park B,Burnett P.Etiology and severity of fusarium root rot of lentil in Alberta.Canadian Journal of Plant Pathology,1994,16(4) : 295-303.
[23]Hwang S,Gossen B,Turnbull G,Chang K,Howard R,Thomas A.Effect of temperature,seeding date,fungicide seed treatment and inoculation with Fusarium avenaceum on seedling survival,root rot severity and yield of lentil.Canadian Journal of Plant Science,2000,80(4) : 899-907.
[24]杨培志.紫花苜蓿根瘤菌共生对干旱及盐胁迫的响应机制研究.杨凌:西北农林科技大学博士学位论文,2012. Yang P Z.Mechanism Involved in drought/dalt tolorance improvement in anfalfa due to symbiotic interaction with rhizobium.PhD Thesis.Yangling: Northwest Agriculture and Forestry University,2012(in Chinese)
[25]Tickoo J,Sharma B,Mishra S,Dikshit H.Lentil (Lens culinaris) in India: Present status and future perspectives.Indian Journal of Agricultural Science,2005,75(9) : 539-562.
(责任编辑 王芳)
Effects of three Fusarium spp.on the growth of lentil in Huining County,Gansu Province
An Huan-le1,Yan Chong1,Xu Na1,Song Yu-yang1,Li Yan-zhong1,2
(1.College of Pastoral Agriculture Science and Technology,Lanzhou University,State Key Laboratory of Grassland Agro-ecosystems,Lanzhou 730020,China; 2.Institution of Grassland Research of CAAS,Hohhot 010010,China)
Lentil is one of the widely planted crops in the center areas of Gansu Province as economic,rotation and soil-fertilized plant.However,death of lentil is very serious in Huining County in recent years.The field investigation,isolation and identification of causal agent were conducted to determine the reasons of plant death.In 2012,incidence of lentil root rot was 58.4%,and mortality was 43.2%.Fungi isolated from the roots of diseased plants were morphologically identified as Fusarium oxysporum,F.acuminatum and F.equiseti,which were consistent with the phylogenetic tree based on ITS sequence.Isolation frequency of these fungi was 55%,18% and 9%,respectively.In the inoculation experiment,the root length and root dry weight of host inoculated with all 3 fungi significantly (P <0.05) decreased in which the host with F.oxysporum decreased most and the host with F.equiseti decreased more.The fresh weight and plant height of host inoculated with F.oxysporum and F.equiseti also decreased.However,the emergence and survival rates of host inoculated with all 3 fungi were not affect (P>0.05).The soils were collected from lentils fields in Huining as plants growth medium.Compared with plants grown in autoclaved soil,root length and root dry weight of plant grown in no-autoclaved soil significantly (P<0.05) decreased.In conclusion,3 Fusarium species were weak pathogenic to lentils.Drought possible was the main reason for these Fusarium species causing serious death on lentils.
Lens culinaris; Fusarium spp.; identification; pathogenicity
Li Yan-zhong E-mail: liyzh@ lzu.edu.cn
S520.8; S435.2
A
1001-0629(2016) 1-0067-08*
10.11829/j.issn.1001-0629.2015-0038
安欢乐,燕翀,徐娜,宋雨阳,李彦忠.3种镰刀菌对小扁豆生长的影响.草业科学,2016,33(1) : 67-74.
An H L,Yan C,Xu N,Song Y Y,Li Y Z.Effects of three Fusarium spp.on the growth of lentil in Huining County,Gansu Province.Pratacultural Science,2016,33(1) : 67-74.
2015-01-16 接受日期: 2015-11-03
国家自然科学基金(31272496) ;公益性行业(农业)科研专项经费项目(201303057) ;国家牧草产业技术体系(CARS-35)
安欢乐(1989-),女,陕西永寿人,在读硕士生,主要从事植物病理学研究。E-mail: anhl13@ lzu.edu.cn
李彦忠(1969-),男,甘肃会宁人,教授,博士,主要从事植物病理学研究。E-mail: liyzh@ lzu.edu.cn
book=73,ebook=77
