尿素合成塔化学爆炸的可能性分析(三)
2016-05-05沈华民
尿素合成塔化学爆炸的可能性分析(三)
沈华民
(中国化工学会化肥专业委员会上海200336)
4尿塔化学爆炸能量
塔器内发生化学爆炸时,其条件比燃烧更为严格,除了需具备发生燃烧的3个充分条件(可燃气、助燃气及火源)外,还被2个必要条件所限制,即爆炸浓度极限和能量极限,且两者必须同时存在,才可能在有火源时被激发进而发生化学爆炸。换言之,只有当塔器内处于爆炸浓度极限范围之内的气体产生足够的能量,此能量源自可燃气与助燃气在火源的激发下发生连锁氧化反应而释放出的化学反应能量,最终导致塔内压力急剧升高而摧毁塔器。现以处于短期停车工况条件下、爆炸浓度极限范围内的3个合成气(E4,E6和E8)为研究对象,对尿塔物系爆炸能量进行研究。
4.1基础数据
4.1.1尿塔设备参数
设备条件:体积40 m3,塔径Φ1 400 mm,塔高26.4 m。
工艺条件:操作压力20.0 MPa,正常氨碳比4.0~4.1,非正常氨碳比2.5,水碳比0.65。
原料:φ(CO2)为98.0%~98.5%,其余为惰气H2和N2,且H2/N2=2(体积比);常规加O2量占CO2体积总量的0.5%,过量加O2量为1.0%;w(NH3)99.80%,w(N2)0.10%,w(H2)0.01%,w(CH4)0.09%。
原料入塔量(以生成1 t尿素计):1 333.75 kg NH3(50 ℃),733 kg CO2(125 ℃),1 275.75 kg甲铵液(100 ℃)。
生产负荷:16.67 t/h[I=10 t/(m3·d)]。
4.1.2标准态燃爆气反应能量[11- 12]
标准态:压力为0.101 3 MPa(即1 atm),温度为25 ℃(298 K)。
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(g)+
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+
4.2爆炸能量
爆炸能量是一个多变量函数,主要有爆炸气的体积和气相组分2个重要参数。
体积参数:处于爆炸极限浓度范围内的气相体积越大,则爆炸释放的能量就越大。
爆炸气成分参数:气相组分中燃爆气种类、含量、与助燃气的比例以及燃爆反应状态等因素与爆炸能量密切相关。种类因素:氢气是强燃爆气,其含量越多,爆炸能量越大;氨是弱燃爆气,爆炸释放的能量较小。比例因素:若爆炸气体积组成为2/3 H2和1/3 O2,爆炸能量必然是最大的。当爆炸气体的组成和含量确定时,则气相体积成为衡量爆炸能量最主要的参数。现以E4,E6和E8为研究对象,3个处于爆炸极限浓度范围内的合成气组分和含量均已确定,故这些气体的体积计算已成为计算爆炸能量的关键。
尿塔爆炸能量的计算分3步进行:第1步,求取尿塔合成气的体积;第2步,对合成气中的氧量分配给H2,NH3及CH4;第3步,计算爆炸能量。
4.2.1爆炸气相体积
本研究对象为短期停车工况下爆炸性混合气(E4,E6和E8)的体积,即当尿塔处于由开车状态转变为短期停车状态时静态尿塔上部气相空间的体积[图12(b)中的G区]。
首先考察工业生产条件下尿塔内进行的合成反应过程。工业尿素合成理论指出,从尿塔塔底到塔顶的物流基本上呈气液两相流的形式进行合
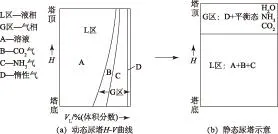
图12 尿塔动态向静态演变示意
成反应,并向上运动直至塔顶[图12(a)]。在气相物流中有1股惰气物流[图12(a)中D],由原料CO2,NH3及防腐空气带入系统的H2,O2,N2,CH4等组分构成,这些物质在尿素合成的液相物流中的溶解度极小,基本可以忽略。因此,可以认为进入系统的惰性物质在塔中几乎全部存在于气相中,故而从塔底到塔顶形成了1股惰气物流,成为计算静态尿塔上部空间气相体积的基础。
当切断尿塔进、出口阀进入短停状态时,尿塔由动态转变为静态,物系随之发生如下变化:封闭在尿塔内存在于纵向物流中的惰气会因重力作用全部转入静态尿塔上部空间;同时,静态气液平衡也随之建立。静态尿塔气相空间总体积VS由惰气总体积VI和尿素合成液相物系的平衡态气相2个部分构成,若惰气总体积及静态物系压力、温度、氨碳比及水碳比已知时,气相总体积VS可按下式求得:
(1)
式中:VS——气相空间总体积,m3(标态);
VI——气相空间中惰气总体积,m3(标态);
P——操作压力,MPa;
P平——静态尿塔物系压力,MPa;
GI——原料CO2,NH3及防腐空气带入系统的惰气总量,m3/t(标态);
Z——负荷,t/h;
τ——物料在尿塔的停留时间,h;
PI——静态尿塔惰气分压,MPa。
对于气相组分及含量皆已知的合成混合气,VS也可用下式计算:
(2)
式中:YI——惰气总摩尔分率;
YH2,YO2,YN2,YCH4——分别为H2,O2,N2,CH4的摩尔分率。

(3)
式中:Vj——合成混合气各组分分体积,m3(标态)或kmol;
Yj——合成混合气各组分摩尔分率。
以E4为例计算如下:GI=26.52m3/t(标态),Z=16.67t/h,τ=0.5h,YI=0.5;代入式(1)可得VS=442m3(标态)。
当各组分摩尔分率已知时,各组分分体积可用式(3)计算。对于NH3:
VNH3=VS·YNH3=203.32(m3,标态)
=9.07(kmol)
同理,可求得VCO2,VH2O,VH2,VN2,VCH4和VO2分别为0.39,0.39,2.31,5.62,0.60和1.33 kmol。
4.2.2氧量分配
由爆炸浓度范围图可知,合成混合气是从爆炸上限进入爆炸极限范围内并成为爆炸性气体的。因此,在气相中基本上是氧量供应不足,燃爆气是过量的,即在合成混合气中的氧量不可能全部满足燃爆反应的需求。
本案例中有3种燃爆组分(NH3,H2,CH4),如何将不足的氧量科学合理分配至每一种燃爆组分中,排除主观性颇为重要,本文从分子运动学原理来确定分配原则。由于尿素合成气是均一气体混合物,按各气体分子间碰撞概率均等的原则,故将氧量按燃爆组分含量多少进行统一分配。
首先计算各单个燃爆气在总燃爆气中所占的比例:
(4)
k=1,2和3,分别代表NH3,H2和CH4。
式中:Fk——单个燃爆气在总燃爆气中的摩尔分率;
Yk——气体摩尔分率。
单个燃爆气分配得的氧量计算式为:
(5)
式中:Wk——单个燃爆气分配得的氧量,m3(标态)或kmol;
VO2——总氧量,按式(3)计算,m3(标态)或kmol。
仍以E4为例,由式(4)计算出NH3,H2和CH4占总燃爆气的分率FNH3,FH2和FCH4分别为0.756 9,0.193 0和0.050 1,再用式(5)计算求得单个燃爆气(NH3,H2,CH4)分得的氧量分别为1.006 7,0.256 7和0.066 6 kmol。
4.2.3燃爆反应能量的校正[13- 14]
本文已提供了标准状态下3个单质化合物燃爆反应能量,但由于合成物系处于压力20.0 MPa和温度180 ℃状态下,故而必须将标准态的反应焓变(即释放能量)转换成合成物系状态下的反应焓变。
4.2.3.1以H2为例(180 ℃)
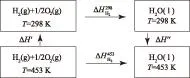
图13 180 ℃条件下反应焓变的计算过程设计
由盖斯定律:
(1)ΔH′的计算
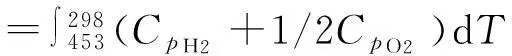

4.808×10-7T2)+1/2(6.095 4+32 533×10-3T-10.171×10-7T2)]dT
=-1 541(cal/mol)

=-286.0 kJ/mol
(3)ΔH″的计算
ΔH″的计算过程设计如下:
298 K373 K 373 K453 K453 K
ΔH″=ΔH1+ΔH2+ΔH3+ΔH4

2.37×10-3T+2.08×10-7T2)dT-481×18
=2 969(cal/mol)

=-66 890(cal/mol)
=-279.6(kJ/mol)
4.2.3.2CH4的校正计算(180 ℃)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+

4.2.3.3NH3的校正计算(180 ℃)
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(l)+

4.2.4爆炸能量计算
爆炸反应与燃烧反应都是由于氧化反应而释放出大量化学反应能量,因燃烧反应而释放出的能量称为燃烧热,因爆炸性气体释放出的能量称为爆炸能量。
爆炸反应的反应通式如下:
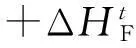
单个可爆气释放的化学能量计算式为:
(6)
式中:Q——爆炸能量,kJ;

VO2——物系氧量,mol;
a——反应助燃物O2的反应系数。
对于混合可爆气,物系总的爆炸能量表达式为:
(7)
式中:QS——物系总的爆炸能量,kJ;
k=1,2和3,分别代表NH3,H2和CH4。
对于合成气E4,3个爆炸性气体(NH3,H2,CH4)的爆炸能量分别由式(6)计算如下。
(1)QNH3的计算
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(l)+
278.0 kJ/mol
QNH3=278.0×1.006 7×103/(7/4)
=1.60×105(kJ)
(2)QH2的计算
H2(g)+1/2O2(g)=H2O(l)+279.6 kJ/mol
QH2=279.6×0.256 7×103/0.5
=1.44×105(kJ)
(3)QCH4的计算
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+874.0 kJ/mol
QCH4=874.0×0.066 6×103/2
=0.29×105(kJ)
由式(7)求得E4总的爆炸能量QS=3.33×105(kJ)。
4.2.5计算结果
合成可爆气E4的各项计算结果汇总如表8所示。按上述方法,同样可对另外2个合成爆炸性气体E6和E8进行计算,计算结果汇总分别列于表9和表10。
表8E4计算结果汇总

项 目NH3CO2H2OH2N2CH4O2总计摩尔分率0.46000.02000.02000.11690.28500.03050.0676分体积/(m3,标态)203.328.848.8451.67125.9713.4829.88442.00分物质的量/kmol9.070.400.402.315.620.601.33可爆气分率0.75690.19300.0501分配氧量/kmol1.00670.25670.0666爆炸能量/kJ1.60×1051.44×1050.29×1053.33×105
表9E6计算结果汇总

项 目NH3CO2H2OH2N2CH4O2总计摩尔分率0.25600.12800.01600.18800.30860.04900.0545分体积/(m3,标态)73.4736.744.5953.9588.5614.0515.64287.00分物质的量/kmol3.281.640.202.413.950.630.70可爆气分率0.5190.3820.099分配氧量/kmol0.360.270.07爆炸能量/kJ0.57×1051.51×1050.31×1052.39×105
表10E8计算结果汇总
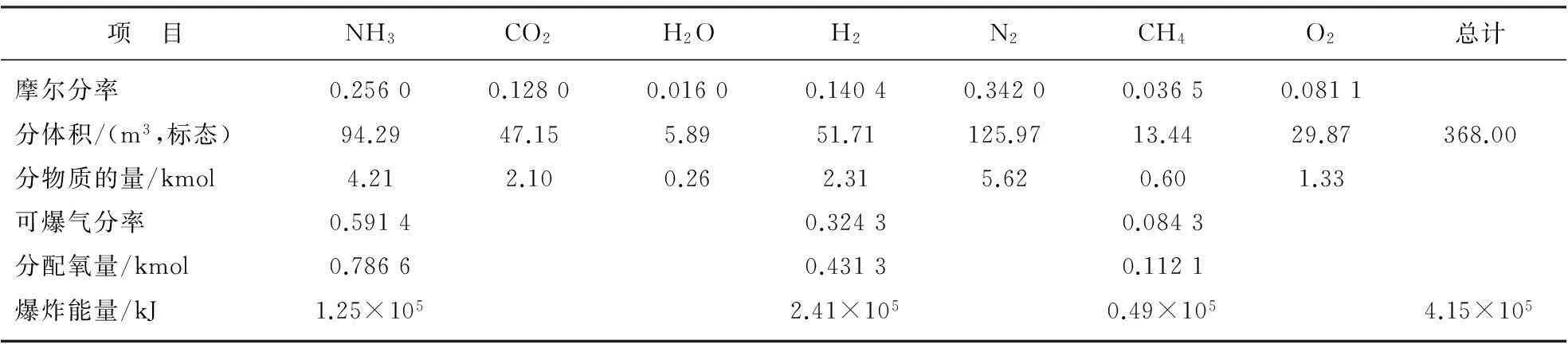
项 目NH3CO2H2OH2N2CH4O2总计摩尔分率0.25600.12800.01600.14040.34200.03650.0811分体积/(m3,标态)94.2947.155.8951.71125.9713.4429.87368.00分物质的量/kmol4.212.100.262.315.620.601.33可爆气分率0.59140.32430.0843分配氧量/kmol0.78660.43130.1121爆炸能量/kJ1.25×1052.41×1050.49×1054.15×105
4.3讨论
4.3.1破坏功
破坏功由上部塔段抛射功[15]、中部塔段平射功[16]和筒体撕裂功[15]3个部分组成。
(1)上部塔段抛射功:包括第1~第8节筒体,约100 t,飞出约86 m,计算得W3n=1.715 8×105kJ。
(2)中部塔段平射功:第9节筒体斜向飞出12.5 m,计算得W2n=3.068 0×104kJ。
(3)筒体撕裂功:第9节筒体上下两焊缝环向撕裂,解得W1n=1.660 0×104×2=3.3200×104(kJ)。
上述3个部分之和得总破坏功WS=2.354 6×105kJ。
4.3.2爆炸能量与破坏功的比较
爆炸能量大于破坏功。由于在爆炸能量转化为对塔器破坏功时有损耗,故而爆炸能量不可能全部转化为破坏功,其转化效率η=WS/QS。本文所计算得到的中型尿塔E4,E6和E8的爆炸能量QS分别为3.33×105,2.39×105和4.15×105kJ,因而转化效率分别为70%,98%和57%。
本文关于化学爆炸能量的计算值与破坏功量文献计算值之间的合理对接,说明两者具有因果关系的,从而也证明了尿塔的爆炸属于化学爆炸。
收稿日期(待续,2015- 06- 19)
