一种基于PCR技术快速筛选低能离子注入重组菌株的方法
2016-05-04钱卫东周颖欣吴启航蔡长龙
钱卫东, 周颖欣, 吴启航, 蔡长龙
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.西安工业大学 光电工程学院, 陕西 西安 710021)
一种基于PCR技术快速筛选低能离子注入重组菌株的方法
钱卫东1, 周颖欣1, 吴启航1, 蔡长龙2
(1.陕西科技大学 食品与生物工程学院, 陕西 西安710021; 2.西安工业大学 光电工程学院, 陕西 西安710021)
摘要:为拓展基于低能离子注入介导药用植物基因组DNA转化酵母、构建能生产天然产物的酵母重组菌的广泛应用,以目标产物龙胆苦苷生物合成途径中的关键酶基因(GGPPS,MECPS和MECT)为分子筛选标记,以基于低能离子注入随机转化重组菌DNA为模板进行PCR扩增,实现对其高通量初筛,利用HPLC方法对初筛所得菌株发酵产物进行分析检测.结果,从1 072株转化酵母菌中初筛出12株候选酵母重组菌,经HPLC复筛后,其中5株重组酵母菌的发酵产物中检测出龙胆苦苷.研究表明,此PCR筛选方法,具有高效、简单、周期短、廉价、易于操作等优点,适用于低能离子注入介导基因组DNA大分子随机转化酵母,构建能生物合成天然产物的酵母重组菌的研究中.
关键词:PCR快速筛选; 低能离子注入; 关键酶; 重组酵母菌
0引言
龙胆苦苷(Gentiopicroside),为倍半萜属裂环环烯萜苷类化合物,是中药药用植物秦艽(Gentiana Macrophylla Pall.)的主要次生代谢产物,研究表明,龙胆苦苷具有重要的药理作用,其单一化合物粉针剂秦龙苦素,属中药一类新药,在黄疸型病毒性肝炎的治疗方面具有显著的疗效[1-3].但随着临床的需求量逐渐增加,秦艽野生资源也在急剧下降,现今已被列为国家三级野生保护药材[4],因此寻求并研究其新的药源途径成了一个新的研究热点[5].
近年来,合成生物学因其在寻求新型药源和药源种质改良方面具有独特优势,逐渐成为当今国际生药学界的研究热点之一.Ro等[6]通过构建酵母工程菌生产抗疟疾药物青蒿素(Artemisinin)前体-青蒿酸(Artemisic Acid),产量达到约100 mg/L.Ajikumar等[7]将植物的催化酶引入上述工程菌中,产生大量抗癌药紫杉醇(Taxol)前体紫杉二烯(Taxadiene),产量高达1.02 g/L.因此,将药用有效成分生物合成代谢基因导入微生物宿主中构建工程菌,实现其定向生产,这已成为生产药用有效成分的重要途径之一.
但利用合成生物学方法对微生物宿主进行遗传改造生产药用有效成分,需要具备一个前提条件,即需要已知生物合成该药用有效成分的分子机理.然而大多数药用植物遗传背景不清楚,代谢途径信息缺乏,遗传及功能基因的研究亦较为薄弱,致使常规的合成生物学方法目前主要应用于构建产具有高附加值天然产物的细胞工厂的研究中,如用于抗癌药物紫杉醇.
近年来,低能离子注入技术在超远缘遗传育种方面具有较为显著地优势,其无需事先清楚药用植物的次生代谢产物的生物合成途径和相关基因信息的情况下,对基因进行转化,实现药用植物代谢产物工程菌的成功构建.吕杰等[8]运用Ar+和N+注入介导蓝麻黄(Ephedrae)基因组DNA转化酵母,获得遗传稳定酵母工程菌,麻黄碱(Ephedrine)和伪麻黄碱(Pseudoephedrine)产量分别为18.85 mg/L和4.11 mg/L.
然而,低能离子注入技术转化是一种无筛选标记的分子遗传育种方法,目前,筛选工程菌大多是根据目的产物的化学性质,利用定性标识去筛选.该方法工作量大,步骤繁琐,大大影响了目的工程菌的筛选效率.为此,本文以龙胆苦苷生物合成途径[9,10]中3个关键酶基因为分子标记,利用PCR技术建立了一种高通量初筛方法,再结合HPLC对初筛菌株的发酵产物进行分析确定.该方法简单快捷、省时省力、廉价、准确性高,大大提高了工作效率,降低了工作成本,为基于低能离子注入介导的合成生物学的广泛应用提供了有力支撑.
1材料与方法
1.1材料
1.1.1菌种
多形汉逊酵母(Hansenula Polymorpha)DL-1菌株,来源于中国工业微生物保藏中心,编号为ATCC No.26012.
1.1.2酶和主要试剂
2×Taq PCR MasterMix购于天根生化科技有限公司,PCR 引物由上海生工公司合成,龙胆苦苷标准品购于Sigma 公司上海金穗生物科技有限公司.其它化学试剂均购于天津市科密欧化学试剂公司.
1.1.3主要仪器与设备
凝胶成像分析仪( UVP),PCR仪(Eppendorf),Ddevic1多功能离子束注入机(IBB,陕西省薄膜技术与光学检测重点实验室),冷冻离心机(Sigma),高效液相仪(美国Waters).
1.2方法
1.2.1引物设计
选取萜类物质生物合成途径中的香叶基焦磷酸(Geranylgeranyl diphosphate synthase,GGPPS)、2-甲基-赤藓醇-2,4-环二磷酸合酶(2-C-methyl erythritol-2,4-cyclodiphosphate synthase,MECPS)、2-甲基赤藓醇-4-磷酸胞苷转移酶(2-C-methyl erythritol-4-phosphate cytidyltransferase,MECT) 三个基因为筛选标记.根据NCBI数据库中发布的氨基酸序列,根据其氨基酸序列组成,对其进行blast序列比对,找出与其同源性较高的氨基酸序列3~5条,利用在线引物设计软件codehop对其分别设计对应的简并引物,如表1所示.
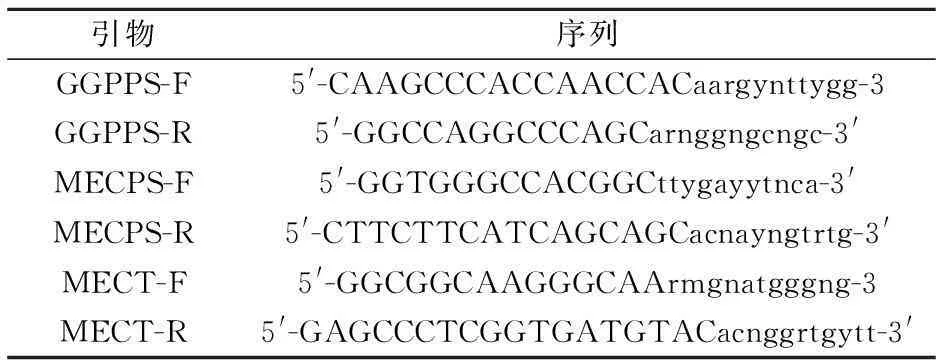
表1 PCR引物序列
1.2.2 秦艽基因组总DNA的提取
基因组提取[11,12]:取秦艽保存嫩叶剪碎,于液氮研磨至细粉状,与预热CTAB缓冲液研磨搅拌混匀,分装,65 ℃水浴后冷却.加入酚-氯仿-异戊醇(25∶24∶1),轻轻震荡摇匀至乳白色,离心,取上清,再加入预冷异丙醇,混匀,有白色絮状物析出,置-20 ℃冷却30 min.离心取白色沉淀,75%乙醇洗涤数次,离心,弃上清,得DNA,65 ℃水浴烘干,TE溶解,-20 ℃保存,并用琼脂糖凝胶电泳及紫外分光光度法分别检测DNA质量.
1.2.3PCR筛选体系的建立
以秦艽总基因组DNA为模板,分别用GGPPS、MECPS、MECT 3对引物进行PCR扩增.反应体系20μL:2×Taq PCR MasterMix 10μL,引物(浓度为10μM)各1μL,模板2μL(浓度为2μg/mL ),ddH2O调整终体积为20μL.反应程序:94 ℃ 5 min;循环35次:94 ℃ 30 s;Tm 45 s,72 ℃ 1 min;72 ℃ 7 min.为提高PCR扩增反应的特异性,根据设计的引物退火温度,以57 ℃为基础,以0.5 ℃递加,直至62 ℃,确定其各自Tm值.PCR 产物琼脂糖凝胶电泳分析.
1.2.4低能离子注入介导秦艽总基因组DNA转化酵母
低能离子注入介导秦艽总基因组DNA转化酵母[13]:37 ℃活化菌种8~10 h,稀释菌体浓度至1.0×107 CFU/mL.取100μL菌悬液均匀涂布于无菌玻璃平板中央,吹干形成菌膜.将其置于离子注入机,在10-3Pa 真空下脉冲10 s注入N+,立即将秦艽总基因组DNA涂于菌膜使其充分接触,2 h后刮下菌膜涂布于YPD平板上,37 ℃培养48 h,挑取单菌落.
1.2.5重组酵母菌株基因组DNA的提取
取1.5 mL酵母菌悬液,离心,收集菌体;无菌水洗涤2次,弃上清液,加入600μL细胞裂解液(200 mmol/L LiOAC、1% SDS溶液),沸水浴中煮20 min.离心,取上清液,即得酵母基因组DNA模板,-20 ℃保存,备用.
1.2.6利用PCR方法高通量初筛重组酵母菌株
(1)以转化子的基因组DNA为模板和以GGPPS-F/GGPPS-R为引物,进行PCR扩增,PCR 产物琼脂糖凝胶电泳分析,选取含GGPPS基因的候选转化子.
(2)以(1)所得候选菌株为研究对象,以其基因组DNA为模板和MECPS-F/MECPS-R为引物,进行PCR扩增,PCR 产物琼脂糖凝胶电泳分析.获得同时含有GGPPS、MECPS基因的转化子.
(3)以(2)所得候选转化子为研究对象,以其基因组DNA为模板和MECT-F/MECT-R为引物,进行PCR扩增, PCR 产物琼脂糖凝胶电泳分析.获得含有GGPPS、MECPS、MECT基因的候选转化子.
1.2.7HPLC对候选重组酵母菌的复筛
将1.2.4所得候选重组酵母菌,进行液体发酵,对发酵产物进行提取分离,利用HPLC对其发酵产物进行检测分析.HPLC色谱条件[14,15]:C18(250 mm×4.6 mm);流动相为甲醇∶水(3∶7);体积流量为1.0 mL/ min;柱温:25 ℃;检测波长275 nm;进样量:10μL.
2结果与讨论
2.1秦艽总基因组DNA提取
将秦艽基因组分别进行OD值测定及电泳检测.结果其OD260/280比值为1.89,凝胶电泳条带较为清晰,如图1所示,表明所提秦艽基因组DNA质量良好,无过多蛋白及RNA等杂质影响.
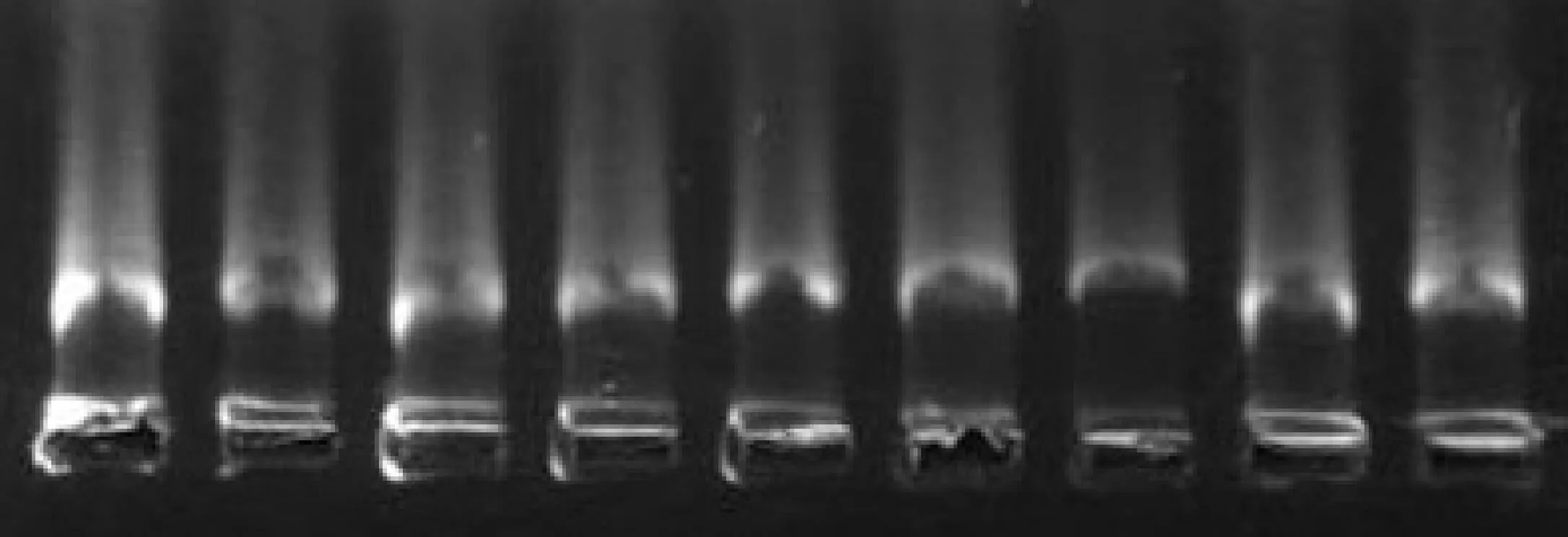
图1 秦艽总基因组DNA凝胶电泳图
2.2PCR筛选体系的建立
以秦艽基因组为模板,分别以GGPPS、MECPS、MECT为分子标记进行PCR扩增.优化扩增条件,结果确定其三个基因片段退火温度依次为61 ℃、61 ℃、60 ℃.凝胶电泳检测结果依次得到相应扩增条带,分别见图2所示,片断大小和理论预计大小相符,表明此PCR筛选体系成功建立,可用于重组菌株的筛选工作.

M泳道为Maker,1、5泳道为GGPPS基因扩增条带,2、3、4泳道为酵母阴性对照(a)GGPPS基因PCR电泳图
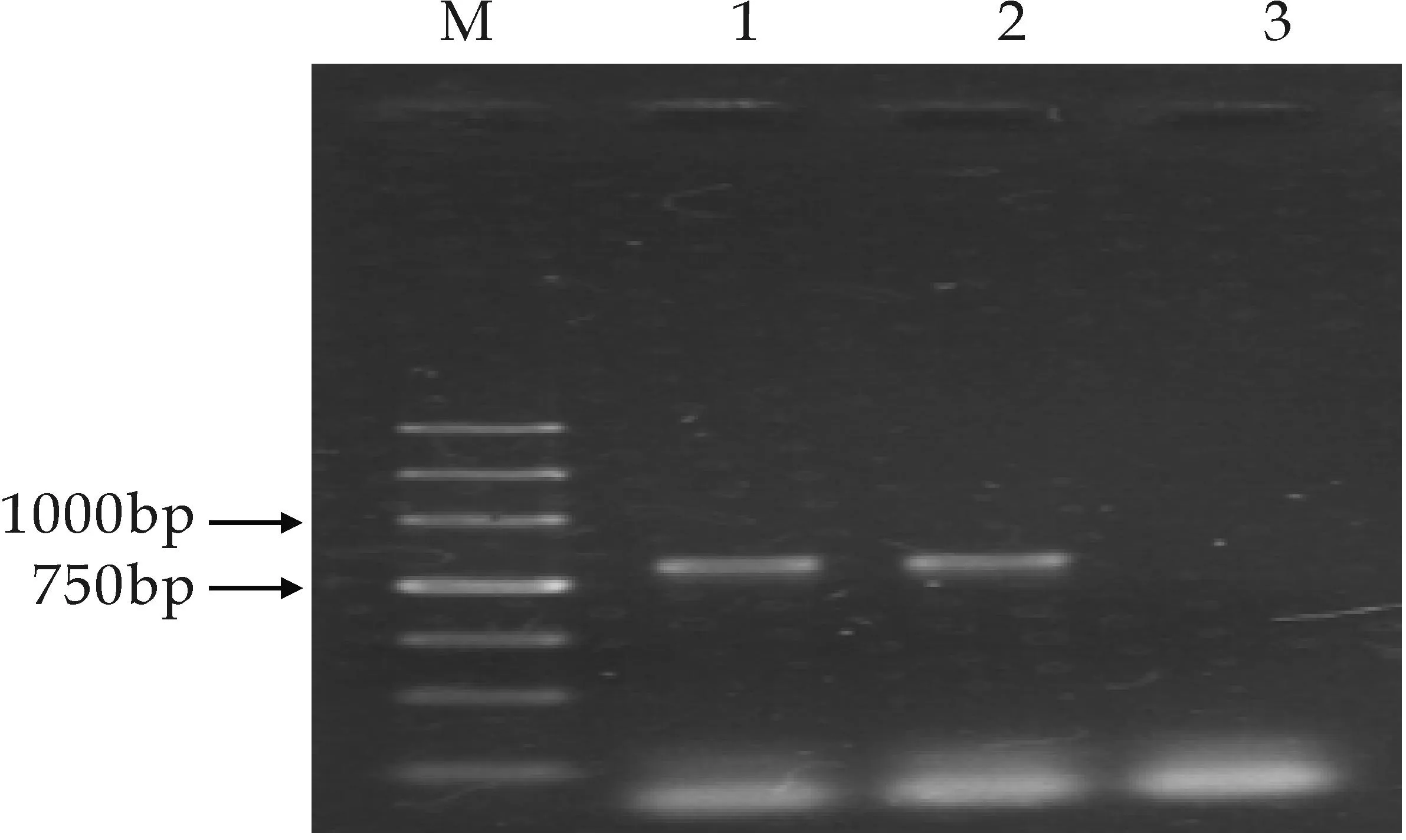
M泳道为Maker,1、2泳道为MECPS基因扩增条带,3泳道为酵母阴性对照(b)MECPS基因PCR电泳图
M泳道为Maker,2、4泳道为MECT基因扩增条带;1、3泳道为酵母阴性对照(c)MECT基因PCR电泳图图2 GGPPS、MECPS、MECT基因PCR电泳图
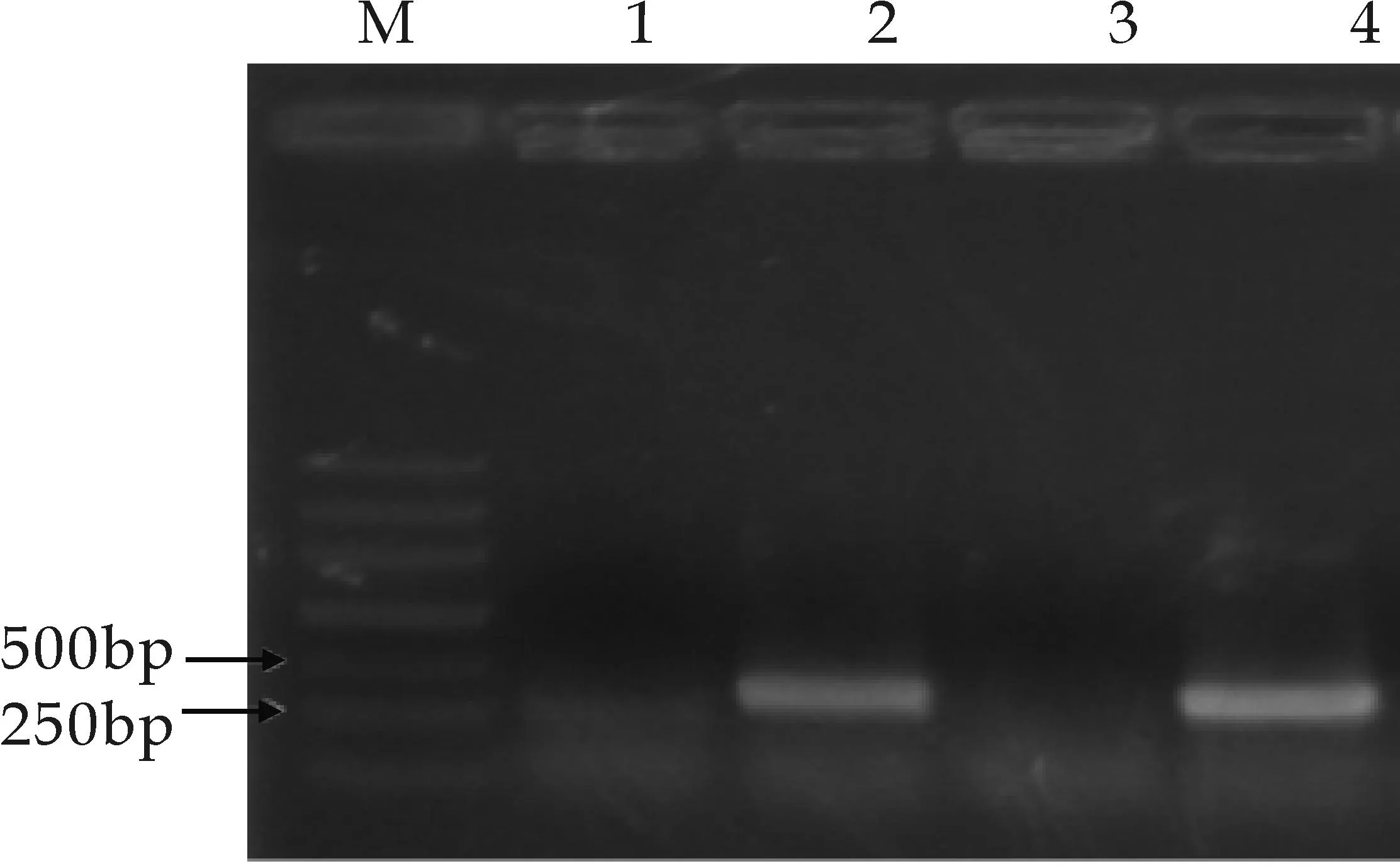
2.3PCR重组酵母菌株初筛
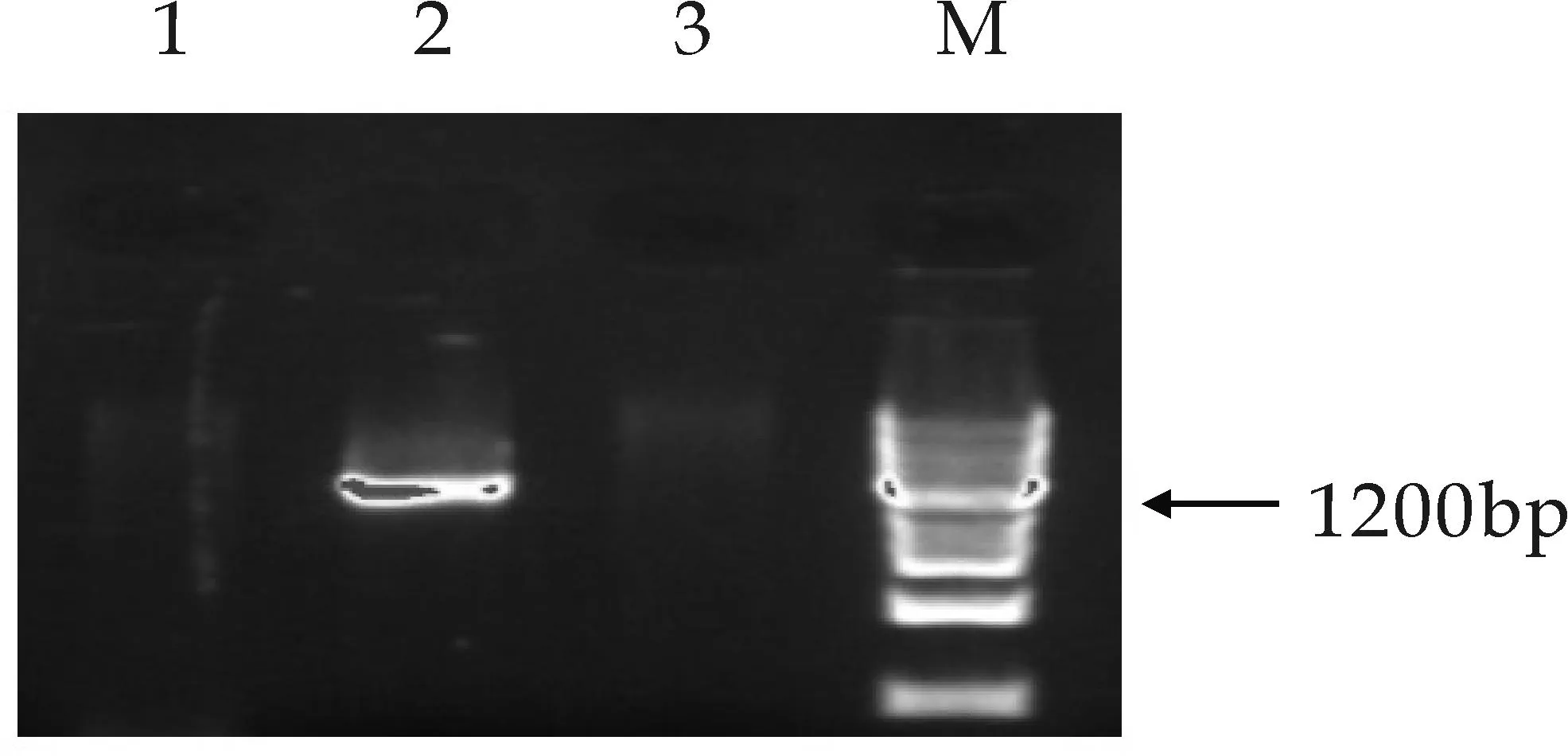
M泳道为Maker,2泳道为GGPPS基因的阳性转化菌扩增条带,1、3泳道为GGPPS基因的阴性转化菌扩增条带(a)转化子GGPPS基因PCR筛选
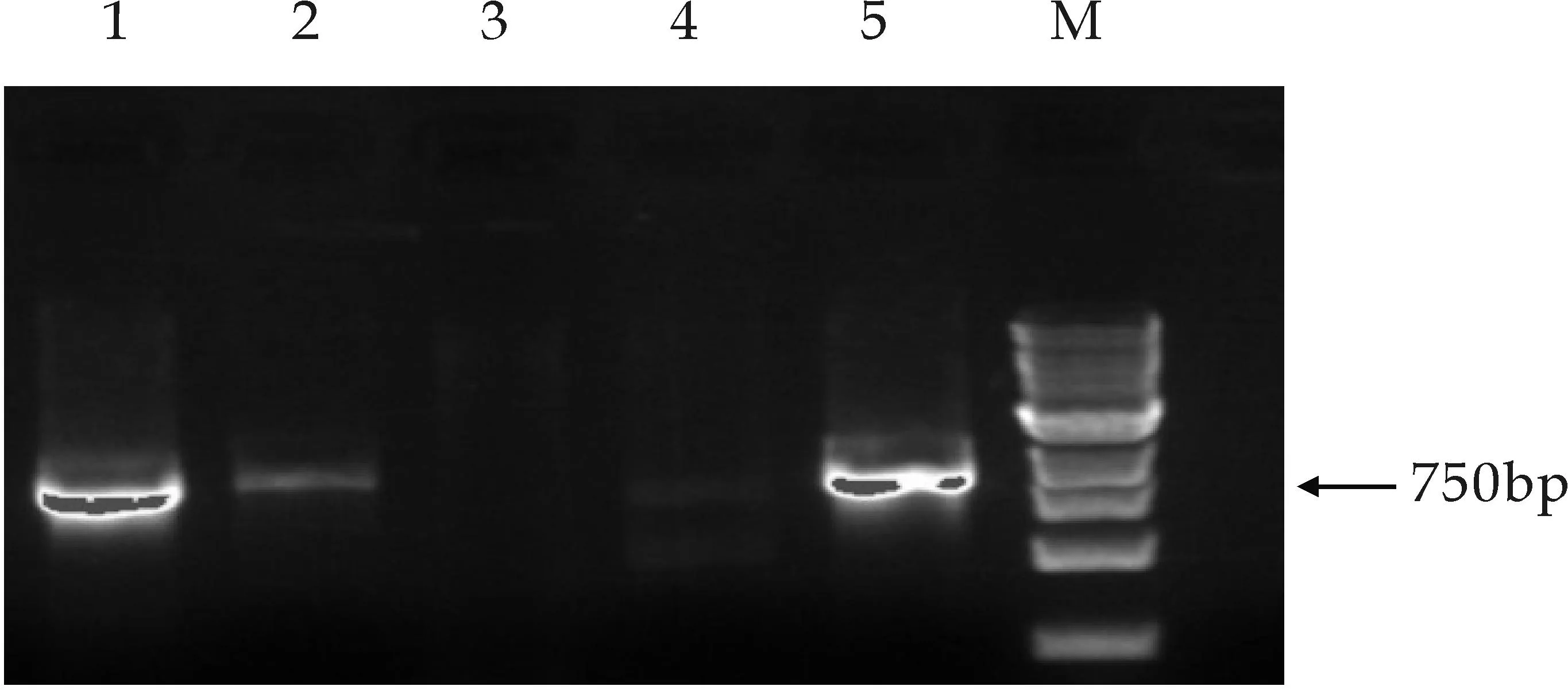
M泳道为Maker,1、2、5泳道为MECPS基因的阳性转化菌扩增条带,3、4泳道为MECPS基因的阴性转化菌扩增条带(b)转化子MECPS基因PCR筛选
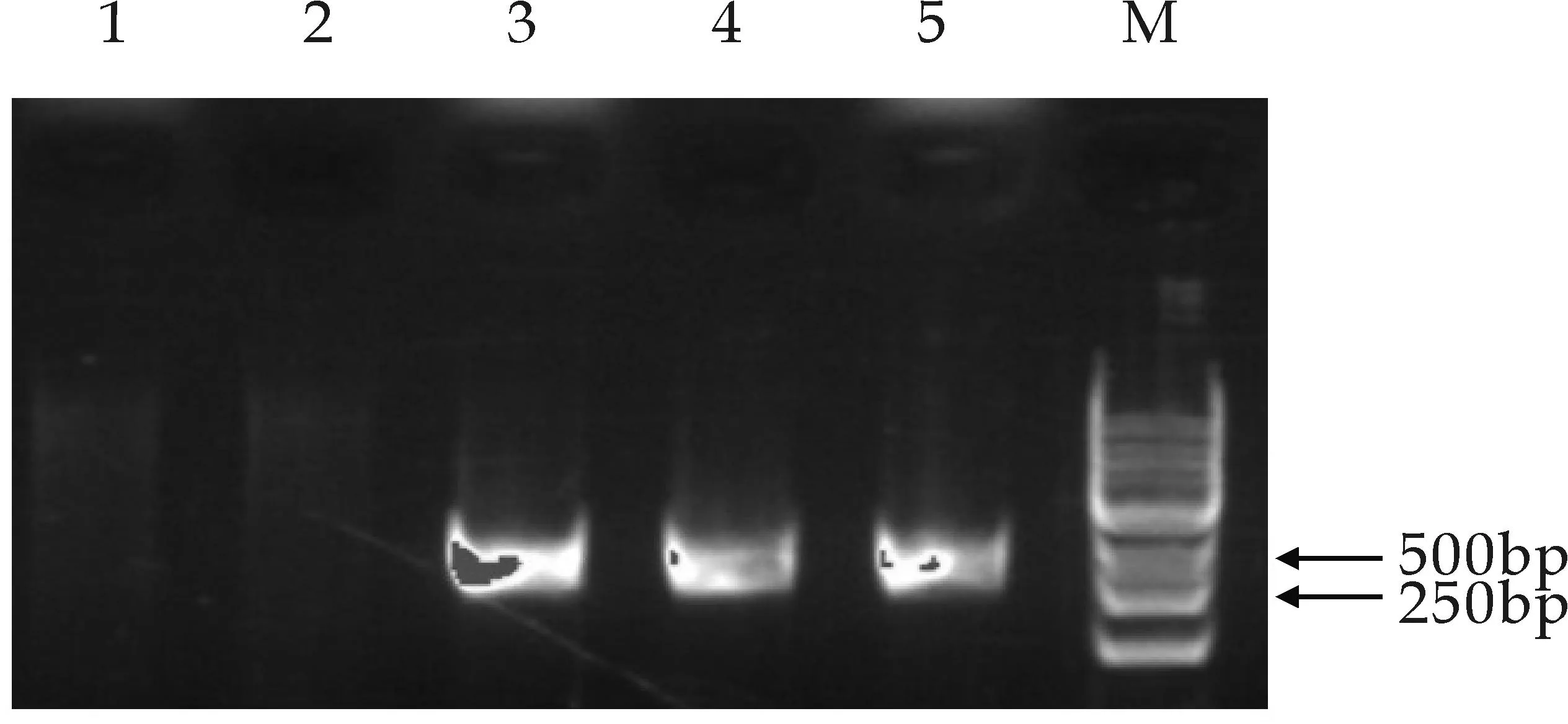
M泳道为Maker,3、4、5泳道为MECT基因的阳性转化菌扩增条带,1、2泳道为MECT基因的阴性转化菌扩增条带(c)转化子MECT基因PCR筛选图3 转化子GGPPS、MECPS、MECT基因PCR筛选
以基于低能离子注入介导秦艽总基因组转化酵母获得的1 072株重组酵母菌为研究对象,分别提取其基因组DNA,首先以GGPPS为目标基因对菌株进行PCR扩增筛选,得到132株候选重组酵母菌;以上述132株重组酵母为研究对象,以MECPS为目标基因分别对其进行PCR扩增筛选,得到22株重组酵母菌株;再以上述22株重组酵母为研究对象,以MECT为目标基因分别对其进行PCR扩增筛选,得到12株重组酵母菌.凝胶电泳检测结果依次得到相应扩增条带,分别见图3所示,上述结果表明秦艽相关酶基因GGPPS、MECPS、MECT经低能离子注入介导转化后,其随机整合到了酵母基因组中.
2.4HPLC对候选重组酵母菌的复筛
将12株重组酵母菌进行YPD液体发酵,提取发酵液,利用HPLC进行龙胆苦苷产物检测分析.如图4所示,有5株重组酵母菌的发酵液中检测到目标产物龙胆苦苷.结果表明,PCR方法可高通量用于基于低能离子注入介导的植物基因组转化酵母、构建产天然产物的酵母重组菌中.

(a)龙胆苦苷标准品HPLC检测图谱
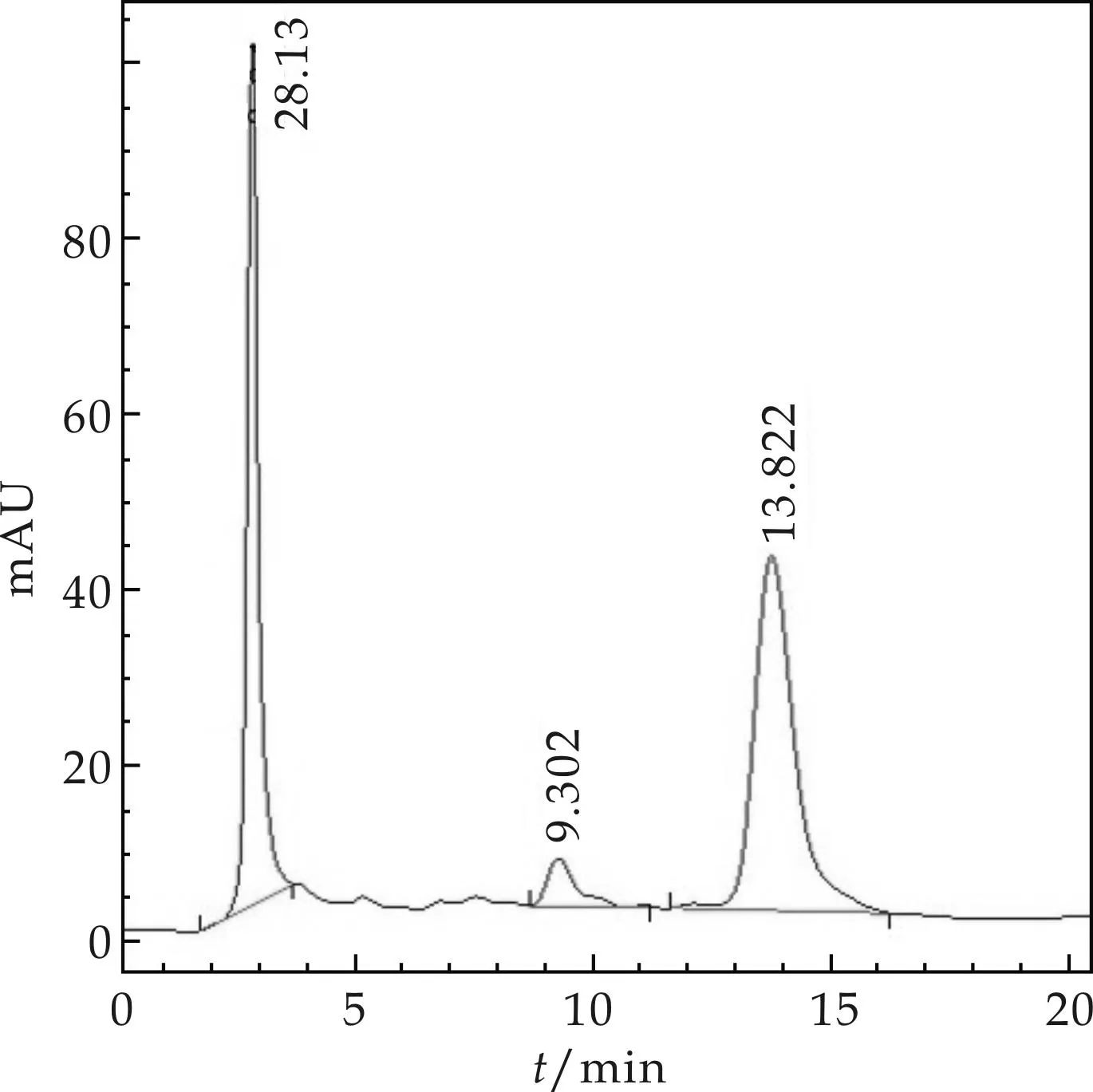
(b)重组酵母菌发酵液HPLC检测图谱图4 重组菌株发酵液的HPLC检测图谱
3结论
目前,基于离子束介导转化基因构建重组菌株的筛选方法是根据目标产物的化学特性进行检识筛选,例如毛培宏等[16]利用颜色反应对低能离子注入介导麻黄基因组转化酵母中重组菌株进行筛选,研究人员从3000多株重组菌中筛选获得9株产麻黄碱酵母重组菌株,表明,根据目标产物的化学性质设计的筛选方法用于筛选重组菌株存在筛选效率低、工作量大、检测限高、筛选周期长等问题.在本研究中,我们将检测限较高的化学反应转变为灵敏度非常高的PCR方法,来实现重组菌株的高通量初筛,这极大地提高了筛选效率.
此外,针对大多数天然产物生物合成途径尚未解析的背景下,利用药用植物的次生代谢产物的属性,如尽管龙胆苦苷的生物合成途径尚不清楚,且相关生物合成基因信息未知的情况下,依据龙胆苦苷属于萜类化合物的特性,根据萜类化合物的生物合成途径中的关键酶基因信息,创新性地设计简并引物,进行PCR扩增筛选.这为基于低能离子注入技术介导药用植物基因组DNA转化酵母构建产天然产物的酵母重组菌提供了新方法,为拓展低能离子注入介导的合成生物学的广泛应用提供了新途径.
参考文献
[1] 陈雷,王海波,孙晓丽,等.龙胆苦苷镇痛抗炎药理作用研究[J].天然产物研究与开发,2008,20(5):903-906.
[2] 陈长勋,刘占文,孙峥嵘,等.龙胆苦苷抗炎药理作用研究[J].中草药,2003,34(9):814-816.
[3] Y Wang,L Y Yang.In vitro inhibition and induction of human liver cytochrome P450 enzymes by gentiopicroside:Potent effect on CYP2A6[J].Drug Metab Pharmacokinet,2013,28(4):339-344.
[4] 张海龙.基于生态位模型的传统中药秦艽潜在地理分布研究[D].西安:陕西师范大学,2014.
[5] Tiwari R K,M Trivedi M,Guang Z C,et al.Genetic transformation of Gentiana macrophylla with agrobacterium rhizogenes:Growth and production of secoiridoid glucoside gentiopicroside in transformed hairy root cultures[J].Plant Cell Rep,2007,26(2):199-210.
[6] Dae Kyun Ro,Eric M.Paradise,Mario Ouellet,et al.Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J].Nature,2006,440(1 038):940-943.
[7] Ajikumar P K,Xiao W H,Tyo K E,et al.Isoprenoid pathway optimization for taxol precursor overproduction in escherichia coli[J].Science,2010,330(6 000):70-74.
[8] 吕杰,金湘.氮离子注入介导麻黄基因组DNA转化酵母菌[J].中草药,2008,39(8):1 227- 1 230.
[9] 王彩云,张晓东,沈涛,等.龙胆苦苷生物合成途径研究进展[J].江苏农业科学,2014,42(3):4-10.
[10] 刘万宏,陈敏,廖志华,等.银杏内酯的生物合成途径及生物技术研究进展[J].中草药,2007,38(6):941-945.
[11] 罗意,范海阔,黄绵佳,等.3种椰子基因组DNA提取方法的比较[J].中国农学通报,2013,29(27):154-158.
[12] 张娟,吴炜亮,谭嘉力,等.植物源性转基因食品DNA 提取技术的研究进展[J].食品工业科技,2015,36(7):396-400.
[13] 付云芳.低能N+注入介导秦艽基因组DNA转化酵母的研究[D].西安:陕西科技大学,2013.
[14] 赵瑞芝,梁伟杰,丘小惠,等.龙胆药材中龙胆苦苷的提取工艺研究[J].中国药房,2005,16(12):956-957.
[15] 郝保华,孙文基,支朝晖,等.超声提取HPLC法测定秦艽中龙胆苦苷的含量[J].西北大学学报(自然科学版),2004,34(1):81-84.
[16] 毛培宏,马向东,金湘,等.氩离子注入介导麻黄基因组DNA转化获得产麻黄碱重组酵母菌[J].微生物学报,2007,47(5):905-909.
【责任编辑:蒋亚儒】
A new method for rapid screening of low energy ion injected recombinant strain by PCR technology
QIAN Wei-dong1, ZHOU Ying-xin1, WU Qi-hang1, CAI Chang-long2
(1.School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China;2.College of Optoelectronic Engineering, Xi′an Technological University, Xi′an 710021, China)
Abstract:To expand application widely based on low energy ion beam mediating medicinal plants transformed yeast genomic DNA and constructing capable of producing natural products in recombinant yeast strains.In this paper,gentiopicroside biosynthetic pathway of key enzyme genes (GGPPS,MECPS and MECT) act as molecular screening marker.Recombinant strains DNA was amplificated for PCR,which transformed to obtain as a template based on inject ation low energy ions to achieve high throughput screening for recombinant yeast strains.And the fermentation products abtained by screening strain were analyzed in HPLC.12 candidate recombinant yeast strains were screened from 1 072 transformed yeast by HPLC repeat screening, and 5 strains of fermentation product was detected gentiopicroside.The result showed the PCR screening method was efficient,simple,short cycle,the advantages of low-cost,easy operation, which was suitable for low energy ion beam mediated genomic DNA molecules randomly transformed yeast,and applied in biosynthesis of natural products for yeast recombinant strains.
Key words:PCR rapid screening; low energy ion implantation; key enzyme; recombinant yeast
中图分类号:R285.5
文献标志码:A
文章编号:1000-5811(2016)02-0139-05
作者简介:钱卫东(1980-),男,安徽芜湖人,副教授,博士,研究方向:高附加值、天然产物资源开发与利用
基金项目:国家自然科学基金项目(11575149); 西安工业大学省级重点实验室开放基金项目(ZSKJ201405)
收稿日期:2015-12-13
