水热时间对K10W12O41·11H2O纳米材料光催化性能的研究
2016-05-04曹丽云孔新刚黄剑锋吴建鹏李嘉胤李翠艳
曹丽云, 李 雯, 孔新刚, 黄剑锋, 吴建鹏, 李嘉胤, 李翠艳
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
水热时间对K10W12O41·11H2O纳米材料光催化性能的研究
曹丽云, 李雯, 孔新刚, 黄剑锋, 吴建鹏, 李嘉胤, 李翠艳
(陕西科技大学 材料科学与工程学院, 陕西 西安710021)
摘要:以WO3和KOH为原料,采用水热法成功制备了K(10)W(12)O(41)·11H2O纳米棒状材料.利用X射线衍射(XRD)、扫描电镜(SEM)等手段对产物物相和形貌进行了表征.探讨了不同水热时间对合成K(10)W(12)O(41)·11H2O的形貌及光催化性能的影响.研究结果表明,当水热时间为12 h时,一维纳米棒状形貌的K(10)W(12)O(41)·11H2O具有更高的光催化效率,紫外50 min对亚甲基蓝的降解效率可达75%.
关键词:水热合成; K(10)W(12)O(41)·11H2O; 光催化
0引言
钨酸盐是一种在很多领域具有潜在应用前景的重要功能性无机材料,因此近年来一直是材料学家们所研究的热点[1],而其中具有独特性能的碱式钨酸盐在超导体[2]、固体燃料[3]、湿度传感器[4]、电致变色原件[5]、气体传感器[6,7]和太阳滤镜[8]等方面的应用越来越受到了科研人员的关注.碱式钨酸盐可以通过固相法[9,10],熔盐电解法[11]和水热方法[12,13]制得.Supothina等[13,14]利用WO3·nH2O为前驱体与K2SO4溶液在水热条件下成功制备了K2W4O13纳米棒.然而水热方法通常制备出碱金属钨青铜材料,即MxWO3(M=Na or K)[7,12,15,16],方法是利用可溶性钨酸盐M2WO4(M=Na or K)作为原料,在pH=1~2的酸性条件下水热处理而得到, 也有使用W箔在KOH溶液中热处理制备出KxWO3材料[6,17]. 目前,研究较多的碱式钨酸盐主要为碱金属钨青铜材料,而仲钨酸盐类化合物虽有报道但是报道较少[18].
水热法制备粉体可实现形貌可控,粉体分散性较好,无团聚;水为反应介质,原料易得,降低了制备成本.基于此,本实验利用水热法通过控制不同的反应时间成功制备了K10W12O41·11H2O纳米棒,并研究了不同反应时间下的样品对光降解有机染料——亚甲基蓝效率的影响.
1实验部分
1.1K10W12O41·11H2O粉体的制备
将1 g WO3溶解在30 mL浓度为1.5 mol/L的KOH溶液中(K/W摩尔比≈10∶1),加入KCl使得溶液K/W摩尔比增加到20∶1,随后逐滴加入HCl调节溶液pH=6.在室温下搅拌30 min,随后将反应前驱液转入容积为100 mL的聚四氟乙烯内衬的反应釜中,在均相反应器中200 ℃下反应.反应过后,待反应釜自然冷却,将所得产物用去离子水反复过滤洗涤至中性,之后在60 ℃烘干即得所需产物.
1.2物相、形貌分析
粉体的物相与形貌表征是分别通过XRD与SEM实现的.本实验使用D/Max-2200型(日本RigakuX)X射线衍射仪对K10W12O41·11H2O的物相成分和晶体结构进行系统、深入的分析.测试条件为:铜靶(Kα)射线,扫描范围为5 °~70 °.扫描电子显微镜分析是利用日本日立公司生产的S-4800型SEM检测样品.
1.3光催化性能表征
K10W12O41·11H2O的光催化性能是通过紫外光催化降解亚甲基蓝溶液的效果来评价的.本实验过程中选择使用西安市生产制造的比朗BL-GHX-V型光催化仪对NaLaTi2O6的光催化性能进行测试.首先,取出50 mg的K10W12O41·11H2O粉末样品放入光催化试管中,倒入50 mL初始浓度为10 mg/L亚甲基蓝溶液.在进行光反应之前,先进行暗反应磁力搅拌60 min,使粉末均匀分散并且达到吸附平衡.暗反应结束后,采用500 W汞灯照射样品进行紫外光反应,同时进行磁力搅拌和水冷,保持反应温度恒定在15 ℃左右.每隔10 min取一次样,对试样进行离心分离以消除K10W12O41·11H2O粉末对测试的影响,取上层清液用可见光分光光度计在亚甲基蓝最大吸收峰波长665 nm左右测量其吸光度,根据郎伯一比耳定律,其吸光度A与浓度C成正比,亚甲基蓝的降解率D%可以用式(1)计算:
D%=(C0-Ct)/C0×100%=
(A0-At)/A0×100%
(1)
式(1)中:C0为亚甲基蓝溶液的初始浓度(mg/L);Ct为反应后亚甲基蓝溶液的浓度(mg/L);A0为反应前亚甲基蓝溶液的吸光度;At为反应后亚甲基蓝溶液的吸光度.
2结果与讨论
2.1XRD表征
图1显示出了在不同水热时间合成产物的X射线衍射图谱,其中a、b、c、d的反应时间分别为4 h、8 h、12 h和18 h.从图1可以看出,当水热时间为4~18 h时均可以得到K10W12O41·11H2O.当水热时间为12 h,样品的衍射图谱与K10W12O41·11H2O的标准衍射图谱JCPDS No.31-1118完全一致,无其他杂质峰存在,说明产物为纯相K10W12O41·11H2O.水热时间由4 h增加到18 h的过程中,样品衍射峰逐渐尖锐,当时间为12 h时,衍射峰尖锐程度达到最大,说明在12 h时样品的结晶性能最好.当水热时间为4 h,12 h和18 h时,23 °左右出现WO3的衍射峰,说明在水热反应过程中有WO3出现,但当水热时间为12 h时消失,造成这种原因可能是由于在12 h的水热条件下,WO3能够被反应完全.

图1 不同水热时间所得产物的X射线衍射图谱
2.2形貌表征
图2为不同水热时间所制备产物的SEM图.由图2可知,随水热反应过程的进行,在不同反应时间所得产物形貌均为棒状结构.该棒状结构随着反应时间的变化而出现长短和粗细的变化,其中在反应时间为4 h时,所得产物形貌直径在200 nm左右,长度在0.2~1μm之间.延长反应时间至8 h时,所得棒状结构稍有变粗,长度增长到0.5~1μm之间.继续延长反应时间至12 h,棒状结构的直径和长度均有所增加,其中长度变化明显,增长1~3μm,整体形貌更为均匀,从放大扫描电镜中可看到棒状表面较为光滑.当反应时间最终延长至18 h时,许多短棒生成,可能是由于时间过长导致长棒的形貌被破坏,因此所得产物棒状形貌的长度和直径的均匀性变差.由水热处理后产物形貌变化可知,该体系中所得产物形貌均呈现棒状结构且直径与长度的均匀性存在先增加后减小的趋势.对于该变化过程,考虑可能与样品对应物相在不同反应时间中的变化有关.其中,随着水热反应时间的延长,产物中逐渐出现WO3的物象,当水热时间增加到12 h时,WO3消失,因此在12 h时产物形貌的均匀性最佳.


(a)4 h (b)8 h (c)12 h (d)18 h图2 不同水热时间下所制备产物的扫描电镜图片
2.3光催化性能研究
光催化剂的光降解能力可以用降解染料罗丹明B来表征.图3是不同水热时间所制备的K10W12O41·11H2O粉体在紫外光照射下对亚甲基蓝溶液的光催化降解曲线.
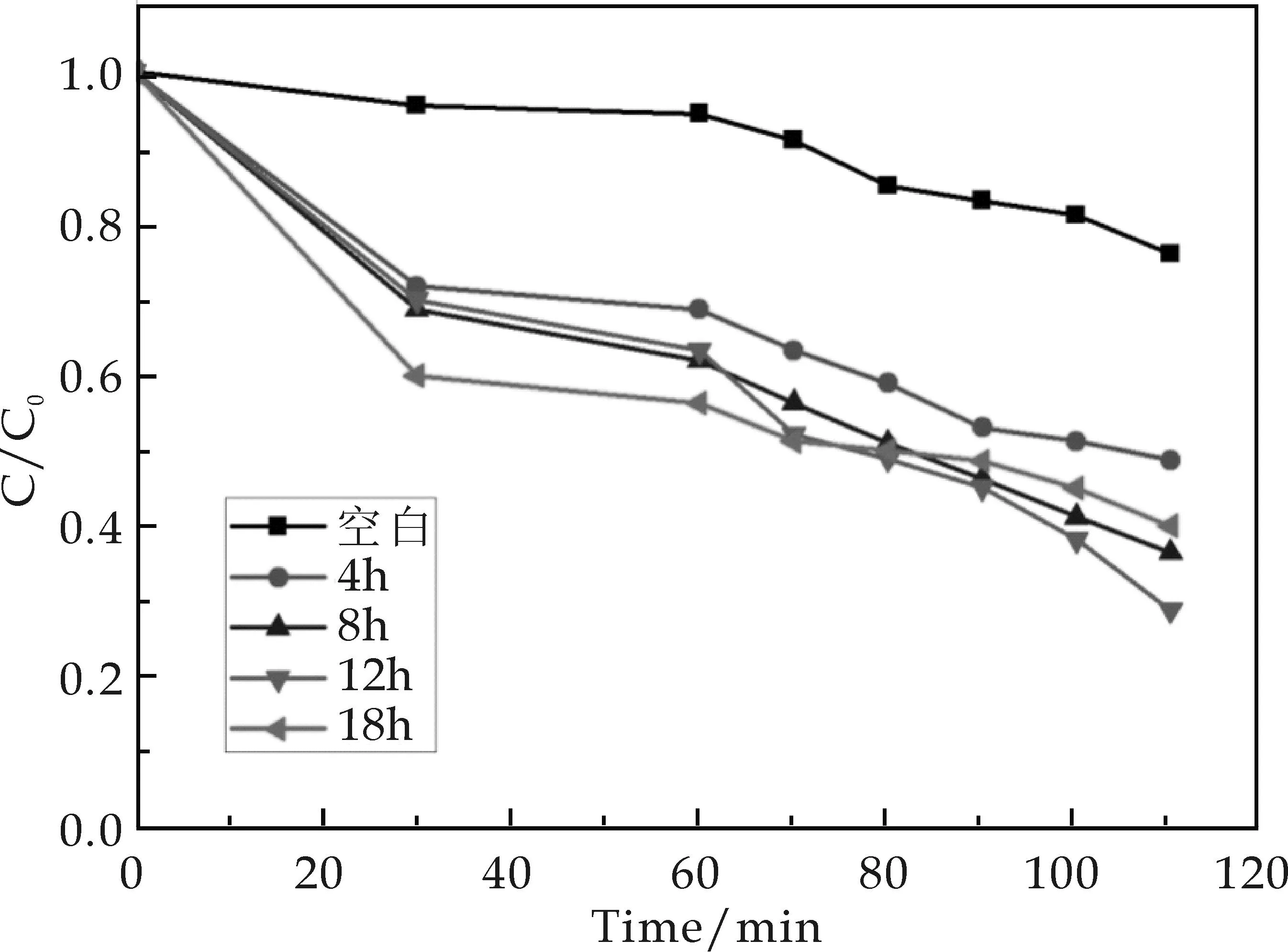
图3 不同水热时间下所制备的产物对罗丹明B的光降解图
从图3中可以看出,实验在暗反应下先反应60 min后,吸附达到平衡.在模拟紫外光的汞灯照射下,随着光照时间的延长,含有样品的亚甲基蓝溶液的降解率逐渐增强.其中当水热反应时间为12 h时,光降解效率达到最大,在光照50 min时降解率接近75%.水热时间为4 h时,光降解效率最低.由此图可以看出,虽然反应产物中含有一定量的WO3,但是由于含量很少,在光催化降解中不起主导作用.而长径比的增大,说明暴露在晶体表面的活性原子,即O原子和W原子的数量增多,使产物具有更高的光催化活性[19],因此样品的长径比对其光降解能力具有一定的影响.
3结论
本实验采用水热方法成功制备出了结晶性良好的K10W12O41·11H2O纳米棒.当水热时间为12 h,产物相貌最为均匀,纳米棒长度为1~3μm,直径为200 nm,并对其光催化性能进行了研究,结果表明,在水热时间为12 h时, K10W12O41·11H2O纳米棒具有更好的光催化性能,紫外50 min对亚甲基蓝的降解可达75%.
参考文献
[1] Zhang Q,Yao W T,Chen X,et al.Near monodisperse tungstate microspheres (MWO4,M=Pb,Ca) surfactant assisted synthesis,and property[J].Crystal Growth Design,2007,7(8):1 423-1 431.
[2] Hussain A,Gruehn R,Rüscher C H.Crystal growth of alkali metal tungsten brozes MxWO3(M=K,Rb,Cs),and their optical properties[J].Journal of Alloys and Compounds,1997,246(1):51-61.
[3] Terada S,Higaki K,Nagashima I,et al.Addition of potassium tungstate to the electrolyte of a molten carbonate fuel cell[J].Journal of Power Sources,1999,83(1):178-185.
[4] Tsuyumoto I,Kudo T.Humidity sensor using potassium hexagonal tungsten bronze synthesized from peroxo-polytungstic acid and its resistivity change mechanism[J].Materials Research Bulletin,1996,31(1):17-28.
[5] Supothina S,Rattanakam R.Effect of stirring and temperature on synthesis yield and crystallization of hydrothermally synthesized K2W4O13nanorods[J].Materials Chemistry and Physics,2011,129(1):439-445.
[6] Xiang Q,Meng G F,Zhao H B,et al.Au nanoparticle modified WO3nanorods with their enhanced properties for photocatalysis and gas sensing[J].The Journal of Physical Chemistry C,2010,114(5):2 049-2 055.
[7] Supothina S,Suwan M,Wisitsoraat A.Hydrothermal synthesis of K2W4O13nanowire with high H2S gas sensitivity[J].Microelectronic Engineering,2014,126:88-92.
[8] Suwan M,Supothina S.Increasing synthesis yield of K-doped tungsten oxide nanowire using stirred hydrothermal reactor and its near-infrared reflectance property[J].Micro & Nano Letters,2014,9(12):877-880.
[9] Chen Q Y,Liu S J,Zhang P M.Heat capacity of potassium tungstates K2WnO3(n=2,3,4) at temperatures from 273 K to 979 K[J].The Journal of Chemical Thermodynamics,1999,31:513-519.
[10] 谢会东,沈德忠,王晓青,等.无水钨酸钾的合成研究[J].无机盐工业,2005,37(11):18-19.
[11] Raj S,Sato T,Souma S,et al.Direct evidence for hidden one-dimensional fermi surface of hexagonal K0.25WO3[J].Physical Review B,2008,77(24):245 120-245 125.
[12] Guo C,Yin S,Huang L,et al.Synthesis of one-dimensional potassium tungsten bronze with excellent near-infrared absorption property[J].ACS Applied Materials & Interfaces,2011,3(7):2 794-2 799.
[13] Suwan M,Supothina S.Increasing synthesis yield of K-doped tungsten oxide nanowire using stirred hydrothermal reactor and its near-infrared reflectance property[J].Micro & Nano Letters,2014,9(12):877-880.
[14] Rattanakam R,Supothina S.Hydrothermal synthesis and electrochromic properties of potassium tungsten oxide nanorods[J].Journal of Nanoscience and Nanotechnology,2011,11(10):8 974-8 978.
[15] Cao G,Song X,Yu H,et al.Hydrothermal synthesis of sodium tungstate nanorods and nanobundles in the presence of sodium sulfate[J].Materials Research Bulletin,2006,41(2):232-236.
[16] Luo J Y,Liu J X,Shi F,et al.Synthesis of sodium tungsten bronze via hydrothermal method assisted by citric acid[J].Advanced Materials Research,2013,712:280-283.
[17] Jia S,Zheng H,Sang H,et al.Self-assembly of KxWO3nanowires into nanosheets by an oriented attachment mechanism[J].ACS Applied Materials & Interfaces,2013,5(20):10 346-10 351.
[18] 王敬平,牛景扬,柏艳,等.仲钨酸铵的合成及其X射线晶体结构分析[J].河南大学学报(自然科学版),1998,28(3):18-22.
[19] 张晓薇.微波水热法制备ZnWO4纳米晶的合成工艺及性能研究[D].西安:陕西科技大学,2012.
【责任编辑:蒋亚儒】
Influences of reaction time on photocatalytic performance of K10W12O41·11H2O nanorod prepared by hydrothermal method
CAO Li-yun, LI Wen, KONG Xin-gang, HUANG Jian-feng,WU Jian-peng, LI Jia-yin, LI Cui-yan
(School of Materials Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:Using KOH and WO3 as raw materials,K(10)W(12)O(41)·11H2O nanorod was successfully synthesized via controlling reaction time.Influences of reaction time on photocatalytic performance of K(10)W(12)O(41)·11H2O nanorod were researched by X-Ray Diffraction (XRD),Scanning Electron Microscope (SEM).Results indicate that the size of K(10)W(12)O(41)·11H2O nanorod was about 200 nm in width and 3~10 μm in length and the K(10)W(12)O(41)·11H2O nanorod has higher photocatalytic activity to degrade Methylene blue, which degradation efficiency reaches 75% under UV irradiation for 50 min.
Key words:hydrothermal method; K(10)W(12)O(41)·11H2O; photocatalysis
中图分类号:TB383
文献标志码:A
文章编号:1000-5811(2016)02-0050-04
作者简介:曹丽云(1972-),女,新疆石河子人,教授,博士,研究方向:无机非金属纳米材料
基金项目:国家科技支撑计划项目(2013BAF09B02); 国家自然科学基金项目(51472152); 陕西省科技厅科研创新团队计划项目(2013KCT-06)
收稿日期:2015-10-25
