微小RNA-150对鼻咽癌细胞放疗抵抗的影响研究
2016-05-04张先锋黄远见张志伟黄卫国
张先锋,黄远见,肖 娟,张志伟,黄卫国
421001 湖南省衡阳市,南华大学附属第二医院耳鼻咽喉头颈外科(张先锋,黄远见,肖娟,张志伟,黄卫国);南华大学肿瘤研究所(张志伟,黄卫国)
·论著·
微小RNA-150对鼻咽癌细胞放疗抵抗的影响研究
张先锋,黄远见,肖 娟,张志伟,黄卫国
421001 湖南省衡阳市,南华大学附属第二医院耳鼻咽喉头颈外科(张先锋,黄远见,肖娟,张志伟,黄卫国);南华大学肿瘤研究所(张志伟,黄卫国)
【摘要】目的探讨微小RNA(miR)-150对于鼻咽癌细胞放疗抵抗的影响,并分析其机制。方法2014年1月—2015年6月,建立放疗抵抗的鼻咽癌细胞株CNE-2R。取CNE-2和CNE-2R,通过克隆形成实验计算不同放疗剂量下(0、3、6 Gy)的克隆形成率(PE)、细胞存活率,采用MTS法检测照射1、2、3、4、5 d时的细胞增殖活性,实时定量荧光聚合酶链式反应(Real-time PCR)法检测miR-150、糖原合成酶激酶3β(GSK3β)mRNA水平,Western blotting法检测GSK3β水平。将CNE-2随机分为miR-150模拟物组(转染miR-150模拟物)、微小RNAs(miRs)无关序列组(转染miRs无关序列),通过荧光素酶报告载体实验检测荧光素酶活性。结果0 Gy放疗剂量时,CNE-2与CNE-2R的PE、细胞存活率比较,差异无统计学意义(P>0.05);3 Gy、6 Gy放疗剂量时,CNE-2R的PE、细胞存活率高于CNE-2(P<0.05)。照射1~5 d时,CNE-2R的细胞增殖活性高于CNE-2(P<0.05)。CNE-2R中miR-150水平高于CNE-2,GSK3β mRNA水平低于CNE-2(P<0.05)。CNE-2R中GSK3β水平低于CNE-2(P<0.05)。转染GSK3β野生型质粒后,miR-150模拟物组荧光素酶活性低于miRs无关序列组(P<0.05);转染GSK3β突变型质粒后,miRs无关序列组与miR-150模拟物组荧光素酶活性比较,差异无统计学意义(P>0.05)。结论miR-150参与了鼻咽癌细胞的放疗抵抗,GSK3β是miR-150的直接靶基因,miR-150-GSK3β轴可能成为一种新的用于合理治疗鼻咽癌的策略。
【关键词】鼻咽肿瘤;放射疗法;微小RNA-150;糖原合成酶激酶类
张先锋,黄远见,肖娟,等.微小RNA-150对鼻咽癌细胞放疗抵抗的影响研究[J].中国全科医学,2016,19(12):1424-1428.[www.chinagp.net]
Zhang XF,Huang YJ,Xiao J,et al.Influence of miR-150 on the radioresistance of nasopharyngeal carcinoma cells[J].Chinese General Practice,2016,19(12):1424-1428.
鼻咽癌是一种具有较强局部侵袭力以及早期转移特点的恶性肿瘤,由于其解剖位置特殊且对放射线较为敏感,放疗是其最重要的治疗方法。然而,放疗抵抗仍然是鼻咽癌治疗中的一大难题[1-3]。微小RNAs(miRs)是一类内源性的短的保守的非编码RNA,其通过与mRNA的3′端非翻译区(3′UTR)特异结合使之降解或者抑制其翻译,从而调控相关靶基因的表达[4-5]。miRs在许多人类癌症中发挥着原癌基因或肿瘤抑制基因的作用[6]。一些miRs已被证实与鼻咽癌的发生、发展、侵袭和转移密切相关,如微小RNA(miR)-141、miR-218、miR-26a[7-9]。然而,miRs在鼻咽癌细胞放疗抵抗中所发挥的作用至今鲜有报道。本研究探讨miR-150对于鼻咽癌细胞放疗抵抗的影响,并分析其机制,以期为合理制定鼻咽癌治疗策略提供科学依据。
1材料与方法
1.1细胞来源鼻咽癌细胞株CNE-2为低分化细胞株,购置于上海细胞研究所,由南华大学肿瘤研究所保存。
1.2主要材料miR-150模拟物及miRs无关序列购自Ambion公司;野生型质粒与突变型质粒由广州复能基因有限公司构建;糖原合成酶激酶3β(GSK3β)抗体购自Santa Cruz Biotechnology;β-actin抗体购自CST公司;山羊抗小鼠(HRP)二抗购自Thermo公司;Lipofectamine 2000转染试剂购自美国Invitrogen生命技术公司;RPMI1640培养基、胎牛血清购自Gibco公司;CellTiter 96®AQueous单溶液细胞增殖检测试剂盒购自Promega公司;ELx800酶标仪购自美国BioTek公司;miRNA提取试剂盒购自OMEGA Bio-Tek公司;miScript Ⅱ RT Kit、SYBR Green PCR试剂盒购自QIAGEN。
1.3研究方法
1.3.1建立放疗抵抗的鼻咽癌细胞株CNE-2R与细胞培养2014年1月—2015年6月,建立放疗抵抗的鼻咽癌细胞株CNE-2R:取对数生长期的鼻咽癌细胞株CNE-2,予以依次递增的放疗剂量(1、2、4、6、8 Gy)照射,每个剂量至少照射3次,直到细胞增殖到80%再进行下一个剂量的照射,该阶段共12个月。CNE-2和CNE-2R培养于含10%新生胎牛血清的RPMI1640培养基中,37 ℃、5% CO2饱和湿度条件下传代培养,每1~2 d更换1次培养基,取生长良好的CNE-2及CNE-2R用于本实验。
本研究创新点:
鼻咽癌是发生于鼻咽腔顶部和侧壁的恶性肿瘤,由于其发生部位的特殊性,放射治疗是鼻咽癌的首选治疗方法。鼻咽癌的治疗失败常与放疗抵抗相关。微小RNAs(miRs)是一类内源性的非编码RNA,一些miRs已被证实与鼻咽癌的发生、发展密切相关,然而,miRs在鼻咽癌放疗抵抗中所发挥的作用至今鲜有报道。本文通过比较放疗抵抗的鼻咽癌细胞株CNE-2R与鼻咽癌细胞株CNE-2,发现CNE-2R中微小RNA(miR)-150表达上调,糖原合成酶激酶3β(GSK3β)表达下调,GSK3β是miR-150的靶基因,提示miR-150可通过靶向抑制GSK3β的表达来调控鼻咽癌细胞的放疗抵抗。本研究丰富了人们对miRs在鼻咽癌放疗抵抗中作用的认识,为预测鼻咽癌细胞放疗抵抗提供了线索,具有一定的创新性和价值。
1.3.2克隆形成实验用0.125%的胰蛋白酶消化对数生长期的CNE-2和CNE-2R,制成单细胞悬液,以2 000个/孔接种于6孔板中,隔夜待细胞贴壁后,分别用0、3、6 Gy放疗剂量满射野照射,继续培养15 d,弃去培养液,0.9%氯化钠溶液洗涤2次,10%甲醇溶液固定15 min,然后去除固定液,使用0.06%结晶紫试剂染色。用显微镜观察,计数细胞团数(>50个细胞,克隆数),计算克隆形成率(PE)〔PE=克隆数/接种细胞数×100%〕。以0 Gy放疗剂量的克隆形成率为对照,计算细胞存活率(细胞存活率=观察组PE/对照组PE×100%)。实验独立重复3次,取均值。
1.3.3MTS法检测细胞增殖活性采用MTS法检测细胞增殖活性,按照CellTiter 96®AQueous单溶液细胞增殖检测试剂盒说明书进行操作。收集生长良好的CNE-2和CNE-2R,分别制成单细胞悬液后,以2 000个/孔(0.20 ml/孔)接种到96孔板中,以3 Gy放疗剂量进行照射。分别在1、2、3、4、5 d时加入MTS(0.02ml/孔),孵育2 h后,用ELx800酶标仪测定每孔在490 nm处的吸光度(OD值),根据OD值判定细胞增殖活性。实验独立重复3次,取均值。
1.3.4实时定量荧光聚合酶链式反应(Real-time PCR)法检测miR-150、GSK3β mRNA水平取适量CNE-2及CNE-2R,采用miRNA提取试剂盒提取纯化miRs,利用miScript Ⅱ RT Kit反转录合成cDNA。按照SYBR Green PCR试剂盒说明书进行Real-time PCR操作。miR-150正向引物:5′-UAUACAAAACAAGCUGUC
UGUTT-3′,反向引物:5′-ACAGCCGCUUGCCCGUUG
UCGCTT-3′;U6正向引物:5′-UUCUCCGAACGUGU
CACGUTT-3′,反向引物:5′-ACGUGACACGUUCGG
AGAATT-3′;GSK3β正向引物:5′-GACTAAGGTCTTCCGACCCC-3′,反向引物:5′-TTAGCATCTGACGCTGCTGT-3′;GAPDH正向引物:5′-ATTCCATGGCACCGTCAAGGCTGA-3′,反向引物:5′-TTCTCCATGGTGGTGAAGACGCCA-3。在Real-time PCR仪内进行PCR扩增,反应体系为20 μl:包括稀释后的RT产物2 μl、2×qRT-PCR缓冲液10 μl、5 μmol/L特异性PCR引物0.4 μl、5 U/μl耐热DNA聚合酶0.2 μl、灭菌双蒸水7.4 μl。反应条件:95 ℃ 3 min活化Taq酶,95 ℃ 12 s、62 ℃ 35 s,共40个循环;熔解曲线检测从62 ℃开始至95 ℃停止。检测miR-150水平时,以U6作为内参;检测GSK3β mRNA水平时,以GAPDH作为内参。实验独立重复3次,取均值。
1.3.5Western blotting法检测GSK3β水平收集CNE-2及CNE-2R,加入RIPA细胞裂解液以及蛋白酶抑制剂,提取细胞总蛋白,采用BCA法对蛋白水平进行测定。分别取等量CNE-2、CNE-2R蛋白,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转移至聚偏氟乙烯(PVDF)膜上,在含5%脱脂牛奶的三羟甲基氨基甲烷(Tris)缓冲溶液中封闭,加入β-actin抗体以及GSK3β抗体,4 ℃过夜,洗膜,加入HRP二抗,室温孵育1 h,TBST洗膜30 min,然后加入发光剂,X片曝光、显影、定影。
1.3.6细胞转染用胰蛋白酶对CNE-2及CNE-2R进行消化,将细胞计数并接种在96孔板中。CNE-2及CNE-2R分别随机分为miR-150模拟物组(转染miR-150模拟物)、miRs无关序列组(转染miRs无关序列),两组再分别转染GSK3β野生型质粒、GSK3β突变型质粒。使用Lipofectamine 2000转染试剂将浓度均为100 nmol/L的miR-150模拟物、GSK3β野生型质粒、GSK3β突变型质粒以及miRs无关序列转染至细胞。在转染36 h后,进行后续实验。
1.3.7荧光素酶报告载体实验检测荧光素酶活性根据GSK3β 3′UTR序列与miR-150结合位点设计合成野生型引物以及突变型引物,正、反向引物分别引入限制性内切酶SpeⅠ和HindⅢ识别位点。当相应的正、反义链扩增退火完成后,将其连接到含有荧光素酶报告基因的载体质粒上。细胞转染后,收集CNE-2,将含有荧光素酶报告基因的载体质粒转染至细胞中。使用双荧光素酶报告基因检测系统检测荧光素酶活性。实验独立重复3次,取均值。

2结果
2.1克隆形成实验结果0Gy放疗剂量时,CNE-2与CNE-2R的PE、细胞存活率比较,差异无统计学意义(P>0.05);3Gy、6Gy放疗剂量时,CNE-2R的PE、细胞存活率高于CNE-2,差异有统计学意义(P<0.05,见表1)。
2.2细胞增殖活性比较照射1~5d时,CNE-2R的细胞增殖活性高于CNE-2,差异有统计学意义(P<0.05,见表2)。
2.3miR-150、GSK3βmRNA水平比较CNE-2R中miR-150水平高于CNE-2,GSK3βmRNA水平低于CNE-2,差异有统计学意义(P<0.05,见表3)。
2.4GSK3β水平比较CNE-2R中GSK3β水平为(0.58±0.04),低于CNE-2的(1.12±0.13),差异有统计学意义(t=11.65,P<0.001)。
2.5荧光素酶活性比较转染GSK3β野生型质粒后,miR-150模拟物组荧光素酶活性低于miRs无关序列组,差异有统计学意义(P<0.05);转染GSK3β突变型质粒后,miRs无关序列组与miR-150模拟物组荧光素酶活性比较,差异无统计学意义(P>0.05,见表4)。
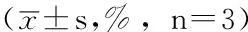
表1 CNE-2与CNE-2R的PE及细胞存活率比较
注:PE=克隆形成率
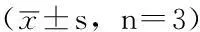
表2 CNE-2与CNE-2R的细胞增殖活性比较
表3CNE-2与CNE-2R中miR-150、GSK3β mRNA水平比较
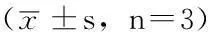
Table 3Comparison of the levels of miR-150 and GSK3β mRNA between CNE-2 and CNE-2R cells

细胞株miR-150GSK3βmRNACNE-20.99±0.041.00±0.07CNE-2R2.02±0.200.57±0.08t值8.176.53P值0.0010.002
注:miR-150=微小RNA-150,GSK3β=糖原合成酶激酶3β

Table 4Comparison of the luciferase activity of CNE-2 cells between miRs irrelevant sequence group and miR-150 mimics group
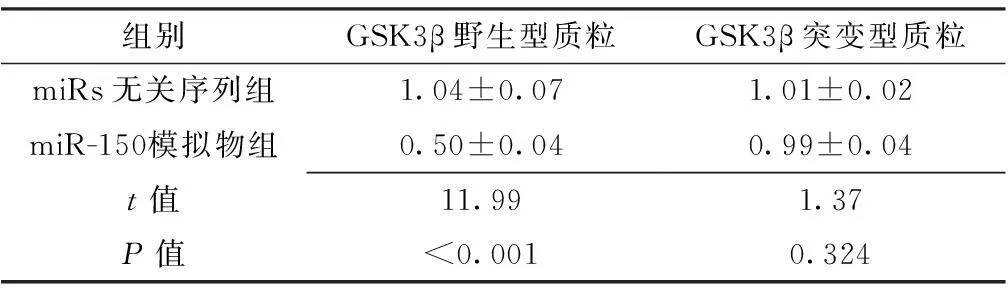
组别GSK3β野生型质粒GSK3β突变型质粒miRs无关序列组1.04±0.071.01±0.02miR-150模拟物组0.50±0.040.99±0.04t值11.991.37P值<0.0010.324
3讨论
肿瘤的化疗抵抗和放疗抵抗是癌症临床治疗中的主要障碍。尽管已经建立了一些肿瘤化疗或放疗抵抗的细胞模型,如耐平阳霉素的舌癌Tca8113细胞株[10]、耐氟尿嘧啶的乳腺癌MCF-7细胞株[11]以及耐放疗胶质瘤MGR2细胞株[12],并且进行了大量的机制研究,但仍然存在许多尚待进一步探讨的问题。近年来,越来越多的研究表明,miRs的异常表达在肿瘤的发生、发展以及放/化疗抵抗中起重要作用,可作为癌症重要的潜在的预后指标或治疗靶点,如miR-200b的表达水平在耐多西他赛的非小细胞肺癌细胞中显著下降[13],其亦可通过调节膀胱癌细胞的上皮-间质转化(EMT)过程从而逆转膀胱癌细胞对表皮生长因子受体的治疗抵抗[14]。且近期研究发现,通过在顺铂耐药舌癌细胞中重新过表达miR-200b和miR-15b,能够减少组蛋白表达水平,使该细胞对化疗重新敏感[15]。放疗抵抗是鼻咽癌治疗成功与否的关键,然而关于miRs在鼻咽癌细胞放疗抵抗中的作用仍不清楚。
为了探究鼻咽癌细胞放疗抵抗机制,本研究建立了放疗抵抗的鼻咽癌细胞株CNE-2R,结果显示,3 Gy、6 Gy放疗剂量时,CNE-2R的PE、细胞存活率高于CNE-2;照射1~5 d时,CNE-2R的细胞增殖活性高于CNE-2。提示放疗抵抗的鼻咽癌细胞株CNE-2R可以耐放疗且可促进细胞的增殖。已有文献报道,miR-150促进一些肿瘤的发生发展,其通过靶向胃癌组织中早期生长反应蛋白2发挥促癌作用[16],在恶性肿瘤中可靶向促凋亡的嘌呤能P2X7受体发挥癌基因作用[17]。Ma等[18]研究发现,抑制GSK3β活性与EZH2过表达和肿瘤的侵袭性增加有关。研究表明,GSK3β活性对鼻咽癌生物学特性有明显的调节作用,然而其在鼻咽癌组织中的表达仍不清楚[18]。miRs是通过调控其下游的靶基因发挥作用的,为探讨miR-150和GSK3β在放疗抵抗的鼻咽癌细胞株CNE-2R的表达改变和作用,本研究进一步检测发现,CNE-2R中miR-150水平高于CNE-2,GSK3β mRNA及其蛋白水平低于CNE-2;转染GSK3β野生型质粒后,miR-150模拟物组荧光素酶活性低于miRs无关序列组,说明GSK3β是miR-150的靶基因,提示miR-150可通过靶向抑制GSK3β的表达来调控鼻咽癌细胞的放疗抵抗。
本研究存在一定的局限性:(1)本研究仅比较了CNE-2与CNE-2R两种细胞株之间的miR-150表达差异,并未涉及更多的鼻咽癌放疗抵抗的细胞系;(2)未检测人鼻咽癌组织标本中miR-150的表达。在之后的研究中,将进一步探讨GSK3β对鼻咽癌细胞放疗抵抗调节的详细机制。
总之,miR-150参与了鼻咽癌细胞的放疗抵抗,GSK3β是miR-150的直接靶基因,miR-150-GSK3β轴可能成为一种新的用于合理治疗鼻咽癌的策略。
作者贡献:张先锋、黄远见、肖娟、张志伟、黄卫国进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张先锋、黄远见、肖娟进行实验实施、评估、资料收集;张志伟进行质量控制及审校。
本文无利益冲突。
参考文献
[1]DeNittis AS,Liu L,Rosenthal DI,et al.Nasopharyngeal carcinoma treated with external radiotherapy,brachytherapy,and concurrent/adjuvant chemotherapy[J].Am J Clin Oncol,2002,25(1):93-95.
[2]Chang JT,Ko JY,Hong RL.Recent advances in the treatment of nasopharyngeal carcinoma[J].J Formos Med Assoc,2004,103(7):496-510.
[3]Gupta AK,McKenna WG,Weber CN,et al.Local recurrence in head and neck cancer:relationship to radiation resistance and signal transduction[J].Clin Cancer Res,2002,8(3):885-892.
[4]Tang H,Kong Y,Guo J,et al.Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22[J].Cancer Lett,2013,340(1):72-81.
[5]Davis-Dusenbery BN,Hata A.MicroRNA in cancer:the involvement of aberrant MicroRNA biogenesis regulatory pathways[J].Genes Cancer,2010,1(11):1100-1114.
[6]Tang H,Deng M,Tang Y,et al.miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression[J].Clin Cancer Res,2013,19(20):5602-5612.
[7]Zhang L,Deng T,Li X,et al.microRNA-141 is involved in a nasopharyngeal carcinoma-related genes network[J].Carcinogenesis,2010,31(4):559-566.
[8]Alajez NM,Lenarduzzi M,Ito E,et al.MiR-218 suppresses nasopharyngeal cancer progression through downregulation of survivin and the SLIT2-ROBO1 pathway[J].Cancer Res,2011,71(6):2381-2391.
[9]Lu J,He ML,Wang L,et al.MiR-26a inhibits cell growth and tumorigenesis of nasopharyngeal carcinoma through repression of EZH2[J].Cancer Res,2011,71(1):225-233.
[10]Zheng G,Zhou M,Ou X,et al.Identification of carbonic anhydrase 9 as a contributor to pingyangmycin-induced drug resistance in human tongue cancer cells[J].FEBS J,2010,277(21):4506-4518.
[11]Zheng G,Peng F,Ding R,et al.Identification of proteins responsible for the multiple drug resistance in 5-fluorouracil-induced breast cancer cell using proteomics analysis[J].J Cancer Res Clin Oncol,2010,136(10):1477-1488.
[12]Cheng JJ,Hu Z,Xia YF,et al.Radioresistant subline of human glioma cell line MGR2R induced by repeated high dose X-ray irradiation[J].Ai Zheng,2006,25(1):45-50.
[13]Rui W,Bing F,Hai-Zhu S,et al.Identification of microRNA profiles in docetaxel-resistant human non-small cell lung carcinoma cells(SPC-A1)[J].J Cell Mol Med,2010,14(1/2):206-214.
[14]Adam L,Zhong M,Choi W,et al.miR-200 expression regulates epithelial-to-mesenchymal transition in bladder cancer cells and reverses resistance to epidermal growth factor receptor therapy[J].Clin Cancer Res,2009,15(16):5060-5072.
[15]Sun L,Yao Y,Liu B,et al.MiR-200b and miR-15b regulate chemotherapy-induced epithelial-mesenchymal transition in human tongue cancer cells by targeting BMI1[J].Oncogene,2012,31(4):432-445.
[16]Wu Q,Jin H,Yang Z,et al.miR-150promotes gastric cancer proliferation by negatively regulating the pro-apoptotic gene EGR2[J].Biochem Biophys Res Commun,2010,392(3):340-345.
[17]Zhou L,Qi X,Potashkin JA,et al.MicroRNAs miR-186 and miR-150down-regulate expression of the pro-apoptotic purinergic P2X7 receptor by activation of instability sites at the 3′-untranslated region of the gene that decrease steady-state levels of the transcript[J].J Biol Chem,2008,283(42):28274-28286.
[18]Ma R,Wei Y,Huang X,et al.Inhibition of GSK3β activity is associated with excessive EZH2 expression and enhanced tumour invasion in nasopharyngeal carcinoma[J].PLoS One,2013,8(7):e68614.
(本文编辑:崔丽红)
Influence of miR-150 on the Radioresistance of Nasopharyngeal Carcinoma Cells
ZHANGXian-feng,HUANGYuan-jian,XIAOJuan,etal.DepartmentofOtorhinolaryngology,theSecondHospital,UniversityofSouthChina,Hengyang421001,China
【Abstract】ObjectiveTo investigate the effect of miR-150 on the radioresistance of nasopharyngeal carcinoma(NPC) cells and analyze its mechanism.MethodsFrom January 2014 to June 2015,we established a radioresistant NPC cell line CNE-2R.CNE-2 and CNE-2R were taken,and clone formation assay was conducted to calculate cloning formation efficiency(PE) and cell survival rate with different radiotherapy doses(0,3 and 6 Gy).MTS method was employed to detect cell proliferation activity on day 1,day 2,day 3,day 4 and day 5.Real-time PCR method was used to detect the levels of miR-150 and GSK3β mRNA,and GSK3β level was measured by Western blotting method.CNE-2 cells were randomly divided into miR-150 mimics group(transfection of miR-150 mimics) and miRs irrelevant sequence group(transfection of miRs irrelevant sequence),and luciferase activity was detected by luciferasereport carrier experiment.ResultsCNE-2 and CNE-2R were not significantly different in PE and cell survival rate when the radiation dose was 0 Gy(P>0.05).CNE-2R was higher than CNE-2 in PE and cell survival rate when the radiation doses were 3 Gy and 6 Gy(P<0.05).After radiation for 1 day to 5 days,the activity of CNE-2R cell proliferation activity was higher than CNE-2(P<0.05).CNE-2R was higher in miR-150 and lower in GSK3β mRNA than CNE-2(P<0.05).CNE-2R was lower than CNE-2 in the level of GSK3β(P<0.05).After the transfection of GSK3β wild type plasmid,miR-150 mimics group was lower than miRs irrelevant sequence group in luciferase activity(P<0.05);after the transfection of GSK3β mutant plasmid,miRs irrelevant sequence group and miR-150 mimics group were not significantly different in luciferase activity(P>0.05).ConclusionmiR-150 is involved in the radioresistance of NPC cells.GSK3β is a direct target gene of miR-150,and miR-150-GSK3β axis may be a possible strategy for rational NPC treatment.
【Key words】Nasopharyngeal neoplasms;Radiotherapy;miR-150;Glycogen synthase kinases
(收稿日期:2015-08-28;修回日期:2016-02-29)
【中图分类号】R 766.3
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.12.014
通信作者:黄卫国,421001 湖南省衡阳市,南华大学附属第二医院耳鼻咽喉头颈外科,南华大学肿瘤研究所;
基金项目:国家自然科学基金资助项目(81172210);湖南省省级科技计划项目(2014SK3081)
E-mail:nhdxzzw@qq.com
