氟乐灵降解菌株的分离鉴定及降解特性研究
2016-05-03季丽吴伟
季丽+吴伟
摘要: 分离筛选出1株能高效降解养殖水体中氟乐灵的微生物菌株FJ-01,经生理生化和序列同源性分析,将该菌株鉴定为Leucobacter菌。结合水产养殖的实际情况,该菌降解氟乐灵的最适pH值为6.0~8.5,最适温度为22~30 ℃,最佳光照条件为光暗比12 h∶ 12 h,最佳接种量为0.01%,氟乐灵的初始浓度0.05 mg/L。
关键词: 氟乐灵;生物降解;16S rDNA;Leucobacter菌;降解特性
中图分类号:X172 文献标志码: A 文章编号:1002-1302(2016)03-0390-04
氟乐灵(trifluralin),别称氟乐宁、氟特力、茄科宁等,化学名称为2,6-二硝基-N,N-二丙基-4-三氟甲基苯胺,分子式C13H16F3N3O4。实际生产中氟乐灵的常用剂为48%的乳油制品,是一种广泛应用的二硝基苯胺类选择性芽前除草剂。因其在虾蟹育苗及养殖过程中可治疗和预防真菌病(链壶菌病)[1]且具灭苔不伤草的功效,也广泛应用于水产养殖中。
然而有研究表明,氟乐灵可使受试动物发生癌变、染色体突变并对哺乳动物具有基因毒性[2-4]。氟乐灵对哺乳动物、虾、蟹、鸟类的毒性较低,但对鱼类的毒性很大[5]。针对氟乐灵的使用情况和有关毒理学试验数据,2004年11月底,美国环保署再次修订氟乐灵最高残留限量[6],重新修订后为 0.05 mg/kg。2010年日本多次检出我国出口的鳗鱼、梭子蟹等水产品中氟乐灵超标,对我国渔业经济造成一定影响。
利用微生物来降解农药最早报道于1951年,当时 Audus[7]研究了土壤微生物对2,4-D的降解,引发了世人对微生物降解能力的关注。微生物降解技术相对于物理、化学技术,具有高效、彻底、无二次污染和成本低等优势,已成为近年来研究的热点。
目前对于氟乐灵的研究主要着重于其对动植物的影响,在土壤中的迁移、转化、降解[8-10]以及检测方法[11-13]。对于如何去除水环境和生物体内的氟乐灵报道较少,因此筛选更多类型水体中的氟乐灵高效降解菌对于氟乐灵残留的生物修复研究和应用具有十分重要的意义。本研究从受污染池塘底泥中筛选到1株可降解低氟乐灵浓度的菌株,并研究其降解特性,以期为合理使用渔用药物和保证水产品质量安全提供理论基础。
1 材料与方法
1.1 氟乐灵降解菌分离源
氟乐灵降解菌分离自江苏宜兴多年使用过氟乐灵的虾蟹养殖池塘的底泥。采用柱状采泥器采集5个不同的池塘底泥各500 g,装入无菌的玻璃广口瓶中,4 ℃保存下运回实验室备用。
1.2 培养基与试剂
菌株富集所用的培养基(葡萄糖1 g、蛋白胨10 g、硝酸铵0.2 g、酵母膏0.06 g、磷酸氢二钾0.1 g、磷酸二氢钾0.2 g、氯化钠1 g、水1 L),pH值为7.0~7.5,121 ℃灭菌20 min。
菌株驯化培养所采用的无碳源培养基(硝酸铵0.2 g、磷酸氢二钾0.1 g、磷酸二氢钾0.2 g、氯化钠1 g、水1 L),pH值为7.0~7.5,121 ℃灭菌20 min。
菌株保存培养基采用液体或固体的肉汤培养基[牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g(固体需加琼脂20 g)、蒸馏水1 L],pH值为7.0~7.5,121 ℃灭菌20 min。
1.3 氟乐灵降解菌株的筛选、分离和纯化
无菌条件下取养殖池塘的底泥1 g,置于经灭菌冷却的99 mL富集培养基中,30 ℃、150 r/min振荡48 h培养。将经富集培养后的底泥悬浊液静置0.5 h,在无菌条件下取1 mL上清液于99 mL富集培养基中按上述条件继续培养48 h。取10 mL经培养所得的菌液于250 mL无碳源培养基(含 0.01 mg/L 氟乐灵)中,培养(条件均为30 ℃、150 r/min)48 h后将菌液转接至下一批次新的无碳源培养基中,并逐步加大无碳源培养基中氟乐灵的浓度,从0.01 mg/L提高至 2.0 mg/L。每次转接前需测定培养液中氟乐灵的实际含量,浓度有明显下降则表明培养液中有降解菌株的存在。
将混合培养物经含2.0 mg/L氟乐灵的无碳源培养基平板涂布,并将其进行分离化,取最终的驯化培养液1 mL于 9 mL 无菌水中,得到10-1的稀释度,并依次获得10-2和10-3的稀释度。从3个不同的稀释度中取样,在含2.0 mg/L氟乐灵的无碳源培养基平板上进行涂布分离,每个稀释度做3个平行,放入30 ℃的恒温培养箱中培养3 d。选择菌落疏密适当的平板,在显微镜下观察,挑取生长状况良好、形态不同的菌落于液体肉汤培养基中培养,再将分离所得的各菌株在平板上连续转接、传代5次,选择其中能在含氟乐灵无碳源培养基上生长的菌株,转接至试管斜面,于4 ℃冰箱保存。
将纯化得到的菌株用肉汤培养基培养至菌数为 109 CFU/mL 水平,按5%的比例接种于250 mL装有100 mL 0.5 mg/L氟乐灵无碳源培养基的三角瓶中,放置振荡培养箱中30 ℃、150 r/min振荡培养5 d。每隔24 h取样1次,经适当稀释后测定D600 nm,做3个平行,分别以培养时间、D600 nm吸光值为横、纵坐标绘制菌株的生长曲线。同时测定其中氟乐灵的浓度,选择降解率和生长性能均较好的菌株作为最终的目标菌株,进行鉴定和降解特性的研究。
1.4 氟乐灵降解率的分析测定
菌株分离筛选时,氟乐灵的测定采用气相色谱(GC)法,其中色谱条件的选择参照文献[14]。取培养液50 mL于 250 mL 分液漏斗中,加入色谱纯二氯甲烷10 mL,摇振萃取 5 min,静置分层,取有机溶剂层,经4 000 r/min离心10 min,弃残余水相。有机相在氮气下吹干,再用二氯甲烷定容至 1 mL,经0.22 μm的滤膜过滤后进气相色谱分析。
氟乐灵的降解率=(Ct-C0)/C0×100%。
式中:Ct为培养液中氟乐灵的最终浓度, mg/L;C0 为培养液中氟乐灵的初始浓度, mg/L。
1.5 氟乐灵降解菌株的16S rDNA的分析
为进一步确定所选菌株的种属,在进行菌落形态观察的同时采用16S rDNA方法鉴定菌株。按SK8255(细菌)试剂盒的操作程度提取菌株的DNA,使用细菌通用引物7f(5′-CAGAGTTTGATCCTGGCT-3′)和1 540 r(5′-AGGAGGTGATCCAGCCGCA-3′)扩增其片段,对扩增产物进行电泳观察(1%琼脂糖电泳,150 V 100 mA,20 min),并由生工(上海)生物工程有限公司进行测序,所得基因序列经Blast程序与GenBank核酸数据库进行比对分析,采用MEGA 5.1软件进行同源性比对分析并建立系统发育树[15]。
1.6 氟乐灵降解菌株的生长曲线及降解特性
在2 500 mL三角瓶中加入1 000 mL的养殖水体水样(水质COD为17.75 mg/L,TN为1.6 mg/L,TP为0.30 mg/L,NH+4-N为0.70 mg/L,NO-3-N为0.15 mg/L,NO-2-N为0.10 mg/L,pH值为7.0),经灭菌冷却后根据养殖生产的实际情况和条件加入氟乐灵并接入一定量的培养至对数生长期的菌液(菌液浓度1×109 CFU/mL),研究在不同的温度(15、22、30 ℃)、pH值(6.0、7.0、8.5)、光暗比(4 h ∶ 20 h、12 h ∶ 12 h、20 h ∶ 4 h)、接种量(1%、0.1%、0.01%)和氟乐灵浓度(0.01、0.05、0.5、1.0、2.0 mg/L)下,菌株经5 d连续作用后对氟乐灵的降解能力;试验设3组平行。
2 结果与讨论
2.1 氟乐灵降解菌株的分离、筛选和纯化
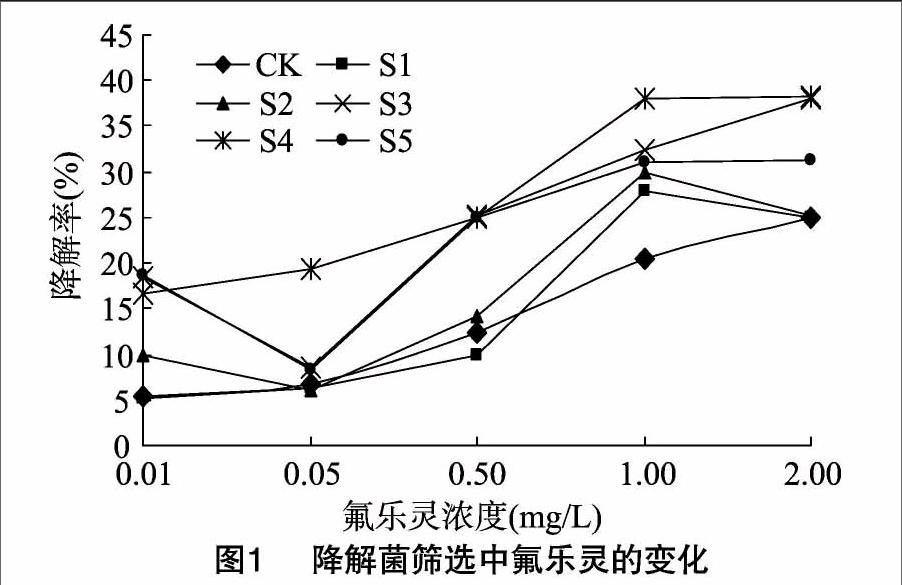
以江苏宜兴多次使用过氟乐灵的5个虾蟹养殖池塘底泥(S1~S5)为分离源,采用富集培养基培养后获得混合菌源。将混合菌源接入含0.01~2.0 mg/L氟乐灵的无碳培养基中,经30 ℃、150 r/min振荡培养48 h,分析培养前后培养液中氟乐灵的降解情况,以判别降解菌的存在和选择适宜的分离源。试验结果详见图1。
由图1可知,在30 ℃、150 r/min条件下培养48 h,因挥发等因素的影响,对照组CK的氟乐灵(0.01~2.0 mg/L)有5.31%~25.08%的去除率,且随着浓度的上升而增大。相对于对照组,富集于S1、S2池塘底泥的菌源,其对氟乐灵的降解效果不显著(P>0.05),而富集于S3~S5池塘底泥的菌源则具有良好的降解效率。其中S4的菌源对于0.05 mg/L以上的氟乐灵降解效果尤其显著(P<0.05),扣除对照组本底变化值后分别达到11.31%、12.48%、12.56%、17.54%和 13.12%。因此降解氟乐灵的菌株重点在S3~S5池塘底泥的菌源中筛选。
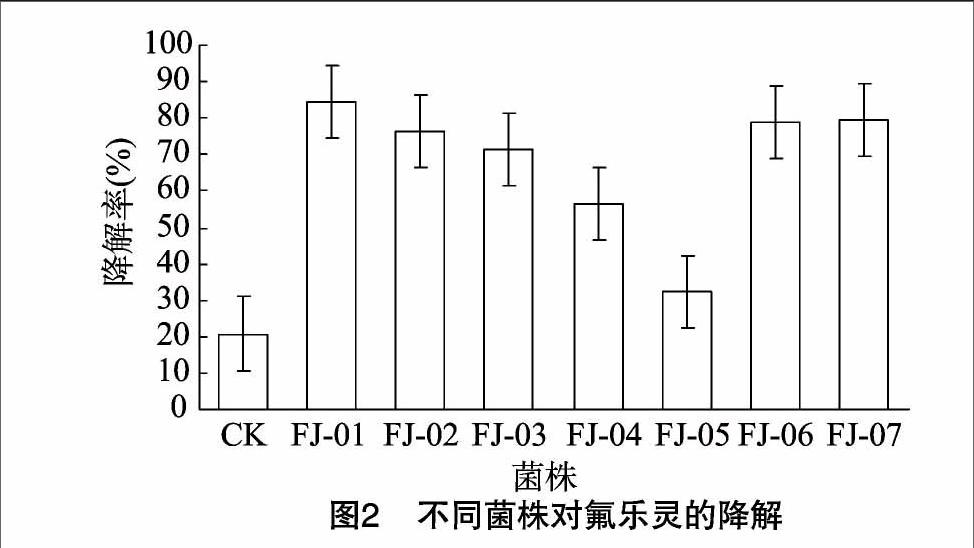
将S3~S5这3组的菌株培养物在无菌条件下,经含氟乐灵2.0 mg/L的无碳源培养基平板进行涂布和分离纯化,共获得菌株7株,编号为FJ-01~FJ-07。将这7株菌株对 0.5 mg/L 的氟乐灵进行5 d的降解,降解结果见图2。由图2可知,在所筛选出的7株菌株中,5 d内对0.5 mg/L氟乐灵降解效果较好的有4株菌,分别为FJ-01、FJ-02、FJ-06和FJ-07,降解率大于76%(扣除对照组本底后大于55%),其中FJ-01菌株的降解率最高,达84.1%(扣除对照组本底后为64.6%)。
试验同时测定了4株具有较好降解作用菌株的生长曲线。由图3可知,4株菌在含0.5 mg/L氟乐灵的无碳培养基中生长良好。相比较而言,FJ-01菌株的生长比较活跃,是唯一D值超过1.0的菌株,因此将其作为降解的首选菌株进行研究和探索。
2.2 氟乐灵降解菌株FJ-01的菌落形态观察和16S rDNA分析
所筛得的氟乐灵降解菌FJ-01在固体肉汤培养基中培养24 h后,菌落圆形且呈乳白色或淡黄色,四周边缘较为光滑,表面湿润,不易挑取,革兰氏染色呈阳性(图4)。
以FJ-01菌株的基因组DNA为模板,利用引物7f(5′-CAGAGTTTGATCCTGGCT-3′)和1 540 r(5′-AGGAGGTGATCCAGCCGCA-3′)对FJ-01菌16S rDNA片段进行PCR扩增,结果见图5。其中右侧第1个条带为FJ-01菌16S rDNA的扩增片段,左侧为对比条带marker。从该图的凝胶成像图可以看出,PCR反应得到的扩增产物长度为1 500 bp,符合16S rDNA的片段大小。
FJ-01的16S rDNA序列在NCBI上比对分析后发现其与多株Leucobacter菌的16S rDNA相似,调出其中相似度较高的Leucobacter菌 16S rDNA序列,建立系统发育树。经计算,菌株FJ-01与Leucobacteralbus strain IAM 14851距离最近,两者同源性为91%,可以判断FJ-01菌株与Leucobacteralbus strain IAM 14 851为不同种,但同属于Leucobacter属。具体种仍待进一步分析,其系统发育树见图6。
2.3 氟乐灵降解菌株FJ-01的降解特性研究
根据养殖生产中氟乐灵使用的实际情况和条件,研究了不同的温度、pH值、光暗比、接种量和氟乐灵初始浓度对菌株FJ-01降解能力的影响,了解菌株FJ-01的降解特性。
2.3.1 氟乐灵初始浓度对菌株FJ-01降解能力的影响 为考察氟乐灵初始浓度对菌株FJ-01降解的影响,试验根据养殖生产中的实际情况,选择了0.01、0.05、0.5、1.0、20 mg/L 5个浓度。试验条件为:温度30 ℃、水体pH值为7.0、光暗比为12 h ∶ 12 h、菌体接种量为0.1%,试验时间为 5 d。试验结果见图7。
由图7可以看出,当其他条件一致时,经过5 d的试验,5个浓度组的氟乐灵均有不同程度的降解:其中0.01 mg/L浓度组的降解率偏低,仅为17.46%,而其他各浓度组的氟乐灵降解较明显,降解率均大于38%,其中0.05 mg/L组的降解效果最为显著,达66.26%。5个浓度组中0.05、0.5、1.0 mg/L这3个浓度组的降解率较为接近。降解率的不同与浓度有直接的关系,0.01 mg/L组本身浓度偏低,可利用性差;而 2.0 mg/L 组浓度偏大,对菌株的生长代谢有一定的抑制作用,故降解率又会有一定的下降。0.05~1.0 mg/L 组的浓度处于菌株代谢的适宜范围,而生产实际中氟乐灵的常用浓度是005 mg/L,因此该菌对养殖水体环境中残留氟乐灵的降解是有效和适宜的。
2.3.2 温度对菌株FJ-01降解能力的影响 为考察水体温度对菌株FJ-01降解的影响,试验根据养殖生产中的实际情况,选择了水温为15、22、30 ℃ 3个温度。试验条件为:水体pH值7.0、光暗比12 h ∶ 12 h、菌体接种量为0.1%,氟乐灵初始浓度为0.05 mg/L,试验时间为5 d,试验结果见图8。
由图8可以看出,相对于15 ℃时22.58%的降解率而言,22 ℃ 和30 ℃ 时FJ-01菌株对氟乐灵5 d的降解率分别达到51.62%和67.32%,表明温度较高适宜氟乐灵的降解。一方面,水温较高,特别是30 ℃左右时,正是微生物生长代谢的适宜温度,有利于微生物对氟乐灵的代谢转化;另一方面,水温上升有利于氟乐灵的挥发,从而加快其去除。15 ℃的水温较低,降解率也偏低,但此时一般不进行养殖生产或虽然养殖但不需要使用氟乐灵,因此对实际应用的影响不大。养殖生产中使用氟乐灵主要在早春水温22 ℃左右,用于杀灭水中的水绵,其次是在水温30 ℃左右时防治虾病。而这2个温度条件下FJ-01菌株对氟乐灵有50%以上的降解率,故适宜在实际生产中应用。
2.3.3 pH值对菌株FJ-01降解能力的影响 为考察水体pH值对菌株FJ-01降解的影响,试验根据养殖生产中实际情况,选择了水体pH值为6.0、7.0、8.5的3个值。试验条件为:水温30 ℃、光暗比12 h ∶ 12 h、菌体接种量为0.1%,氟乐灵初始浓度为0.05 mg/L,试验时间为5 d,试验结果见图9。
从图9可以看出,pH值为6.0、7.0、8.5时,菌株FJ-01降解氟乐灵无显著差异,5 d后降解率分别为61.97%、66.26% 和68.05%,表明在pH值在6.0~8.5范围内,对菌株的降解能力无影响,且养殖水体的pH值基本在此范围内波动,故对菌株FJ-01而言是适宜降解的条件。
2.3.4 光暗比对菌株FJ-01降解能力的影响 为考察光暗比对菌株FJ-01降解的影响,试验根据养殖生产中的实际情况,选择了光暗比为20 h ∶ 4 h、12 h ∶ 12 h、4 h ∶ 20 h(光照度为2 500 lx)3个水平。试验条件为:水温30 ℃、pH值为 7.0、菌体接种量为0.1%,氟乐灵初始浓度为0.05 mg/L,试验时间为5 d,试验结果见图10。
由图10可以看出,在5 d的试验中,各组最终的降解率在63.93%~66.15%之间,并无显著性差异,但5 d中的降解速率存在差异。光暗比为20 h ∶ 4 h、12 h ∶ 12 h的2组,在试验前2 d的降解速度明显快于光暗比为4 h ∶ 20 h的试验组,且2 d的降解率分别为55.04%和51.79%,远大于光暗比为4 h ∶ 20 h试验组的39.32%。表明在试验开始后的2 d内,菌株处于适应并增殖状态,氟乐灵的降解中包含了部分的光降解,若此时光照时间长,降解率会明显提高。随着微生物代谢能力的加剧,后3 d此种影响减弱,氟乐灵的代谢以菌株的代谢为主,最终的降解率趋于一致。
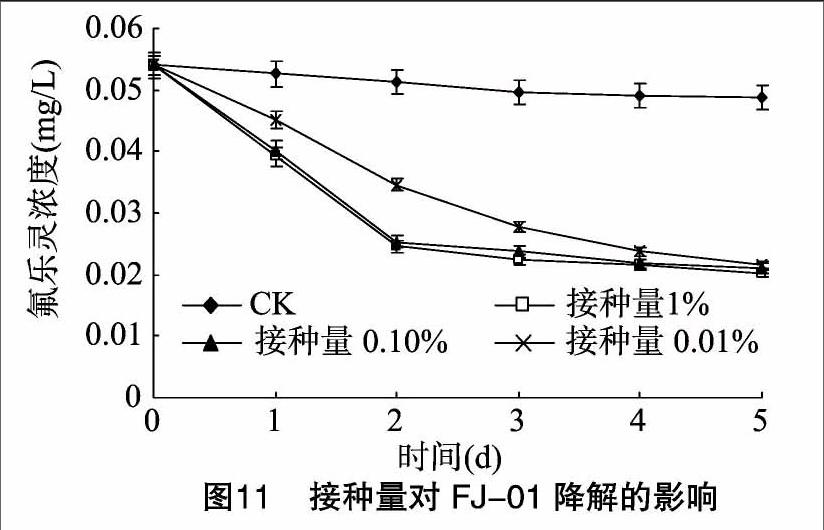
2.3.5 接种量对菌株FJ-01降解能力的影响 为考察菌株FJ-01接种量对降解效果的影响,试验根据养殖生产中的实际情况,选择了接种量为1%、0.1%和0.01% 3个水平进行试验。试验条件为:水温30 ℃、pH值为7.0、光暗比 12 h ∶ 12 h,氟乐灵初始浓度为0.05 mg/L,试验时间为5 d,试验结果见图11。
由图11可以看出,在5 d的试验中,各组最终的降解率在60.19%~62.41%之间,并无显著性差异,但5 d中的降解效果存在差异。接种量为0.1%和1%的2组,试验前2 d的降解效率明显要高,2 d的降解率分别为54.44%和 53.15%,远大于另一组的35.93%。表明在试验开始后的 2 d 内,菌株处于适应和增殖状态,菌株活性菌数高的试验组降解能力明显要强,但随着菌体的代谢,从第3天起降解作用效果趋于一致。因此菌株的接种量以0.1%为佳,但在实际生产中应用必须考虑经济有效性以及最终的降解结果,故接种量的选择宜小不宜大,0.01%及以下的接种量则更加适宜,这还有待于在实际应用中加以修正和完善。
3 小结
采用富集培养基和含氟乐灵的无碳源培养基从养殖池塘底泥中定向分离得到具有降解功能的4株菌株,菌株分别标记为FJ-01、FJ-02、FJ-06和FJ-07。将此4菌株加入含有氟乐灵的无碳源培养基中,经过5 d的培养,发现FJ-01菌株在培养液中生长情况最好,且对氟乐灵的降解率最高,故选择FJ-01菌株作为重点研究菌株。
对菌株FJ-01进行了纯化和培养,分析了其菌落、菌株形态,提取了菌体DNA并进行了16S rDNA片段的PCR扩增,对扩增得到的目标片段进行测序。利用Blast对序列结果进行比对,构建系统发育树进行分析,初步确定菌株FJ-01为Leucobacter sp.。
研究表明,结合水产养殖的实际情况,菌株FJ-01对氟乐灵降解的适宜条件为:pH值为6.0~8.5,水温为22~30 ℃,光暗比为12 h ∶12 h,接种量为0.01%,氟乐灵初始浓度为0.05 mg/L。
参考文献:
[1]梁飞龙,刘洪军,傅道军. 斑节对虾幼体链壶菌病的防治试验[J]. 水产科技情报,2000,27(3):102-104,144.
[2]Naqvi S M,Leung T S. Trifluralin and oryzalin herbicides toxicities to juvenile crawfish(Procambarus clarkii) and mosquitofish(Gambusia affinis)[J]. Bulletin of Environmental Contamination and Toxicology,1983,31(3):304-308.
[3]杜柳涛,邬惠琼,杨杏芬. 氟乐灵对大鼠肝、肾微粒体酶的影响[J]. 中国职业医学,2000,27(5):16.
[4]Ribas G,Frenzilli G,Barale R,et al. Herbicide-induced DNA damage in human lymphocytes evaluated by the single-cell gel electrophoresis(SCGE) assay[J]. Mutation Research,1995,344(1/2):41-54.
[5]吴正铠. 除莠剂氟乐灵(trifluralin)引起的幼鱼脊椎骨畸形[J]. 淡水渔业,1979,9(增刊1):59-60.
[6]胡 敏,李二虎,吴兵兵,等. 气相色谱法测定大豆中氟乐灵、甲草胺和乙草胺农药残留[J]. 现代农药,2006,5(6):27-28,47.
[7]Audus L J. The biological detoxication of hormone herbicides in soil[J]. Plant and Soil,1951,3(2):170-192.
[8]郑 麟,王福钧. 14C-氟乐灵在土壤中的迁移和降解[J]. 核农学报,1993,7(1):37-44.
[9]张大弟,张晓红,徐正泰. 除草剂氟乐灵在土壤中的残留降解[J]. 上海环境科学,1988,7(6):11-15.
[10]安 琼,陈祖义. 氟乐灵在土壤中的持留及其结合残留研究[J]. 土壤学报,1993,30(3):304-311.
[11]安 琼,钱文恒. 测定土壤中氟乐灵残留物的毛细管色谱方法[J]. 土壤,1992,24(1):48-50.
[12]李孝军,林仙军,王亚楠,等. 超高效液相色谱法测定鳗鱼中氟乐灵残留量[J]. 中国兽药杂志,2011,45(5):17-19.
[13]黄灵芝,戴 华,李拥军,等. 高效液相色谱法测定荞头中氟乐灵残留量[J]. 食品科学,2004,25(7):151-153.
[14]季 丽,张骞月,晏 涛,等. 氟乐灵在养殖水体环境中消解动态的模拟研究[J]. 农业环境科学学报,2015,34(1):182-189.
[15]王 琼,吴 伟,季 丽. 侧孢芽孢杆菌对铜绿微囊藻生长胁迫的研究[J]. 农业环境科学学报,2014,33(2):383-391.
